Форма выпуска
Порошок для приготовления раствора для инфузионной терапии. В пакетах по 50 г.
Порошок для приготовления раствора для местного применения и перорального приема. В пакетах по 10, 25 и 50 г.
Раствор для инфузий 4%. Выпускается по 2 и 5 мл в одноразовых контейнерах из полимерных материалов; по 100, 200 и 400 мл в бутылках; по 100 и 250 мл в полимерных контейнерах.
Таблетки 0,3 и 0,5 г.
Свечи для ректального применения 0,3, 0,5 и 0,7 г по 10 суппозиториев в упаковке.
Фармакодинамика и фармакокинетика
Способствует восстановлению нарушенного баланс воды и электролитов, а также кислотно-щелочного равновесия.
При диссоциации (в химии и биохимии — обратимый распад сложных веществ на отдельные элементы и/или составляющие компоненты) гидрокарбоната натрия высвобождается бикарбонатный анион. Он связывает ионы водорода, в результате чего образуется карбоновая кислота, которая впоследствии распадается на воду и диоксид углерода (выделяется при дыхании).
Это вызывает щелочной сдвиг и повышение буферной емкости крови.
Натрия гидрокарбонат повышает осмотический диурез и выведение из организма ионов Na и Cl, снижает кислотность мочи, предупреждает оседание мочевой кислоты в мочевыделительной системе.
Бикарбонатный анион не проникает во внутриклеточное пространство.
Фармакокинетический профиль препарата не исследовался.
Польза и вред
Несмотря на то, что щёлочность не нормируется в большей части типов вод (кроме бутилированной), у щёлочности есть физиологическое воздействие: при употреблении воды с повышенной щёлочностью неизбежны негативные последствия для организма. Наиболее опасна свободная щёлочность. Общую и карбонатную щёлочности (при отсутствии свободной) лучше контролировать по содержанию гидрокарбонатов. Их содержание не должно превышать 400 мг/л.
При повышенной щёлочности наблюдается:
- нарушение кислотно-щелочного равновесия;
- снижение щелочного резерва крови;
- снижение кислотности желудочных соков;
- ускорение фильтрации мочевины;
- увеличение риска развития гипоацидного гастрита.
Показания к применению: что лечит пищевая сода?
Применение в медицине показано при заболеваниях, которые сопровождаются повышением кислотности пищеварительного сока в желудке, язвенной болезни, метаболическом ацидозе (в том числе при ацидозе, который развивается в послеоперационном периоде или на фоне сахарного диабета, инфекционной болезни, интоксикации).
К лечению с помощью средства прибегают при воспалительных офтальмологических болезнях, а также при воспалительных болезнях слизистых верхних отделов дыхательных путей и ротовой полости.
Лечебные свойства питьевой соды используются в случаях, когда возникает необходимость разрыхления ушной серы и разжижения секрета бронхиальных желез, для подщелачивания мочи и уменьшения дискомфорта при легких инфекциях мочевыделительной системы, при тубулярном (канальцевом) почечном ацидоз.
Бикарбонат натрия также применяется в терапии, целью которой является удаление цистиновых и уратных конкрементов почек.
Противопоказания
Противопоказания на лечение питьевой содой:
- гиперчувствительность;
- состояния, которые сопровождаются развитием алкалоза.
Кроме того, противопоказаниями к применению являются гипохлоремия и гипокальциемия. В первом случае прием Натрия гидрокарбоната может спровоцировать длительное снижение всасывания в пищеварительном канале и рвоту, что в свою очередь приводит к значительной потере организмом ионов хлора, в том числе и тяжелому алкалозу.
Прием соды при гипокальциемии может сопровождаться тетаническими судорогами и повышением риска алкалоза.
Побочные действия
Длительное применение гидрокарбоната натрия приводит к алкалозу (повышению рН крови), клиническими проявлениями которого являются:
- тошнота;
- рвота;
- ухудшение аппетита (до полной потери);
- боли в животе;
- тетанические судороги (в особо тяжелых случаях);
- повышение АД.
При использовании суппозиториев может развиваться послабляющий эффект, возникают позывы на дефекацию, урчание, диарея и метеоризм.
Натрия гидрокарбонат: инструкция по применению
Инструкция по применению бикарбоната натрия в порошке
Порошок Натрия гидрокарбоната используется для приготовления водных растворов для промываний, полосканий и ингаляционного применения.
При стоматите, рините, ларингите и ряде других болезней рта, носа и горла готовят раствор с концентрацией 0,5-2%.
Для промывания кожи и слизистых верхних дыхательных путей при их поражении кислотами, отравляющими (фосфор- и хлорорганическими) и раздражающими веществами следует использовать двухпроцентный раствор.
Инструкция на раствор для внутривенного введения
Раствор для инфузий следует применять под контролем щелочного состояния крови. Взрослым его вводят капельным путем, в вену или ректально, детям — внутривенно.
Средство может применяться в чистом или в разведенном виде. Для разведения используют пятипроцентный раствор глюкозы (в пропорции 1:1).
Скорость введения — 60 капель/мин., суточная доза — до 200 мл. Кратность инфузий зависит от показаний кислотно-щелочного баланса.
Новорожденным детям вводят в вену в дозе 4-5 мл/кг, детям других возрастных групп — в дозе 5-7 мл/кг.
Необходимость повторного введения определяется показателями КЩР (кислотно-щелочного равновесия).
Как пить таблетки Натрия гидрокарбоната?
Таблетки принимают внутрь несколько раз в течение дня. Разовая доза для взрослого человека варьирует в пределах от 0,5 до 1 г, для ребенка — от 0,1 до 0,75 г (в зависимости от возраста и показаний).
Лечение по Неумывакину: как лечиться содой, чтобы не навредить?
Следуя рекомендациям профессора Неумывакина, натрий двууглекислый (натрий двууглекислый — это та же сода) следует принимать на пустой желудок примерно за 20-30 минут до завтрака и ужина. Если есть такая возможность, можно ввести еще один прием в дневное время.
Главный принцип лечения заключается в том, что прием соды нельзя совмещать с процессом пищеварения. Это связано с тем, что при попадании пищи в желудок в нем образуется кислая среда. Среда пустого желудка — нейтральная.
Начинают лечение с половины кофейной ложки средства в день. Для разведения используют 200 мл горячего молока или аналогичный объем горячей воды. Кипятить воду/молоко не стоит, поскольку в таком случае получится совершенно другая формула. Соду можно также принимать, не размешивая в жидкости, а просто запивая ей.
Лечение проводят трехдневными курсами, между которыми выдерживают такие же по продолжительности интервалы. Если организм нормально реагирует на прием соды, разовую дозу можно повысить до 7-10 грамм (соответствует объему 1 ч. ложки).
Через три дня регулярного приема средства снова следует выдержать трехдневный перерыв.
Постепенно, отслеживая состояние здоровья человека и не забывая о необходимости делать перерывы в лечении, дозу доводят до 7-30 грамм.
Полезные свойства натрия гидрокарбоната обусловлены способностью этого средства нейтрализовать кислоту, поддерживать оптимальный баланс кислот и щелочей в организме, а также повышать щелочной резерв организма.
При помощи соды снимают кислотные наслоения в пищеварительном канале, почках и печени, чистят сосуды. Содовая клизма, сделанная после приема Пиперазина, повышает эффективность последнего при заражении острицами и аскаридами.
Помимо приема внутрь, для здоровья человека весьма полезны также полоскания ротовой полости и горла раствором пищевой соды и горячие ванны с добавлением морской соли и соды. Вода должна быть нагрета до температуры 39-42˚С, соль и соду берут, соответственно, из расчета 100 и 200-250 г на 100 л воды.
Такая процедура позволяет оздоровить кожу и опорно-двигательный аппарат. В клетках начинают восстанавливаться биохимические и энергетические процессы, повышается гемодинамика, улучшается усвоение кислорода тканями. Как результат — нормализуется самочувствие, повышаются умственная трудоспособность и физическая выносливость.
Натрия гидрокарбонат принимают для лечения диабета, онкологических заболеваний, наркомании, алкоголизма и токсикомании.
Помимо этого, сода растворяет вредные для позвоночника и суставов отложения, облегчает состояние больного при подагре, остеохондрозе, ревматизме, полиартрите, желче- и мочекаменной болезни.
Лечение рака пищевой содой: бакарбонат натрия против рака
Туллио Симончини (врач из Италии) полагает, что рак — это не что иное как сильно разросшаяся колония грибов рода Candida, а традиционное толкование природы заболевания является в корне неверным.
То, что в официальной медицине принято считать неконтролируемым делением клеток, по его мнению, представляет собой процесс, который организм запускает самостоятельно для борьбы с молочницей.
Следуя этой теории, можно предположить, что грибок, который обычно хорошо контролируется иммунитетом здорового человека, в ослабленном организме начинает активно размножаться, формируя большую колонию.
Когда происходит заражение какого-либо органа молочницей, иммунная система реагирует на него выстраиванием защитного барьера из клеток организма. Метастазирование можно объяснить дальнейшим разрастанием колонии и миграцией грибка в организме.
Уничтожить грибок способны только клетки нормально функционирующей иммунной системы. Таким образом, ключом к выздоровлению является сильный иммунитет.
Причиной снижения иммунитета и, следовательно, возникновения многих серьезных заболеваний, является снижение показателя рН. Если говорить об онкологических заболеваниях, то оптимальной для их развития является кислая среда, то есть среда, при которой водородный показатель не превышает 5,41.
У новорожденного ребенка он, для сравнения, равен 7,41, а у здорового взрослого должен колебаться в пределах от 7,3 до 7,4.
В рекомендациях, которые приводятся в Справочнике терапевта, датированном 1973 годом, указывается, что пациентам с рН 7,25 и ниже следует назначать ощелачивающую терапию или, говоря другими словами, им рекомендуют принимать от 5 до 40 грамм соды в сутки.
Сода восстанавливает внутриклеточный метаболизм, препятствует потере калия и усиливает усвоение кислорода.
Натрия гидрокарбонат для лечения от рака принимают натощак, за полчаса до еды, начиная с объема, равного пятой части чайной ложки, и постепенно увеличивая дозу в 2-3 раза.
Разовую дозу разводят в 200 мл горячего молока (очень теплой воды) или запивают таким же количеством воды/молока. Принимать “лекарство” необходимо 2 или 3 раза в день.
Натрия гидрокарбонат (пищевая сода)
Натрия гидрокарбонат
(англ.
sodium bicarbonate
; синонимы:
двууглекислый натрий, бикарбонат натрия, питьевая сода, пищевая сода
) — антацидное, нормализующее кислотно-щелочное равновесие вещество.
Гидрокарбонат натрия — химическое вещество
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Химическая формула гидрокарбоната натрия: NaHCO3. Гидрокарбонат натрия — белый кристаллический порошок без запаха, солено-щелочного вкуса. Гидрокарбонат натрия устойчив в сухом воздухе, медленно разлагается во влажном. Легко растворим в воде с образованием щелочных растворов. Кислотность пятипроцентного раствора гидрокарбоната натрия = 8,1 pH. Гидрокарбонат натрия практически нерастворим в этаноле. Молекулярная масса 84,01. Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая сразу же распадается на углекислый газ и воду.
Натрия гидрокарбонат — лекарственное средство
Натрия гидрокарбонат (такое его название принято в фармацевтике) — международное непатентованное наименование (МНН) лекарственного средства. По фармакологическому указателю натрия гидрокарбонат относится к группам «Регуляторы водно-электролитного баланса и КЩС» и «Антациды», по АТХ — к группе: «B05 Плазмозамещающие и перфузионные растворы» и имеет коды B05CB04 и B05XA02. Кроме того, в группе «A02 Препараты для лечения заболеваний связанных с нарушением кислотности» имеется пятизначный код «A02AH Антациды в сочетании с натрия бикарбонатом».
Терапия гидрокарбонатом натрия беременных и кормящих матерей
В связи с нежелательными побочными эффектами натрия (отек и увеличение веса) некоторые специалисты выступают за использование у беременных альтернативных антацидов, не содержащих гидрокарбонат натрия. Категория риска для плода по FDA при терапии гидрокарбонатом натрия — «C» (исследования на животных выявили отрицательное воздействие лекарства на плод, а надлежащих исследований у беременных женщин не было, однако потенциальная польза, связанная с применением данного лекарства у беременных, может оправдывать его использование, несмотря на имеющийся риск). В связи с отсутствие данных об экскреции натрия гидрокарбоната в материнское молоко, ограничений для терапии кормящих грудью матерей нет.
Питьевая сода — традиционное, но опасное средство для купирования изжоги
| Bсе наклоненья и залогиИзжеваны до одного.Хватить бы соды от изжоги!Так вот итог твой, мастерство? Б.Л. Пастернак. «Bсе наклоненья и залоги». 1936. |
Натрия гидрокарбонат — традиционное средство для купирования изжоги, всасывающийся антацид. Всасывающимися называют антациды, которые или сами, или продукты их реакции с кислотой желудочного сока растворяются в крови.
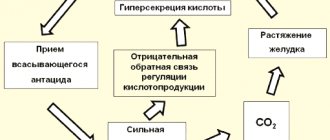
Положительным качеством всасывающихся антацидов является быстрое снижение кислотности после приёма лекарства. Отрицательными — кратковременность действия, кислотный рикошет (увеличение секреции соляной кислоты после окончания действия лекарства), образование углекислого газа при их реакции с соляной кислотой, растягивающего желудок и стимулирующего гастроэзофагеальные рефлюксы (см. справа рисунок из статьи Д.С. Бордина)
. Всасывание в кровь бикарбонатов может привести к развитию системного алкалоза, а их длительный приём в сочетании с молочной диетой — к развитию синдрома Бернетта (молочно–щелочного синдрома).
После приема 3 г гидрокарбоната натрия рН желудочного содержимого сохраняется на уровне выше 3 единиц рН лишь в течение 75 минут. Образующаяся при нейтрализации углекислота вызывает отрыжку и вздутие живота. Как редкое осложнение после приема гидрокарбоната натрия, описан разрыв желудка из-за резкого освобождения большого количества газа (А.В. Охлобыстин).
В XIX веке «сода» была одним из самых популярных средств от изжоги, например, её постоянно принимал П.И. Чайковский.
Натрий гидрокарбонат в составе кислотоподавляющих лекарств
Несмотря на отрицательное отношение к гидрокарбонату натрия как средству купирования изжоги, он иногда включается в состав лекарств, предназначенных для снижения кислотности в верхних отделах желудочно-кишечного тракта, в достаточном количестве, чтобы его рассматривать, как еще одно действующее вещество (хотя в инструкции к такому препарату гидрокарбонат натрия может быть перечислен среди вспомогательных, а не активных веществ).
Ингибиторы протонной помпы
. На рынке США представлены две версии ингибитора протонной помпы
Zegerid
. Собственно Zegerid — рецептурный и безрецептурный
Zegerid OTC
. В России Zegerid не имеет регистрации, но в России зарегистрирован
Омез Инста
. Оба лекарства содержат омепразол и гидрокарбонат натрия. В США Zegerid позиционируется, как единственный ингибитор протонной помпы «немедленного реагирования» и у которого отсутствует феномен «ночного кислотного прорыва». Он предназначен для для купирования симптомов гастроэзофагеальной рефлюксной болезни, краткосрочной (4–8 недель) терапии эрозивного эзофагита, подтвержденного данными эндоскопии, язв желудка и двенадцатиперстной кишки. Содержание омепразола и гидрокарбоната натрия в различных лекарственных формах этих препаратов приведено в таблице:
| Основные ингредиенты | Zegerid , капсула | Zegerid , капсула | Zegerid , пакетик* | Zegerid , пакетик* | Zegerid OTC , капсула | Омез Инста , пакетик* |
| Омепразол , мг | 20 | 40 | 20 | 40 | 20 | 20 |
| Натрия гидрокарбонат , мг | 1100 | 1100 | 1680 | 1680 | 1100 | 1680 |
Примечание. *) Пакетик содержит порошок для приготовления суспензии для приема внутрь.
Альгинаты.
Единственным лекарством для лечения кислотозависимых заболеваний из этой группы, допущенном в России, а также в США является
Гевискон
и его варианты Гевискон форте и Гевискон Двойное Действие. Кроме «основного» действующего вещества — натрия альгината, Гевискон содержит натрия гидрокарбонат и кальция карбонат. При попадании в желудок натрия альгинат быстро реагирует с его кислым содержимым, в результате чего образуется гель альгината, имеющий почти нейтральное значение кислотности (рН геля около 7). Гель образует защитный барьер на поверхности содержимого желудка, препятствуя возникновению гастроэзофагеальных рефлюксов. В случае регургитации или рефлюкса гель попадает в пищевод, где он оказывает нейтрализующее влияние на попадающие при рефлюксах соляную кислоту и пепсин и дополнительно защищает слизистую оболочку пищевода. Содержание натрия альгината и натрия гидрокарбоната в различных лекарственных формах Гевискона приведено в таблице:
| Основные ингредиенты | Гевискон , 10 мл суспензии | Гевискон , таблетка жевательная | Гевискон форте , 10 мл суспензии | Гевискон Двойное Действие , таблетка жевательная | Гевискон Двойное Действие , 10 мл суспензии |
| Натрия альгинат , мг | 500 | 250 | 1000 | 250 | 500 |
| Натрия гидрокарбонат , мг | 267 | 133,5 | — | 267 | 213 |
Натрия гидрокарбонат в составе других лекарств
Кроме описанных выше лекарств для лечения кислотозависимых заболеваний натрия гидрокарбонат входит, как действующее вещество, в частности, в следующие лекарства:
- осмотическое слабительное Эндофальк
, один пакетик которого включает: макрогол 3350 52,5 г, натрия хлорид 1,4 г, натрия гидрокарбонат 715 мг, калия хлорид 185 мг - осмотическое слабительное Лавакол
, один пакетик которого включает: макрогол 4000 12,0 г, натрия сульфат безводный 1,0 г, натрия гидрокарбонат 0,6 г, натрия хлорид 0,2 г, калия хлорид 0,2 г - противокашлевый препарат Коделак
, одна таблетка которого содержит: кодеин 8 мг, натрия гидрокарбонат 200 мг, порошок корня солодки 200 мг, порошок травы термопсиса ланцетного 20 мг - препарат для лечения кашля, оказывающий муколитическое и отхаркивающее действие, Коделак Бронхо
, одна таблетка которого содержит: амброксола гидрохлорид 20 мг, натрия глицирризинат 30 мг, сухой экстракт термопсиса 10 мг, натрия гидрокарбонат 200 мг - раствор для инфузий с дезинтоксикационным действием Гемодез-Н
, 100 мл которого содержит: повидон медицинский с молекулярной массой 8000 6 г, натрия хлорид 550 мг, калия хлорид 42 мг, кальция хлорид 50 мг, магния хлорид безводный 500 мкг, натрия гидрокарбонат 23 мг
Применение гидрокарбоната натрия при исследовании желудка (тест Ноллера)
Тест Ноллера (щелочной тест) выполняется с целью получения информации о количестве соляной кислоты в желудке пациента, об интенсивности кислотообразования, а также, косвенно, о количестве желудочного сока. Тест проводится одновременно с процедурой внутрижелудочной рН-метрии
, через 20 минут после стабилизации кислотности в базальных условиях или через 45 минут после введения стимуляторов. При рН равном или выше 4,0 щелочной тест не проводится.
Пациент выпивает 0,5 г гидрокарбоната натрия, растворенного в 30 мл дистиллированной воды. Обычно в теле желудка рН регистрируется ниже 2,5. В результате введения в желудок щелочи показатели рН изменяются до щелочных и в течение определенного времени сохраняются на одном уровне, а затем, через некоторое время, называемое «щелочным временем», возвращаются к исходным. По щелочному времени определяется состояние кислотопродукции желудка пациента (С.И. Рапопорт и др.):
| Оценка продукции соляной кислоты в желудке | Щелочное время , мин | |
| натощак | при стимуляции | |
| Резко повышенная кислотопродукция | <10 | <5 |
| Повышенная кислотопродукция | 10–20 | 5–10 |
| Нормальная кислотопродукция | 20–25 | 10–15 |
| Пониженная кислотопродукция | >25 | >15 |
На рисунке дан пример рН-граммы в
трёх отделах желудка
(в антруме — нижний график, в тела желудка — средний и в кардиальной, ближней к пищеводу отделе желудка — нижний график) пациента с хроническим поверхностным гастритом и повышенной кислотностью в антральном отделе. Показана базальная кислотность (первые 30 минут, базальная — то есть до какой-либо стимуляции) и кислотность после проведения щелочного теста (Щ) и стимуляции гистамином (СТ).
Бикарбонаты, как естественное средство защиты органов ЖКТ от кислоты
В желудке и двенадцатиперстной кишке ионы бикарбонатов HCO3– секретируются клетками поверхностного эпителия. Бикарбонаты играют важнейшую роль в пищеварительном процессе, нейтрализуя соляную кислоту и защищая ткани органов пищеварения от её воздействия.
В кислой среде ионы бикарбоната необратимо реагируют с ионами водорода с образованием воды и углекислого газа:
H+ + HCO3–= Н2CO3 = H2O + CO2
Бикарбонаты вместе со слизью составляют так называемый предэпителиальный уровень защиты слизистой оболочки желудка. Слизь не может защищать эпителий от ионов Н+ без постоянно поступающих в нее бикарбонатов, также секретируемых поверхностным эпителием. С помощью бикарбонатов в слизи поддерживается градиент рН: на поверхности, обращенной в просвет желудка, среда кислая, а у эпителиоцитов — нейтральная или слабощелочная. Немедленного смешивания бикарбонатов с кислым секретом в просвете и нейтрализации не происходит: слой слизи образует барьер, благодаря которому и существует градиент рН (Т.Л. Лапина ).
Бикарбонаты также секретируются протоковыми клетами поджелудочной железы и вместе с соком поджелудочной железы поступают в двенадцатиперстную кишку, где участвуют в нейтрализации соляной кислоты (О.А. Саблин и др.).
Гидрокарбонат в минеральных водах
Ионы гидрокарбонатов HCO3– присутствуют практически во всех природных минеральных водах. Для их определения в воде применяется ГОСТ 23268.3-78 «Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Методы определения гидрокарбонат-ионов». Согласно ГОСТ Р 54316-2011. «Воды минеральные природные питьевые. Общие технические условия» содержание гидрокарбонаты указывается на потребительской таре (на этикетках бутылок с минеральной водой).
Содержание гидрокарбонатов в некоторых природных минеральных водах (г/л):
- лечебные минеральные воды:
- Нагутская-17 — 5,0–7,2
- Ессентуки № 17 — 4,9–6,5
- Нагутская-56 — 4,2–5,6
- Ессентуки № 4 — 3,4–4,8
- Нарзан — 1,0–1,5
- Кашинская — менее 0,05
- Геленджикская 117 — 0,35–0,7
- Ессентуки Новая-55 — 0,2–0,35
Анионы гидрокарбоната придают минеральной воде щелочной характер и чаще всего сочетаются с катионами натрия, образуя гидрокарбонат натрия. Гидрокарбонатно-натриевые воды повышают щелочной резерв крови, оказывают антацидное действие (за счет снижения концентрации ионов Н+), уменьшают спазм привратника и ускоряют эвакуацию желудочного содержимого, что способствует уменьшению боли и диспепсических явлений. Щелочные воды разжижают и способствуют удалению избытка слизи, которая образуется при воспалении в желудочно-кишечном тракте, мочевыводящих и дыхательных путях. Кроме того, они улучшают нуклеиновый обмен, уменьшают образование мочевой кислоты и способствуют выведению избытка ее из организма, ощелачивают желчь и усиливают выделение с ней билирубина, холестерина и слизи. При сахарном диабете эти воды уменьшают гипергликемию и повышают толерантность к углеводам. И, наконец, в сочетании с гидрокарбонатом из кишечника лучше всасываются макро- и микроэлементы, в частности железо (Барановский А.Ю. и др.).
Профессиональные медицинские статьи, затрагивающие роль бикарбонатов и натрия гидрокарбоната в гастроэнтерологии
- Михеев А.Г., Невский Д.И., Ракитин А.Б., Ракитин Б.В. Исследование динамики рН при щелочном тесте // Известия ВУЗов. Северо-Кавказский регион. Естественные науки. – 2006. Спецвыпуск. – С. 44–46.
- Саблин О.А., Гриневич В.Б., Успенский Ю.П., Ратников В.А. Желудок. Методы исследования щелочной секреции. Функциональная диагностика в гастроэнтерологии. СПб. 2002 г.
- Лапина Т.Л. Возможности лекарственного воздействия на цитопротективные свойства гастродуоденальной слизистой оболочки // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2006. – №5. – том XVI. – c. 2–7.
- Ушкалова E.А. Клиническая фармакология современных антацидов // Фарматека. – 2006. – №11. – с.1–6.
- Гельфанд Б.Р. , Филимонов М.И., Мамонтова О.А. и др. Профилактика и лечение стресс-повреждений ВО ЖКТ у больных в критических состояниях // Методические рекомендации. — Москва. — 2010. — 34 с.
На сайте в каталоге литературы имеется раздел «Антациды», содержащий статьи, посвященные терапии заболеваний органов ЖКТ антацидными средствами. Назад в раздел
Передозировка
При превышении рекомендуемой инструкцией возможно развитие гипералкалоза и тетанические судороги. При развитии гипералкалоза слеудет прекратить введение препарата. Если есть риск развития тетании, больному назначают введение в вену 1-3 грамм кальциевой соли глюконовой кислоты (кальция глюконата).
Взаимодействие
Под влиянием бикарбоната натрия повышается рН мочи, что приводит к:
- уменьшению выведения амфетамина;
- снижению токсичности и усилению выведения метотрексата;
- задержке выведения из организма эфедрина и повышению риска развития связанных с его приемом побочных эффектов — нарушения сна, повышения тревожности, тремора, тахикардии.
На фоне применения поддерживающей дозы лития карбоната бикарбонат натрия способствует уменьшению плазменной концентрации лития, что обусловлено влиянием ионов Na.
Препарат способствует уменьшению всасывания тетрациклинов при одновременном приеме внутрь.
Раствор для инфузий при капельном введении в вену может способствовать усилению антигипертензивного действия резерпина.
Раствор реагирует с кислотами (аскорбиновой, никотиновой и др.), алкалоидами (кофеином, Атропином, теобромином, апоморфином, Папаверином), солями кальция, тяжелых металлов (меди, цинка, железа), магния, сердечными гликозидами, что сопровождается выпадением осадка или гидролизом (разложением) органических соединений. Поэтому указанные вещества не следует растворять в растворе Натрия гидрокарбоната.
Также не следует смешивать гидрокарбонат натрия с растворами, в состав которых входит фосфор.
Натрия гидрокарбонат порошок для приготовления раствора для наружного применения 10г
Наименование
Натрия гидрокарбонат пор 10г пак.
Описание
Белый кристаллический порошок без запаха, медленно разлагается во влажном воздухе. Водные растворы имеют щелочную реакцию.
Основное действующее вещество
Натрия гидрокарбонат
Форма выпуска
Порошок
Фармакологическое действие
Натрия гидрокарбонат — белый кристаллический порошок, растворяется в воде с образованием щелочных растворов. Раствор питьевой натрия гидрокарбоната используется в качестве слабого антисептика для полосканий, а также как кислотонейтрализующее средство.
Показания к применению
в комплексной терапии воспалительных заболеваний полости рта; как нейтрализатор при ожогах кожи и слизистых оболочек кислотами.
Способ применения и дозы
Натрия гидрокарбонат используют для приготовления водных растворов для полоскания и промывания. При стоматитах для полосканий применяют 0,5%-2% растворы (1 чайная ложка натрия гидрокарбоната на 1 л воды — 1 чайная ложка натрия гидрокарбоната на 1 стакан воды). Для промывания кожи и слизистых оболочек при попадании на них кислот, раздражающих и отравляющих веществ (фосфорорганических и хлорорганических) — 2% раствор натрия гидрокарбоната (1 чайная ложка натрия гидрокарбоната на 1 стакан воды).
Меры предосторожности
Не рекомендуется принимать натрия гидрокарбонат внутрь. При применении внутрь возможно защелачивание мочи и повышение риска образования фосфатных камней. Сдвиг кислотно-основного состояния в щелочную сторону при кратковременном приеме не сопровождается клиническими симптомами, однако при хронической почечной недостаточности возможно значительное ухудшение состояния. Рвота, часто сопровождающая язвенную болезнь, способна усиливать выраженность алкалоза. Препарат не рекомендуется применять внутрь для лечения изжоги и болей в желудке. Это связано с тем, что при нейтрализации соляной кислоты желудка гидрокарбонатом натрия происходит выделение углекислоты, которая оказывает возбуждающее действие на рецепторы слизистой оболочки желудка, усиливает выделение гастрина и может вызвать вторичное усиление желудочной секреции — «кислотный рикошет». Интенсивное выделение СО2 может спровоцировать перфорацию стенок желудочно-кишечного тракта. У больных с сопутствующими заболеваниями сердца или почек избыточное употребление Na+ вызывает отеки и сердечную недостаточность. Применение во время беременности и в период лактации. При наличии показаний, применение лекарственного средства возможно только после оценки соотношения пользы и риска для матери и плода/ребенка. Влияние на способность к управлению автотранспортом и другими потенциально опасными механизмами. Не влияет.
Взаимодействие с другими препаратами
При совместном использовании снижается выведение с мочой амфетамина из-за увеличения pH мочи под действием гидрокарбоната натрия. При приеме внутрь гидрокарбоната натрия на фоне использования карбоната лития возможно снижение в плазме крови концентрации лития, что обусловлено воздействием ионов натрия. При совместном использовании с метотрексатом повышается выведение с мочой метотрексата и снижается его токсическое влияние на почки из-за увеличения pH мочи под действием натрия гидрокарбоната. При совместном приеме внутрь с гидрокарбонатом натрия снижается всасывание тетрациклинов. Из-за увеличения pH мочи под действием гидрокарбоната натрия наблюдается замедление выведения из организма эфедрина и увеличивается возможность развития побочных реакций (тремор, нарушения сна, тревога, тахикардия).
Противопоказания
Гиперчувствительность, гипокальциемия, состояния, которые сопровождаются развитием алкалоза; гипохлоремия.
Состав
Натрия гидрокарбонат — 10 г.
Передозировка
При передозировке гидрокарбонатом натрия усиливаются побочные эффекты. Необходимо поддерживающее и симптоматическое лечение.
Побочное действие
При продолжительном использовании — алкалоз и его клинические проявления: тошнота, потеря аппетита, боли в животе, рвота, головная боль, беспокойство, тетанические судороги; повышение артериального давления; при применении свечей — позывы на дефекацию, послабляющий эффект, метеоризм, диарея, урчание. В случае возникновения вышеперечисленных побочных реакций или побочных реакций, не указанных в данной инструкции по медицинскому применению лекарственного средства, необходимо обратиться к врачу.
Условия хранения
Хранить в недоступном для детей месте. Хранить в защищенном от влаги месте при температуре не выше 25°С.
Особые указания
Бикарбонат натрия — это что? Все о пищевой соде
Что такое сода, знают все. Это мелкий кристаллический порошок белого цвета со специфическим соленощелочным вкусом. Согласно Википедии, вещество совершенно нетоксично для человеческого организма, а также взрыво- и пожаробезопасно.
В Фармакопее указывается, что порошок устойчив в сухом воздухе, практически нерастворим в 95% спирте и хорошо растворим в воде. Под воздействием влаги медленно разлагается.
Если гидрокарбонат натрия прокалили, он теряет в весе. При прокаливании порошка при температуре 280-300°С его масса уменьшается как минимум на 36,6%.
Вещество известно под названиями натрий двууглекислый, пищевая (или питьевая) сода, бикарбонат (или гидрокарбонат) натрия. Питьевая сода является чистым веществом и представляет собой кислую соль натрия и угольной кислоты (H2CO3).
Нейтрализует кислоты (довольно часто встречаются указания типа “соляную или азотную кислоту нейтрализовали содой”).
Химическая формула пищевой соды (или, иначе говоря, формула гидрокарбоната натрия) — NaHCO3. Рациональная формула натрия двууглекислого — CHO3Na.
Название вещества на латинском — Sodium bicarbonate (Sodium hydrogen carbonate).
Натрий двууглекислый выпускается по ГОСТ 2156 76. Стандарт является действующим и распространяется на продукт, который выпускается для нужд химической, легкой, пищевой, фармацевтической и медицинской промышленности, розничной торговли и цветной металлургии.
Кальцинированная сода и пищевая сода — одно и то же? Кальцинированная сода — что это такое?
Натрий двууглекислый и кальцинированная сода — это два разных продукта, которые не следует путать. Что такое кальцинированная сода? Это вещество с химической формулой Na2CO3. Главным его отличием от гидрокарбоната натрия является степень щелочной активности.
Если натрий двууглекислый — это слабая щелочь с водородным показателем 8,1, то кальцинированная сода проявляет сильные основные свойства (ее показатель рН — 11).
В Общероссийском классификаторе продукции пищевой и кальцинированной соде присвоены разные коды ОКПД.
Кальцинированная сода используется для бытовых нужд: смягчения воды, чистки посуды, кафеля, мытья полов, устранения засоров труб, предотвращения образования накипи и т.д..
Целебные свойства, польза и вред пищевой соды
Области применения натрия двууглекислого достаточно разнообразны. Его используют для профилактики инсультов, лечения онкологических и ряда других серьезных заболеваний, алкоголизма, табачной и любых других видов зависимости (в том числе от токсичных и наркотических веществ), для выведения из организма вредных веществ и шлаков, для ухода за волосами.
Очень многие российские врачи рекомендуют использовать лечебные возможности пищевой соды в качестве достойной альтернативы традиционным методам лечения.
Сода уничтожает ацидоз и провоцирует щелочной сдвиг, что сопровождается ощелачиванием пищеварительных соков, диссоциацией содержащейся в организме воды на ионы ОН- и Н+ за счет аминокислот, ферментов, аминных щелочей, нуклеотидов Д- и РНК и общим оздоровлением организма.
У здорового человека желчь и соки поджелудочной и бруттнеровой желез, слизистой 12-типерстной кишки должны быть щелочными: пищеварение может нормально протекать только в щелочной среде. Кроме того щелочная среда губительна для паразитов — аскарид, червей из рода Opisthorchis, остриц, цепней и т.д..
В щелочной среде в разы повышается биохимическая активность тиамина, холина, витамина РР, пиридоксина, кобамамида.
При повышенной кислотности кислой становится и слюна, из-за чего у человека постепенно начинает разрушаться зубная эмаль. Поэтому для лечения кариеса и ощелачивания слюны применение фтор содержащих паст дополняют назначением соды.
А.Т. Огулов, например, настоятельно рекомендует использовать этот продукт при лечении болезней зубов и ротовой полости для массажа десен, полосканий и приема внутрь.
Разведенная в стакане воды чайная ложка соды — это известное средство от изжоги. А еще натрия гидрокарбонат используют для лица: добавляя каждый день щепотку соды в пенку или гель для умывания, можно хорошо почистить кожу от черных точек и слоя ороговевших поверхностных клеток, снять воспаление и избавиться от прыщей.
Очень хорошо помогает при высыпания маска из размолотых в пудру овсяных хлопьев (1 стакан) и соды (1 чайная ложка). Ингредиенты хорошо перемешивают и пересыпают в стеклянную банку. Для приготовления маски столовую ложку смеси заливают водой, чтобы получилась кашица. Массу наносят на лицо на 15-25 минут.
Большим плюсом средства является то, что оно не имеет противопоказаний и подходит для всех типов кожи.
Соду используют при укусах насекомых, солнечных ожогах, цистите, неприятном запахе изо рта и от ног, опрелостях, мигренях и простуде.
Большие дозы соды не всасываются с водой и вызывают понос, что позволяет использовать натрия гидрокарбонат в качестве мягко действующего слабительного средства.
Зная всё о том, что это такое — пищевая сода, и насколько она полезна, следует определить всегда ли можно пить ее. Итак, когда Натрия гидрокарбонат вместо пользы может навредить организму?
Средство представляет опасность при любых сопутствующих болезнях почек и сердца, индивидуальной непереносимости, а также при попадании на слизистую глаз.
При систематическом приеме в желудке начинает выделяться углекислота, которая действует возбуждающе на рецепторы слизистой желудка, стимулирует выделение гастрина и способна вызвать вторичное усиление секреции. При регулярном приеме также повышается риск образования фосфатных конкрементов.
Выведение углекислоты может стать причиной перфорации стенок пищеварительного канала.
Чем полезна питьевая сода в быту?
В быту гидрокарбонат натрия используется при выпечке хлебобулочных и кондитерских изделий, для удерживания неприятных запахов в кошачьем туалете, чистки мусорного ведра от загрязнений и запаха, мытья плитки, обоев и сантехники, мытья рук после работы с сильно пахнущими продуктами (луком, чесноком и т.д.), ускорения варки бобовых, в качестве средства от муравьев.
Как почистить пятки содой? Из чего делают содовые ванночки для ног?
Соду нередко используют для смягчения пяток и устранения неприятного запаха от ног. Чтобы приготовить ванночку, следует добавить к литру теплой воды столовую (без горки) ложку гидрокарбоната натрия и пару капель любого эфирного масла. Ноги держат в воде в течение 15 минут (делать ванночку лучше на ночь).
После того, как кожа размягчится, ее следует аккуратно обработать пемзой. Затем ноги ополаскивают водой и смазывают жирным кремом, а сверху надевают носки.
Вместо воды можно использовать теплое молоко.
Для приготовления скраба для ног, можно смешать 1 ч. ложку растительного масла (например, оливкового) со столовой ложкой соды, а можно просто развести соду водой до кашицеобразного состояния. Смесь наносят на кожу и хорошо массируют, чтобы убрать огрубевшую кожу.
Елена Рерих о пищевой соде
Рерих Е.И. (русский религиозный философ, общественный деятель и писательница) считала лечебные свойства пищевой соды настолько сильны, что регулярный прием 2 раза в день этого простого и доступного средства позволяет предупредить многие болезни, включая в том числе и онкологические.
При сильном напряжении сама Елена Ивановна принимала до 8 кофейных ложек пищевой соды в день, высыпая их на язык и запивая водой. Детям она советовала разводить соду в горячем молоке. Такой рецепт в народной медицине нередко используется для лечения простудных заболеваний, которые сопровождаются сильным кашлем.
Горячее, доведенное почти до кипения, молоко с содой хорошо снимает не только боль и воспаление в горле, но и ломоту в теле.
Прием соды является самым простым и естественным методом решить проблему запора. Кроме того, вещество хорошо нейтрализует ядовитые вещества.
В работах Е.И. Рерих встречаются упоминания и о лечении рака бикарбонатом натрия. Автор указывает, что сода является важной составной частью крови человека. Она присутствует в плазме и лимфоплазме, в которой находятся лимфоциты. Предположительно, сода необходима для энергетического питания лимфоцитов — клеток, которые отвечают за иммунный ответ организма.
Меры предосторожности
При появлении признаков алкалоза следует сделать перерыв в лечении. Если препарат используется для коррекции ацидоза, следует держать под контролем показатели КЩР.
Щёлочность
Описание: многоуровневый интегральный параметр, отражающий концентрацию анионов слабых органических и неорганических кислот в воде, в основном — угольной. Характеризует направленность гидро- и геохимических процессов, коррозионной агрессивности воды по отношению к бетону, стали, отопительным котлам, парогенераторам.
Методы определения: титриметрия с использованием индикаторов, потенциометрическое определение.
Типы щёлочности
| Тип | Обусловленность |
| Свободная щелочность | Наличие в воде карбонат-ионов CO2−3 и гидроксильных ионов OH− в водах с pH > 8,3 |
| Карбонатная щелочность | Наличие в воде продуктов диссоциации угольной кислоты — карбонатов CO2−3 и гидрокарбонатов HCO−3, находящихся в равновесии |
| Общая щелочность | Наличие в воде анионов слабых неорганических и органических кислот, титруемых сильной кислотой |
Методики, используемые в Испытательном центре МГУ определения концентрации гидрокарбонатов в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
| Вода | ||
| ГОСТ 31957-2012 | титриметрия | вспомогательное оборудование |
| РД 52.24.493-2006 | титриметрия | вспомогательное оборудование |
| Почва | ||
| ГОСТ 26424-85 | титриметрия | весы |
Распространённость: гидрокарбонаты HCO−3, карбонаты CO2−3, гидроксид-ион OH− и ионы слабых органических и неорганических кислот появляются в природной воде естественным образом в процессе растворения в воде углекислого газа, минералов и вмещающих пород при контакте воды с почвой. Поэтому практически все типы вод характеризуются щёлочностью отличной от нуля. Щёлочность тесно связана с показателем pH, поэтому разные щёлочности могут не присутствовать в воде одновременно.
Аналоги
Синонимами являются препараты Сода Буфер и Натрия бикарбонат. Код ATC 4-го уровня совпадает с Глюксилом, Калия хлоридом, Кальция хлоридом, Ксилатом, Лактоксилом, Магния сульфатом, Натрия хлоридом, Плериго, Реамберином.
Похудение с помощью пищевой соды. Польза и вред пищевой соды
Сода пищевая для похудения используется с целью изменить кислотность в организме, нормализовать пищеварение и облегчить течение ряда других физиологических процессов, а также уменьшить аппетит.
Рецепт пищевой соды для похудения следующий: свежевыжатый сок 3-х лимонов и 1 ст. ложку Натрия гидрокарбоната на литр воды.
Опасность использования питьевой соды для похудения заключается в том, что при систематическом приеме раствора натрия двууглекислого можно спровоцировать возникновение ряда болезней пищеварительной системы (или усугубить уже имеющиеся заболевания).
Более безопасный рецепт похудения — это содовые ванны. Натрия гидрокарбонат в горячей воде (36-37°C) стимулирует открытие пор и выведение токсинов, благодаря чему тело освобождается от избыточного веса и уменьшает свои объемы.
Для приготовления ванны на 150-200 л следует развести в небольшом объеме очень горячей воды 200 г соды.
Даже если такая процедура не решит кардинально проблему лишнего веса, ее польза для организма будет огромной, поскольку она позволит очистить лимфатическую систему, уменьшить проявления целлюлита (в особенности, если добавить в воду эфирные масла), улучшить состояние кожи и укрепить нервную систему.
Нормирование
С нормированием щёлочностей дела обстоят сложно. Сама по себе эта группа параметров в воде не нормируется. Однако нормируются гидрокарбонаты (только в бутилированной воде), частично обуславливающие значение щёлочностей. Содержание карбонатов напрямую не нормируются, но, если учесть, что в питьевой воде строго нормируется pH, свободная щёлочность в питьевой воде должна быть равна нулю.
Предельно допустимая концентрация (ПДК) гидрокарбонатов в различных типах вод
| Нормирование | ПДК, мг/л |
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–400 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 30–400 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | — |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | — |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Сточные воды в бытовых системах водоотведения Постановление Правительства РФ № 644 | — |
| Сточные воды в ливневых системах водоотведения Постановление Правительства РФ № 644 | — |
Отзывы
Сода — это проверенное временем средство “для красоты, чистоты и здоровья”. Именно такие отзывы о Натрия гидрокарбонате можно найти в сети Интернет. Его используют для чистки лица, отбеливания зубов и лечения кариеса, для похудения и ухода за волосами, а также для определения беременности.
К слову, отзывы о соде пищевой для похудения весьма оптимистичны, но лишь в тех случаях, когда она рассматривалось не как панацея, а как вспомогательное средство. Некоторые девушки отмечают, что после содовой ванны у них сразу уходило до 2 кг веса, но без физических нагрузок, корректировки питания процедуры не дали бы видимого результата.
Нетрадиционная медицина использует Натрия гидрокарбонат для лечения рака. Найти отзывы о лечении содой при онкологии с описанием результатов лечения самим человеком довольно сложно. Известно лишь то, что пациенты врача, который пропагандирует этот метод лечения, также умирают.
Статистики излечившихся от рака содой нет. Самолечение, когда речь идет о раке, чревато потерей времени и шанса на излечение.
Цена Натрия гидрокарбоната
Купить в аптеке Бикабонат натрия в форме 4%-ного раствора можно за 15-28 грн. В российских аптеках его цена от 103 до 160 рублей (зависит от объема флакона и производителя).
Сколько стоит сода пищевая?
Цена пищевой соды за кг — в среднем 2,5 грн (17-25 российских рублей), за пачку 500 г — 3,8 грн (11-16 российских рублей).
Купить оптом гидрокарбонат натрия можно примерно за 3,2-3,5 тыс. грн/т (около 10 тыс. руб./т).
- Интернет-аптеки РоссииРоссия
- Интернет-аптеки УкраиныУкраина
ЗдравСити
- Натрия гидрокарбонат р-р д/инф. 40мг/мл фл. 200мл №28ОАО Дальхимфарм
1880 руб.заказать
Аптека Диалог
- Натрия гидрокарбонат (фл. 40мг/мл 200мл)Дальхимфарм
1685 руб.заказать
показать еще
Аптека24
- Натрия гидрокарбонат 4% 100 мл раствор ТОВ»Юрія-Фарм», Україна
27 грн.заказать - Натрия гидрокарбонат 4% 200 мл раствор ТОВ»Юрія-Фарм», Україна
35 грн.заказать
Карбонаты и гидрокарбонаты
ГИДРОСФЕРА
Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов, например:
CaCO3 + CO2 + H2O <�–> Сa2+ + 2HCO3-;
MgCO3 + CO2 + H2O <�–> Mg2+ + 2HCO3-.
Некоторая часть гидрокарбонатных ионов поступает с атмосферными осадками и грунтовыми водами. Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние могут выпадать в осадок:
Ca(HCO3)2–> CaCO3 + H2O + CO2;
Сa2+ + CO32-–> CaCO3.
В речных водах содержание гидрокарбонатных и карбонатных ионов колеблется от 30 до 400 мг HCO3-/дм3, в озерах – от 1 до 500 мг HCO3-/дм3, в морской воде – от 100 до 200 мг/дм3, в атмосферных осадках – от 30 до 100 мг/дм3, в грунтовых водах – от 150 до 300 мг/дм3, в подземных водах – от 150 до 900 мг/дм3.
Карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферного СО2, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, жизненными процессами дыхания всех водных организмов.
Определение карбонат- и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидрокарбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0-8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН. 4,1-4,5) – гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислот (гидроксо-, карбонат- и гидрокарбонат-анионов),
а также величины свободной и общей щелочности воды, т.к. они находятся в стехиометрической зависимости от содержания гидроксол-, карбонат- и гидрокарбонат-анионов. Для титрования обычно используют титрованные растворы соляной кислоты с точно известным значением концентрации 0,05 г-экв/л либо 0,1 г-экв/л.
Определение гидрокарбонат-анионов основано на реакции:
СО3 2- + Н+ =НСО3.
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0-8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
ОН-+Н+=Н2О.
Определение гидрокарбонат-анионов основано на реакции:
НСО3-+Н+=СО2+Н2О.
Таким образом, при титровании по фенолфталеину в реакции с кислотой участвуют анионы ОН- и СО32- , а при титровании по метиловому оранжевому – ОН- , СО32- и НСО3- .
Величина карбонатной жесткости рассчитывается с учетом эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
При анализе карбонатных природных вод правильность получаемых результатов зависит от величины потребления кислоты на титрование по фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной, то в присутствии метилового оранжевого, при изменении окраски от желтой до оранжевой, определить момент окончания титрования иногда довольно сложно. Это может привести к значительной ошибке при определении объема кислоты, израсходованной на титрование. В этих случаях, для более четкого выявления момента окончания титрования, определение полезно проводить в присутствии контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию анализируемой воды (во второй склянке), добавляя такое же количество индикатора.
В результате титрования карбоната и гидрокарбоната, которое может выполняться как параллельно в разных пробах, так и последовательно в одной и той же пробе, для расчета значений концентраций необходимо определить общее количество кислоты (V0) в миллилитрах, израсходованной на титрование карбоната (VK) и гидрокарбоната (VГК). Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (Vмо) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты Vмо содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обусловливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (Vф) и метилоранжу (Vмо). Рассмотрим несколько возможных вариантов, сопоставляя величины Vф и Vмо.
1. Vф = 0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
2. Vф ¹ 0, причем 2Vф < Vмо. В исходной пробе отсутствуют гидроксо-анионы, но присутствуют и гидрокарбонаты, и карбонаты, причем доля последних эквивалентно оценивается как VК = 2VФ, а гидрокарбонатов – как VГК = VМО – 2VФ .
3. 2 VФ = Vмо. Гидрокарбонаты в исходной пробе отсутствуют, и потребление кислоты обусловлено содержанием практически только карбонатов, которые количественно переходят в гидрокарбонаты. Именно этим объясняется удвоенное, по сравнению с Уф, потребление кислоты Vмо.
4. 2 VФ> Vмо. В данном случае в исходной пробе гидрокарбонаты отсутствуют, но присутствуют не только карбонаты, но и другие потребляющие кислоту анионы, а именно – гидроксо-анионы. При этом содержание последних эквивалентно составляет Vон = 2Vф – Vмо. Содержание карбонатов можно рассчитать, составив и решив систему уравнений:
5. VФ = Vмо. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено присутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных водах.
Массовые концентрации анионов (не солей!) рассчитываются на основе уравнений реакций потребления кислоты карбонатами (Ск) и гидрокарбонатами (Сгк) в мг/л по формулам:
| С к= 2 • VA С гк = ( VA | где V к и Н – точная концентрация титрованного раствора соляной кислоты (нормальность), г-экв/л; V A – объем пробы воды, взятой для анализа, мл; 60 и 61 – эквивалентная масса карбонат- и гидрокарбонат-аниона соответственно, в соответствующих реакциях; 1000 – коэффициент пересчета единиц измерений. |
Результаты титрования по фенолфталеину и метилоранжу позволяют рассчитать показатель щелочности воды, который численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л. При этом потребление кислоты при титровании по фенолфталеину характеризует свободную щелочность, а по метилоранжу – общую щелочность, которая измеряется в мг-экв/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСО3.
Следует иметь в виду, что при анализе сточных и загрязненных природных вод получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп.