- Резюме
- Введение
- Вакцинация
- Результаты исследования и их обсуждение
- Выводы
- Литература
РЕЗЮМЕ
Для профилактики сезонных острых респираторных вирусных инфекций используются три основных подхода: вакцинация, использование индукторов интерферона и препаратов интерферона. Обсуждается эпидемиологическая эффективность различных методов профилактики.
K.G. Gurevich Prophylactics of seasonal acute respiratory virus infections
For seasonal acute respiratory virus infections prophylactics the three common methods are used: vaccination, interferon-inductors drugs, and interferon. Epi-demiological effectiveness of different prophylactics methods is discussed.
ВВЕДЕНИЕ
Проблема профилактики острых респираторных вирусных инфекций (ОРВИ) в настоящее время представляется весьма актуальной в виду исключительно высокого уровня заболеваемости. Всплески числа инфицированных и заболевших ОРВИ обычно носят характер сезонных эпидемий, что приводит к значительным экономическим потерям. Высокий уровень заболеваемостью ОРВИ связан с исключительной легкостью распространения вирусов в скученных коллективах людей (на работе, в транспорте, внутри семьи и т.д.) и практически полным отсутствием возможностей профилактики распространения вирусов через воздух. В наибольшей степени подвержены сезонной заболеваемости ОРВИ лица из так называемых групп риска: дети, пожилые, больные с различными видами иммунодефицитов, бронхолегочными заболеваниями, болезнями почек, сахарным диабетом, раком, гемофилией и др. [18]. В настоящее время разработаны, в основном, симптоматические методы лечения ОРВИ; исключение составляют препараты интерферонов и ингибиторы включения вируса в клетку (римантадин, арбидол). В 1960-80 гг. наблюдалось тенденция к использованию антибиотиков (в первую очередь, макролидного ряда), для лечения ОРВИ, которая не только не увенчалась успехом, но и привела к появлению большого числа резистентных микроорганизмов [1]. Поэтому в настоящее время большое внимание уделяется профилактике ОРВИ.
Профилактика ОРВИ может вестись по трем основным направлениям: 1. Вакцинация. 2. Использование иммуномодуляторов и индукторов интерферонов. 3. Применение препаратов интерферонов.
Заметим, что последнее направления профилактики также может быть использовано для патогенетически обоснованной терапии ОРВИ.
Страница 212
ВАКЦИНАЦИЯ
Вакцинация проводится только против определенных (заранее известных) штаммов возбудителей ОРВИ. Несмотря на то, что современные вакцины содержат несколько штаммов вирусов, она оказывается неэффективной вначале эпидемии, когда не установлены актуальные штаммы, вызвавшие эпидемию. Также она оказывается неэффективной в случае, если наблюдается мутация вируса. Кроме того, для того, чтобы вакцинация оказалась эффективной, необходимо ее проведение за 2-3 недели до начала эпидемии. Существенным ограничением для проведения вакцинации является детский возраст (обычно до 7 лет), беременность и лактация, гиперчувствительность к компонентам вакцин и иммунодефициты [7]. Между тем, на сегодняшний день вакцинация считается наиболее эффективным и безопасным методом профилактики ОРВИ не только у людей, но и у животных [33]. В настоящее время разработаны как инъек-ционные, так и интраназальные виды вакцин. Эффективность примене-ния вакцин двух видов примерно равна и составляет более 90% [32]. Во многих странах мира вакцинация против сезонных эпидемий включено в государственные медицинские программы [37]. Интересно отметить, что вакцинация обладает не только пассивным действием на иммунитет, как это полагали раньше, но активно стимулирует выработку антител против вируса-возбудителя, по-видимому, оказывая праймирующее (подготовительное) действие. Причем этот эффект наблюдается не только у здоровых лиц, но и у людей из групп риска [18]. Показано, что профилактическая вакцинация против ОРВИ более оправдана с экономической точки зрения, чем последующее лечение. Так, в результате широкого эпидемиологического исследования, проведенного в Финляндии, обнаружено, что стоимость вакцинации составляет 141 финскую марку (фм) на 1 человека. Заболеваемость среди вакци-нированных составляет примерно 5%, не подвергшихся вакцинации — 47%. В случае, если после вакцинации человек заболевает, то его лечение обходится в среднем в 1183 фм. Если заболевает невакцинированный человек, то его лечение стоит примерно в 5,3 раз дороже (6270 фм) [32]. Разница в стоимости лечения лиц, подвергшихся и неподвергшихся вакцинации, вероятно, связана с отмеченной выше стимуляцией иммунитета под влиянием иммунизации. Показано, что проведение вакцинации позволяет снизить не только вероятность инфицирования в период эпидемии, но и вероятности возникновения сердечных осложнений в случае инфицирования [40], уменьшить число летальных исходов от ОРВИ [36].
ИММУНОМОДУЛЯЦИЯ
Средства для иммуномодуляции наиболее широко представлены на фармакологическом рынке РФ; существующие препараты можно разделить на три основные группы: · витамины и микроэлементы; · индукторы интерферона; · другие.
Препараты витаминов и микроэлементов обладают общестимулирующим и иммуномодулирующим действием [5, 9]. При этом могут быть использованы как монопрепараты витаминов и микроэлементов, так и их комплексы. Двойные слепые плацебо-контролируемые испытания показали что введение цинка (10 мг в день в виде сульфата, 6 дней в неделю в течение 6 мес) в структуру питания 100 детей в Эпиофии в возрасте от 6 до 12 мес уменьшало число эпизодов ОРDB [42]. Многоцентровое исследование о возможном влиянии селена на число респираторных заболеваний у недоношенных детей проводилось в Новой Зеландии. Обследовано 534 девочки, рожденные с весом до 1,5 кг, с первой недели жизни до первой менструации. Селен назначали в дозе 7 мкг/кг/день парентерально в младеческом возрасте или 5 мг/кг/день орально в старшем возрасте. Описано увеличение содержания селена и глютатионпероксидазы в плазме крови в группе, принимавшей селен по сравнению с плацебо-пруппой. При этом в раннем возрасте низкое содержание селена было связано с повышенным риском смерти из-за вирусных респираторных заболеваний [20]. В многоцентровом исследовании, проводившемся в США течение 2 лет, доказано, что ежедневное назначение даже половины рекомендуе-мой дозы цинка и селена пожилым людям существенно снижает заболеваемость ОРВИ [30]. Многоцентровое исследование SU.VI.MAX (SUpplementation en Vitamines et Mineraux AntiOxidant Studi), проведенное во Франции, включало в себя наблюдение в течение 8 лет за 12735 людьми. Обследо-ваны женщины в возрасте 35-60 лет и мужчины — 45-60 лет. Исследуе-мые каждый день получали МЭ селен- 100 мкг, цинк-20мг и антиок-сидантные витамины С-120 мг, Е-30 мг, b-каротин — 6 мг (100-300% от рекомендуемой дозы). Показано, что назначение микроэлементов с витаминами снижало риск развития ОРЗ и ОРВИ [26]. Аналогичный ре-зультат был получен в многоцентровом исследовании MIN.VIT.AOX [24]. Необходимо отметить, что для того, чтобы проявились иммуномодулирующие эффекты микроэлементов и витаминов, необходимо их длительное применение. Так, в исследовании SU.VI.MAX значимое снижение заболеваемости ОРВИ наблюдалось только через 6 мес. после приема витамино-минеральных комплексов [23].
Индукторы интерферона.
В настоящее время двойные слепые плацебо-контролируемые испытания установили эффективность применения нескольких низкомолекулярных индукторов интерферона — амиксина, циклоферона, бендазола и дипиридамола. При этом последние два препарата изначально имели показания к применению в качестве вазодилатаров. Несмотря на то, что многие вазодилататоры потенциально являются индукторами интерферона [6], клиническая эффективность их применения не подтверждена. Индукторы интерферона представляются одними из наиболее перспективных препаратов для профилактики сезонных эпидемий ОРВИ. Это связано с тем, что они «включают» естественные механизмы противовирусной защиты, которые сохраняются даже после применения этих препаратов [13].
Амиксин и циклоферон
— сходные индукторы биосинтеза интерферона, при этом первый является преимущественным индуктором биосинтеза интерферона-alfa/betta Т-клетками, а второй — интерферона-alfa В-клетками. Двойные слепые плацебо-контролируемые испытания показали клиническую эффективность препаратов, которая в случае профилак-тики ОРВИ достигает 80% [41].
Бендазол (дибазол, глиофен)
потенцирует образование интерферона [8]. Двойные слепые плацебо-контролируемые испытания показали, что профилактический прием бендазола оказывается эффективным в более чем в 80% случаев для профилактики сезонных эпидемий ОРВИ [10]. В настоящее время правительством г.Москвы всем школьникам города раздается бендалоз в период эпидемиологических вспышек ОРВИ для профилактики заболеваемости. Ограничения к применению бендазола: пожилой возраст, индивидуальная непереносимость препарата [7].
Дипиридамол (курантил, персантил, парседил, аподипиридамол)
является индуктором интерферона как in vitro [2, 22], так in vivo [14, 15]. Плацебо-контролируемые испытания показали, что препарат эффективен в более, чем в 90% случаев для профилактики в период эпидемий ОРВИ [11, 12]. Несмотря на то, что эффективность профилактического применения дипиридамола выше, чем у бендазола, препарат имеет существенные ограничения к применению: детский возраст (до 12 лет), беременность, кормление грудью из-за отсутствия данных о безопасности применения в этих группах, индивидуальная непереносимость препарата [4, 7]. Длительное время полагали, что дипиридамол может вызывать синдром коронарного обкрадывания у больных ишемической болезнью сердца (ИБС). В настоящее время доказано, что коронарное обкрадывание может развиваться только при внутривенном введении препарата, а не парентеральном, используемом для профилактики ОРВИ [4]. Однако осторожность при назначении дипиридамола лицам с ИБС необходима.
Страница 213
ПРЕПАРАТЫ ИНТЕРФЕРОНА
Интерфероновая система является естественной защитной системой организма. Ее основная роль — ингибирование репликации вирусов. Тем самым интерфероновая система противостоит вирусным инфекциям. Однако помимо противовирусной функции, интерфероновая система имеет и целый ряд других: регуляторная, нейромодулирующая и др. [6]. Достаточно часто наблюдается супрессия выработки интерферона, приводящая к пониженной сопротивляемости вирусным инфекциям, к их частым рецидивам. Даже среди популяции условно здоровых жителей г.Москвы до 20% имеют продукцию интерферона ниже нормы. Существует несколько причин уменьшения биосинтеза интерферона: генетические (II группа крови, синдром Дауна) [3, 29], стресс [14], недостаток витаминов и/или микроэлементов [5] и др. Назначение препаратов интерферонов в случае сниженной естественной продукции этого цитокина играет роль заместительной терапии, что может быть использовано как для профилактики, так и для лечения сезонных эпидемий ОРВИ вне зависимости от штамма вируса, вызвавшего эпидемию [21, 38], что выгодно отличает препараты интерферонов от вакцин, которые эффективны только против конкретных штаммов. Изначально в клинической практике применялся человеческий лейкоцитарный интерферон. Однако использование интерферона, полученного в культуре клеток человека, даже при использовании самых совершенных систем контроля не может позволить со 100% вероятностью гарантировать, что полученный препарат не содержит вирусы иммунодефицита человека, гепатитов В, С, D и др. Кроме того, несмотря на высокоэффективные методы отчистки получаемого сырья, полностью избавиться от баластных белков невозможно. Поэтому препараты человеческого лейкоцитарного интерферона потенциально являются сильными аллергенами [6]. Между тем, сам интерферон не является аллергеном. Поэтому, в связи с развитием генной инженерии, в последние годы чрезвычайно широко используются препараты рекомбинантного интерферона. Строгим противопоказанием к применению этих препаратов являются аутоиммунные заболевания. При беременности и кормлении грудью рекомбинантные интерфероны применяют с осторожностью [7]. Доказано, что при интраназальном применении интерфероны поступают в кровь и проходят через гематоэнцефалический барьер [6], то есть при интраназальном применении интерфероны оказывают как местное, так и центральное действие, что позволяет не только мобилизовать противовирусную защиту со стороны иммунной системы, но и активировать центральную нервную и эндокринную систему так, чтобы изменить метаболизм по пути, оптимальному для борьбы с вирусной инфекцией [6, 13]. В качестве средства профилактики ОРВИ интерфероны относятся к мерам экстренного применения. Если для того, чтобы проявился эффект вакцинации или иммуномодуляторов, необходимо время, то препараты интерферонов могут быть использованы сразу же после контакта с больным ОРВИ или же при первых симптомах заболевания. Даже в случае, если появились первые симптомы ОРВИ, интраназальное применение интерферонов позволяет избежать манифестации заболевания более, чем в 80% случаев [19]. Выявлено, что у детей профилактическое применение интраназальное применение препаратов интерферонов оказалось более эффективным для профилактики гриппа, чем вакцинация. При этом многие дети имели противопоказания к проведению вакцинации [31]. Обнаружено, что наибольшая вероятность заражения ОРВИ — внутри семьи, при постоянных бытовых контактах. Членам семьи, в которой был один человек с ОРВИ, рандомизированно (при первых признаках простуды) назначали интраназально интерферон или плацебо 2 раза в день в течение 2 дней. Показано, что в группе, получавшей плацебо, число лиц с клинической манифестацией ОРВИ оставило более 55%, тогда как среди принимавших интерферон — менее 13% [27]. В аналогичном исследовании, проведенном Hayden F.G. и соавт. показано, что эффективность применения плацебо для предотвращения ОРВИ составляет 39%, интерферона — 79% [25]. Здоровых добровольцев заражали риновирусом. Рандомизировано назначали интерферон или плацебо в течение 4 дней. Применение интерферона позволило предотвратить развитие заболевания в 90% случаев, плацебо не имело никакого эффекта [28]. Четырехнедельное применение интерферона в период эпидемии позволило уменьшить заболеваемость ОРВИ более, чем на 75% по сравнению с группой, принимавшей плацебо [34]. Двухмесячное профилактическое интраназальное применение интерферона (с момента начала эпидемии ОРВИ) оказалось эффективным в 76% случаев [35]. Однако следует заметить, что столь длительное применение препаратов интерферонов нежелательно, так как выработка интерферона в организме контролируется механизмом отрицательной обратной связи [6]. Поэтому длительное введение экзогенного интерферона приводит к угнетению выработки эндогенного. Показано, что по окончании месячного интраназального применения интерферона ОРВИ у человека наблюдается еще более глубокий иммуноинтерферонодефицит, чем до ее начала, что сопровождается пониженной сопротивляемостью вирусным инфекциям [39]. Поэтому оптимальней использовать препараты интерферонов до 5 дней [6]. При необходимости курс можно повторить. В последние годы на фармакологическом рынке РФ появились препараты рекомбинантного интерферона-alfa2. Их профилактическая эффективность составляет 87% [17], что существенно больше, чем у человеческого лейкоцитарного интерферона. Показано, что рекомбинантный интерферон-alfa2 также эффективен для лечения ОРВИ: сокращает сроки клинического выздоровления больных, уменьшает степень выраженно-сти симптомов заболевания [16].
ЗАКЛЮЧЕНИЕ
Широко распространенная в настоящее время вакцинопрофилактика ОРВИ не может обеспечить 100% защиту от сезонных эпидемий ОРВИ, что связано с тем, что только возможных штаммов-возбудителей вируса гриппа насчитывают более 170, между тем обычно вакцина эффективна против 3 штаммов. Поэтому все шире для профилактики ОРВИ начинают применяться препараты, влияющие на интерфероновую систему, которая представляет собой механизм естественной противовирусной защиты. Используются как индукторы интерферонов, так и препараты интерферонов. Преимущество этих препаратов заключается в том, что они включают естественные механизмы защиты и обладают биологической активностью по отношению ко всем вирусам-возбудителям ОРВИ. С нашей точки зрения, эти препараты наиболее перспективны для профилактики ОРВИ в XXI в.
ЛИТЕРАТУРА
1. Алексанян Л.А., Верткин А.Л., Гуревич К.Г., Ищенко А.Л., Колобов С.В., Лобанова Е.Г., Пашков К.А., Попков С.А., Попкова А.М., Солдатенко И.В. Макролиды./ Под ред. А.М. Попковой, А.Л. Верткина, С.В. Колобова. — М.: Диалог-МГУ, 2000. — 108 с. 2. Галабов А.С., Мастикова М. Дипиридамол — индуктор интерферона.- Acta Virol., 1982. V. 26. P. 137-147. 3. Григорян С.С., Ершов Ф.И. Система интерферона в норме и при патологии.- М., 1996. — С. 147-155. 4. Гуревич К.Г., Лобанова Е.Г. Биохимическая фармакология дипиридамола (Курантила): механизмы действия, клиническое применение. — Кардиология, 2000. Т. 42. N12. С. 87-91. 5. Гуревич К.Г. Нарушения обмена микроэлементов и их коррекция. — Фарматека, 2001. N3. C. 45-53. 6. Ершов Ф.И. Система интерферона в норме и при патологии. — М.: Медицина, 1996. — 239 с. 7. Крылов Ю.Ф. РЛС. Энциклопедия лекарств. М.: РЛС-2001, 2001. — 1503 с. 8. Поволотский И.Л., Кривохатская Л.Д. Влияние дибазола и аскорбиновой кислоты на антивирусную активность человеческого интерферона в культуре клеток. — Антибиотики, 1989. Т. 24. N4. С. 291-294. 9. Подколзин А.А., Донцов В.И. Факторы малой интенсивности в биоактивации и иммунокоррекции. — М.: Панас-Аэро, 1995. — 195 с. 10. Семененко Т.А., Перепелкин В.С., Прозоровский С.В. Теоретические и профилактические аспекты профилактики инфекционных заболеваний. — Воен. Мед. Журн., 1996. Т. 317. © 8. С. 40-43. 11. Слепушкин А.Н., Федорова Г.И., Кучеренко Т.П., Бирюкова И.Г. О тактике применения иммуномодулятора «Курантила» для неспецифической профилактики острых респираторных заболеваний (ОРЗ) на промышленных предприятиях.- в кн. «Вирусные инфекции», Екатеринбург, 1993. С. 62-66. 12. Слепушкин А.Н., Федорова Г.И. Клиническое применение дипиридамола (Курантила) для профилактики острых респираторных заболеваний. — Клин. Фармакол. Тер., 2000. Т. 9. N1. С. 39-41. 13. Суркина И.Д. Индуцирующие интерферон эффекты дипиридамола: противовирусные и регуляторные. — Тер. Архив, 2000. Т. 72. N8. С. 61-64. 14. Суркина И.Д., Готовцева Е.П., Гуревич К.Г., Учакин П.Н. Применение дипиридамола (Курантила) для коррекции стресс-индуцированных нарушений интерфероногенеза и профилактики инфекционных заболеваний. — Клин. Фармакология и терапия, 2000. Т. 9. N2. С. 39-43. 15. Суркина И.Д., Готовцева Е.П., Балашов А.М., Учакин П.Н., Гуревич К.Г., Школьник Н.М. Дипиридамол в лечении рецидивирующих стресс-индуцированных оппортунистических инфекционных заболеваний. — Русс. Мед. Журнал, 2000. Т. 8. N13-14. С. 554-556. 16. Феликсова Л., Шебекова В., Целипанова Е., Михайлова Н., Гапонюк П. Гриппферон у детей, больных ОРВИ. — Врач, 2001. N1. С. 40-41. 17. Шумилов В.И., Шевцов В.А., Лобов С.П. Грипп и ОРВИ: неспецифическая профилактика с использованием геноинженерного alfa-2 интерферона и его новых форм. — Лечащий врач, 2000.N9. С.20-21. 18. Brydak L.B., Machala M. Humoral immune response to influenza vaccination in patients from high risk groups. — Drugs, 2000. V. 60. N. 1. P. 35-53. 19. Cantell K. Development of antiviral therapy with alpha interferons: promisese, false hopes and accomplishments. -Ann. Med., 1995. V. 27. N. 1. P. 23-28. 20. Darlow B.A., Winterborn C.C., Inder T.E., Graham P.J., Harding J.E., Weston P.J., Austin N.C., Elder D.E., Mogridge N., Buss I.H., Stuils K.B. The effect of selenium supplementation on outcome in very low birth weight infants: a randomized controlled trial. The New Zealnd Neonatal Study Group. — J. Pediatr., 2000. V. 136. N. 4. P. 473-480. 21. Finter N.B., Chapman S., Dowd P., Johnston J.M., Manna V., Sarantis N., Sheron N., Scott G., Phua S., Tatum P.B. The use of interferon- alpha in virus infections. — Drugs, 1991. V. 42. N. 5. P. 749-765. 22. Galabov A.S., Mastikova M. Dipyridamole induces interferon in man.- Biomed. Pharmacother., 1984. V. 38. P. 413-414. 23. Girodon F., Lombard M., Galan P., Brunet-Lecomte P., Monget A.L., Arnaud J., Preziosi P., Hercberg S. Effect of micronutrient supplementation on infection in institutionalised elderly subjects: a controlled trial. — Ann. Nut. Methab., 1997. V. 41. N. 2. P. 98-107. 24. Girodon F., Galan P., Monget A.L., Boutron-Runault M.S., Brunet-Lecomte P., Preziozi P., Arnaud J., Manuguerra J.C., Herchberg S. Im-pact of trace elements and vitamin supplementation on immunity and infection in instituonalized elderly patients: a randomised controlled trial. MIN.VIT.AOX. geriatric network. — Arch. Intern. Med., 1998. V. 159. N. 7. P. 748-754. [19] 25. Hayden F.G., Albrecht J.K., Kaiser D.L., Gwaltney J.M. Jr. Prevention of natural colds by contact prophylaxis with intranasal alpha 2-interferon. — N. Engl. J. Med., 1986. V. 314. N. 2. P. 71-75. 26. Hercberg S., Galan P., Preziosi P., Roussel A.M., Arnaud J, Richard M.J., Malvi D., Paul-Dauphin A., Briancon S., Favier A. Background and rationale behind the SU.VI.MAX study, a prevention trial using nutritional dose of a combination of antioxidant vitamins and minerals to reduce cardiovascular diseases and cancer. SUpplementation et Min-eraux AntioXydants study. — Int J. Vitam. Nutr. Res., 1998. V. 68. N. 1. P. 3-20. 27. Herzong C., Berger R., Fernex M., Friesecke K., Havas L., Just M., Dubach U.C. Intranasal interferon (rIFN-alpha A, Ro 22-8181) for contact prophylaxis against common cold: a randomized, double-blind and placebo-controlled filed study. — Antiviral Res., 1986. V. 6. P. 171-176. 28. Higgins P.G., Al-Nahib W., Wilman J., Tyrrell D.A. Interferon-beta ser as prophylaxis against experimental rhinovirus infection in volunteers. — J. Interferon Res., 1986. V.6. N. 2. P. 153-159. 29. Horisberger M.A. Interferones, Mx genes, and resistance to influenza virus. — Am. J. Resp. Crit. Care Med., 1995. V. 152. N. 4. Pt. 2. S67-S71. 30. Johnson M.A., Porter K.H. Micronutrient supplementation and infection in institutionalized elders. — Nutr. Res., 1997. V. 55. N. 11. Pt 1. P. 400-404. 31. Kneyber M.C., Moll H.A., de Groot R. Treatment and prevention of respiratory virus infection. — Eur. J. Pediatr., 2000. V. 159. N. 6. P. 399-411. 32. Kumpulainen V., Makela M. Influenza vaccination among healthy employees: a cost-benefit analysis. — Scand. J. Infect. Dis., 1997. V. 29. N. 2. P. 181-185. 33. Lutticken D. Viral disease of the immune system and strategies to control infectious bursal disease by vaccination. — Acta Vet. Hung., 1997. V. 45. N. 3. P. 239-249. 34. Monto A.S., Shope T.C., Schwartz S.A., Albrecht J.K. Intranasal interferon-alpha 2bretta for seasonal prophylaxis of respiratory infection. — J. Infect. Dis., 1986. V. 154. N. 1. P. 128-133. 35. Monto A.S., Albrecht J.K., Schwartz S.A. Demonstration of doseresponse relationship in seasonal prophylaxis of respiratory infections with alpha-2betta interferons. — Atimicrob. Agents Chemother., 1988. V. 32. N. 1. P. 47-50. 36. Monto A.S. The clinical efficacy of influenza vaccination. — Pharma-cogenomics., 1996. V. 9. Suppl. 3. P. 16-25. 37. Plotkin S.A. Vaccination against the major infectious diseases. — C.R. Acad. Sci. III, 1999. V. 322. N. 11. P. 943-951. 38. Saravolac E.G., Sabula D., Crist C., Blasetti K., Schnell G., Yang H., Kande M., Levy H.B., Wong J.P. Immunoprophylactic strategies against respiratory influenza virus infection. -Vaccine, 2001. V. 19. N. 17-19. P. 2227-2232. 39. Scott G.M., Onwubalili J.K., Robinson J.A., Dore C., Secher D.S., Cantell K. Tolerance of one-month intranasal interferon. — J. Med. Vi-rol., 1985. V. 17. N. 5. P. 99-106. 40. Siscovick D.S., Raghunathan T.E., Lin D., Weinmmann S., Arbogast P., Lemaitre R.N., Psaty B.M., Alexander R., Cobb L.A. Influenza vaccination and the risk of primary cardiac arrest. — Am. J. Epidemiol., 2000. V. 152. N. 7. P. 674-677. 41. Tazulakhova E.B., Parshina O.V., Guseva T.S., Ershov F.I. Russian experience in screening, analysis, and clinical application of novel interferon inducers. — J. Interferon Cytokine Res., 2001. V. 21. N. 2. P. 65-73. 42. Umeta M., West C.E., Haidar J., Derenberg P., Hutvast J.G. Zinc supplementation and stunted infants in Ethiopia: a randomized controlled trial. — Lancet, 2000. V. 355. P. 2021-2026.
МЕДИЦИНСКИЙ ЦЕНТР
- Уровень циркулирующего интерферона (сывороточный интерферон).
- Спонтанная продукция интерферона in vitro.
- Индуцированный синтез альфа-интерферона in vitro.
- Индуцированный синтез гамма-интерферона in vitro.
Дополнительные тесты:
- Определение чувствительности к препаратам интерферона (№ 1044 — Ингарон, № 1045 — Интрон, № 1047 — Реаферон, № 1048 — Реальдирон, № 1049 — Роферон).
- Определение чувствительности к индукторам интерферона (№ 1050 — Амиксин, № 1051 — Кагоцел, № 1052 — Неовир, № 1053 — Ридостин, № 1054 — Циклоферон).
- Определение чувствительности к иммуномодуляторам (№ 1055 — Галавит, № 1056 — Гепон, № 1057 — Иммунал, № 1058 — Имунофан, № 1059 — Иммуномакс, № 1060 — Ликопид, № 1061 — Полиоксидоний, № 1062 — Тактивин, № 1063 — Тимоген, № 1066 — Имунорикс, № 1148 — Панавир, № 1064 — Изопринозин).
Интерфероны (ИФН) – важнейший компонент врождённой неспецифической защиты организма от инфекций (название интерфероны произошло от их свойства интерферировать с вирусной инфекцией клеток). Это семейство белков местной (аутокринной и паракринной) регуляции, которые способны активировать внутриклеточные процессы и межклеточные взаимодействия, обеспечивающие устойчивость к вирусным инфекциям, усиливающие врождённый и приобретённый иммунные ответы, модулирующие процессы развития и гибели нормальных и опухолевых клеток. Резистентность организма к вирусным инфекциям и ряду других заболеваний во многом зависит от активности группы генов системы интерферонов.
Препараты интерферона широко используют в медицине. Эффекты интерферонов непрямые – активация интерферонами специфических рецепторов вызывает каскад клеточных процессов, приводящих к индукции специфических стимулируемых интерферонами генов, кодирующих синтез множества белков, которые и обеспечивают противовирусные эффекты, противоопухолевое и антипролиферативное действие интерферонов. Индуцируемые интерферонами белки включают: ферменты, транскрипционные факторы, клеточные поверхностные гликопротеиды, цитокины, хемокины и другие факторы, действие которых продолжают исследовать. Продукция интерферонов клетками является преходящей, временной — «молчащие» в норме гены интерферонов индуцируются под действием продуктов вирусного и микробного происхождения и химических индукторов.
Интерфероны делят на три типа (α, β и γ), которые ассоциируют с определёнными функциями и определёнными клетками-продуцентами. Интерфероны α и β , несмотря на значительные структурные различия, имеют общие рецепторы и сходные функции. Вместе их называют также интерфероны I типа, или кислотно-стабильные интерфероны, в отличие от интерферона-γ, который имеет свои рецепторы и частично отличающиеся функции (он известен также как интерферон II, или кислотно-лабильный интерферон).
Интерферон α (выявлено более 20 его субтипов) — основной интерферон, который синтезируется в культуре лейкоцитов, индуцированной вирусом. Главными продуцентами ИФН-α являются плазмацитоидные дендритные клетки, существенный вклад в ИФН-α-продуцирующую способность крови вносят моноциты. Основные его функции – противовирусная активность и активация естественных киллеров.
Интерферон β — основной интерферон, продуцирующийся культурой фибробластов, индуцированной двухспиральной РНК. Его основные продуценты – фибробласты, эпителиальные клетки и макрофаги, основная функция – противовирусная активность.
Интерферон γ — основной интерферон, продуцирующийся иммунологически стимулированной (митогенами или антигенами) культурой лимфоцитов. Основные клетки-продуценты ИФН -γ — Т-лимфоциты. Основная функция гамма-интерферона – иммунорегуляция (включая активацию макрофагов, усиление Th1-ответа, индукцию экспрессии антигенов главного комплекса гистосовместимости типа II на антигенпрезентирующих клетках и др.); также как и другие интерфероны, он проявляет противовирусную и антипролиферативную активность. Все клетки животных способны продуцировать интерфероны, определенные клетки (лейкоциты и фибробласты) могут продуцировать более одного типа — как ИФН-α таки ИФН-β.
Исследование параметров интерферонового статуса позволяет выявить недостаточность системы интерферона. Оценка выявляемых изменений может служить ориентиром при диагностике, лечении и прогнозе заболеваний как вирусной, так и невирусной этиологии. Здоровые люди характеризуются низким уровнем сывороточного интерферона и высокими значениями индуцированного синтеза интерферонов. Стрессы и острые вирусные инфекции, аллергические состояния сопровождаются повышением уровня циркулирующего интерферона и снижением уровня индуцируемой продукции альфа- и гамма-интерферонов лейкоцитами. При бронхиальной астме, крапивнице уровень циркулирующего интерферона коррелирует с тяжестью заболевания.
Хронические вирусные инфекции (герпес, гепатит), рассеянный склероз сопровождаются подавлением всех показателей интерферонового статуса. Аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит) характеризуются подавлением индуцируемой продукции альфа-интерферона. Острый лимфолейкоз, злокачественные образования сопровождаются подавлением индуцируемой продукции гамма-интерферона. Результаты исследования интерферонового статуса следует рассматривать в комплексе с остальными лабораторными и клинико-анамнестическими данными. Снижение продукции альфа- и гамма- интерферона, которое может быть и причиной, и следствием острых и хронических вирусных заболеваний, свидетельствует о врождённом или приобретённом дефиците системы интерферонов и может рассматриваться как показание для интерферон-стимулирующей терапии. Нормализация показателей интерферонового статуса обычно совпадает с процессами выздоровления. У людей старше 50 лет относительно чаще выявляется недостаточность системы интерферонов. Исследование параметров интерферонового статуса с определением чувствительности к лекарственным препаратам используют для подбора эффективной терапии при использовании препаратов экзогенного интерферона, индукторов интерферона и иммуномодуляторов.
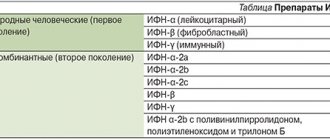
Препараты интерферона
- Ингарон — рекомбинантный человеческий интерферон-γ.
- Интрон — рекомбинантный человеческий интерферон-α-2b.
- Реаферон — рекомбинантный человеческий интерферон-α-2.
- Реальдирон — рекомбинантный человеческий интерферон-α-2b.
- Роферон — рекомбинантный человеческий интерферон-α-2a.
Индукторы интерферона
- Амиксин (межд. непатент. название — тилорон): дигидрохлорид 2,7-бис-[2(диэтиламино)-этокси]-флуорен-9-ОН-дигидрохлорид.
- Кагоцел: активное вещество — натриевая соль сополимера (1-4)- 6- 0- карбоксиметил -b-D-глюкозы, (1- 4)-b-D-глюкозы, (21-24) -2,3,14,15,21,24,29,32-октагидрокси -23-(карбокси-метоксиметил) -7,10-диметил- 4,13 -ди(2-пропил)-19,22,26,30,31-пентаоксагептацикло [23.3.2.216.05.28.08.27.09.1В.012.17] дотриаконта-1,3,5(28),6,8(27),9(18),10,12(17),13,1-декаена.
- Неовир – 2-(9-оксо-9,10-дигидроакридин-10-ил) ацетат натрия.
- Ридостин — смесь натриевых солей двухцепочечной и одноцепочечной РНК.
- Циклоферон – меглумина акридонацетат.
Иммуномодуляторы
- Галавит — производное фталгидразида.
- Гепон (Hepon) — синтетический пептид, состоящий из 14 аминокислотных остатков.
- Иммунал – препарат сока эхинацеи пурпурной.
- Иммунофан — гексапептид (аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин).
- Иммуномакс — кислый пептидогликан с молекулярной массой 1 000 — 40 000 кД.
- Ликопид – активное вещество – глюкозаминилмурамилдипептид — 4-О-( 2-ацетиламино-2-дезокси-бета-D-глюкопиранозил )-N-ацетилмурамил]-L-аланил-D-альфа-глутамиламид.
- Полиоксидоний — международное непатентуемое название /состав: Azoximer (Азоксимер) — N-оксидированное производное полиэтиленпиперазина.
- Тактивин — комплекс полипептидов из вилочковой железы крупного рогатого скота.
- Тимоген — полипептид из вилочковой железы крупного рогатого скота.
- Панавир (Panavir) — очищенный экстракт побегов растения Solanum tuberosum, основное действующее вещество — гексозный гликозид, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С РАСШИРЕННЫМ СПЕКТРОМ АКТИВНОСТИ
СОВРЕМЕННАЯ АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
СОВРЕМЕННАЯ АНТИМИКРОБНАЯ ХИМИОТЕРАПИЯ
Л.С. Страчунский, С.Н. Козлов. Руководство для врачей
| Содержание | ANTIBIOTIC.ru |
Противовирусные препараты
РИБАВИРИН
Виразол, Ребетол
Обладает широким спектром активности в отношении многих ДНК- и РНК-содержащих вирусов и высокой токсичностью. Механизм противовирусного действия до конца не выяснен.
Спектр активности
Клиническое значение имеет активность против респираторно-синцитиального вируса, а также вирусов, вызывающих лихорадку Ласса, геморрагическую лихорадку с почечным синдромом и гепатит С (в комбинации с интерфероном-альфа).
Фармакокинетика
Биодоступность при приеме внутрь — 35-45%. При ингаляционном применении высокие концентрации отмечаются в секретах дыхательных путей и значительно более низкие в плазме. При повторных введениях может накапливаться в эритроцитах. Проникает через ГЭБ. Метаболизируется в печени, экскретируется с мочой. Т1/2 — 30-60 ч, при почечной недостаточности возрастает.
Нежелательные реакции
- Местные — сыпь, раздражение кожи, слизистых оболочек глаз и дыхательных путей, бронхоспазм (отмечаются как у пациентов, так и у медперсонала
при использовании аэрозольной лекарственной формы). Возможна кристаллизация рибавирина в дыхательных путях и интубационных трубках. - Гематотоксичность — анемия, лимфоцитопения (у больных СПИДом); гемолитическая анемия (чаще к 4 неделе), обратима, не требует специфического лечения, нормализация гемоглобина наступает при временном уменьшении дозы.
- Нейротоксичность — головные боли, усталость, раздражительность, бессонница.
- ЖКТ — металлический вкус во рту, боли в животе, метеоризм, тошнота.
- Тератогенное действие.
Показания
- Инфекции, вызванные РСВ (серологически подтвержденные): тяжёлый бронхиолит и пневмония у новорожденных и детей раннего возраста, относящихся к группе риска (врожденные пороки сердца, иммунодефицит, бронхолегочная дисплазия), а также ассоциированные с тяжелым муковисцидозом или легочной гипертензией.
- Лихорадка Ласса.
- Геморрагическая лихорадка с почечным синдромом.
- Гепатит С (в сочетании с интерфероном-альфа или пегинтерфероном альфа).
Противопоказания
Абсолютные
- Беременность.
- Терминальная почечная недостаточность.
- Анемия.
- Гемоглобинопатии.
- Тяжелая сердечная недостаточность.
Относительные
- Неконтролируемая гипертензия.
- Пожилой возраст.
Предупреждение
Из-за его тератогенного действия противопоказан при беременности и представляет опасность в случае беременности у медперсонала.
Всем женщинам, получающим рибавирин (и в том случае, если их партнеры получают его), следует предохраняться от беременности во время всего курса терапии, а также на протяжении 4 месяцев после окончания лечения. Тест на беременность необходимо повторять ежемесячно, а также в течение 4 месяцев после окончания лечения. Если в этот период возникает беременность, необходимо предупредить пациентку о высоком риске тератогенного эффекта.
В целях «защиты» медперсонала ингаляционное введение рибавирина допускается только с использованием специального небулайзера.
Перед применением рибавирина необходимо обязательное серологическое подтверждение наличия РСВ-инфекции, а также определение HCV РНК методом полимеразной цепной реакции (у пациентов с гепатитом С).
Дозировка
Взрослые
При лихорадке Ласса и геморрагической лихорадке: внутривенно — первая доза 2,0 г, затем по 1,0 г каждые 6 ч в течение 4 дней и далее по 0,5 г каждые 8 ч в течение 6 дней.
При гепатите С: внутрь 1,0-1,2 г в сутки в течение 12 месяцев.
Новорожденные и дети
При РСВ-инфекции: ингаляционно (с помощью небулайзера) 20 мг/мл (6,0 г в 300 мл стерильной воды) в течение 18 ч в день, курс лечения — 3-7 дней.
Форма выпуска
Флаконы по 6,0 г порошка для приготовления раствора для инфузий; капсулы по 0,2 г.
ЛАМИВУДИН
Зеффикс, Эпивир ТриТиСи
Активен против ретровирусов и вируса гепатита В.
Фармакодинамика
В клетках, пораженных вирусом, активируется, превращаясь в ламивудин трифосфат, который ингибирует ДНК-полимеразу вируса гепатита В и обратную транскриптазу ВИЧ. Отмечены случаи развития резистентности вируса гепатита В.
Фармакокинетика
Биодоступность при приеме внутрь — 86-88%. Распределяется во многие ткани и секреты, проходит через ГЭБ. Выводится почками. Т1/2 — 5-7 ч, при почечной недостаточности возможно удлинение.
Нежелательные реакции
Как правило, хорошо переносится. В редких случаях вызывает лактацидоз и гепатомегалию со стеатозом, которые, возможно, связаны с нарушением функции митохондрий.
Показания
- Хронический гепатит В.
Предупреждение
При монотерапии может довольно быстро развиваться резистентность к ламивудину как вируса гепатита В, так и ВИЧ, если имеет место двойное инфицирование.
Дозировка
Взрослые
Внутрь — по 0,1 г один раз в день в течение года; у ВИЧ-инфицированных пациентов — по 0,15 г каждые 12 ч.
Форма выпуска
Таблетки по 0,1 г.
Интерфероны — группа биологически активных белков, синтезируемых клеткой в процессе защитной реакции. Интерферон секретируется во внеклеточную жидкость и через рецепторы действует на другие клетки, повышая устойчивость к внутриклеточным микроорганизмам, в первую очередь — вирусам. Интерфероны не обладают специфичностью и подавляют репликацию различных вирусов. Основной механизм противовирусного действия интерферона заключается в подавлении синтеза вирусных белков.
По структуре и биологическим свойствам интерфероны подразделяются на три вида: α, β, γ
. По способу получения выделяют лейкоцитарные, лимфобластоидные и рекомбинантные интерфероны. Наиболее широко как противовирусные препараты используются рекомбинантные интерфероны альфа. В последние годы разработаны пегилированные интерфероны (пегинтерфероны), получаемые путём присоединения полиэтиленгликоля и обладающие более высоким периодом полувыведения и клинической эффективностью.
ИНТЕРФЕРОН-АЛЬФА: ОБЩИЕ СВОЙСТВА
Фармакокинетика
Являясь белком, интерферон-альфа разрушается в ЖКТ, поэтому применяется только парентерально. При внутримышечном введении биодоступность составляет 80%, максимальная концентрация в крови достигается в среднем через 3,8 ч. Отмечены низкие концентрации в секретах дыхательных путей, тканях глаза, ЦНС. Подвергается быстрой инактивации в почках, в меньшей степени — в печени. Т1/2 — 2-4 ч, при почечной недостаточности не изменяется. Пегинтерферон альфа имеет более длительный Т1/2.
Нежелательные реакции
Нежелательные реакции рекомбинантных интерферонов-альфа являются дозозависимыми.
Ранние
(чаще на первой неделе лечения).
- Гриппоподобный синдром, проявляющийся лихорадкой, миалгией, болезненностью глазных яблок, как правило, исчезает после 4-5 инъекций и не требует снижения дозы или отмены препарата.
Меры профилактики:
назначение парацетамола перед введением интерферона.
Поздние
(на 2-6 неделе терапии, нередко бывают причиной отмены интерферона).
- Гематотоксичность — анемия, тромбоцитопения, агранулоцитоз.
- Нейротоксичность — сонливость, заторможенность, депрессия, реже судороги.
- Кардиотоксичность — аритмии, транзиторная кардиомиопатия, артериальная гипотензия.
- Аутоиммунный тиреоидит.
- Гиперлипидемия.
- Аллопеция, кожные высыпания. Меры контроля:
контроль кроветворения, уровня печеночных ферментов, электролитов, ЭКГ.
Лекарственные взаимодействия
Интерферон альфа ингибирует микросомальные ферменты печени (цитохром Р-450), поэтому может нарушать метаболизм многих препаратов (теофиллина и др.), повышая их концентрацию в крови.
В связи с риском возникновения нежелательных реакций со стороны ЦНС следует с особой осторожностью применять одновременно с интерфероном альфа наркотические, снотворные и седативные препараты.
Показания
- Хронический гепатит В (при наличии репликации вируса: HBV, ДНК, HBeAg, в сыворотке крови) и повышенного уровня трансаминаз.
- Острый гепатит С.
- Хронический гепатит С (HCV РНК в сыворотке крови), повышенный уровень трансаминаз.
Противопоказания
Абсолютные
- Психоз (на момент лечения или в анамнезе).
- Тяжелая депрессия.
- Нейтропения или тромбоцитопения.
- Тяжелая патология сердца.
- Декомпенсированный цирроз печени.
- Неконтролируемые судороги.
- Трансплантация органов (кроме печени).
Относительные
- Аутоиммунные заболевания.
- Неконтролируемый диабет.
Дозировка
Взрослые
Хронический гепатит В
По 5 млн МЕ ежедневно или по 10 млн МЕ 3 раза в неделю в течение 4-6 месяцев.
Острый гепатит С
Режим высоких доз — по 10 млн МЕ ежедневно до нормализации трансаминаз, далее 3 млн МЕ 3 раза в неделю в течение 6 месяцев.
Режим средних доз — по 5 млн МЕ 3 раза в неделю в течение 2 месяцев, далее 3 млн МЕ 3 раза в неделю в течение 4-10 месяцев.
При плохой переносимости переходить на режим малых доз по 3 млн МЕ 3 раза в неделю в течении 3-6 месяцев.
Хронический гепатит С
Монотерапия — по 3 млн МЕ 3 раза в неделю в течение 12 месяцев. При отсутствии ответа (сохранение HCV РНК в сыворотке крови) через 3 месяца от начала терапии целесообразно проведение комбинированной терапии.
Комбинированная терапия:
- 1) Интерферон альфа + рибавирин. При массе тела ≤75 кг интерферон альфа 3 млн МЕ 3 раза в неделю, рибавирин 1 г/сут (2 капсулы утром + 3 капсулы вечером). При массе тела >75 кг интерферон альфа 3 млн МЕ 3 раза в неделю, рибавирин 1,2 г/сут (3 капсулы утром + 3 капсулы вечером).
2) Пегинтерферон альфа-2b + рибавирин. При массе тела <65 кг пегинтерферон альфа-2b 1,5 гк/кг 1 раз в неделю, рибавирин 0,8 г/сут. При массе тела 65-85 кг пегинтерферон альфа-2b 1,5 гк/кг 1 раз в неделю, рибавирин 1 г/сут. При массе тела >85 кг пегинтерферон альфа-2b 1,5 мгк/кг 1 раз в неделю, рибавирн 1,2 г/сут.
При хроническом гепатите С — по 3 млн МЕ 3 раза в неделю в течение 3 месяцев, при нормализации уровня трансаминаз и снижении концентрации HCV РНК — введение в той же дозе в течение 9-15 месяцев. Если через 3 месяца от начала терапии уровень АЛТ остается повышенным и продолжает определяться HCV РНК, доза может быть повышена до 5 млн МЕ 3 раза в неделю.
Дети старше 1 года
Эффективность и безопасность интерферонов у детей окончательно не установлены. В законченных к настоящему моменту контролируемых исследованиях выявлена эффективность следующих режимов терапии: хронический гепатит В — 6 млн МЕ/м2 поверхности тела 3 раза в неделю в течение 6 месяцев; хронический гепатит С — 3-5 млн МЕ/м2 3 раза в неделю в течение 12 месяцев.
ПРЕПАРАТЫ ИНТЕРФЕРОНА АЛЬФА
Рекомбинантные интерфероны
Все коммерческие препараты этой группы представляют собой рекомбинантную форму человеческого α2-интерферона, поэтому их фармакологическое действие сходно. В зависимости от содержания аминокислот выделяют инетрферон альфа-2а и интерферон альфа-2b, которые существенно не отличаются по клинической эффективности и безопасности.
ИНТЕРФЕРОН АЛЬФА-2а
Роферон-А, Реаферон
Формы выпуска
Флаконы и ампулы по 3, 9 и 18 млн МЕ (Роферон-А
) и ампулы по 1 млн МЕ (
Реаферон
) порошка для приготовления раствора для инъекций.
ИНТЕРФЕРОН АЛЬФА-2b
Интрон-А, Реальдирон
Формы выпуска
Флаконы по 1, 3, 5 и 10 млн МЕ (Интрон-А
) и ампулы по 1, 3 и 6 млн МЕ (
Реальдирон
) порошка для приготовления раствора для инъекций.
ПЕГИНТЕРФЕРОН АЛЬФА-2b
ПегИнтрон
Соединение интерферона альфа-2b с полиэтиленгликолем (Пегилированый интерферон альфа-2b). Обладает пролонгированым эффектом и более высокой терапевтической активностью. Назначается 1 раз в неделю. Рекомендован для лечения гепатита С у лиц, имеющих противопоказания к рибавирину, а также в случае отмены рибавирина вследствие развития анемии.
Формы выпуска
Флаконы по 50, 80 и 100 мкг порошка для приготовления раствора для инъекций.
| Copyright © 2000-2007 ANTIBIOTIC.ru Размещено: 15.05.2004 |
Адрес этой страницы: https://www.antibiotic.ru/books/mach/mac0403.shtml
Дата последнего изменения: 24.05.2004 18:56