Показания к применению препарата Инозин
Инозин — ИБС (в комплексном лечении), постинфарктный период, нарушения сердечного ритма, обусловленные применением сердечных гликозидов, дистрофия миокарда. Применение инозина также показано при урокопропорфирии, гепатите, циррозе печени. Улучшает функцию органа зрения при открытоугольной форме глаукомы с нормализованным в результате лечения внутриглазным давлением. Инозин пранобекс — вирусные инфекции у пациентов с нормальным иммунным статусом и при иммунодефицитных состояниях, в том числе заболевания, вызванные вирусами Herpes simplex 1-го и 2-го типов, кори, паротита, вирусами Эпштейна — Барр и цитомегаловирусами, Varicella zoster; вирусный бронхит, вирусный гепатит; заболевания, вызванные вирусом папилломы человека; подострый склерозирующий панэнцефалит; хронические инфекционные заболевания мочевыделительной и дыхательной систем; стрессовые ситуации; послеоперационный период и период реконвалесценции после тяжелых заболеваний; пожилой возраст; лучевая терапия.
Применение препарата Инозин
Инозин — внутрь до еды или в/в медленно, струйно или капельно. Вначале вводят 200 мг (10 мл 2% р-ра) 1 раз в сутки, в дальнейшем при хорошей переносимости — до 400 мг (20 мл 2% р-ра) 1–2 раза в сутки. Скорость введения — 40–60 капель в 1 мин. Курс лечения — 10–15 дней. При остром нарушении ритма сердца струйное введение в разовой дозе 200–400 мг (10–20 мл 2% р-ра). При в/в капельном введении 2% р-р инозина разводят в 5% р-ре глюкозы или изотоническом р-ре натрия хлорида (до 250 мл). Суточная доза при приеме внутрь — 0,6–2,4 г. В первые дни лечения суточная доза равна 0,6–0,8 г (по 0,2 г 3–4 раза в сутки). В случае хорошей переносимости эту дозу повышают на протяжении 2–3 дней от 1,2 г (по 0,4 г 3 раза в сутки) до 2,4 г. Продолжительность курса — от 4 нед до 1,5–3 мес. При урокопропорфирии суточная доза составляет 0,8 г (по 0,2 г 4 раза в сутки). Принимают ежедневно в течение 1–3 мес. Инозин пранобекс — взрослым обычно назначают в дозе 50 мг на 1 кг массы тела в 3–4 приема; детям — 50–100 мг/кг в 3–4 приема. Средняя продолжительность лечения 5–8 дней, в тяжелых случаях до 15 дней. При опоясывающем лишае (Неrреs zoster) назначают по 1 г 3–4 раза в сутки в течение 10 дней. При генитальном герпесе — по 1 г 3 раза в сутки в течение 5–6 дней (острая фаза) в комбинации с местным лечением, в дальнейшем по 1 таблетке 2 раза в сутки до 6 мес, в зависимости от тяжести заболевания и частоты рецидивов. При остроконечных кондиломах назначают по 1 г 3 раза в сутки в комбинации с местным лечением в течение 14–28 дней. При комбинации с криотерапией или СО2 — лазерной терапией — по 1 г 3 раза в сутки в течение 5 дней; проводят 3 курса лечения с интервалом 1 мес. При афтозном стоматите назначают по 1 г 4 раза в сутки в течение 6 дней (острая фаза), в дальнейшем по 1 г 3 раза в сутки 2 раза в неделю на протяжении 6 нед. При хронических, рецидивирующих инфекциях мочевых и дыхательных путей у больных пожилого возраста назначают по 1 г 4 раза в сутки в течение 2–3 мес. При хронических, рецидивирующих инфекционных заболеваниях у детей с ослабленной иммунной системой — 50–100 мг на 1 кг массы тела в сутки в 3–4 приема в течение 1–2 нед (с 1 года — по 0,5 г на 10 кг массы тела). При вирусных гепатитах назначают по 1 г 3–4 раза в сутки в течение 2–3 нед, поддерживающая терапия — по 0,5 г 2 раза в сутки до 6 мес.
Газета «Новости медицины и фармации» 19(342) 2010
Актуальность проблемы
В последние годы отмечается повышенный интерес практических врачей к иммуномодулирующим средствам, что дало толчок к активной публикации результатов применения синтетических аналогов инозина (САИ) при различных инфекционных заболеваниях [1–3], поражениях кожи и слизистых оболочек, ассоциированных с вирусом папилломы человека (ВПЧ) [4–7] (Линаск и Григорьева, 2005), и состояниях, обусловленных иммунодефицитом у детей [8], в научно-медицинских и научно-популярных изданиях. Это обусловлено тем, что широко известные в Западной Европе САИ только в самом конце прошлого столетия были зарегистрированы в странах СНГ. В настоящее время фармацевтический рынок России насыщен разнообразными иммуномодуляторами, их количество увеличивается с каждым годом [9]. При этом в СМИ используется агрессивная маркетинговая технология, что затрудняет практическим врачам выбор оптимального лекарственного агента для лечения и профилактики вирусных и оппортунистических инфекций, особенно у больных с нарушениями иммунной системы.
Основные аспекты применения Гропринозина, одного из САИ, достаточно широко освещены ранее Л.М. Беляевой [8] в комплексном лечении часто болеющих детей, нами — при герпетической и папилломовирусной инфекции [10, 11], что предопределило тематику данного обзора:
1. Современная тенденция в распространении и течении инфекционных болезней.
2. Какие требования предъявляются к «идеальному» иммуномодулятору и чем обусловлен интерес ученых и клиницистов к иммуномодуляторам, подобным инозину пранобексу (Гропринозину).
3. Природа прямых аналогов инозина (ПАИ) и САИ.
4. Молекулярные механизмы потенцирования иммунной системы с помощью САИ.
5. Результаты, касающиеся применения САИ при инфекциях, вызванных вирусом иммунодефицита человека (ВИЧ), и других вирусных, воспалительных и аутоиммунных заболеваниях у трудных или проблемных пациентов.
Современные тенденции распространения инфекционных болезней
Глобальные изменения климата, загрязнение окружающей среды, внедрение модифицированных пищевых продуктов и ежедневный стресс, присущие нашей эпохе, кардинально изменили образ жизни людей и адаптационные возможности человеческого организма. Возросшие международные связи, массовый туризм и глобализация способствуют активному переносу и широкому распространению патогенных микроорганизмов из одних географических регионов в другие, подвергая смертельному риску жителей новых ареалов [12, 13].
По данным ВОЗ, половина населения Земли подвергается риску заражения различными инфекционными заболеваниями, что ежегодно сопровождается смертью около 17 млн человек [14]. Наглядным примером появления новых для людей инфекционных агентов или модифицированных штаммов возбудителей инфекционных болезней, которые угрожают новыми пандемиями, являются ВИЧ-инфекция, вспышка птичьего и свиного гриппа последних лет.
Антибиотики существенно снизили заболеваемость и смертность от инфекционных заболеваний и тем самым сохранили жизнь и здоровье миллионам людей. Ряд факторов, таких как неуклонный рост потребления антибактериальных препаратов, беспорядочный и бесконтрольный прием антибиотиков, привели к формированию антибиотикоустойчивых штаммов возбудителей инфекции. Так, по данным центров контроля болезней, ежегодный бюджет клиник возрастает на 661 млн долларов США вследствие антибактериальной резистентности, не считая плату за больничный лист и другие непрямые финансовые потери [15]. В настоящее время выбор антибактериальных и противовирусных препаратов для лечения распространенных инфекционных заболеваний становится лимитированным и порою невозможным.
В результате агрессивного воздействия всех вышеуказанных факторов все чаще и чаще возникают мутации в геноме человека, происходят нарушения в гомеостазе и иммунной системе, что приводит к снижению резистентности организма и повышению риска развития заболеваний, вызываемых оппортунистическими возбудителями и тяжелой клинической манифестацией вирусных инфекций и грибковых поражений. Нарушение иммунной защиты организма сопровождается клинической манифестацией оппортунистических инфекций, вызванных бактериями, вирусами простого герпеса (ВПГ), опоясывающего лишая, папилломы человека (ВПЧ), цитомегаловирусом (ЦМВ), грибками кандида, криптококками, токсоплазмой и другими протозойными паразитами. Современная клиническая патология характеризуется, с одной стороны, ростом хронических инфекционных заболеваний, вызываемых условно-патогенными микробами, с другой стороны — снижением иммунологической реактивности населения, наблюдаемым практически во всех развитых странах [16].
Мотивы поиска иммуномодуляторов
Лечение оппортунистической инфекции является архисложной задачей, что обусловлено отсутствием адекватной иммунной защиты у таких больных. Более того, все еще отсутствуют терапевтические средства, направленные на полную эрадикацию таких возбудителей, как, например, ВПГ, ВПЧ, ЦМВ, или облигатных микроорганизмов существующих в человеческом организме в форме симбиоза, которые часто проявляются в виде оппортунистической инфекции [12]. При этом следует отметить, что в большинстве случаев организм иммунокомпетентного хозяина самостоятельно элиминирует ВПЧ или переводит в латентную стадию ВПГ- или ЦМВ-инфекции [10, 11, 17]. Возможности целенаправленного взаимодействия иерархически организованных компонентов иммунной системы, которая у здоровых индивидов контролирует ситуацию при внедрении микроорганизмов, зависит от природы инфекционного агента и компетентности иммунной системы [12].
На основании выдающихся результатов вакцинопрофилактики инфекционных болезней была выдвинута гипотеза, что если естественную иммунную защиту организма рассматривать как наиболее высокоорганизованную противоинфекционную терапевтическую систему, то с этой точки зрения она является многообещающей мишенью для лечебных манипуляций. Такое положение вещей предопределило необходимость появления иммуномодулирующих средств, направленных на стимуляцию, т.е. потенцирование или, наоборот, ингибирование того или иного звена иммунной системы. Так, по мнению Р.М. Хаитова и Б.В. Пинегина [16], «главной мишенью иммуномодулирующих препаратов являются вторичные иммунодефициты, которые проявляются в виде часто рецидивирующих, трудно поддающихся лечению инфекционно-воспалительных заболеваний различных локализаций. В основе любого хронического инфекционно-воспалительного процесса лежат те или иные изменения в иммунной системе, которые и являются одной из причин существования этого процесса».
Первой попыткой применения системного иммуномодулирущего средства являлась серия клинических экспериментов доктора Уильяма Колея, выполненных в 80-е годы XIX столетия с целью изучения противоопухолевого свойства бактерий. Сначала Колей с успехом вводил взвесь живых стрептококков непосредственно внутрь опухолевых масс. В последующем он расширил свои эксперименты и использовал грамположительные и грамотрицательные бактерии после их термической обработки, получившие название «токсины Колея» [18].
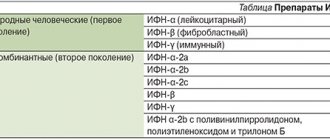
В настоящее время существуют многочисленные иммуномодулирующие препараты как естественного, так и искусственного происхождения (табл. 1).
Идет интенсивный поиск иммуномодулирующих средств, применение новых наукоемких технологий в этой области расширяет возможности разработки новых мощных, в частности рекомбинантных, эндогенных цитокинов, обладающих оптимальным лечебно-профилактическим потенциалом с минимальными побочными эффектами [12, 19, 20].
Принципы иммунотерапии и характеристика «идеального» иммуномодулятора
По мнению академика А.А. Воробьева [21], назначение лечения, воздействие, направленное на иммунную систему, должно исходить из общих принципов иммунотерапии и основными требованиями для иммуномодулирующих препаратов являются наличие у данного препарата иммуномодулирующего свойства, клинически доказанная высокая противовирусная эффективность, предпочтительное естественное происхождение, безопасность, безвредность, отсутствие привыкания, отсутствие побочных и канцерогенных эффектов. Иммуномодуляторы не должны вызывать чрезмерную сенсибилизацию и индукцию иммунопатологических реакций, а также не должны потенцировать ее у других медикаментов. Необходимыми качествами приемлемости кандидата также являются предсказуемость схемы метаболизма и пути выведения из организма, высокая совместимость с другими препаратами, применяемыми при инфекционных и воспалительных заболеваниях. Предпочтительным качеством считается легкость доставки препарата в область назначения и возможность его использования непарентеральным путем [21].
Иммуномодуляторы стимулируют защитные механизмы хозяина против возбудителей инфекционных заболеваний. В идеале оптимальными иммуномодуляторами считаются вещества, принимающие участие в регуляции иммунных процессов в организме (цитокины), или их синтетические или рекомбинантные аналоги. Однако применение цитокинов лимитировано в связи с присущей цитокинам токсичностью, непредсказуемостью их фармакологического поведения и наличием в них плейотропного эффекта (множественный эффект). Следует отметить, что эффективность экзогенных цитокинов лимитирована у лиц со сниженным иммунитетом в связи с отсутствием соответствующих эффекторных клеток или наличием патогномоничных факторов заболевания, препятствующих активации лимфоцитов. Короткий период полураспада экзогенных цитокинов и необходимость применения таких цитокинов в высоких дозах для достижения терапевтического эффекта стимулируют исследователей к поиску наиболее приемлемого и адекватного иммунопотенциатора, принимающего участие в регуляции иммунных процессов в организме, но не обладающего побочными эффектами цитокинов. К таким иммуномодуляторам можно отнести САИ, предшественниками которых являются природные пурины. В анатомо-терапевтическо-химической, т.е. международной, системе (АТС) классификации лекарственных средств, ассоциированной ВОЗ, как инозин, так и инозин пранобекс зарегистрированы кодами как препараты для лечения заболеваний кожи (D), урогенитальных органов (G), органов чувств (S), в качестве иммуномодуляторов (L) и противомикробных антивирусных препаратов (J) для системного использования [22].
Инозин, производный пуринов — натуральный иммуномодулирующий и метаболический агент
Известно, что пурины обладают мощными иммуномодулирующими свойствами и являются одним из основополагающих веществ, необходимых для нормальной жизнедеятельности клеток. Пурины постоянно присутствуют в организме, они ежедневно поступают с пищей и принимают участие во многих физиологических жизненно важных процессах в ядре клеток.
Наиболее известным представителем веществ этого класса является нуклеозид аденозин, который влияет на все аспекты иммунной системы [23, 24]. Так, аденозин и его аналоги препятствуют развитию различных воспалительных заболеваний, ревматоидного артрита, воспаления плевры, нефритов, колитов, увеитов и токсического шока. Считается, что эффекты аденозина частично обусловлены ингибированием вредоносных процессов, инициируемых иммунной системой, включая выделения провоспалительных цитокинов и радикалов кислорода. Проводятся активные поиски терапевтических средств, основанных на воздействии рецепторов аденозина, для лечения и профилактики инфекционных, аутоиммунных, ишемических и дегенеративных заболеваний.
Инозин является метаболитом аденозина, формируемым вследствие расщепления последнего под воздействием диаминазы (рис. 1).
Инозин обладает аналогичными предшественнику свойствами, включая противовоспалительный эффект при эндотоксическом и септическом шоке, колитах и тяжелых формах пневмонии, которые были продемонстрированы на различных экспериментальных моделях. Он ингибирует секрецию провоспалительных цитокинов, в том числе фактора некроза опухоли (TNF-α) и интерлейкина (IL-1β), продуцируемых активированными моноцитами и эпителиальными клетками. Инозин также ингибирует продукцию радикалов супероксида стимулированными нейтрофилами. Биодоступность инозина высокая (более 90 %), а полная элиминация инозина и его метаболита мочевой кислоты из организма происходит в течение 48 часов, следовательно, кумуляции инозина в организме не происходит.
Прямые аналоги инозина (ПАИ) под торговым названием рибоксин или инозин F применяются в качестве анаболических средств за счет их метаболического, антигипоксического и антиаритмического свойств. Рибоксин [9-Рибофуранозилпурин-6 (1Н)-ОН] содержит в качестве пуринового основания гипоксантин, соответственно, в печени препарат расщепляется на рибозу и гипоксантин. Далее гипоксантин, как предшественник АТФ, стимулирует синтез нуклеотидов, активирует метаболизм пировиноградной кислоты для обеспечения нормального процесса тканевого дыхания, усиливает активность некоторых ферментов цикла Кребса. ПАИ, проникая в клетки, повышают энергетический уровень, оказывают положительное действие на процессы обмена в миокарде, повышая его энергетический баланс, улучшают коронарное кровообращение и, таким образом, увеличивают силу сокращений сердца. ПАИ принимают непосредственное участие в обмене глюкозы и способствуют активизации обмена в условиях гипоксии и при отсутствии АТФ. Соответственно, ПАИ широко применяют при заболеваниях ССС, ИБС, циррозе печени, тяжелых пост- инфекционных состояниях, отравлениях, радиоактивном облучении и других тяжелых заболеваниях.
Инозин пранобекс — синтетический аналог инозина (САИ)
Инозин пранобекс состоит из двух компонентов: первый (активный) компонент — инозин, метаболит пурина (1,9-дигидро-9-β-D-рибофуранози-ло-6Н-пурин-6-OH); второй (вспомогательный) компонент повышает доступность инозина для лимфоцитов (соли 4-ацетамидобензойной кислоты с N,N-диметиламино-2-пропанолом) в молярном отношении 1 : 3, который запатентован в США под названием Methisoprinol.
В настоящее время на фармацевтических рынках присутствует более 10 торговых наименований САИ (Groprinosin, Inosiplex, Inosine pranobex, Immunovir, Methisoprinol, Isoprinosine, Viruxan, Prinosine, Virimun, Modimunal и т.д.) различных фармацевтических компаний в 3 лекарственных формах (таблетки, сироп, раствор), которые хорошо зарекомендовали себя в качестве мощного иммуномодулятора и противовирусного препарата. К 1990 г. САИ зарегистрированы более чем в 70 странах мира, а к 1996 году, по данным Newport Pharmaceuticals, опубликованы результаты более 1750 клинических исследований. С момента использования препарата в клинической практике таблеточный эквивалент потребления САИ составил 109, в связи с чем при перерасчете на курсовую дозу «6 таблеток × × 10 дней» индекс потребления оказался равным 18 × 106. САИ являются безопасными продуктами пуринового ряда, нетоксичными даже при назначении высоких доз [25, 26].
Существуют данные о том, что САИ подавляют репликацию ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения и способствуют восстановлению клеточного звена иммунитета при лечении злокачественных опухолей, особенно у больных, получающих химиотерапию или облучение.
Гропринозин считается универсальным иммуномодулятором с преобладанием тимомиметических эффектов (рис. 2).
Гропринозин активирует пролиферацию Т-лимфоцитов, Т-хелперов, естественных клеток (NK)-киллеров, уравновешивает баланс клеточного и гуморального звена в иммунной системе:
— с одной стороны, стимулируя биохимические процессы в макрофагах, усиливает хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно-ядерных клеток;
— с другой стороны, параллельно повышая продукцию цитокинов (интерферонов и интерлейкинов), усиливает синтез антител.
Результаты клинических испытаний САИ при различных заболеваниях и ВИЧ-инфекции
За более чем 38-летний период применения САИ не зарегистрированы случаи серьезных побочных эффектов их клинического использования. Примечательно, что имеются данные многочисленных клинических испытаний об эффективности САИ как иммуномодулирующего и противовирусного агента у проблемных или трудных пациентов.
САИ во многих странах использовались для лечения различных инфекционных и аутоиммунных заболеваний, особенно у трудных больных, включая гепатиты [27, 28], артриты [29], ВИЧ-ин- фекцию [30–36], грипп и ОРВИ [2, 3, 26], при синдроме хронической усталости [37] и таких заболеваниях кожных покров, волос и слизистой оболочки, как очаговая и тотальная алопеция (выпадение волос) [38–41] и ВПЧ-позитивная пролиферативная бородавчатая лейкоплакия слизистой полости рта [42].
С практической точки зрения представляет интерес применение САИ у ВИЧ-инфицированных индивидов. Так, на начальном этапе пандемии ВИЧ САИ широко применялись в комплексе с различными противовирусными препаратами. Считалось, что САИ, как иммуномодулирующие агенты, задерживают прогрессирование ВИЧ-инфекции и, таким образом, предупреждают развитие СПИДа [30, 43, 44]. Доводом для такой гипотезы явились результаты многочисленных клинических испытаний САИ [31–35]. Скандинавской исследовательской группой проводилось рандомизированное двойное слепое плацебо-контролируемое исследование для оценки эффективности и безопасности САИ в лечении больных с ВИЧ без клинической манифестации СПИДа. В этой многоцентровой работе анализировали результаты 866 больных из 21 медицинского центра Дании и Швеции [31, 35]. В зависимости от уровня концентрации CD4+ клеток больные были распределены на 3 группы, которым в двойном рандомизированном порядке назначали САИ по 1 г 3 раза в сутки (n = 429) или плацебо (n = 437) в течение 24 недель. Отмечена хорошая переносимость препарата, и длительный период применения САИ не вызвал никаких побочных эффектов. В конце лечения развитие признаков прогрессирования СПИДа отмечено в 17 случаях среди лиц, получивших плацебо, и только в 2 случаях среди инфицированных индивидов, получивших САИ. Эффективность САИ по этому показателю существенно превосходила аналогичный результат в плацебо-контроле (р < 0,001) с коэффициентом вероятности успешного исхода 8,6 (95% ДИ 2,2–52,6). На основании этих данных B.K. Pedersen и соавт. считают, что САИ значительно отсрочивают прогрессирование СПИДа у ВИЧ-инфицированных индивидов. J. Rhodes [45], проанализировав данные по применению иммуномодуляторов, считает, что противовирусный эффект инозина пранобекса связан с его способностью усиливать продукцию IFN-α. Он полагает, что способность САИ задерживать прогрессирование СПИДа, выявленная в процессе клинического применения, связана с интерференцией САИ синтеза фолатов (солей фолиевой кислоты), присущей репликации возбудителя пневмоцистной пневмонии (P.carinii) [45, 46].
В середине 90-х годов прошлого века вследствие разработки и внедрения новых высокоэффективных препаратов против ВИЧ интерес к применению иммуномодулирующих препаратов спал, тем не менее в 1999 году Newport Pharmaceuticals International и National Institute of Allergy and Infectious Diseases спонсировали 7 научных проектов для клинического испытания САИ. Основными направлениями испытания явились тяжелые формы СПИДа; симптомокомплекс, связанный со СПИДом; заболевания лимфатических узлов и иммунодепрессированные больные при отсутствии генерализованной лимфаденопатии. В этом комплексе испытаний проводились также определение оптимальной дозы инозина пранобекса на иммунодепрессированных добровольцах, оценка его эффективности и безопасности у пациентов с ослабленной иммунной системой и заболеваниями лимфатических узлов, а также фазы I и II клинического испытания сочетанного применения рибовирина и САИ у бессимптомных ВИЧ-инфицированных пациентов. Клинические испытания по применению САИ у ВИЧ-инфицированных пациентов продолжаются, что свидетельствует о значимости САИ при ВИЧ-инфекции, и рациональным подходом считается комбинированное применение противовирусных и иммуномодулирующих средств [19, 20, 36].
Имеются также клинико-экспериментальные результаты оценки эффективности САИ при ОРВИ [2, 3], гриппе [47] и аллергических заболеваниях [1]. Так, у больных с хронической обструктивной болезнью легких Гропринозин был использован для лечения ОРВИ в период развития клинических симптомов (у 14 чел. по 1 г 3 раза в день в течение 5–7 дней). По мнению автора, включение Гропринозина в комплексное лечение ОРВИ значительно сокращает длительность клинической манифестации ОРВИ с минимальными симптомами интоксикации и предотвращает осложненное течение ОРВИ. Применение Гропринозина для профилактики ОРВИ у 12 больных (50 мг/кг ежедневно или 3 раза в неделю в течение двух месяцев) способствовало существенному снижению частоты развития ОРВИ у часто болеющих лиц. Если эти пациенты заболевали, то у них ОРВИ протекали непродолжительно, с минимальными и легкими симптомами [3]. Аналогичные позитивные клинические данные получены и в другой работе, когда Гропринозин был использован у 27 больных для лечения ангины на фоне ОРВИ [2].
М.М. Абелевич и соавт. [1], применив САИ у 31 ребенка с осложненным течением аллергических заболеваний кожи и дыхательных путей, показали снижение инфекционных осложнений и рецидивирования основного заболевания по сравнению с аналогичными показателями в контрольной группе из 29 больных.
И.З. Каримов [27] показал эффективность САИ при остром вирусном гепатите В, назначив САИ 14 пациентам ежедневно по 50 мг/кг в течение 5–10 дней на фоне традиционной терапии и 21 пациенту — традиционное лечение. Отмечено сокращение сроков в плане как регрессии клинических симптомов, так и нормализации биохимических параметров, свидетельствующих об улучшении функции печени, что привело к снижению времени пребывания больных в клинике.
У 33 больных J. Janeczko [48] установил диагноз мононуклеоза на основании клинических симптомов и степени нарушения показателей анализов крови с помощью неспецифических и/или специфических серологических тестов. При этом общее число лимфоцитов варьировало от 884 до 992 в 1 мм3. Количество В-лимфоцитов варьировало от 146 до 198, CD4 — от 482 до 645 и CD8 — от 245 до 364 в 1 мм3. 18 больным назначали тимозин ежедневно по 0,02 г подкожно в течение 30 дней, а 15 — САИ по 3 г в аналогичном режиме. Для контроля дополнительно наблюдали 12 больных с менее выраженной лимфопенией, которым лечение не проводилось. Оценка эффективности лечения проводилась путем определения общего количества лимфоцитов, В-лимфоцитов, CD4- и CD8-клеток до и после курса вышеуказанного лечения, с последующими контрольными исследованиями каждые 6 месяцев в течение 5 лет наблюдения. У 33 больных, получивших иммунотерапию, общая эффективность терапии мононуклеоза составила 64 %, что превосходило таковую (40 %) у 12 больных со спонтанной нормализацией показателей крови.
Результаты успешного применения САИ при тотальной и очаговой алопеции, по нашему мнению, представляют особый интерес, учитывая сложность этиопатогенеза данной патологии и низкую эффективность существующих методов ее лечения. Так, S. Georgala и соавт. [40] проводили рандомизированное двойное слепое плацебо-контролируемое исследование у 34 больных с очаговой алопецией, у которых ранее проведенное системное и локальное лечение было безуспешным. Критериями включения являлись длительность заболевания более 1 года и отсутствие ранее проводимой иммунотерапии. 16 больным назначали по 50 мг/кг САИ (Inosine pronabex) ежедневно в 5 приемов в течение 12 недель, остальным 16 пациентам — плацебо в аналогичном режиме. Скрупулезно оценивалась эффективность терапии каждые 4 недели в процессе лечения и по его окончании. Лечение с САИ сопровождалось в 33,3 % случаях полным восстановлением волос, в 53,3 % наблюдений — частичным, т.е. снижением более 50 % пораженной поверхности, и в 13,3 % случаев — отсутствием эффекта. Эти результаты в плане эффективности существенно превосходили аналогичные показатели плацебо-контролируемой группы (р < 0,01), где полного восстановления волос не было зарегистрировано, частичное восстановление отмечалось в 28,5 % случаев, а отсутствие эффекта — в 71,5 % наблюдений.
Механизм восстановления волос, по данным G.M. Galbraith и соавт. [38, 39], обусловлен усилением функции Т-клеток под воздействием САИ. Эти авторы также получили клинически значимые результаты с восстановлением волос у 7 больных с тотальной алопецией в серии наблюдений, состоящих из 9 пациентов. Причем позитивный эффект САИ на функцию Т-клеточного звена иммунной системы отмечен во всех наблюдениях. Аналогичные клинико-лабораторные результаты получены M. Lowy и соавт. [41], которые применяли САИ у больных как с тотальной алопецией, так и с очаговым выпадением волос. При этом наряду со стимуляцией иммунокомпетентных клеток обнаружено исчезновение специфических аутоантител, выявленных до начало курса лечения с САИ, с положительной корреляцией между позитивными клиническими данными об эффективности терапии и лабораторными показателями.
Разделив на группы 50 больных с ВПЧ-позитивной пролиферативной бородавчатой лейкоплакией (ПБЛ) слизистой полости рта, F. Femiano и соавт. [42] в первой группе (n = 25) применяли комбинированное лечение (САИ и хирургическое удаление ПБЛ), а во второй группе (n = 25) — только хирургическое лечение. Спустя 18 месяцев после комбинированного лечения рецидив ПБЛ был зарегистрирован в 4 (16,0 %) случаях, а после хирургической элиминации — в 18 (72,0 %) наблюдениях, что свидетельствует о высокой эффективности САИ при ВПЧ-ассоциированных заболеваниях полости рта.
Результаты оценки эффективности применения САИ при патологиях шейки матки и наружных половых органов, ассоциированных с ВПЧ-инфекцией
В последние годы специалисты из различных областей практической гинекологии стали широко применять САИ. Так, активные исследования в этом направлении проводятся под руководством профессоров В.Н. Прилепской (в Научном центре акушерства, гинекологии и перинатологии имени академика В.И. Кулакова), В.П. Козаченко (в Российском онкологическом центре имени Н.Н. Блохина), Е.Е. Григорьевой (в Алтайском государственном медицинском университете), А.В. Забелева (в Ростовском государственном медицинском университете) и многими другими. Об этом свидетельствуют серии работ, опубликованных в периодических изданиях и научных монографиях [4–7, 49].
Практические врачи применяют САИ при разнообразных гинекологических заболеваниях, включая генитальный герпес, цитомегаловирусную, папилломавирусную инфекции, и при других сочетанных патологиях, таких как хламидиоз и уреаплазмоз [50]. Однако основной точкой приложения САИ являются различные гинекологические заболевания, обусловленные вирусными и оппортунистическими возбудителями. На наш взгляд, особый интерес для практических врачей представляют результаты применения САИ при патологиях шейки матки, влагалища и вульвы, ассоциированные с ВПЧ-инфекцией. Так, группа профессора В.Н. Прилепской при дисплазии шейки матки тяжелой степени, классифицируемой как LSIL по системе Бетезда, применяла САИ в комбинированном режиме у 34 пациенток по 3 г в сутки в течение 5 дней на протяжении 7–10 дней до деструкции и в монорежиме у 29 женщин по 3 г в сутки в течение 10 дней. Следует отметить, что у всех пациенток очаги LSIL были обнаружены на фоне хронического цервицита сочетанной этиологии. Контрольной группой служили 34 женщины с аналогичной патологией шейки матки, которым проводилась только деструкция патологического очага шейки матки. При этом эффективность комбинированного режима применения САИ составила 87,5 %, а монодеструкции очагов LSIL — 65,6 % с частотой рецидивов 9,4 и 28,1 % соответственно. Эффективность элиминации частиц ВПЧ-инфекции после комбинированной терапии составила 65,6 %, а после монодеструкции очагов LSIL — 46,9 %. Клинически выраженный эффект улучшения самочувствия пациенток с прекращением патологических выделений (бели) обнаружен после монотерапии с САИ в 72,4 % случаев, а элиминация вирионов ВПЧ-инфекции — в 65,5 % наблюдений [6, 7].
В открытой проспективной работе А.Г. Кедрова и соавт. [5] применяли САИ в комбинированном режиме 45 пациенткам с дисплазией различной степени и раком шейки матки (РШМ) in situ. Для того чтобы определить тактику лечения и ведения больных в зависимости от тяжести дисплазии, пациентки были условно разделены на 3 группы: 20 пациенток с дисплазией I–II степени; 15 женщин с дисплазией III степени и РШМ in situ; 10 пациенток с рецидивами дисплазии и РШМ in situ. Основным критерием включения больных в это исследование явилось вирусоносительство ВПЧ, т.е. наличие генотипов ВПЧ высокого риска (генотипы 16 и 18 или один из них). САИ назначали по 3 г в сутки в течение 10 дней с контрольным обследованием на вирусоносительство через 10 дней после окончания курса лечения, а объем хирургического лечения определялся в зависимости от тяжести патологии шейки матки. После первого курса лечения САИ в 77,8 % наблюдений отмечено исчезновение вирионов ВПЧ-инфекции в образцах материалов, взятых из пораженных участков шейки матки. Повторные курсы САИ повышали эффективность такого подхода, в связи с чем авторы выполняли дополнительные курсы в 13 случаях.
В работе K.C. Mohanty и C.S. Scott [51] эффективность САИ изучалась при множественных генитальных кондиломах (более трех кондилом) как у женщин, так и у мужчин. У 145 пациентов, разделенных на 3 группы, применяли традиционный метод удаления кондилом (подофиллин), САИ или сочетание традиционной терапии с САИ. Хотя эффективность применения самого САИ не отличалась от традиционной терапии, дополнение традиционной терапии САИ существенно повысило эффективность лечения с 41 до 94 %. Причем применение САИ было успешным при длительно персистирующих генитальных кондиломах. По результатам мультицентровой двойной слепой плацебо-контролируемой работы, проведенной J. Davidson-Parker и соавт. [52], дополнительное применение САИ по 3 г ежедневно в течение 4 недель улучшило результаты традиционного лечения подофиллином у 55 больных с длительно протекающими (не менее 12 месяцев) генитальными кондиломами. Терапевтический эффект САИ был особенно более выраженным при тяжелой форме клинической манифестации ВПЧ с рецидивирующими множественными и крупными кондиломами. S. Georgala и соавт. [53] в рандомизированной плацебо-контролируемой работе, применив САИ в дозе 50 мг/кг в течение 12 недель, также показали высокую эффективность и безопасность данного препарата.
Клинико-экспериментальными и лабораторными исследованиями доказано, что САИ стимулируют активность иммунокомпонентных клеток (моноциты, макрофаги и NK-клетки) в плане как хемотаксиса и фагоцитоза, так и процессинга и презентации антигена, усиливают продукцию цитокинов (интерфероны и интерлейкины). САИ также стимулируют пролиферацию лимфоцитов (ускоряют дифференцировку пре-Т-лимфоцитов, стимулируют индуцированную митогенами пролиферацию Т- и В-лимфоцитов), увеличивают суммарное число и повышают функциональную активность Т-лимфоцитов, стимулируют образование лимфокинов, усиливают продукцию интерлейкина-2 и интерферона, нормализуют соотношение CD4/CD8, повышают способность клеток реагировать на лимфокины и хемотаксические факторы. Благодаря указанным свойствам САИ можно использовать для лечения и профилактики острых и хронических вирусных инфекций.
Таким образом, данные литературы свидетельствуют о необходимости использования иммуномодулирующих средств для коррекции заболеваний, обусловленных оппортунистическими возбудителями, что связано с нарастающим количеством больных с вторичным иммунодефицитом. Это требует поиска наиболее приемлемого и адекватного иммунопотенциатора, не обладающего побочными и плейотропными эффектами, присущими экзогенным цитокинам. В качестве подходящего иммуномодулятора представлен лекарственный аналог инозина Гропринозин (инозин пранобекс), метаболит натуральных пуринов, который инициирует продукцию интерферонов, интерлейкинов и других цитокинов, активирует иммунокомпетентные клетки, а также уравновешивает баланс клеточного и гуморального звена иммунной системы и таким образом выстраивает противовирусную защиту организма, что особенно актуально у трудных пациентов.