Драстоп р-р в/м 100 мг/мл 2 мл x10
Торговое название: ДРАСТОП
Международное название: Хондроитина сульфат&, (Chondroitin sulfate)
Фармакологическая группа: репарации тканей стимулятор
Фармакологическая группа по АТХ: M01AX25. Хондроитин сульфат
Фармакодинамика:
Высокомолекулярный мукополисахарид, замедляющий резорбцию костной ткани и снижающий потерю Ca2+. Улучшает фосфорно-кальциевый обмен в хрящевой ткани, ускоряет процессы ее восстановления, тормозит процессы дегенерации хрящевой и соединительной ткани. Подавляет ферменты, вызывающие поражение хрящевой ткани, стимулирует синтез гликозаминогликанов, способствует регенерации суставной сумки и хрящевых поверхностей суставов, увеличивает продукцию внутрисуставной жидкости. Ввиду своей структурной близости к гепарину, препятствует образованию фибриновых тромбов в синовиальном и субхондральном микроциркуляторном русле. Уменьшает болезненность и увеличивает подвижность пораженных суставов.
Гель, мазь: замедляет прогрессирование остеоартроза. ДМСО, входящий в состав мазевых форм, оказывает противовоспалительное, анальгезирующее и фибринолитическое действие, способствует лучшему проникновению хондроитина через клеточные мембраны.
Фармакокинетика:
Гель, мазь: практически не обладает системной абсорбцией.
Для таблеток, капсул, раствора для инъекций, лиофилизата для приготовления раствора для инъекций: при однократном приеме внутрь среднетерапевтической дозы TCmax в плазме — 3-4 ч, в синовиальной жидкости — 4-5 ч. Биодоступность — 13%.
Через 30 мин после в/м введения обнаруживается в крови в значительных концентрациях, через 15 мин — в синовиальной жидкости. TCmax — 1 ч, затем концентрация препарата медленно снижается в течение 2 сут.
Накапливается главным образом в хрящевой ткани (максимальная концентрация в суставном хряще достигает через 48 ч), синовиальная оболочка не является препятствием для его проникновения в полость сустава.
Выводится почками в течение 24 ч.
Показания к применению:
Мазь и гель: дегенеративно-дистрофические заболевания суставов и позвоночника — первичный артроз, остеоартроз с преимущественным поражением крупных суставов, межпозвонковый остеохондроз, остеопороз, пародонтопатия, переломы костей (для ускорения образования костной ткани).
Порошок для приготовления раствора для наружного применения: для ускорения репаративных процессов при длительно незаживающих ранах, трофичесике язвы, пролежни (в стадии гранулирования).
Таблетки, капсулы, раствор для инъекций, лиофилизат для приготовления раствора для инъекций: дегенеративно-дистрофические заболевания суставов и позвоночника: первичный артроз, остеоартроз с преимущественным поражением крупных суставов, межпозвонковый остеохондроз.
Противопоказания:
Гиперчувствительность, острые воспалительные процессы в области раны, распространенный некроз тканей, избыточные грануляции, нарушение целостности кожных покровов в местах предполагаемого нанесения,
детский возраст (эффективность и безопасность не установлены).
С осторожностью:
Беременность, период лактации, возраст до 18 лет.
Таблетки, капсулы, раствор для инъекций, лиофилизат для приготовления раствора для инъекций: кровотечения и склонность к кровоточивости, тромбофлебиты.
Режим дозирования:
Наружно: наносят 2-3 раза в день на кожу над очагом поражения и втирают в течение 2-3 мин до полного впитывания. Курс лечения — 2-3 нед. При необходимости курс лечения повторяют.
Порошок для приготовления раствора для наружного применения: непосредственно перед применением во флакон, содержащий 50 мг порошка для приготовления раствора для наружного применения, вводят 5 мл 0.5% раствора прокаина или 0.9% раствора натрия хлорида. Содержимое флакона тщательно взбалтывают. Образующийся вязкий раствор распределяют на поверхности двухслойной стерильной марлевой салфетки и накладываю на рану, а поверх — обычную марлевую повязку. Перевязки производят 1 раз в 2-3 дня. Продолжительность лечения в зависимости от течения — 10-30 дней.
Таблетки, капсулы, раствор для инъекций, лиофилизат для приготовления раствора для инъекций: внутрь, в/м.
Внутрь: взрослым — по 0.75 г 2 раза в сутки в течение первых 3 нед, затем — по 0.5 г 2 раза в день. Капсулы принимают, запивая небольшим количеством воды.
В/м: по 0.1 г через день, при хорошей переносимости дозу увеличивают, начиная с 4 введения, до 0.2 г. Курс лечения — 25-35 инъекций. Повторный курс — через 6 мес.
Побочные действия:
Мазь, гель, порошок для приготовления раствора для наружного применения: аллергические реакции.
Таблетки, капсулы, раствор для инъекций, лиофилизат для приготовления раствора для инъекций: аллергические реакции, геморрагии в месте инъекции.
Взаимодействие:
Таблетки, капсулы, раствор для инъекций, лиофилизат для приготовления раствора для инъекций: возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертывания крови при совместном применении.
Особые указания:
При выраженности рубцовых изменений краев раны и избыточных грануляциях препарат может быть применен после лечения препаратами, содержащими гиалуронидазу.
Следует избегать попадания мази и геля на слизистые оболочки и открытые раны.
Описание подключено по МНН
Дата актуализации инструкции 27.10.2015
Производитель: S.C.Rompharm Company S.R.L., Румыния
Владелец регистрационного удостоверения: World Medicine Ltd, Великобритания
Формы выпуска: раствор для внутримышечного введения 100 мг/мл, ампулы
Условия отпуска: по рецепту
Данные гос. регистрации: ЛП-003472 от 26.02.2016
Состояние регистрационного удостоверения: окончание срока действия 26.02.2021
Эффективность препарата Драстоп в лечении хронической боли в спине
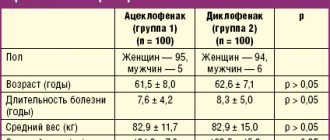
Представлены результаты исследования эффективности и переносимости хондроитина сульфата (препарата Драстоп) в комплексном лечении пациентов с хронической болью в спине. Все больные (n = 50) получали стандартную терапию, включающую нестероидные противовоспалительные препараты и миорелаксанты. Пациентам основной группы (n = 30) дополнительно был назначен Драстоп в первые три дня по 1 мл через день, затем по 2 мл через день, всего 25 инъекций. Контрольная группа (n = 20) лечения хондропротекторами не получала. Группы были сопоставимы по клиническим проявлениям дорсопатии, возрасту, результатам обследований. После проведенной терапии у пациентов основной группы уменьшилась выраженность болевого синдрома, увеличилась подвижность позвоночного столба и улучшились функциональные возможности, причем положительный эффект нарастал в течение двух месяцев после окончания лечения. Драстоп не оказывал негативного воздействия на субъективный статус пациентов. Его применение не сопровождалось возникновением побочных эффектов. Препарат хорошо переносился, улучшая клиническое течение болезни и повышая эффективность проводимой терапии.
Таблица 1. Выраженность болевого синдрома по визуальной аналоговой шкале
Таблица 2. Динамика показателей опросника Освестри
Введение
Боль в спине – одна из самых частых жалоб в клинической практике врачей различных специальностей. По разным данным, 49–90% населения испытывает хотя бы один эпизод боли в спине в течение жизни [1]. У основной массы пациентов боль разрешается в короткие сроки (до двух недель). Так, анализ эффективности лечения 280 больных в амбулаторных условиях показал, что средняя длительность болевого синдрома при радикулопатии составила 13,8 дня, а при неспецифических дорсопатиях – 11,2 дня [2]. Вместе с тем повторные эпизоды боли в спине в течение года развились у 20–44% таких пациентов, а в дальнейшем – более чем у 3/4.
Боль в спине ведет к значительным социально-экономическим потерям, связанным с временной нетрудоспособностью, а также в 10% случаев с инвалидностью [3].
Острая поясничная боль чаще всего вызвана неопасным для жизни заболеванием, но в основе диагностических алгоритмов лежит необходимость исключения специфических причин, поскольку такие ситуации требуют экстренного лечения, иначе значительно ухудшается прогноз на выздоровление [4]. Неадекватная терапия даже благоприятной по прогнозу неспецифической боли в спине усугубляет прогноз, вызывает ее хронизацию, снижает качество жизни пациента.
Причины развития дорсопатий весьма разнообразны. К факторам риска относятся генетическая предрасположенность, женский пол, средний возраст, различные анамнестические травмы позвоночника, неадекватные физические перегрузки, деятельность, связанная с пребыванием длительное время в вынужденной и нефизиологичной позе, курение, избыточный вес, гиподинамия и т.д. [5]. Чаще всего в основе вертеброгенных дорсопатий лежит остеохондроз позвоночника – дегенеративно-дистрофический процесс в межпозвонковых дисках, вовлекающий тела соседних позвонков, межпозвонковых суставов и связочный аппарат [6].
Изначально процесс затрагивает студенистое ядро межпозвонкового диска, которое из-за потери влаги перестает выполнять физиологические функции, теряет упругость. Под действием различных механических факторов могут формироваться секвестры, и ядро начинает выпячиваться в направлении фиброзного кольца диска. С течением времени в фиброзном кольце появляются трещины. Дефектный диск может провисать в просвет позвоночного канала (формируя пролапс диска), а фрагменты студенистого ядра, проникая через трещины фиброзного кольца, образуют грыжи диска. Описанные процессы в хотя бы одном позвоночном сегменте способствуют развитию реактивных изменений со стороны соседних позвонков и межпозвонковых суставов, в результате чего начинает страдать функциональное состояние всего позвоночного столба. Наряду с этим патологический процесс может охватывать желтую связку, которая начнет уплотняться, давить на корешок и оболочки спинного мозга. В дальнейшем может наступить стабилизация, вызванная фиброзом диска [6].
При всем разнообразии факторов, способствующих развитию дорсопатий, чаще всего к формированию данной патологии приводят два основных аспекта: нарушение функции трофических систем и перегрузка позвоночно-двигательных сегментов [5, 6]. Ограниченные перегрузки позвоночно-двигательных сегментов развиваются на фоне экзогенных (перегрузок в бытовых условиях, на производстве) и эндогенных (конституциональные особенности мышечно-связочного аппарата) причин. Все эти факторы лежат в основе разрушения хрящевой ткани с вовлечением межпозвонковых дисков и межпозвонковых суставов.
Хрящевая ткань – одна из разновидностей соединительной ткани, внешне напоминающая гель. Толщина хряща определяется типом сустава и его функциональным предназначением и составляет 1–7 мм. Суставной хрящ – высокоспециализированная хрящевая ткань, покрытая надхрящницей, обеспечивающей скольжение суставных поверхностей друг о друга, а также одинаковое распределение нагрузки при местном воздействии, что снижает травмирующее действие при движении. Хрящевая ткань межпозвоночных дисков состоит из подвижных параллельно направленных коллагеновых пучков (до 97%), которые, постепенно разрыхляясь, переходят в гиалиновый хрящ. Кроме коллагеновых волокон межклеточное вещество хрящевой ткани, или внеклеточный матрикс, состоит из воды (до 70%), гиалуроновой кислоты и протеогликанов (около 10–20%). Состав данной матрицы определяет свойства суставного хряща. Строение протеогликана обусловливает его высокую гидрофильность, что в сочетании с низкими показателями вязкости делает его идеальной структурой для противодействия суставным нагрузкам. При оценке функции суставного хряща необходимо обратить внимание на то, что он обеспечивает эластичность, стабильность при нагрузках, упругость при движении.
Питание хряща происходит пассивно из синовиальной жидкости и сосудов подлежащей кости. По мере старения организма концентрация протеогликанов и связанная с ними гидрофильность ткани в хряще уменьшается. Замедляется процесс образования хондробластов и молодых хондроцитов. На сегодняшний день доказано, что метаболизм хрящевой ткани носит анаэробный характер. Это объясняет низкую интенсивность процессов обмена в зрелой ткани, поэтому компенсаторные возможности хрящевой ткани весьма ограниченны, и дефекты суставного хряща практически не компенсируются, а только замещаются волокнистым хрящом, который имеет низкую плотность. Изменение коллагена, основного вещества, снижение числа эластических волокон в связках и сухожилиях, мышечные атрофии, разрастание в них соединительной ткани усугубляют функциональные нарушения в суставах [7].
К основным целям лечения и реабилитации пациентов с дорсопатиями относятся купирование клинических проявлений заболевания (ослабление боли, увеличение мобильности позвоночного столба), улучшение самообслуживания и качества жизни. Для разрешения этих вопросов применяется широкий спектр средств, как медикаментозных (нестероидные противовоспалительные препараты (НПВП), миорелаксанты, витамины группы В, препараты, улучшающие проводимость по нервному волокну, вазоактивные препараты), так и немедикаментозных (различные виды лечебной физкультуры, физиотерапия, рефлексотерапия, мануальная терапия, ударно-волновая терапия) [5, 7, 8]. При хронизации болевого синдрома на первый план выступают те методы терапии и реабилитации, которые способны предупреждать обострение заболевания и замедлять процессы дегенеративно-дистрофического прогрессирования в позвоночном столбе. Среди них различные методы физической терапии, которые позволяют сформировать адекватный мышечный корсет, коррекция психологического статуса, обучение правильному двигательному стереотипу [8, 9].
НПВП играют важную роль в купировании болевого синдрома при заболеваниях позвоночника [9, 10]. По результатам метаанализа, НПВП эффективны как при острой, так и при хронической боли в спине [9] и потому должны использоваться в качестве первой линии терапии. Необходимо отметить, что НПВП особенно эффективны на ранних этапах. При острой боли также назначают ненаркотические анальгетики и миорелаксанты [9]. При хронизации боли, когда активируются центральные патофизиологические механизмы, монотерапия НПВП не всегда эффективна [9, 10]. Длительное применение анальгезирующих и противовоспалительных препаратов, возможно, снизит выраженность неприятных ощущений, но не задержит разрушение хрящевой ткани, а следовательно, не замедлит дальнейшее прогрессирование заболевания. Пациент, принимающий анальгетики, благодаря которым болевые ощущения уменьшаются, часто превышает допустимую нагрузку на позвоночный столб, что может усугублять деструктивные изменения и способствовать быстрому прогрессированию заболевания [10]. Поэтому при хронизации заболевания самым перспективным считается сочетание медикаментозной терапии (НПВП, миорелаксанты, хондропротекторы, антидепрессанты) с лечебной физкультурой, мануальной и когнитивно-поведенческой психотерапией [10].
Структурно-модифицирующие (хондропротективные, хондромодулирующие) средства могут влиять на течение заболевания благодаря коррекции нарушений метаболизма гиалинового хряща. Хондропротекторы способствуют регенерации хрящевой ткани за счет восстановления хондроцитов и соединительной ткани. Хондропротективные препараты подавляют активность ферментов, которые ведут к дегенерации дисков, и одномоментно стимулируют процессы регенерации. Их применение замедляет дегенеративные процессы в позвоночнике и снижает риск хронизации боли. К препаратам со структурно-модифицирующими свойствами относятся хондроитин, глюкозамин, комбинированные препараты хондроитина сульфата и глюкозамина, неомыляемые вещества сои и авокадо, препараты гиалуроновой кислоты, стронция ранелат, имбирь (стандартизованный препарат экстракта Zingler officinale
и
Alpinia galanga
) и эстрогены [9]. Наиболее изученными и используемыми сегодня являются хондроитин и глюкозамин.
Хондроитина сульфат – группа соединений, которые имеют различную молекулярную массу и удельный вес. В основе механизма их действия лежит способность сохранять воду внутри хряща в форме водных полостей, создающих адекватную амортизацию и смягчающих удары, что увеличивает прочность соединительной ткани. Эффективность хондроитина сульфата доказана в различных исследованиях [5].
Фармакологический эффект от применения хондроитина сульфата определяется не только хондропротективным, но и противовоспалительным, обезболивающим действием, что также стимулирует регенерацию хрящевой ткани. Фармакодинамическая особенность хондроитина сульфата – способность препятствовать разрушению макромолекулярных структур нормальных тканей и активировать процессы регенерации в интерстициальной ткани и суставном хряще, что объясняет его анальгезирующее действие. Противовоспалительный механизм и механизм регенерации основаны на подавлении активности гиалуронидазы и активации синтеза гиалуроновой кислоты.
Среди хондропротекторов, в состав которых входит хондроитина сульфат, влияющий на фосфорно-кальциевый обмен в хрящевой ткани, следует отметить Драстоп. Драстоп показан при первичном и вторичном остеоартрозе различной локализации (коксартрозе, гонартрозе, артрозе мелких суставов), остеохондрозе и спондилезе. Обобщая опыт применения Драстопа в клинической практике, мы провели наблюдение с использованием Драстопа и дальнейшей оценкой динамики клинических симптомов распространенного остеохондроза, степени выраженности болевого синдрома и качества жизни пациентов.
Цель исследования
Определить возможности использования Драстопа как метаболического и анальгезирующего средства у пациентов с болью в спине на фоне традиционной терапии, включающей НПВП и миорелаксанты, а также оценить его переносимость.
Материал и методы
В исследование на условиях информированного согласия включены 50 пациентов с хроническим болевым синдромом в нижней части спины продолжительностью не менее трех месяцев. Болевой синдром не был обусловлен специфическими причинами (инфекционными поражениями, онкопатологией, системными поражениями). Дегенеративно-дистрофические изменения в позвоночнике были подтверждены результатами рентгенографии, компьютерной или магнитно-резонансной томографии.
В основную группу вошли 30 человек (18 женщин и 12 мужчин, средний возраст 39,4 ± 9,8 года). У 15% больных обнаружены протрузии межпозвонкового диска без компрессии корешка, у 26% – синдром фасеточных суставов, у 12% – радикулопатия, вызванная грыжей диска. Контрольную группу составили 20 пациентов (семь мужчин и 13 женщин, средний возраст 41,7 ± 9,3 года). Между группами не было существенных различий по таким показателям, как возраст, продолжительность заболевания, выраженность симптомов.
Всем пациентам обеих групп разрешалось принимать НПВП в стабильной дозе в сочетании с миорелаксантами. Кроме того, больным основной группы внутримышечно вводился Драстоп по схеме: в первые три дня по 1 мл через день, затем по 2 мл через день, всего 25 инъекций.
Эффективность препарата оценивалась с помощью визуальной аналоговой шкалы и опросника Освестри до начала исследования, после завершения инъекционного курса и через два месяца после окончания лечения. Статистическая обработка данных выполнялась с помощью комплекса статистических программ Statistica 6.0 с использованием критерия Манна – Уитни для двух несвязанных выборок.
Результаты и их обсуждение
На фоне лечения пациенты обеих групп отмечали некоторое уменьшение боли и улучшение состояния, но в группе больных, получавших Драстоп, выраженность положительных сдвигов была более выраженной (табл. 1). Лечебный эффект препарата проявлялся уже в конце курса инъекционной терапии и продолжал нарастать в течение двух месяцев после окончания лечения.
До начала терапии практически все пациенты отмечали нарушения по всем подшкалам опросника Освестри, отражающего качество и полноту жизни (привычной повседневной деятельности, самообслуживания, подвижности, качества сна, сексуальной жизни). Помимо снижения выраженности болевого синдрома применение препарата также привело к улучшению качественных характеристик жизни, нормализации сна, увеличению объема повседневной деятельности, ведению более активного образа жизни (табл. 2).
По данным опросника Освестри, у больных отмечалась положительная динамика общего состояния здоровья (физического, психологического и социального компонентов), о чем свидетельствует облегчение выполнения таких повседневных действий, как одевание, уход за собой, вставание, личная гигиена, ходьба. Причем положительный эффект нарастал в течение двух месяцев после окончания лечения. Побочных явлений в ходе применения Драстопа не наблюдалось.
Проведенное нами исследование эффективности Драстопа показало, что у пациентов с хронической болью в спине препарат способствовал уменьшению выраженности болевого синдрома, увеличению подвижности позвоночного столба и улучшению функциональных возможностей. Достаточный анальгетический эффект, который был получен за небольшой период, свидетельствует о том, что компоненты Драстопа обладают не только структурно-модифицирующими, но и противовоспалительными свойствами [5].
Одним из результатов проведенного наблюдения стало достоверное снижение степени расстройств функциональных способностей пациентов на фоне лечения, оцениваемых по шкале Освестри. Это имеет большое значение для скорейшего возвращения больных к нормальной повседневной двигательной активности и препятствует хронизации болевого синдрома [5]. Известно, что хроническая боль в спине, длительный постельный режим, отказ от физической активности негативно сказываются на восстановлении активизации и ослаблении выраженности болевого синдрома.
Выводы
Лечение Драстопом способствовало достоверному уменьшению выраженности болевого синдрома у пациентов с хронической болью в спине. Анальгетический эффект продолжал нарастать и в течение двух месяцев после окончания лечения. На фоне применения Драстопа также отмечено достоверное улучшение двигательных функций больных, что важно для профилактики хронизации болевого синдрома. Драстоп может быть рекомендован в качестве эффективного средства в составе комплексной терапии хронической боли в спине.