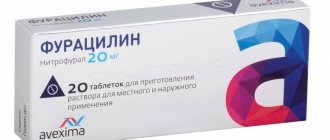
Фторид натрия
| Имена | |
| Произношение | / ˌ с oʊ д I ə м е л ʊər aɪ д / [1] |
| Название ИЮПАК Фторид натрия | |
| Другие имена Флоцид | |
| Идентификаторы | |
| Количество CAS |
|
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.789 |
| Номер ЕС |
|
| КЕГГ |
|
| PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
| Номер ООН | 1690 |
| CompTox Dashboard ( EPA ) |
|
ИнЧИ
| |
| Характеристики | |
| Химическая формула | NaF |
| Молярная масса | 41,988173 г / моль |
| Внешность | От белого до зеленоватого твердого вещества |
| Запах | без запаха |
| Плотность | 2,558 г / см 3 |
| Температура плавления | 993 ° С (1819 ° F, 1266 К) |
| Точка кипения | 1704 ° С (3099 ° F, 1977 К) |
| Растворимость в воде | 36,4 г / л (0 ° С); 40,4 г / л (20 ° С); 50,5 г / л (100 ° C) [2] |
| Растворимость | слабо растворим в , аммиак незначительно в спирте , ацетоне , SO 2 , диметилформамиде |
| Давление газа | 1 мм рт. Ст. При 1077 C ° [3] |
| Магнитная восприимчивость (χ) | −16,4 · 10 −6 см 3 / моль |
| Показатель преломления ( n D ) | 1,3252 |
| Структура | |
| Кристальная структура | Кубический |
| Постоянная решетки | а = 462 пм |
| Молекулярная форма | Восьмигранный |
| Термохимия | |
| Теплоемкость ( C ) | 46,82 Дж / моль К |
| Стандартная мольная энтропия ( S o 298 ) | 51,3 Дж / моль К |
| Std энтальпия формации (Δ F H ⦵ 298 ) | -573,6 кДж / моль |
| Свободная энергия Гиббса (Δ f G ˚) | -543,3 кДж / моль |
| Фармакология | |
| Код УВД | A01AA01 ( ВОЗ ) A12CD01 ( ВОЗ ), V09IX06 ( ВОЗ ) ( 18 F ) |
| Опасности | |
| Паспорт безопасности | [4] |
| Пиктограммы GHS | |
| Сигнальное слово GHS | Опасность |
| Формулировки опасности GHS | H301 , H315 , H319 , H335 [4] |
| NFPA 704 (огненный алмаз) | 0 3 0 |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
| LD 50 ( средняя доза ) | 52–200 мг / кг (перорально крысам, мышам, кроликам) [6] |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (Допустимо) | TWA 2,5 мг / м 3 [5] |
| REL (рекомендуется) | TWA 2,5 мг / м 3 [5] |
| IDLH (Непосредственная опасность) | 250 мг / м 3 (как F) [5] |
| Родственные соединения | |
| Другие анионы | Хлорид натрия Бромид натрия Йодид натрия Астатид натрия |
| Другие катионы | Фторид лития Фторид калия Фторид рубидия Фторид цезия Фторид франция |
| Родственные соединения | Реагент TASF |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| N проверить ( что есть ?)YN | |
| Ссылки на инфобоксы | |
Фторид натрия
(
NaF
) — неорганическое соединение с формулой NaF. Он используется в следовых количествах при фторировании питьевой воды, зубной пасты, в металлургии в качестве флюса , а также используется в пестицидах и крысином яде. Это бесцветное или белое твердое вещество, легко растворимое в воде. Это распространенный источник фтора при производстве фармацевтических препаратов и используется для предотвращения кариеса .
В 2021 году это было 247-е место среди наиболее часто назначаемых лекарств в Соединенных Штатах с более чем одним миллионом рецептов. [7] [8]
Получение в промышленности
Фторид натрия — довольно полезное соединение, поэтому синтезируется он в промышленных масштабах. Мировое производство составляет более 10000 тонн в год. В большинстве случаев сырьем являются гексафторсиликаты, которые также получают искусственно. На производстве их подвергают щелочному гидролизу, в результате которого в реакционной смеси выделяется фторид натрия. Но его еще необходимо отделить от примесей оксида кремния и силиката натрия. Делают это зачастую обыкновенной фильтрацией.
Но гексафторсиликаты даже при термическом разложении или при взаимодействии с карбонатом натрия могут давать фторид натрия. Это также может быть использовано при промышленном синтезе.
Также в промышленности существует способ получения фторида натрия из кальцинированной соды (карбоната натрия) и плавиковой кислоты. В результате их взаимодействия с помощью фильтрации удается получать технически чистый продукт:
Na2CO3 + HF → 2NaF + CO2 + H2O
Меры безопасности при хранении и транспортировке
Принесет фторид натрия вред или пользу зависит от того, насколько соблюдаются меры безопасности при работе с токсичным веществом. На производстве, где используется фтористый натрий, регулярно проводят анализ состава воздуха для оценки содержания ПДК. Сотрудники, кто взаимодействует с токсичным химикатом, должны надевать средства индивидуальной защиты. Рабочее место оснащается системой принудительной вентиляции.
Транспортировка фтористого натрия происходит любым видом транспорта. Складировании и хранение токсичного вещества возможно только в сухих, хорошо проветриваемых помещениях.
Получение в лаборатории
В лаборатории возможны и другие способы получения этого соединения. Самый простой — это реакция нейтрализации гидроксида натрия плавиковой кислотой. Другой вариант: взаимодействие гидроксида натрия с фторидом аммония. Гидроксид натрия может давать фторид и при взаимодействии с простым фтором.
В теории фторид натрия можно получать и из простых веществ: натрия и фтора. Эта реакция протекает очень бурно, хотя на практике ее проводят очень редко.
F2 + 2Na → 2NaF
Еще один способ получения — это термическое разложение дифторгидрата и некоторых комплексных солей. В этом случае получается продукт очень высокой чистоты.
Na(HF2) → NaF + HF
При окислении простого фтора броматом натрия или другими окислителями, содержащими натрий, в качестве продукта может получаться фторид натрия.
F2 + NaBrO3+ 2NaOH → NaBrO4 + 2NaF + H2O
Взаимодействием трифторида бора с гидридом натрия, также можно получить эту соль.
BF3 + NaOH → Na3BO3 + NaF + H2O
Класс опасности
Фтористый натрий является токсичным и ядовитым веществом. Присвоен фториду натрия класс опасности 2. Особенно токсичен при попадании в дыхательные пути и в органы пищеварения. Отравление веществом приводит к нарушениям работы сердечно-сосудистой системы, скачкам артериального давления, раздражению желудочного тракта, включая появление язв.
При отравлении фтористым натрием проявляются такие симптомы:
- тошнота, диарея и рвота;
- слюно- и слезотечение;
- падение уровня артериального давления;
- повышение температуры тела;
- нарушения зрения.
Вред фтористый натрий приносит и при попадании на кожу, что способствует появлению сильных химических ожогов.
Химические свойства
В водных растворах фторид натрия диссоциирует и образует комплексное соединение.
NaF + 4H2O → [Na(H2O)4]+ + F-
При взаимодействии с плавиковой кислотой образуется дифторгидрат. Но при избытке фтороводорода могут образовываться иные комплесксные соединения, которые называются гидрофториды натрия. Их состав может быть разным в зависимости от соотношения реагентов.
Как видно из химической формулы, фторид натрия — это типичная соль, поэтому он вступает в реакции обмена с другими солями, если в результате реакции образуется осадок или газ. При взаимодействии с кислотами выделяется газообразный фтороводород. А с гидроксидом лития образуется осадок фторида лития.
Фторид натрия может образовывать и другие комплексные соли, в зависимости от реагентов и условий реакции.
Взаимодействие
Инструкция указывает, что соли кальция связывают фторсодержащие соединения в желудочно-кишечном тракте. Кроме этого, препараты, в основе которых лежат алюминий или магний, имеют аналогичный эффект. Лекарства, которые обладают обволакивающими свойствами, также препятствуют усвоению фтора, поэтому их надо принимать отдельно. Усиливать действие натрия фторида могут витамины А и D.
Лечение натрия фторидом эффективно при борьбе с кариесом и остеопорозом, однако всегда необходимо соблюдать рекомендации врача и периодически сдавать анализ крови для предупреждения возможных побочных действий.
Применение
Фторид натрия обладает хорошими антисептическими свойствами, поэтому его иногда добавляют в моющие средства. По той же причине он используется для обработки древесины. Раствор этой соли помогает бороться с плесенью, грибком и насекомыми. Чаще всего используют трехпроцентный раствор. Он хорошо проникает в древесину и защищает ее от гниения. Но у этого средства есть недостаток, из-за которого фторид натрия редко используют, — он легко вымывается из древесины во время дождей, так как эта соль хорошо растворима в воде.
Он также используется при синтезе некоторых химических соединений, в частности фреонов и инсектицидов. Ионы фтора останавливают гликолиз (окисление глюкозы), поэтому фторид натрия применяют для биохимических исследований.
Часто его используют и в металлургической промышленности для очистки поверхностей металлов, а также при их плавке и пайке. Вещество иногда добавляют и в цемент, делая бетон стойким к воздействию кислот, и в смазки для повышения термостойких качеств.
Самое спорное его применение — это добавление в зубные пасты. Для зубов фторид натрия — это источник фтора, который необходим для придания костям и зубам прочности, также служит для профилактики кариеса. Но при высоком потреблении этого элемента могут возникать негативные последствия. Поэтому до сих пор ведутся споры о применении фторидов в качестве добавок для зубной пасты.
Что можно сделать?
Многие исследователи считают, что фтор не имеет безопасной дозы. Даже незначительные регулярные дозы вызывают нагрузку на организм, укоряют старение, снижают здоровье, приводят к развитию хронических заболеваний. Как только человек перестает употреблять фтористый натрий, организму становится легче устранить его из тела. Чем быстрее он будет покидать тело, тем быстрее здоровье начнет улучшаться. Кто согласится повышать риск снижения интеллекта ребенка и своего собственного, в целях сокращения небольшого количества кариеса для зубов? Хотя и по этому вопросу – вопросу кариеса – тоже нет достаточных доказательств.
ИТАК:
1 Не используйте зубную пасту с добавлением фтора. К таким пастам относятся «Paradontax с фтором», «Colgate «Максимальная защита от кариеса», «Blend-a-Med с активным фтором». Здесь названия говорят сами за себя, но если вы хотите на 100% быть уверенными в том, что паста не содержит фтор, убедитесь, что в составе нет следующих соединений: — Монофторофосфат; — Фторид алюминия; — Фторид натрия; — Аминофторид (также может встречаться под названием олафлур); — Фторид олова. Зубные пасты без фтора: «Президент», «Сплат», «Рокс», «Асепта», «Новый жемчуг с кальцием» и ряд других зубных паст, состав которых вы можете изучать самостоятельно. 2 При покупке молока, изучайте состав продукта. Не приобретайте молоко с добавлением фторида натрия. 3 По возможности, приобретите многоступенчатую систему очистки воды , которая использует технологию обратного осмоса и установите ее в вашем доме. Такая очистка воды снизит риск токсичности фтора.
Проявляйте бдительность в вопросах, касающихся вашей безопасности и безопасности родных и близких, и будьте здоровы!
- < Назад
- Вперёд >
Позитивное влияние фтора на организм
Фтор является довольно важным микроэлементом в организме человека, без которого невозможна нормальная его жизнедеятельность. В сутки необходимо потреблять 0,03 мг фтора на килограмм массы тела для взрослого человека. Ребенку же необходимо в 5 раз больше.
Функции фтора в организме очень разнообразны. Он способствует правильному росту и формированию костей, волос и ногтей, так как стабилизирует кальций в процессе минерализации. Особенно это важно во время роста и развития детей, а также при переломах. Этот элемент необходим для поддержания иммунитета. Железо лучше усваивается организмом, если в этом процессе участвует фтор.
При недостатке этого элемента ослабляется зубная эмаль, возрастает риск кариеса. У детей в этом случае могут появляться дефекты при развитии скелета. У взрослых появляется риск развития остеопороза. Это заболевание характеризуется пониженной плотностью костей, из-за чего возрастает их хрупоксть.
Как правильно подобрать дозировку
Подобрать дозу должен ваш лечащий врач. Инструкция по применению фторида натрия указывает, что при остеопорозе курс лечения должен быть длительным и составлять не менее года. Ориентировочная доза для взрослого составляет 0,015–0,02 грамма 3 раза в день. С профилактической целью достаточно принимать 1 таблетку натрия фторида 1 раз в день. Для лечения кариеса у ребёнка доза колеблется от 0,0011 до 0,0022 грамма в сутки, но её надо обязательно согласовать с врачом. Детям (в возрасте от 16 лет) лучше всего подойдут полоскания рта 0,05–0,2% раствором натрия фторида.
Проблемы при избытке фтора в организме
При повышенном содержании фтора в организме может возникнуть флюороз. Это заболевание характеризуется рядом необратимых последствий. В начальных периодах развития болезни страдает зубная эмаль. На ней появляются пятна разной формы и цвета. Пятна легко диагностируются стоматологом, и при своевременном лечении от них можно без труда избавится. Для отбеливания часто используют растворы неорганических кислот, раствор перекиси водорода или растворы других перекисей. После отбеливания эмали проводят реминерализацию раствором глюконата кальция. При лечении более тяжелых форм флюороза рекомендуется приминать глюконат кальция внутрь до окончания терапии. Если при флюорозе возникла эрозия зубной эмали, то применяют композитные материалы и восстанавливают форму зуба, примерно так же, как при пломбировании.
В качестве профилактики данного заболевания можно снизить поступление фтора в организм, если его концентрация в питьевой воде велика. Для этого обычно заменяют источник воды либо же просто проводят фильтрацию. Также можно убрать из рациона продукты, в которых содержится много фтора: морскую рыбу, животное масло, шпинат. Может помочь введение в пищу витаминов С и D, а также глюконата кальция.
Если избыток фтора наблюдается на протяжении длительного периода (10-20 лет), начинают страдать кости. Возникает остеосклероз, при котором, в отличие от остеопороза, плотность костей становится выше нормы, что приводит к снижению их упругости. Это также может стать причиной частых переломов. Но переживать не стоит. Настолько сильный переизбыток фтора в организме может возникнуть только у людей, работающих на производстве фторидов без соблюдения техники безопасности.
Ссылки [ править ]
- ↑
Wells, John C. (2008),
Словарь произношения Longman
(3-е изд.), Longman, стр. 313 и 755, ISBN 9781405881180. Согласно этому источнику, альтернативное произношение второго слова / е л ɔːr aɪ д / и, в Великобритании, а также / е л ¯u ə г aɪ д / . - Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press . п. 5.194. ISBN 978-1439855119.
- Льюис, Опасные свойства RJ Sax промышленных материалов. 10-е изд. Тома 1–3 Нью-Йорк, Нью-Йорк: John Wiley & Sons Inc., 1999., стр. 3248
- ^ a b Sigma-Aldrich Co. , Фторид натрия . Проверено 17 марта 2015.
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0563» . Национальный институт охраны труда и здоровья (NIOSH).
- Мартель, B .; Кэссиди, К. (2004), Анализ химического риска: Практическое руководство
, Баттерворт-Хайнеманн, стр. 363, ISBN 978-1-903996-65-2 - «Топ 300 2020» . ClinCalc
. Проверено 11 апреля 2021 . - «Фторид натрия — Статистика употребления наркотиков» . ClinCalc
. Проверено 11 апреля 2021 . - ↑
Bourne, редактор тома, Джеффри Х. (1986).
Диетические исследования и рекомендации по здоровью и болезням
. Базель: Каргер. п. 153. ISBN. 978-3-8055-4341-5. - ↑
Jr, Корнелис Кляйн, Корнелиус С. Херлбут (1999).
Руководство по минералогии: (по Джеймсу Д. Дане)
(21-е изд., Ред. Ред.). Нью-Йорк: Дж. Вили. ISBN 978-0-471-31266-6. - Селвиц, Роберт H; Исмаил, посреди меня; Питтс, Найджел Б. (январь 2007 г.). «Кариес». Ланцет
.
369
(9555): 51–59. DOI : 10.1016 / S0140-6736 (07) 60031-2 . PMID 17208642 . S2CID 204616785 . - Отдел гигиены полости рта, Национальный центр по профилактике услуг, CDC (1993), Фторирование Перепись 1992 (PDF) , извлекаются 2008-12-29 . CS1 maint: несколько имен: список авторов ( ссылка )
- Haguenauer, D; Велч, В; Ши, B; Tugwell, P; Уэллс, Г. (2000). «Фторид для лечения постменопаузального остеопороза». Кокрановская база данных систематических обзоров
(4): CD002825. DOI : 10.1002 / 14651858.CD002825 . PMID 11034769 . - Вестергаард, P; Jorgensen, NR; Schwarz, P; Mosekilde, L (март 2008 г.). «Влияние лечения фтором на минеральную плотность кости и риск переломов — метаанализ». Osteoporosis International
.
19
(3): 257–68. DOI : 10.1007 / s00198-007-0437-6 . PMID 17701094 . S2CID 25890845 . - Блау, Монте; Ганатра, Раманик; Бендер, Меррилл А. (январь 1972 г.). «18F-фторид для визуализации костей». Семинары по ядерной медицине
.
2
(1): 31–37. DOI : 10.1016 / S0001-2998 (72) 80005-9 . PMID 5059349 . - Ордонез, AA; Демарко, вице-президент; Klunk, MH; Поккали, С .; Джайн, СК (октябрь 2015 г.). «Визуализация хронических туберкулезных поражений с использованием натриевой [18F] фторид-позитронно-эмиссионной томографии у мышей» . Молекулярная визуализация и биология
.
17
(5): 609–614. DOI : 10.1007 / s11307-015-0836-6 . PMC 4561601 . PMID 25750032 . - Грант, ФО; Fahey, FH; Packard, AB; Дэвис, RT; Алави, А .; Treves, ST (12 декабря 2007 г.). «Скелетный ПЭТ с 18F-фторидом: применение новой технологии к старому индикатору» . Журнал ядерной медицины
.
49
(1): 68–78. DOI : 10,2967 / jnumed.106.037200 . PMID 18077529 . - Хальперн, DF (2001), «фторид натрия», Энциклопедия Реагенты для органического синтеза
, John Wiley & Sons , DOI : 10.1002 / 047084289X.rs071 , ISBN 978-0471936237 - ^ a b c Aigueperse, Жан; Моллард, Поль; Девилье, Дидье; Chemla, Marius; Фарон, Роберт; Романо, Рене; Куэр, Жан-Пьер (2000). «Соединения фтора неорганические». Энциклопедия промышленной химии Ульмана
. Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a11_307 . - Хаус, Джеймс Э .; Хаус, Кэтлин А. (10.09.2015). Описательная неорганическая химия . Академическая пресса. п. 397. ISBN. 978-0-12-802979-4.
- Меткалф, Роберт Л. (2007), «Контроль над насекомыми», Энциклопедия промышленной химии Ульмана (7-е изд.), Wiley, стр. 9
- ^ a b Капп, Роберт (2005), «Фтор», Энциклопедия токсикологии
,
2
(2-е изд.), Elsevier, стр. 343–346. - Грин Шеперд (2005), «Фтор», Энциклопедия токсикологии
,
2
(2-е изд.), Elsevier, стр. 342–343 - Паспорт безопасности данных NaF . hazar.com
- CDC — Карманный справочник NIOSH по химической опасности
- Мюррей TM, Ste-Marie LG. Профилактика и лечение остеопороза: консенсусные заявления Научного консультативного совета Канадского общества остеопороза. 7. Фторидная терапия остеопороза . CMAJ
. 1996. 155 (7): 949–54. PMID 8837545 . - Национальный совет здравоохранения и медицинских исследований (Австралия). Систематический обзор эффективности и безопасности фторирования
[PDF]. 2007. ISBN 1-86496-415-4 . Резюме: Yeung CA. Систематический обзор эффективности и безопасности фторирования.
Доказанная вмятина
. 2008. 9 (2): 39–43. DOI : 10.1038 / sj.ebd.6400578 . PMID 18584000 . - Уэллс, AF (1984), Структурная неорганическая химия
, Оксфорд: Clarendon Press , ISBN 978-0-19-855370-0 - «Химическая и физическая информация», Токсикологический профиль фторидов, фтористого водорода и фтора (PDF) , Агентство по регистрации токсичных веществ и заболеваний (ATDSR), сентябрь 2003 г., стр. 187 , дата обращения 01.11.2008
- Справочник по минералам (PDF) , публикация минеральных данных, 2005.
Фторирование воды
Как уже было сказано выше, фтор может использоваться для профилактики кариеса. По этой причине в середине прошлого века в некоторых странах начали применять фторирование водопроводной воды. Его суть напоминает хлорирование. В воду добавляют небольшое количество фторида натрия или иного компонента, содержащего фтор, для придания ей определенных свойств. Сегодня в США фторируется 2/3 всей воды.
Чтобы человек получал необходимое количество фтора, по данным Всемирной организации здравоохранения, питьевая вода должна содержать 0,5-1,0 мг фтора в литре. Но обыкновенная вода не всегда содержит такое количество, поэтому приходится увеличивать его искусственно.
Фторирование воды никак не влияет на ее вкус или запах. Благодаря этому процессу очень сильно снижается риск заболевания кариесом, особенно среди детей. Это происходит из-за того, что фтор уничтожает бактерии, которые могут растворять эмаль зубов и вызывать кариес.
Конечно, повышенное содержание фтора может привести к флюорозу, но, согласно авторитетным исследованиям, фторирование воды не может являться причиной развития данной патологии. Других побочных действий у такой воды также не наблюдается. Хотя в последнее время стали появляться некоторые низкокачественные исследования, говорящие об обратном. Набирал популярность и миф, что фторирование воды служит способом для утилизации фторидов, которые являются отходом алюминиевых предприятий. Но эта версия не нашла подтверждения.
Употребление фторированной воды не рекомендуется лишь при некоторых заболеваниях: диабете, гормональных нарушениях, артрите, болезнях щитовидной железы, почек и сердца.
В любом случае воду несложно избавить от присутствия фтора. Фильтры, работающие по принципу обратного осмоса, удаляют почти весь фтор, а дистилляция очищает воду от него полностью. Бытовые фильтры также могут частично или полностью задерживать фтор в себе. Пропуская воду через глинозем, костную муку или костный уголь можно также убрать фтор из воды. Некоторые фториды (например, фторид кальция) нерастворимы в воде, поэтому можно использовать метод осаждения, чтобы перевести весь фтор в осадок. Для этого зачастую используют известь.
Фторид Натрия. В чем опасность для здоровья?
- Интересное
- Печать
На полках магазинов мы, как правило, видим фторированные зубные пасты или ополаскиватели для полости рта. Однако, многие люди в последнее время стараются избегать таких средств гигиены. Покупатели сомневаются в пользе для здоровья фтористого натрия из-за некоторой открывающейся информации об этой добавке. И это несмотря на заверения ряда стоматологов о важности фтора для зубной эмали. Почему же так происходит? Вы когда-нибудь задумывались, почему фторированные пасты имеют такие предупреждающие надписи на этикетке, как: «Детям до 6 лет рекомендуется использовать зубную пасту размером с горошину и под присмотром взрослых», «Не глотать», «В случае попадания фторида внутрь обратитесь за медицинской помощью» и т.д. Причина, по которой зубные пасты имеют предупреждающие надписи, заключается в защите их производителей от судебных процессов, связанных с отравлением фторидом. Не содержащие фтор зубные пасты обычно не имеют таких предупредительных этикеток, потому что у них нет ингредиентов, способных нанести серьезный вред организму. Сегодня фторируется стоматологические пасты, водопроводная вода, и даже молоко. Фтор может содержаться в фосфорных удобрениях, следовательно, черный и зеленый чай (при выращивании которого используются фосфорные удобрения) может содержать фтор. И еще один факт, на который важно обратить внимание. В ряде стран существует запрет на фторирование питьевой воды: Австрия, Бельгия, Китай, Чешская Республика, Дания, Финляндия, Франция, Германия, Венгрия, Индия, Израиль, Япония, Люксембург, Нидерланды, Северная Ирландия, Норвегия, Шотландия, Швеция, Швейцария. И это совсем не случайно. Когда в этих странах узнали о «пользе» фтора, то сразу приняли необходимое решение на законодательном уровне – запретили его использование. Поскольку теперь у вас существует большее понимание того, что причина наличия предостережений на этикетках фторированных зубных паст есть, давайте разберемся в различиях между природным и синтетическим фтором, чтобы знать, какого фторида следует избегать.
Применение в фармакологии
Фторид натрия является действующим веществом некоторых лекарственных препаратов. Как правило, прием таких таблеток осуществляется по назначению врача, иногда терапия требует специального наблюдения и сопровождается регулярными исследованиями динамики протекания. Торговые названия препаратов фтора: «Натрия фторид», «Натриум флуоратум» и «Оссин». Их прописывают при недостатке фтора в организме, в частности при остеопорозе.
Препарат в виде драже и таблеток принимают внутрь. Почти весь фтор усваивается организмом, вне зависимости от приема пищи. Обычно такую терапию сочетают с приемом кальция и магния по 1-1,5 г в сутки. Это помогает костям более стабильно минерализоваться.
Но препарат опасно принимать свыше нормы. В таком случае может возникнуть избыток фтора, приводящий к флюорозу. При приеме лекарственных средств, содержащих фторид натрия, необходимо наблюдаться у стоматолога, чтобы предупредить развитие флюороза.
Различия между природным и синтетическим фтором
Природный образец фторида – это не то же самое, что синтетическая промышленная версия (фторид натрия). Фторид, который содержится в природе, известен как фторид кальция. Этот природный минерал в природе встречается в виде флюорита преимущественно в земной коре и грунтовых водах на малых уровнях.
Синтетическая версия фторида называется фторид натрия, который является побочным продуктом фосфатной промышленности. Когда речь идет об этом синтетическом промышленном варианте, термин «фторид» используется для обозначения множества различных химических веществ, из которых состоит фторид, включая, но, не ограничиваясь ими: свинец, алюминий, кадмий, мышьяк, гидрофторосиликарную кислоту и даже радиоактивные материалы. Во времена нацисткой Германии фторид натрия был передан заключенным в концентрационных лагерях, потому что нацистские врачи обнаружили, что его компоненты оказывают лоботомическое воздействие на заключенных, что делает их покорными и ими становится легче управлять. Слышали ли вы когда-либо, что многие эксперты связывают фторид натрия с понижением IQ и возрастанием раковых болезней? Может ли в действительности этот токсин быть одной из основных причин этих проблем?