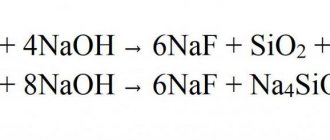Хитозан – полисахарид, является компонентом хитина. Производят из панцирей ракообразных, верхнего покрова насекомых и крыльев бабочек. В большом количестве содержится в панцире красного краба. Входит в состав морских водорослей и грибов.
Вещество химически связано с целлюлозой являющейся опорным материалом клеточной стенки растений. Хитозан относится к классу пищевых волокон. В желудочно-кишечном тракте преобразуется в гель. Способен соединятся с жирами, токсинами, холестерином. Оказывает на них разрушающее действие. Выводится из организма в неизменном виде, естественным путем.
Натуральное биологическое вещество регулирует множество физиологических процессов в организме. Широко используется в медицине. Входит в состав средств для борьбы с дисбактериозом кишечника и нарушениями работы ЖКТ. Диетологи назначают хитозан в виде пищевой добавки для профилактики и очищения организма от шлаков. При попадании в желудок хорошо усваивается. Распадается на простые составляющие, всасывается в кровь. Препарат применяют для лечения травм, порезов, ожогов. Ускоряет регенерацию кожных покровов. Стимулирует заживление без образования рубцов.
Нозологическая классификация (МКБ-10)
- E11 Инсулинонезависимый сахарный диабет
- E65-E68 Ожирение и другие виды избыточности питания
- E78.0 Чистая гиперхолестеринемия
- I10 Эссенциальная (первичная) гипертензия
- I15 Вторичная гипертензия
- I20-I25 Ишемическая болезнь сердца
- I70 Атеросклероз
- K59.8.0* Атония кишечника
- K59.8.1* Дискинезия кишечника
- K63.8.0* Дисбактериоз
- K80 Желчно-каменная болезнь [холелитиаз]
- K82.8.0* Дискинезия желчного пузыря и желчных путей
- M10 Подагра
- M81 Остеопороз без патологического перелома
- T78.4 Аллергия неуточненная
- X40-X49 Случайное отравление и воздействие ядовитыми веществами
Хитозан (снижает массу тела) таблетки №100
Страна
Россия
Страна производства может меняться в зависимости от партии товара. Детальную информацию уточняйте у оператора при подтверждении заказа.
Состав
1 таблетка содержит: хитозана 125 мг, микрокристаллической целлюлозы 311 мг, аскорбиновой кислоты 10 мг, лимонную кислоту, глюкозу, ароматизатор пищевой.
Фармакологическое действие
Благодаря широкому спектру биологической активности препарат способствует снижению массы тела. Хитозан — Эвалар создан на основе хитозана — аминополисахарида, полученного из панцирей ракообразных, являющегося натуральным источником пищевых волокон. Хитозан связывает и выводит из организма жиры, поступающие с пищей, способствует нормализации обмена веществ, снижению уровня холестерина и сахара в крови.— Увеличивает перистальтику кишечника и обеспечивает быстрое выведение из организма пищевых жиров, токсических соединений, поступающих в кишечник, и образующихся в нем канцерогенов; способствует нормализации кишечной флоры; — Обладает антибактериальными и антигрибковыми свойствами;— Способствует укреплению костей и зубов; предотвращает развитие остеопороза и подагры;— Нормализует кровяное давление.
Показания к применению
Рекомендуется в качестве БАД для желающих контролировать свой вес, а также для очищения организма от шлаков и токсинов при аллергических реакциях, хронических и острых интоксикациях или в целях общего оздоровления организма.— при атеросклерозе;— для снижения уровня холестерина в крови;— при сахарном диабете II типа, подагре, остеопорозе;— при дискинезии желчевыводящих путей или толстой кишки, желчно-каменной болезни, атонии кишечника, дисбактериозе;— при гипертонии, ишемической болезни сердца;— при онкологических заболеваниях.
Способ применения
Взрослым по 3-4 табл. 2 раза в день перед едой, запивая стаканом воды. Курс приема 1 месяц. Повторные курсы — по рекомендации врача.Курсовое лечение можно повторять 2-3 раза в год на фоне адекватной основному заболеванию диеты. С профилактической целью достаточно принимать по 2 табл. 2 раза в день продолжительное время.Для получения стойкого эффекта снижения массы тела рекомендуется принимать по 4 табл. 3 раза в день в течение двух-трех курсов без перерыва (2-3 месяца). При приеме препарата очень важно принимать таблетки перед каждым приемом жирной пищи.
Противопоказания
Не рекомендуется беременным и кормящим женщинам, детям до 12 лет, при индивидуальной непереносимости продукта.Прием витаминов или лекарств на жирной основе следует перенести на время, когда «Хитозан-эвалар» не используется, чтобы не снизить эффективность их действия.
Особые указания
Перед применением рекомендуется проконсультироваться со специалистом.
Свойства компонентов
Хитозан (аминосахарид, полученный из панцирей ракообразных) понижает уровень холестерина, мочевой кислоты и глюкозы (у больных сахарным диабетом) в крови, обладает антибактериальными и противогрибковыми свойствами, улучшает усвоение кальция из пищи. Пищевые волокна (хитозан) в комплексе с витамином С и лимонной кислотой сорбируют жиры, предотвращают их всасывание и накопление в клетках и тканях, а вместе с МКЦ — усиливают перистальтику кишечника, ускоряет выведение из организма пищевых жиров, шлаков и токсинов, способствует нормализации кишечной микрофлоры, обеспечивает ощущение сытости.
История открытия
В 1821 году хитин обнаружен в стенках грибов. Вещество нерастворимое в серной кислоте названо фунгином. В 1822 году французский химик выделил из тканей насекомых нерастворимую в щелочной среде фракцию и назвал хитином. В 1829 году описана структура вещества. В 1859 году профессор С. Роже получил хитозан путем извлечения из хитина карбоновых соединений. В 1970 году ученые начали подробно изучать полезные свойства. В 1991 году разработана технология получения хитозана из панциря крабов. В 1997 году вещество начали применять при производстве лекарственных средств и пищевых добавок. Природный полимер включили в состав косметических средств по уходу за волосами, кожей лица и телом. Хитозан активно используют в биомедицине. Благодаря способности быстро соединяться со слизистыми оболочками и впитывать влагу. На его основе изготавливают препараты для остановки крови.
Рекомендуется
Для профилактики и комплексного лечения нарушения холестеринового обмена (атеросклероз, гиперхолестеринемия), дискинезии желчевыводящих путей или толстой кишки, желчнокаменной болезни, атонии кишечника, дисбактериоза, подагры, остеопороза, инсулиннезависимого сахарного диабета, гипертензии, ИБС, онкологических заболеваний, а также для снижения избыточной массы тела и очищения организма от шлаков и токсинов при аллергических заболеваниях, интоксикациях или с целью общего оздоровления организма.
Морфология хитина
В зависимости от источника хитин встречается в виде двух алломорфов, а именно α и β форм, которые можно различить с помощью инфракрасной и твердотельной NMR спектроскопии, а также рентгеновской X-ray дифракции. В твердом состоянии хитиновые цепи собраны сетью, которая контролирует растворимость, набухание и реакционную способность.
Изоморф α-хитина является наиболее распространенным; он встречается в клеточных стенках грибов и дрожжей, в сухожилиях криля, омаров и крабов, в панцирях креветок, а также в кутикуле насекомых. Помимо нативного хитина, α-хитин систематически образуется путем: перекристаллизации из раствора хитина, биосинтеза invitro или ферментативной полимеризации из-за высокой термодинамической стабильности этого изоморфа.
Более редкий β-хитин встречается в ассоциации с белками в перьях кальмара и в трубках, синтезируемых червями погонофорами и вестиментиферанами . Кристаллографические параметры двух изоморфов позволяют заключить, что в α-хитине на одну элементарную ячейку приходится две антипараллельные молекулы, а в β-хитине только одна в параллельном расположении. В заключение следует отметить, что как α, так и β-формы нерастворимы во всех распространенных растворителях. Эта нерастворимость является серьезной проблемой с точки зрения развития переработки и применения хитина.
Способ применения и дозы
Внутрь, взрослым и детям старше 12 лет. В комплексной терапии — по 3–4 табл. 2 раза в сутки, во время еды. Длительность приема 25–30 дней. Курс можно повторять 2–3 раза в год при соблюдении адекватной основному заболеванию диеты. Профилактически — по 2 табл. 2 раза в день, в течение продолжительного времени. Для снижения массы тела — по 4 табл. 3 раза в день, запивая водой, в течение 2–3 мес. Для контроля массы тела — по 1 табл. перед каждым приемом жирной пищи, соблюдая низкоуглеводную диету.
Фармацевтическое и биомедицинское применение хитина и хитозана
Основные свойства хитина и хитозана, применяемые для конкретных целей, уже описаны, например: биосовместимость, возобновляемое происхождение, не токсичность, не аллергенность и биоразлагаемость в организме. Кроме того, благодаря их привлекательной биологической активности (противогрибковая, антибактериальная, противоопухолевая, иммуноадъювантная, антитромбогенная, антихолестериновая) и биоадгезивности (особенно хитозана и его производных, они широко используются в качестве промоторов абсорбции и гидратирующих агентов, а также для производства пленки и заживления ран.
Хитин и более легко хитозан могут быть переработаны, в зависимости от предполагаемого применения, в различные формы, такие как волокна, порошки, пленки, губки, бусины, растворы, гели и капсулы . Следовательно, хитозан может использоваться в пероральном, назальном и глазном путях, для доставки лекарств как в имплантируемых, так и в инъекционных формах. Хитин и хитозан в виде волокон или пленок в основном применяются для тканевой инженерии и перевязки ран.
Кроме того, эффект хитозана, способствующий трансмукозальному всасыванию, особенно важен для назальной и пероральной доставки полярных лекарств, для введения пептидов и белков, а также для доставки вакцин. Катионный хитозан может влиять на транспорт ионов через взаимодействие с клеточной поверхностью (вызывая возмущение бислоев фосфолипидов мембраны).
Отзывы
В интернете можно встретить разные мнения о БАДАх с хитозаном. Часть покупателей оставляют восторженные отзывы: капсулы помогли уменьшить аппетит, сбросить вес.
Отмечается, что таблетки проглатываются хуже, чем капсулы, но не имеют запаха. Некоторые покупатели не заметили серьезного эффекта от приема, а жалуются на дискомфорт в желудке и запор.
Мнения врачей о хитозане также разнообразны. Некоторые являются сторонниками БАДа и рекомендуют при назначении лечения сосудистых болезней, ожирения, патологий печени. По мнению специалистов, решить проблему лишнего веса только приемом хитозана не решить. Необходимо уменьшить в рационе присутствие жирной и углеводной пищи, делать зарядку, больше ходить пешком. К тому же организм каждого человека уникален и реакция на принимаемые препараты может быть разной. Встречаются также и скептические выводы об эффективности препарата о выведении жира из организма.
Какие эффекты оказывает прием Хитозана
Прием биодобавки оказывает положительное действие по не нескольким направлениям:
- абсорбирует в кишечнике жиры и ядовитые вещества, которые выделяются в процессе переваривания пищи или попадания бактерий;
- снижает количество холестерина в крови;
- препятствует всасыванию жира и вредных веществ в кровь;
- способствует лучшему усвоению кальция, поступающего с пищей;
- выводит из организма излишек соли и тем самым нормализует уровень АД;
- улучшает работу ЖКТ: нормализует перистальтику кишечника, ускоряет вывод продуктов переработки;
- помогает в нормализации микрофлоры кишечника;
- улучшает обмен веществ, приводит показатель глюкозы к норме;
- помогает поддерживать чувство сытости и способствует избавлению от лишних жировых отложений;
- положительно влияет на хрящевую ткань и кожу;
- стимулирует иммунитет и повышает защитные силы организма.
Хитозан, как биодобавка к пище
Хитозан – это вещество из группы аминополисахаридов, которое извлекают из хитинового покрова ракообразных обитателей морского мира. Богат естественными пищевыми волокнами, способен соединяться с жирами и выводить их из человеческого организма, не давая усвоиться.
Фармацевтической промышленностью выпускается в виде таблеток и капсул для приема внутрь, а также добавляется в кремы для ухода за кожей и шампунь для волос.
Состав препарата зависит от производителя. Например:
- одна капсула Хитозан от фармзавода МИЛВЕ АД содержит 0,25 г хитозана, в упаковке 60 штук;
- одна таблетка Хитозан-Эвалар содержит 0,125 г хитозана, в упаковке 100 штук;
- одна таблетка Хитозан ЭККО плюс-форте содержит 0,25 мг хитозана, в упаковке 150 штук.
В качестве дополнительных веществ присутствуют микрокристаллическая целлюлоза, стеарат магния, также биодобавка может содержать аскорбиновую кислоту, пиколинат хрома, желатин и другие компоненты, необходимые для формирования оболочки.
Капсулы продаются в пластиковых баночках, таблетки фасуются в пластины с ячейками, которые помещают в коробку из картона.
В статье рассматриваются противоаллергическая активность хитина и хитозана и вызываемые ими биохимические реакции в живом организме, а также перспективы использования хитозана в качестве носителя лекарственных средств, используемых при лечении и профилактике различных форм аллeргической патологии.
Введение
Состоящий из остатков N-ацетилглюкозамина хитин и его производное — хитозан, в составе которого преобладают остатки глюкозамина, — природные полимеры, обладающие широким спектром биологических свойств [1]. Эти биополимеры способны стимулировать иммунную систему посредством активации макрофагов, фибробластов, системы комплемента, миграции полиморфноядерных лейкоцитов. Благодаря биосовместимости и биодеградируемости хитин и хитозан уже используются в качестве биомедицинских материалов и компонентов косметических средств. В последнее время хитозан рассматривается как один из перспективных материалов при создании полимерных матриц для доставки лекарственных препаратов и ДНК.
Рис. 1. Структурная формула пентамера хитина (А) и пентамера хитозана (В)
В настоящем обзоре рассматриваются аспекты применения хитина и хитозана в терапевтических целях при аллергических заболеваниях: описывается противоаллергическая активность самих биополимеров и вызываемые ими биохимические реакции в живом организме, а также перспективы использования хитозана в качестве носителя лекарственных средств, используемых при патогенетической терапии с целью повышения их фармакологической активности в лечении и профилактики различных форм аллeргической патологии.
Применение хитина против аллергических заболеваний
Воспалительные процессы при аллергических реакциях сопровождаются участием Th2-клеток, которые выделяют соответствующие цитокины, а также способствуют образованию иммуноглобулинов классов Е и G1. Одним из способов предотвращения аллергического процесса, опосредуемого Th2-клетками, является активизация CD4+-клеток типа Th1. Th1-клетки супрессируют IgE-ответ и подавляют дифференцировку Th2-клеток и секрецию ими ИЛ-4, ИЛ-5 и ИЛ-10. Эта активность Th1-клеток связана в основном с ИФ-γ, обладающего действием, противоположным влиянию ИЛ-10. В связи с этим, любые факторы, способствующие дифференцировке Th1-клеток, автоматически ингибируют развитие Th2-клеток и аллергических реакций [2, 3].
При участии Th1-клеток осуществляется иммунный ответ организма на присутствие клеток бактерий [4]. Имитируя бактериальные клетки, Y. Shibata с соавторами попытались использовать микрочастицы хитина различного размера для активации Th1-опосредованного иммунного ответа с целью предотвращения аллергических проявлений у мышей, сенсибилизированных аллергеном [4-6]. Было показано, что пероральное и интраназальное введение микрочастиц хитина размером 1-20 мкм может оказывать профилактический и терапевтический эффект. При этом отмечалось снижение уровня ИЛ-4, ИЛ-5 и ИЛ-10 в клетках селезенки, сывороточного IgE, тканевой инфильтрации эозинофилами тканей легких [4-6]. Гистологические исследования легких мышей, которые были подвергнуты действию аллергенов, также подтвердило эффективность профилактического и терапевтического действий хитиновых микрочастиц — при действии аллергена в ткани легких развивалась воспалительная клеточная реакция, а использование частиц хитина значительно уменьшало выраженность воспаления, и структура тканей была близка к здоровой, что выражалось в сокращении количества столбчатых секреторных клеток эпителия, выстилающих слизистые оболочки дыхательных путей, сохранении исходных размеров и морфологии эпителиального слоя, базальной мембраны и субэпителиального слоя гладких мышц [6, 7].
Способностью индуцировать в клетках селезенки мышей ИФ-γ обладали только те микрочастицы хитина, которые могли быть поглощены фагоцитами. Дисперсный хитин и хитиновые микрочастицы размером более 50 мкм, макрофагами не фагоцитируемые, подобной активностью не обладали [5]. Способность микрочастиц хитина активировать макрофаги ингибировалось, если эти частицы были покрыты маннаном или маннан был добавлен в среду. Таким образом, в распознавании микрочастиц хитина, возможно, играют ключевую роль расположенные на поверхности макрофагов маннозные рецепторы, и суперсемейство Toll-подобных рецепторных белков, через которые и поступает сигнал на усиление синтеза ИФ-γ и других цитокинов, характерных для Th1-опосредованного иммунного ответа.
Применение хитозана при аллергических заболеваний
В последнее время противоаллергические свойства были обнаружены и у хитозана — деацетилированного производного хитина. Противоаллергический эффект хитозанового полимера связывают с его действием на макрофаги [8]. Отмечено, что у больных с атопической бронхиальной астмой при контакте с аллергеном макрофаги образуют на поверхности клеток большое количество микропсевдоподий. При действии хитозана морфология макрофагов не изменялась и образование псевдоподий не происходило. Было показано, что хитозан способен ингибировать в макрофагальных клетках каскад реакций, который активируется протеинкиназой-Сζ при действии аллергена. Деактивация хитозаном протеинкиназы-Сζ уменьшает гиперфосфорилирование и последующую деградацию ингибитора фактора транскрипции NK-κB, который связывается со специфической в энхансере гена каппа легкой цепи иммуноглобулина в B-клетках, а также взаимодействует с регуляторными участками генов и активирует транскрипцию определенных групп генов, в том числе провоспалительных медиаторов [8].
Определенную роль в предотвращении аллергических реакций могут выполнять также антибактериальные и сорбционные свойства хитозана. Так, у больных атопическим дерматитом присоединение бактериальной инфекции кожи наблюдается более чем в 30% случаев. Лидирующим этиологическим микробным агентом, инфицирующим кожу при этом заболевании, является золотистый стафилококк [9]. Это позволяет рассматривать хитозан как перспективный антимикробный агент для местной терапии кожных инфекций стафилококковой этиологии [10, 11].
Развитие атопической экземы у пациентов, инфицированных S. aureus, во многом определяется способностью этого вида бактерии продуцировать широкий спектр токсинов и суперантигенов, которые могут вызывать и поддерживать воспалительную реакцию в дерме [12]. Имеются данные, что хитозан на уровне регуляции генов ингибирует продуцирование стафилококками таких токсинов, как TSST-1, энтеротоксинов В и С, дельта-гемолизина [13]. Другим способом элиминации токсинов может быть их сорбция хитозановым полимером по аналогии со связыванием эндотоксина грамотрицательных бактерий, эффективность которого была продемонстрирована в модельных опытах на животных [14].
Таким образом, антимикробные и сорбционные свойства хитозанового полимера дают возможность использовать этот полимер в качестве компонента присыпок, гелей и мазевых форм при местном применении на инфицированных участках кожи при атопической патологии.
Применение хитозана в качестве матрицы для доставки лечебных средств
В последнее время проводятся интенсивные исследования по возможности использования хитозана в качестве полимерной матрицы для доставки лекарственных веществ с пролонгированным высвобождением, поскольку большинство веществ сами по себе характеризуются низкой проникающей способностью через биологические мембраны [15, 16]. Кроме того, многие используемые в настоящее время лекарственные средства, несмотря на безусловную эффективность при лечении того или иного заболевания, вызывают нежелательные побочные эффекты. Совершенная лекарственная система должна осуществлять доставку лекарственного вещества в больной орган и его высвобождение в нужный момент и в минимальном количестве, необходимом для достижения терапевтического эффекта. Создание такой системы позволило бы существенно снизить дозы лекарственных веществ и, следовательно, избежать их побочных реакций.
Традиционные способы введения лекарств — назальный и пероральный — позволяют избежать связанных с парентеральным путем введения риска инфицирования и болевых реакций. Скорость выделения контролируется количеством лекарства в матрице, растворимостью его в полимере, степенью гидратации геля, кинетикой набухания-обезвоживания полимера. Скорость сорбции и десорбции можно направленно менять путем введения в гель лигандов, способных специфически связываться с сорбируемым веществом.
В настоящее время известны примеры успешного использования целого ряда полимерных систем на основе хитозана для доставки и контролируемого освобождения веществ через слизистые и, в частности, при их назальном и пероральном введениях [17]. Основные требования к лекарственной форме, предназначенной для назального и перорального приема, следующие: обеспечение защиты доставляемого вещества от деградирующего действия ферментов и кислой среды желудка (при пероральном ведении), наличие повышенной мукоадгезивной активности к поверхностным компонентам слизистых оболочек, контролируемое высвобождение лекарства (для перорального введения — в нейтральной среде тонкого кишечника или прямой кишки).
Так, теофиллин — гетероциклический алкалоид растительного происхождения, действие которого основано на расслаблении бронхиальной гладкой мускулатуры, но применение которого вызывает затруднение необходимостью точного соблюдения дозировки, поскольку ее превышение может привести к побочным эффектам, например, сердечной аритмии, головной боли и тошноте, в результате чего в настоящее время все более распространенными становятся ингаляционные глюкокортикоиды. Кроме того, теофиллин супрессирует активацию нейтофилов и эозинофилов в концентрации меньшей, чем требуется для бронхорелаксации [18]. Для уменьшения побочных эффектов и увеличения эффективности терапевтического действия теофиллина было предложено осуществлять применение алкалоида в составе хитозановых микрочастиц. Посредством назального способа введения такого комплекса мышам, сенсибилизированных овальбумином, было достигнуто уменьшение легочного воспаления, патологических изменений в структуре эпителия, гиперплазии столбчатых клеток и гиперсекреции ими слизи. Отмечено увеличение апоптотических клеток в тканях воздухоносных путей [19].
У действующего вещества, введенного назально, для проникновения в слизистую носового прохода время ограничено из-за постоянной ее самоочистки. Для того чтобы действующие вещества оставались на слизистой дольше, они могут быть включены в состав комплекса, один из компонентов которого обладает высокой мукоадгезивной активностью. Такой комплекс будет адгезироваться на слизистой на более длительный промежуток времени, обеспечивая пролонгированное высвобождение лекарственного средства.
Хитозан обладает хорошей мукоадгезивностью благодаря своим многочисленным аминогруппам, которые могут взаимодействовать с остатками сиаловой и сульфоновой кислот на поверхностях слизистых [19]. Повышение мукоадгезивной активности хитозана можно достичь путем введение в состав полимера тиоловых групп, которые, как полагают, образуют дисульфидные связи с цистеин-содержащими субдоменами муциновых гликопротеидов [20, 21]. Благодаря этому, микрочастицы на основе тиолированного хитозана были более эффективны в доставке теофиллина по сравнению с микрочастицами из немодифицированного полимера [19]. Кроме того, хитозан увеличивает эпителиальную проницаемость за счет ослабления связи между эпителиальными клетками [22].
Была продемонстрирована доставка противоаллергических веществ в составе более сложных комплексов, где этилцеллюлозное ядро микрочастицы выполняло роль носителя лекарственного средства — лоратадина, а хитозановая оболочка обеспечивала мукоадгезивные свойства комплекса [23]. Эффективность доставки с помощью микрочастиц с аналогичной структурой была показана и для другого противоаллергического вещества — прометазина [17]. Следует отметить, что варьирование количественного соотношения этилцеллюлозы и хитозана в составе микрочастиц влияло на уровень их загрузки доставляемым веществом, степень их максимальной гидратации и набухания, что определяло кинетику высвобождения лекарственного компонента из комплекса и делало этот процесс контролируемым.
Использовать хитозан как матрицу можно и для специфической иммунотерапии с использованием аллергенов. Поскольку периферийная Т-клеточная толерантность может быть индуцирована посредством доставки растворимого антигена через мукозальную слизистую [24], но специфическая иммунотерапия, в некоторых случаях очень эффективная, может иногда стать причиной серьезных осложнений из-за IgE-опосредовнной активации эффекторных клеток, поэтому было предложено вводить аллерген в составе комплекса с хитозаном [25]. Этим обеспечивалась как эффективность доставки вещества через слизистые оболочки, так и возможность контролировать длительность высвобождения и количество поступающего в организм аллергена. Контроль этих параметров очень важен, поскольку они определяют кинетику активации антиген-презентирующих клеток (АПК) [26], влияя на количество и аффинности МНС-пептидного комплекса, экспрессию совместно стимулирующихся молекул и цитокинов, которые продуцируются во время презентации АПК Т-клеткам, по разному регулирующие индукцию Th1- и Th2-ответов [25].
Было показано, что назальное введение мышам пептида, являющегося иммунодоменантным эпитопом Der p 1-аллергена из Dermatophagoides pteronyssinus, в комплексе с хитозаном способствовало снижению продукции спленоцитами IL-5 и IL-13. У сенсибилизированных мышей комплекс пептида и хитозана уменьшал эозинофилию легких, содержание в них IL-4 и IL-5, в то время как антиген введенный сам по себе в том же количестве никакого эффекта не оказывал [25].
Практически все биохимические процессы, протекающие в организме, определяются экспрессией генетического аппарата клеток. При аллергических реакциях уровень экспрессии некоторых генов изменяется в нежелательном направлении. Так, повышается уровень синтеза некоторых цитокинов, например, ИЛ-5, чему предшествует транскрипция соответствующего гена и образование мРНК. Ингибировать синтез ИЛ-5 можно с помощью введения в клетку антисмысловых олигомеров нуклеиновых кислот, которые благодаря комплементарности будут специфически блокировать трансляцию с мРНК данного цитокина. Таким образом, будет остановлен каскад нежелательных реакций, запуск которого определяется повышенной концентрацией в клетках и тканях ИЛ-5. Однако применение подобных антисмысловых полинуклеотидов в экспериментах с моделированием аллергического ринита на мышах был неэффективен, поскольку нативные олигомеры подвергались быстрому ферментативному расщеплению. Использование олигомеров в комплексе с хитозаном при назальном введении мышам обеспечивало терапевтическое действие. В клетках слизистых воздухоносных путей происходило уменьшение синтеза ИЛ-5, а уровень IgE в сыворотке оставался на уровне нормы. Сами слизистые у мышей, которым вводили комплекс, сохраняли нормальный вид по сравнению с таковыми у мышей, у которых аллергический ринит не подвергался терапии либо которым были введены нативные олигомеры [27].
В составе комплекса с хитозаном была продемонстрирована эффективность трансдермальной доставки siRNA рецептора натриуретического пептида. Натриуретический пептид является белком, ассоциированным с аллергическими проявлениями, который связывается со своими рецепторами, расположенными на поверхности различных клеток, активируя внутриклеточную гуанилат-циклазу и образование цГМФ, что ведет к активации соответствующих протеинкиназ и изменению работы мембранных ионных каналов, приводящей в итоге к запуску некоторых клеточных процессов, участвующих в воспалительной реакции [28]. Введение в ткани siRNA приводило к умолканию гена рецептора натриуретического пептида, что в итоге способствовало не только уменьшению аллергических воспалительных процессов, но на ранних этапах терапии предотвращало переключение иммунной системы в сторону Th2-ответа. Использование нативной siRNA было неэффективным, по всей видимости, из-за расщепления молекул нуклеазами [29].
Таким образом, доставка с использованием хитозанового полимера различных терапевтических агентов может стать одним из эффективных инструментов в лечении аллергических проявлений.
Применение хитозана в качестве ДНК-вектора
Благодаря поликатионной природе хитозан способен образовывать с отрицательно заряженными полимерами, такими как нуклеиновые кислоты, полиэлектролитные комплексы [30, 31]. Поэтому хитозан может быть использован для конструирования ДНК-содержащих носителей с целью получения генетически модифицированных клеток. Трансфекция эукариотических клеток является мощным инструментом целенаправленного изменения генома и одновременно одним из самых больших достижений молекулярной и клеточной биологии последнего времени, открывающий неограниченные возможности в медицине в виде генной терапии.
В настоящее время развиваются несколько подходов к созданию эффективных инструментов доставки ДНК в клетку. Среди них использование катионных липосом, а также адено- и ретровирусов. В качестве перспективного инструмента для доставки ДНК в клетку рассматриваются полимерные системы, в том числе наночастицы и нанокапсулы [15].
Для трансфекции клеток плазмидной ДНК используются рН-чувствительные липосомы. В кислых условиях они способны связывать генетический материал и проникать в клетку, а при изменении рН — сливаться с мембраной эндосомы, освобождая ДНК. Однако их использование имеет ряд недостатков, таких как высокая стоимость, иммуногенность, а также возможность агрегации липосом.
Использование вирусов в качестве носителей ДНК обеспечивают хорошую эффективность трансфекции. И хотя большинство медицинских протоколов в настоящее время базируется именно на вирусных ДНК-векторах, использование таких систем ограничено по некоторым причинам: возможны их онкогенные свойства; ограниченное количество генетического материала, которое можно доставить с помощью вируса; необходимостью соблюдения правил общей биобезопасности при производстве вирусов.
Хитозан является перспективным кандидатом для конструирования носителей ДНК-векторов, поскольку созданные на его основе системы доставки с внедренными в них ДНК-векторами имеют несколько преимуществ перед всеми рассмотренными выше: на их поверхности можно ковалентно присоединить лиганды, которые обеспечивают высокоспецифическое взаимодействие с клеточными рецепторами; можно ввести в клетку не одну, а несколько ДНК-плазмид в одной наночастице или нанокапсуле; можно защитить нуклеиновую кислоту от расщепления ферментами; ДНК-плазмиды приобретают компактный вид, что предотвращает их механический разрыв и облегчает проникновение через мембраны клеток; такие наночастицы можно лиофильно высушить и длительно хранить в такой форме без потери активности [15, 32].
Так, использование хитозановых наночастиц в комплексе с ДНК γ-интерферона, введенных интраназально мышам, обеспечивало эффективную трансфекцию, что подтверждалось повышением уровня синтеза γ-интерферона в эпителиальных клетках слизистой и в легочных моноцитах. Отмечен протекторный эффект в отношении метахолин-индуцированного бронхоспазма, предотвращалось увеличение количества эозинофилов и клеточная инфильтрация. Профилактическое введение комплекса способствовало повышению уровня продуцировании клетками селезенки γ-интерферона и уменьшению уровня ИЛ-4, ИЛ-5, а также уровня IgE в сыворотке. Показано, что основной мишенью для комплекса являются бронхиальный эпителиум и макрофаги — два типа клеток, играющие важную роль в развитии астмы и иммуномодуляции [33]. Терапевтическое использование комплекса на мышах, сенсибилизированных овальбумином, предотвращало воспалительные процессы в слизистой бронхов через несколько часов после сенсибилизации аллергеном, и индуцировало апоптотические процессы у столбчатых клеток слизистой [34].
Доставка гена γ-интерферона возможна и с использованием аденовирусного вектора, однако такая система имеет некоторые недостатки, прежде всего — это отсутствие специфических для аденовируса рецепторов на апикальной части эпителиальных клеток, которые экспрессируются в основном на базолатеральной поверхности. В случае использования хитозановой матрицы, которая обладает хорошими мукоадгезивными свойствами, этот недостаток устраняется [35]. Так, использование комплекса на основе хитозана приводило к более резкому уменьшению эозинофилии по сравнению с аденовирусной доставкой, и хотя количество γ-интерферона было меньшим, терапевтический эффект был более выраженным, вероятно из-за более эффективной доставки ДНК хитозановым вектором в эпителиальные клетки [34]. Показано, что помимо назального и трансдермального, пероральное введение комплекса ДНК и хитозана может являться эффективным инструментом для доставки генов и их трансфекции в клетки кишечника [36].
Была продемонстрирована эффективность подобного вида доставки гена цитокина — трансформирующего фактора роста β1 (ТФР-β1), который выполняет определенную функцию в сдерживании аутоиммунных процессов. Кроме того, ТФР-β1 играет важную роль в индукции и поддержании пищевой толерантности посредством индукции секреции IgA и трансформации наивных Т-клеток в Т-регуляторы, которые остаются функционировать в кишечнике и супрессируют IgE ответ [37]. Комплекс хитозана с плазмидой, кодирующей ТФР-β1, перорально введенный мышам, обладал терапевтическим действием против пищевой аллергии. У мышей с искусственно вызванной пищевой аллергической реакцией введение комплексного средства приводило к нормализации состояния организма за счет повышения уровня экспрессии цитокина в клетках кишечника: происходило снижение уровня IL-4 и усиление синтеза ИФ-γ в Пейеровых бляшках тонкой кишки, понижался уровень специфического IgE в сыворотке. Действие комплекса сохранялось на протяжении как минимум двух недель после введения, тогда как применение нативного ТФР-β1 было кратковременным [38].
Для специфической иммунотерапии также может быть применена трансформация клеток кишечника с пероральным введением генетического материал [39]. Так, пероральное введение гена арахисного аллергена Arah2 в комплексе с хитозаном оказывало профилактическое действие против пищевой аллергической реакции на этот аллерген. При этом повышения уровня специфического IgE не наблюдалось, но повышался уровень IgG2a в сыворотке, что говорит о Th1-опосредованном иммунном ответе, а в кишечнике индуцировался синтез IgA, что свидетельствует о включении мукозального иммунного ответа. Нативная же ДНК без хитозана терапевтическим эффектом не обладала [40].
Аналогичным образом на мышиной модели продемонстрирована возможность специфической иммунотерапии против клещевого аллергена Der p 1 из D. pteronyssinus [41]. Доставка ДНК, кодирующая аллерген клеща, в комплексе с хитозаном при пероральном введении вызывала повышение уровня специфических IgG2a, но не IgG1, что свидетельствует о Th1 пути иммунного ответа. Эффективность трансформации связывают с мукоадгезивными свойствами хитозана, что позволяет ему взаимодействовать с эпителиальными клетками кишечника с последующим захватом комплекса М-клетками, попаданием в Пейеровы бляшки и транспортировке до селезенки и лимфатических узлов, где в дальнейшем продуцируются специфические иммуноглобулины классов М и G. Кишечные эпителиальные клетки ворсинчатого эпителия тоже могут захватывать такой антигенный комплекс и осуществлять его представление [42]. Такие клетки имеют тесный контакт с интраэпителиальными лимфоцитами, являющимися специализированной популяцией Т-лимфоцитов, которые мигрируют из периферической крови в прослойку между базолатеральными мембранами эпителиальных клеток. Таким образом, возможно осуществление регуляции Т-клеточного ответа. Дендритные клетки, располагающиеся в различных местах кишечника, вероятно также могут захватывать комплекс или получать его от эпителиальных клеток с последующей миграцией к лимфоузлам, поставляя тем самым необходимый сигнал для созревания наивных Т-клеток [41].
Заключение
Таким образом, возможность использования хитина и хитозана с терапевтической целью применительно к аллергическим заболеваниям как самостоятельно, так и в качестве матрицы для доставки лекарственных препаратов и ДНК расширяет спектр практического применения этих биополимеров. Возможность варьирования свойств этих биополимеров, в том числе и за счет получения на их основе различных производных, способна в перспективе дать еще более эффективные медицинские системы для лечения всевозможных заболеваний у человека.
Благодарности
Благодарим ведушего научного сотрудника РАН А. В. Ильину за внимательное рассмотрение работы и сделанные ценные замечания.
С. Н. Куликов, Ю. А. Тюрин, Р. С. Фассахов, В. П. Варламов
Казанский НИИ Эпидемиологии и Микробиологии Роспотребнадзора
РАН, г. Москва
Куликов Сергей Николаевич — кандидат биологических наук, с.н.с. лаборатории иммунологии Казанского НИИ эпидемиологии и микробиологии Роспотребнадзора
Литература:
1. Куликов С.Н., Тюрин Ю.А., Долбин Д.А., Хайруллин Р.З. Роль структуры в биологической активности хитозана. Вестник Казанского технологического университета 2007; 6: 10-15.
2. Куликов С.Н., Тюрин Ю.А., Долбин Д.А., Фассахов Р.С. Хитин и хитиназы при аллергических реакциях. Российский Аллергологический Журнал 2009; 1: 18-23.
3. Ярилин А.А. Основы иммунологии. М.: Медицина, 1999. с. 608.
4. Shibata Y., Foster L.A., Kurimoto M., et al. Immunoregulatory roles of IL-10 in innate immunity: IL-10 inhibits macrophage production of IFN-γ-inducing factors but enhances NK cell production of IFN-γ. J. Immunol. 1998; v. 161; 4283-4288.
5. Shibata Y., Foster L.A., Metzger W.J., Myrvik Q.N. Alveolar macrophage priming by intravenous administration of chitin particles, polymers of N-acetyl-D-glucosamine, in mice. Infect. Immun. 1997; v. 65: 1734-1741.
6. Shibata Y., Foster L.A., Bradfield J.F., Myrvik Q.N. Oral administration of chitin down-regulates serum IgE levels and lung eosinophilia in the allergic mouse. J. Immunol. 2000; v. 164: 1314-1321.
7. Ozdemir C., Yazi D., Aydogan M., et al. Treatment with chitin microparticles is protective against lung histopathology in a murine asthma model. Clin. Exp. Allergy 2006; v. 36: 960-968.
8. Chen C.L., Wang Y.M., Liu C.F., Wang J.Y. The effect of water-soluble chitosan on macrophage activation and the attenuation of mite allergen-induced airway inflammation. Biomaterials 2008; v. 29: 2173-2182.
9. Hauser C., Wuthrich B., Matter L. Staphylococcus aureus skin colonization in atopic dermatitis. Dermatologica. 1985; v. 170: 35-39.
10. Куликов С.Н., Долбин Д.А., Тюрин Ю.А. Антибактериальные свойства низкомолекулярного хитозана при атопическом дерматите. Российский Аллергологический Журнал 2008;1 (прил. 1): 146-147.
11. Moon J.S., Kim H.K., Koo H.C. et al. The antibacterial and immunostimulative effect of chitosan-oligosaccharides against infection by Staphylococcus aureus isolated from bovine mastitis. Appl. Microbiol. Biotechnol 2007; v. 75: 989 — 998.
12. Breuer K., Kapp A., Werfel T. Bacterial infections and atopic dermatitis. Allergy. 2001; v. 56: 1034-1041.
13. Schlievert P.M. Chitosan malate inhibits growth and exotoxin production of toxic shock syndrome-inducing Staphylococcus aureus strains and group A streptococci. Antimicrob. Agents Chemother. 2007; v. 51: 9: 3056-3062.
14. Большаков И.Н., Насибов С.М., Куклин Е.Ю., Приходько А.А. Использование хитозана и его продуктов при воспалительных заболеваниях желудочно-кишечного тракта. Хитин и хитозан: получение, свойства и применение. М.: Изд-во Наука, 2002. с. 280-301.
15. Марквичева Е.А. Хитозан и его производные в биоинкапсулировании. Хитин и хитозан: получение, свойства и применение. М.: Изд-во Наука, 2002. с. 315-326.
16. Koping-Hoggard M., Mel’nikova Y.S., Varum K.M., et al. Relationship between the physical shape and the efficiency of oligomeric chitosan as a gene delivery system in vitro and in vivo. J. Gene Med. 2003; v. 5: 2: 130-141.
17. Hafner A., Filipovi-Gri J., Voinovich D., Jalsenjak I. Development and in vitro characterization of chitosan-based microspheres for nasal delivery of promethazine. Drug Develop. Industr. Pharm. 2007; v. 33; 427-436.
18. Kobayashi M., Nasuhara Y., Betsuyaku T., et al. Effect of low-dose theophyllin on airway inflammation in COPD. Respirology. 2004; v. 9: 249-254.
19. Lee D.W., Powers K., Baney R. Physicochemical properties and blood compatibility of acylated chitosan nanoparticles. Carbohydrate Polymers 2004; v. 586: 371-377.
20. Bernkop-Schnurch A., Hornof M., Zoidl T. Thiolated polymers-thiomers: synthesis and in vitro evaluation of chitosan-2-iminothiolane conjugates. Int. J. Pharm. 2003; v. 260: 229-237.
21. Kast C.E., Valenta C., Leopold M., Bernkop-Schnurch A. Design and in vitro evaluation of a novel bioadhesive vaginal drug delivery system for clotrimazole. J. Control. Release 2002; v. 81: 347-354.
22. Fernandez-Urrusuno R., Romani D., Calvo P., et al. Development of a freeze-dried formulation of insulin-loaded chitosan nanoparticles intended for nasal administration. Stp. Pharma. Sciences 1999; v. 9: 429-436.
23. Martinac A., Filipovic-Grcic J., Perissutti B., et al. Spray-dried chitosan/ethylcellulose microspheres for nasal drug delivery: swelling study and evaluation of in vitro drug release properties. J. Microencapsul. 2005; v. 22: 5: 549-561.
24. Astori M., von Garnier C., Kettner A., et al. Inducig tolerance by intranasal administration of long peptides in naive and primed CBA/J mice. J. Immunol. 2000; v. 165: 3497-3505.
25. Hall G., Lund L., Lamb J.R., Jarman E.R. Kinetics and mode of peptide delivery via the respiratory mucosa determine the outcome of activation versus Th2 immunity in allergic inflammation of the airways. J. Allergy. Clin. Immunol. 2002; v. 110: 883-890.
26. Langenkamp A., Messi M., Lanzavecchia A., Sallusto F. Kinetics of dendric cell activation: impact of priming of Th1, Th2 and nonpolarised T cells. Nat. Immunol. 2000; v. 1: 311-316.
27. Kim S.T., Kim C.K. Water-soluble chitosan based antisense oligodeoxynucleotide of interleukin-5 for treatment of allergic rhinitis. Biomaterials 2007; v. 28: 3360-3368.
28. Mohapatra S.S., Lockey R.F., Vesely D.L., Gower W.R. Natriuretic peptides and genesis of asthma: an emerging paradigm? J. Allergy Clin. Immunol. 2004; v. 114: 520-526.
29. Wang X., Xu W., Mohapatra S., et al. Prevention of airway inflammation with topical cream containing imiquimod and small interfering RNA for natriuretic peptide receptor. Genet. Vaccin. Therapy. 2008; v. 6: 7: 15-23.
30. Ильина А.В., Варламов В.П. Полиэлектролитные комплексы на основе хитозана. Прикладная Биохимия и Микробиология 2005; т. 41: 1: 9-16.
31. Danielsen S., Varum K.M., Stokke B.T. Structural analysis of chitosan mediated DNA condensation by AFM: influence of chitosan molecular parameters. Biomacromolecules 2004; v. 5: 928-936.
32. Koping-Hoggard M., Varum K.M., Issa M., et al. Improved chitosan-mediated gene delivery based on easily dissociated chitosan polyplexes of highly defined chitosan oligomers. Gene Ther. 2004; v. 11: 19: 1441-1452.
33. Tang C., Inman M.D., van Rooijen N., et al. Th type 1 stimulating activity of lung macrophages inhibits Th2-mediated allergic airway inflammation by an IFN-gamma-dependent mechanism. J. Immunol. 2001; v. 166: 1471-1481.
34. Kumar M., Kong X., Behera A.K., et al. Chitosan IFN-γ-pDNA nanoparticles (CIN) therapy for allergic asthma. Genet. Vaccines Therapy. 2003; 1 (1): 3.
35. Filipovic-Grcic J., Skalko-Basnet N., Jalsenjak I. Mucoadhesive chitosan-coated liposomes: characteristics and stability. J. Microencapsul. 2001; v. 18: 3-12.
36. Chen J., Yang W.L., Li G., et al. Transfection of mEpo gene to intestinal epithelium in vivo mediated by oral delivery of chitosan-DNA nanoparticles. World J. Gastroenterol. 2004; v. 10:1: 112-116.
37. von Boehmer H. Oral tolerance: is it all retinoic acid? J. Exp. Med. 2007; v. 204: 1737-1739.
38. Li F., Wang L., Jin X.M., et al. The immunologic effect of TGF-beta 1 chitosan nanoparticle plasmids on ovalbumin-induced allergic BALB/c mice. Immunobiol. 2009; v. 214: 2: 87-99.
39. Moffart M.F., Cookson W.O.C. Gene therapy for peanut allergy. Nat. Med. 1999; v. 5: 4: 380-381.
40. Roy K., Mao H.Q., Huang S.K., Leong K.W. Oral gene delivery with chitosan-DNA nanoparticles generates immunologic protection in a murine model of peanut allergy. Nat. Med. 1999; v. 5: 4: 387-391.
41. Chew J.L., Wolfowicz C.B., Mao H.Q., et al. Chitosan nanoparticles DNA encoding house dust mite allergen, Der p 1 oral vaccination in mice. Vaccine. 2003; v. 21: 2720-2729.
42. Hershberg R.M., Mayer L.F. Antigen processing and presentation by intestinal epithelial cells — polarity and complexity. Immunol. Today. 2000; v. 21: 1: 123-128.
Показания для приема Хитозана
БАД с хитозаном применяется как в составе комплексного лечения, так и для профилактики следующих заболеваний:
- атеросклероза и повышенной концентрации холестерина в крови;
- слабой моторики кишечника;
- нарушения микрофлоры кишечника;
- нарушения моторики желчевыводящих путей, толстого кишечника;
- камней в желчном пузыре или желчных протоках;
- повышенного давления и ишемической болезни сердца;
- подагры;
- сахарного диабета;
- разрушения костей и повышения их хрупкости;
- онкозаболеваний.
Также согласно инструкции Хитозан рекомендован лицам, желающим стать стройнее и очистить организм от шлакоподобных веществ, токсинов, оздоровить организм в целом.