Рофлумиласт (Roflumilastum)
Рофлумиласт — нестероидное противовоспалительное средство, предназначенное для поддерживающего лечения больных хронической обструктивной болезнью лёгких тяжелого течения с частыми обострениями. В связи с тем обстоятельством, что в общей популяции этого заболевания существенно преобладают пациенты в возрасте старше 40 лет, при назначении препарата пациентам до 40 лет требуется спирометрическое подтверждение диагноза хронической обструктивной болезни лёгких .
Согласно показаниям к применению препарата, необходимо, чтобы значение постбронходилатационного объёма форсированного выдоха за первую секунду составляло менее 50 % от рассчитанного должного показателя.
Рофлумиласт не предназначен для лечения острого приступа одышки (острого бронхоспазма). Пациента следует предупредить о том, что для облегчения острого приступа важно всегда иметь назначенный врачом препарат, чтобы купировать приступ. Рофлумиласт в таком случае не эффективен.
В ходе исследований, проведенных в течение года, чаще наблюдалось снижение массы тела у пациентов, получавших рофлумиласт, по сравнению с пациентами, получавшими плацебо. После прекращения приема препарата у большинства пациентов масса тела восстанавливалась в течение 3 месяцев.
У пациентов с недостаточной массой тела следует контролировать ее при каждом визите к врачу. Пациентам следует советовать регулярно контролировать массу своего тела. В случае необъяснимого или клинически значимого снижения массы тела, необходимо прекратить прием препарата рофлумиласт и отслеживать динамику.
Вследствие отсутствия достаточного опыта, не следует начинать лечение препаратом рофлумиласт пациентам, получающим постоянную поддерживающую терапию пероральными глюкокортикостероидами, за исключением краткосрочных курсов системных клюкокортикостероидов.
Опыт применения препарата рофлумиласт у пациентов с латентными инфекциями, такими как туберкулез, вирусный гепатит, вирусный герпес и опоясывающий лишай, ограничен.
Применение рофлумиласта ассоциировано с повышенным риском таких психических расстройств как бессонница, тревожность, нервозность и депрессия. В ходе клинических исследований выявлены редкие случаи проявления суицидального мышления и поведения. Поэтому, если пациенты сообщают о ранее проявлявшихся симптомах со стороны психики или такие симптомы проявляются у них в настоящее время, или если планируется сопутствующая терапия другими лекарственными средствами, связанная с вероятностью появления психических нарушений, следует провести тщательную оценку риска и пользы, связанных с началом или продолжением лечения рофлумиластом. Пациентов следует проинструктировать о необходимости уведомлять врача, назначившего лечение, о любых изменениях в поведении, настроении или появлении суицидальных мыслей любого характера.
Не смотря на то, что неблагоприятные реакции, такие как диарея, тошнота, боли в животе и головная боль возникают в основном в первые недели лечения и в большинстве случаев проходят при продолжении лечения, в случае сохранения данных симптомов следует пересмотреть вопрос о лечении рофлумиластом.
Непереносимость может возникать в случае особых популяций больных, в частности, у чернокожих некурящих женщин или пациентов, получающих лечение ингибитором CYP1A2 флувоксамином или двумя ингибиторами CYP3A4/1А2 — эноксацином и циметидином.
Нет клинических данных, касающихся сопутствующего лечения теофиллином в качестве поддерживающей терапии. Поэтому сопутствующее лечение теофиллином не рекомендовано.
Рофлумиласт: новые возможности фармакотерапии ХОБЛ
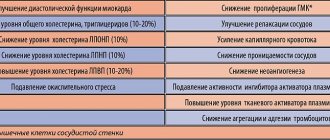
Традиционно в программе лечения заболевания используются бронходилататоры (м–холинолитики, β2–агонисты) и глюкокортикостероиды (ГКС), обладающие универсальной противовоспалительной активностью. Новые фармакотерапевтические возможности обусловлены появлением на фармацевтическом рынке препаратов, способных подавлять специфическое воспаление при ХОБЛ. В 2010 г. представитель нового класса препаратов рофлумиласт (Даксас®) зарегистрирован в странах Евросоюза и Канады. В марте 2011 г. его применение для лечения пациентов с ХОБЛ одобрено Управлением по контролю за пищевыми продуктами и лекарственными препаратами США (Food and Drug Administration (FDA)), в сентябре того же года рофлумиласт зарегистрирован в Российской Федерации. Механизм действия Согласно современным представлениям ключевую роль в патогенезе ХОБЛ играет воспалительный процесс, в реализации которого участвует в том числе и фосфодиэстераза 4–го типа (ФДЭ4) – фермент, регулирующий метаболизм циклического аденозинмонофосфата (цАМФ). Циклический нуклеотид является вторичным внутриклеточным посредником при осуществлении эффектов гормонов и биологически активных соединений, не проникающих внутрь клетки. Под действием последних в клетках активируются мембранные аденилатциклазы (АЦ), катализирующие образование цАМФ из аденозинтрифосфата (АТФ), в результате чего происходит накопление циклического нуклеотида. Его концентрация при этом многократно превышает концентрацию действующей на клетку биологически активной субстанции. В основе действия цАМФ лежит способность взаимодействовать с клеточной протеинкиназой А (ПК А). Связывание циклического нуклеотида с регуляторной субъединицей фермента приводит к его диссоциации и активации каталитической субъединицы, которая, освободившись от регуляторной части, осуществляет фосфорилирование эффекторных белков [4]. Результатом модификации белковых молекул является, среди прочего, и снижение продукции провоспалительных медиаторов, замедление клеточной пролиферации и апоптоза и, как следствие, уменьшение выраженности воспаления (рис. 1). Действие циклического нуклеотида ограничено активностью фосфодиэстеразы (ФДЭ). В настоящее время известно 11 изоформ данного фермента, катализирующего расщепление цАМФ и другого циклического нуклеотида – гуанинмонофосфата (цГМФ), эффекты которого зачастую противоположны эффектам цАМФ [6]. ФДЭ 4, 7 и 8–го типов обладают тропностью к цАМФ, 5, 6 и 9–го типов – к цГМФ. Ферменты 1–3–го и 10–11–го типов воздействуют на оба циклических нуклеотида. Распределение отдельных типов ФДЭ в клетках различных органов и тканей существенно отличается. Следует отметить, что преобладающей изоформой фермента, экспрессируемой провоспалительными и иммунными клетками, ответственными за развитие хронического воспаления при ХОБЛ, является ФДЭ4. Данный тип фермента, в свою очередь, имеет несколько подтипов. Действие всех подтипов энзима направлено на активацию гидролиза цАМФ и образование его неактивной формы – аденозинмонофосфата (АМФ). Уменьшение концентрации циклического нуклеотида сопровождается повышением провоспалительного потенциала клеток, в том числе нейтрофилов, Т–лимфоцитов (CD8+) и макрофагов. Высвобождая различные медиаторы, эти клетки запускают каскад воспалительных реакций, приводящих к ограничению бронхиальной проходимости и развитию системного воспаления [7]. Подавление активности ФДЭ4, напротив, приводит к накоплению в клетках цАМФ и реализации противовоспалительных эффектов гормонов и медиаторов, посредником которых служит циклический нуклеотид (табл. 1). Уменьшение провоспалительной активности клеток, наблюдаемое при подавлении ФДЭ4, определило особый интерес к возможностям фармакологического ингибирования фермента как к способу влияния на выраженность хронического воспаления при ХОБЛ. В настоящее время известен ряд препаратов, способных блокировать действие ФДЭ. Одни, не являясь селективными, взаимодействуют с различными типами фермента (теофиллин), другие, обладая высокой селективностью, подавляют активность одной изоформы энзима (ингибитор ФДЭ3 – милринон, ФДЭ5 – илденафил). Действие теофиллина, являющегося неселективным ингибитором практически всех типов ФДЭ и, кроме того, антагонистом аденозиновых рецепторов, сопряжено с развитием большого числа разнообразных эффектов, среди которых следует упомянуть влияние на сократительную активность гладкой мускулатуры, мукоцилиарный клиренс, тонус кровеносных сосудов, частоту и силу сердечных сокращений, кислотность желудочного содержимого и т.д. В то же время активность теофиллина в отношении ФДЭ4, а значит и его противовоспалительный эффект, выражены в минимальной степени. Применение препарата ассоциируется с высоким риском развития нежелательных реакций и клинически значимых лекарственных взаимодействий. Важным обстоятельством, ограничивающим терапевтические возможности теофиллина при ХОБЛ, является снижение его эффективности у курильщиков. Первым селективным ингибитором ФДЭ4 стал циломиласт, существенным недостатком которого является преимущественная активность в отношении D–подтипа фермента. Воздействие циломиласта на ФДЭ4D, присутствующую в париетальных клетках слизистой желудка и клетках рвотных центров, обусловило частое возникновение тошноты и рвоты, ассоциирующихся с приемом препарата, что послужило причиной для ограничения его использования. Новый представитель селективных ингибиторов ФДЭ4, рофлумиласт, превосходит своего предшественника по силе воздействия на фермент и, в отличие от него, обладает одинаковой активностью в отношении всех подтипов энзима. Результатом действия рофлумиласта является уменьшение активности клеток, участвующих в развитии воспаления при ХОБЛ. Подавление активности ФДЭ4 гладкомышечных клеток бронхов, как показали результаты проведенных исследований, не сопровождается выраженной бронходилатацией, в связи с чем препарат не может использоваться для купирования бронхоспазма. Фармакокинетика Эффективность и безопасность лекарственных препаратов в значительной степени обусловлена их фармакокинетическим профилем. Благоприятные фармакокинетические характеристики рофлумиласта определяют его привлекательность для практического применения. Препарат быстро и достаточно полно (биодоступность составляет 80%) всасывается в желудочно–кишечном тракте. Максимальная сывороточная концентрация достигается через 0,5–2 ч после приема рофлумиласта. Подвергаясь метаболизму ферментами системы цитохрома Р450 (CYP 3A4 и 1A2), ингибитор ФДЭ4 образует активный метаболит – N–оксид рофлумиласта, превосходящий по фармакокинетическим параметрам исходную молекулу (табл. 2). Образование неактивных метаболитов N–оксид рофлумиласта осуществляется при помощи изоферментов CYP3A4 и 2C19. Применение рофлумиласта в терапевтической дозе, как свидетельствуют результаты проведенных исследований, не сопровождается значимым ингибированием ферментативной системы. Длительный период полувыведения ингибитора ФДЭ4 и его активного метаболита позволяют вводить препарат 1 раз/сут. Элиминация препарата осуществляется преимущественно почками (70%) в виде неактивных метаболитов [9]. Следует отметить, что участие в метаболизме рофлумиласта ферментов системы цитохрома Р450 определяет вероятность возникновения клинически значимых лекарственных взаимодействий с такими выраженными индукторами печеночных ферментов, как рифампицин, фенобарбитал и карбамазепин, а также ингибиторами CYP 3A4 и 1A2 эноксацином и циметидином. В то же время не получено данных о взаимодействии препарата с варфарином, дигоксином, теофиллином, мидазоламом, антацидами. Наличие выраженной печеночной недостаточности (классы В и С по Child–Pugh) сопровождается значимым повышением Cmax и AUC0–∞ ингибитора ФДЭ4 и служит противопоказанием для его назначения. Одновременный прием пищи, снижая максимальную сывороточную концентрацию рофлумиласта, тем не менее не оказывает влияния на фармакокинетические характеристики его активного метаболита. Курение также не влияет на фармакокинетический профиль ингибитора ФДЭ4 и не снижает его эффективность [11]. Клиническая эффективность Доказательства эффективности рофлумиласта в лечении больных ХОБЛ получены в ходе многочисленных плацебо–контролируемых клинических исследований. Результаты наиболее значимых исследований представлены в таблице 3. Анализ представленных данных свидетельствует о том, что применение препарата сопровождается достоверным увеличением объема форсированного выдоха за 1 с (ОФВ1) по сравнению с плацебо. Следует отметить, что пациенты, принимавшие ингибитор ФДЭ4 в рамках проведенных исследований, имели выраженные нарушения бронхиальной проходимости (ОФВ1<60% от должных значений). Достоверное улучшение вентиляционной функции легких отмечалось через 4 нед. применения рофлумиласта и сохранялось на протяжении всего лечебного периода. Согласно имеющимся данным степень бронхиальной обструкции коррелирует с выраженностью воспаления в дыхательных путях, что позволяет объяснить увеличение ОФВ1 на фоне приема препарата, не являющегося бронхолитиком. Особого внимания заслуживает влияние ингибитора ФДЭ4 на частоту возникновения обострений заболевания. Как показали недавно проведенные исследования, именно частота обострений является одним из наиболее важных факторов, определяющих качество жизни больных ХОБЛ, темпы прогрессирования заболевания и экономические потери [18,19]. Согласно мнению международных экспертов, отраженному на страницах Глобальной стратегии по диагностике, лечению и профилактике ХОБЛ (Global Initiative for Chronic Obstructive Lung Disease (GOLD)), снижение частоты и тяжести обострений является одной из основных целей лечения заболевания [20]. При объединенном анализе данных, полученных в ходе исследований RATIO и OPUS, было показано, что рофлумиласт достоверно снижает частоту тяжелых и среднетяжелых обострений ХОБЛ по сравнению с плацебо. Наиболее выраженным данный эффект препарата оказался у пациентов, клиническая картина заболевания которых характеризовалась наличием симптомов хронического бронхита. Применение ингибитора ФДЭ4 у данной категории пациентов позволило снизить частоту обострений заболевания на 26,2%, в то время как у пациентов с эмфиземой и без хронического бронхита – лишь на 1,1% [15]. Более эффективным использование рофлумиласта было и у пациентов, принимавших ингаляционные ГКС (ИГКС). Снижение частоты обострений среди пациентов, принимавших ИГКС (в суточной дозе, эквивалентной ≤ 2000 мкг беклометазона), и пациентов, их не принимавших, составило 18,8 и 7,7% соответственно [15]. Кроме того, при ретроспективном анализе данных, полученных в ходе 52–недельных исследований препарата, была выявлена корреляция между снижением частоты обострений на фоне приема рофлумиласта и количеством обострений в анамнезе пациентов. Было показано, что наличие частых обострений ХОБЛ (2 и более в течение предшествующих 12 мес.) ассоциируется с большей эффективностью препарата (рис. 2). Использование ингибитора ФДЭ4 в комбинации с бронхолитиками, как свидетельствуют результаты проведенных исследований, повышает эффективность терапии заболевания. Так, добавление рофлумиласта (500 мкг 1 раз/сут.) к тиотропиуму позволило достоверно повысить пребронходилатационный ОФВ1 по сравнению с плацебо [17]. Использование препарата у пациентов, принимавших β2–агонисты длительного действия, также сопровождалось достоверным улучшением бронхиальной проходимости и снижением частоты тяжелых и среднетяжелых обострений ХОБЛ (рис. 3). Профиль безопасности В 2011 г. были опубликованы данные о переносимости рофлумиласта, полученные в ходе анализа 14 плацебо–контролируемых исследований (табл. 4). Согласно полученным данным, наиболее часто прием ингибитора ФДЭ4 ассоциируется с возникновением диареи и тошноты (10,1 и 5,2% соответственно). Кроме того, применение рофлумиласта может быть связано с развитием таких нежелательных реакций, как головокружение, головная боль, бессонница, повышением риска психических расстройств. Не получено данных о влиянии препарата на частоту возникновения инфекций дыхательных путей. Следует отметить, что нежелательные явления (НЯ), связанные с использованием рофлумиласта, возникают, как правило, в первые недели лечения и в дальнейшем разрешаются, не требуя отмены препарата [11]. В ходе клинических исследований был выявлен достаточно неожиданный эффект ингибитора ФДЭ4 – снижение массы тела пациентов, наблюдающееся, как правило, в течение первых 6 мес. лечения. Так, согласно данным, полученным в ходе исследований AURA и HERMES, в группе пациентов, получавших рофлумиласт, данный показатель уменьшился в среднем на 2,1 кг [16]. Наибольшая потеря массы тела отмечалась среди пациентов, страдавших ожирением (индекс массы тела >30 кг/м2) (рис. 4). Этот эффект обусловлен, в основном, прямым липолитическим действием препарата. Прекращение приема рофлумиласта, согласно имеющимся данным, сопровождается восстановлением исходной массы тела. Дозировка и применение Рофлумиласт назначается взрослым внутрь по 500 мкг 1 раз/сут., независимо от приема пищи. У пожилых пациентов, а также при наличии почечной недостаточности коррекцию дозы препарата проводить не требуется. Заключение Появление рофлумиласта в арсенале средств, использующихся для лечения ХОБЛ, расширяет возможности фармакотерапии заболевания, позволяя воздействовать на его патогенетические механизмы. Как свидетельствуют результаты исследований, применение ингибитора ФДЭ4 наиболее оправданно у пациентов с симптомами хронического бронхита, тяжелой бронхиальной обструкцией (ОФВ1<50%) и частыми обострениями заболевания (≥2/12 мес.). Согласно существующим рекомендациям по лечению ХОБЛ, препарат может использоваться в качестве средства дополнительной терапии у наиболее тяжелой категории пациентов (группа D) [20].
Литература 1. Atsou K., Chouaid C., Hejblum G. Variability of the chronic obstructive pulmonary disease key epidemiological data in Europe: systematic review // BMC Medicine. 2011. Vol. 9. Р. 7. 2. Menezes A.M., Perez–Padilla R., Jardim J.R., et al. Chronic obstructive pulmonary disease in five Latin American cities (the PLATINO study): A prevalence study // Lancet. 2005. Vol. 366. Р. 1875–1881. 3. World Health Organisation Website. Chronic Obstructive Pulmonary Disease https://www.who.int./ respiratory/copd. 4. Houslay MD: Underpinning compartmentalised cAMP signalling through targeted cAMP breakdown // Trends Biochem Sci. 2010. Vol. 35. Р. 91–100. 5. Rabe KF. Roflumilast for the treatment of chronic obstructive pulmonary disease // Expert Rev Respir Med. 2010. Vol. 4 (5). Р. 543–555. 6. Jeon Y., Heo Y., Kim C. et al. Phosphodiesterase: overview of protein structures, potential therapeutic applications and recent progress in drug development // Cell. Mol. Life Sci. 2005. Vol. 62 (11). Р. 1198–1220. 7. Barnes P.J., Hansel T.T. Prospects for new drugs for chronic obstructive pulmonary disease // Lancet. 2004. Vol. 364. Р. 985–996. 8. Page C.P., Spina D. Selective PDE inhibitors as novel treatments for respiratory diseases // Curr Opin Pharmacol. 2012. Vol. 12. Р. 275–286. 9. Tenor H.H.A., Beume R., Lahu G., Zech K., Bethke T. Pharmacology, clinical efficacy and tolerability of phosphodiesterase–4 inhibitors: impact of human pharmacokinetics. In: Francis SH et al. (eds). In “Phosphodiesterases as drug targets, handbook of experimental pharmacology 204”. Berlin Heidelberg: Springer–Verlag, 2011. 10. Taegtmeyera А.В., Leuppib J.D., Kullak–Ublicka G.A. Roflumilast – a phosphodiesterase–4 inhibitor licensed for add–on therapy in severe COPD // Swiss Med Wkly. 2012. Vol. 142: w13628. 11. Rabe K.F. Update on roflumilast, a phosphodiesterase 4 inhibitor for the treatment of chronic obstructive pulmonary disease // Br J Pharmacol. 2011. Vol. 163 (1). Р. 53–67. 12. Rabe K.F., Bateman E.D., O’Donnell D. et al. Roflumilast – an oral antiinflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial // Lancet. 2005. Vol. 366. Р. 563–571. 13. Calverley P.M., Sanchez–Toril F., McIvor A. et al. Effect of 1–year treatment with roflumilast in severe chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 2007. Vol. 176 (2). Р. 154–161. 14. FDA. Centre for Drug Evaluation and Research. Application number 022522Orig1s000. Medical Review(s). Available at https://wwwaccessdatafdagov/drugsatfda_docs/nda/2011/022522Orig1s000MedRpdf. 15. Rennard SI, Calverley PM, Goehring UM, et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast – the importance of defining different subsets of patients with COPD // Respir Res. 2011. Vol. 12. Р. 18. 16. Calverley P.M., Rabe K.F., Goehring U.M. et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials // Lancet. 2009. Vol. 374. Р. 685–694. 17. Fabbri L.M., Calverley P.M., Izquierdo–Alonso J.L. et al. Roflumilast in moderate–to–severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised clinical trials // Lancet. 2009. Vol. 374. Р. 695–703. 18. Hurst J.R., Vestbo J., Anzueto A. et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease // N Engl J Med. 2010. Vol. 363. Р. 1128–1138. 19. Soler–Cataluna J.J. Martinez–Garcia M.A., Serra P.C. Frequent exacerbations contribute to the mortality of COPD // Thorax. 2005. Vol. 64. Р. 925–931. 20. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011. Available from: https://www.goldcopd.org/. 21. Bateman E., Calverley P.M., Fabbri L.M. et al. Efficacy of roflumilast in patients with a history of frequent exacerbations: Pooled data from pivotal 12’mont studies. European Respiratory Society Annual Congress 2010. Barcelona, 2010. P. 4003.
Даксас (Daxas®)
Даксас — нестероидное противовоспалительное средство, предназначенное для поддерживающего лечения больных ХОБЛ тяжелого течения с частыми обострениями. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают пациенты в возрасте старше 40 лет, при назначении препарата пациентам до 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Согласно показаниям к применению препарата, необходимо, чтобы значение постбронходилатационного ОФВ1 составляло менее 50% от рассчитанного должного показателя.
Даксас не предназначен для лечения острого приступа одышки (острого бронхоспазма). Пациента следует предупредить о том, что для облегчения острого приступа важно всегда иметь назначенный врачом препарат, чтобы купировать приступ. Даксас в таком случае ситуации не эффективен.
В ходе исследований, проведенных в течение года, чаще наблюдалось снижение массы тела у пациентов, получавших Даксас, по сравнению с пациентами, получавшими плацебо. После прекращения приема препарата Даксас у большинства пациентов масса тела восстанавливалась в течение 3 месяцев.
У пациентов с недостаточной массой тела следует контролировать ее при каждом визите к врачу. Пациентам следует советовать регулярно контролировать массу своего тела. В случае необъяснимого или клинически значимого снижения массы тела, необходимо прекратить прием препарата Даксас и отслеживать динамику.
Вследствие отсутствия достаточного опыта, не следует начинать лечение препаратом Даксас пациентам, получающим постоянную поддерживающую терапию пероральными ГКС, за исключением краткосрочных курсов системных ГКС.
Опыт применения препарата Даксас у пациентов с латентными инфекциями, такими как туберкулез, вирусный гепатит, вирусный герпес и опоясывающий лишай, ограничен.
Применение препарата Даксас ассоциировано с повышенным риском таких психических расстройств как бессонница, тревожность, нервозность и депрессия. В ходе клинических исследований выявлены редкие случаи проявления суицидального мышления и поведения. Поэтому, если пациенты сообщают о ранее проявлявшихся симптомов со стороны психики или такие симптомы проявляются у них в настоящее время, или если планируется сопутствующая терапия другими лекарственными средствами, связанная с вероятностью появления психических нарушений, следует провести тщательную оценку риска и пользы, связанных с началом или продолжением лечения препаратом Даксас. Пациентов следует проинструктировать о необходимости уведомлять врача, назначившего лечение, о любых изменениях в поведении, настроении или появлении суицидальных мыслей любого характера.
Несмотря на то, что неблагоприятные реакции такие, как диарея, тошнота, боли в животе и головная боль возникают в основном в первые недели лечения и в большинстве случаев проходят при продолжении лечения, в случае сохранения данных симптомов следует пересмотреть вопрос о лечении препаратом Даксас.
Непереносимость может возникать в случае особых популяций больных, в частности, у чернокожих некурящих женщин или пациентов, получающих лечение ингибитором CYP1A2 флувоксамином или двумя ингибиторами CYP3A4/1А2 эноксацином и циметидином.
Нет клинических данных, касающихся сопутствующего лечения теофиллином в качестве поддерживающей терапии. Поэтому сопутствующее лечение теофиллином не рекомендовано.
Влияние на способность к вождению автотранспорта и управлению механизмами
Из-за возможности развития побочных реакций пациенты должны соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Рофлумиласт: истина рождается в споре
В 2010 г. в странах Евросоюза и Канады был зарегистрирован первый пероральный ингибитор фосфодиэстеразы 4-го типа – рофлумиласт. В марте 2011 г. его применение для лечения пациентов с хронической обструктивной болезнью легких (ХОБЛ) одобрило Управление по контролю качества пищевых продуктов и лекарственных препаратов США. В августе того же года рофлумиласт был зарегистрирован в России. За это время появились новые данные об эффективности и безопасности препарата, его способности снижать частоту обострений ХОБЛ, нежелательных явлениях, возникающих на фоне его применения. В данной статье проанализированы последние публикации, посвященные результатам экспериментальных и клинических исследований механизма действия рофлумиласта, обсуждению данных о его эффективности и профиле безопасности.
Подходы к терапии хронической обструктивной болезни легких (ХОБЛ) постоянно совершенствуются. Однако достижения в этой области достаточно скромные, поскольку реальных способов модифицировать течение заболевания пока не найдено [1].
На протяжении последних 30 лет перспективы развития терапии ХОБЛ связывали прежде всего с бронхолитиками и ингаляционными стероидами. Отказ в регистрации первых ингибиторов фосфодиэстеразы 4-го типа (ФДЭ-4), в частности циломиласта [2, 3], снизил к ним интерес ряда фармацевтических компаний. Сегодня ситуация иная: в 61 стране мира одобрили первый клинически значимый ингибитор ФДЭ-4 – рофлумиласт. Вновь возросший интерес к ингибиторам ФДЭ-4 привел не только к появлению на медицинском рынке рофлумиласта, но и к разработке новых молекул и способов доставки, различных комбинаций с ингибиторами ФДЭ-4 [4].
Некоторые специалисты называют рофлумиласт селективным теофиллином. Между тем теофиллин был внедрен в практику в качестве бронхолитика, слабого и неселективного ингибитора ФДЭ изоферментов 1–11-й групп, ведущим механизмом которого являлся антагонизм с аденозином [5, 6]. Теофиллин имеет низкий терапевтический индекс и по эффективности уступает ингаляционным бронхолитикам длительного действия [6].
Рофлумиласт изначально рассматривался не как бронхолитик, а как противовоспалительный препарат принципиально нового класса, избирательно влияющий на ФДЭ-4.
ФДЭ – большая группа ферментов, которые катализируют расщепление циклического аденозинмонофосфата (цАМФ) и/или циклического гуанозинмонофосфата (цГМФ) до неактивной формы. ФДЭ-4 имеет высокий уровень экспрессии в лейкоцитах и других воспалительных клетках, вовлеченных в патогенез таких воспалительных заболеваний легких, как бронхиальная астма и ХОБЛ. Это и определило прогноз практического применения ингибиторов ФДЭ-4 как противовоспалительных средств со значимым терапевтическим эффектом.
Рофлумиласт оказался единственным ингибитором ФДЭ-4, которому удалось достичь фармацевтического рынка благодаря хорошему соотношению «эффективность/переносимость». Препарат был рекомендован для лечения больных ХОБЛ с тяжелой обструкцией, симптомами хронического бронхита и обострениями в анамнезе, то есть для тех пациентов, у которых заболевание не поддается адекватному контролю при терапии длительно действующими бронходилататорами.
Результаты клинических исследований рофлумиласта создают предпосылки для расширения показаний к его применению при ХОБЛ и других респираторных (например, при бронхиальной астме) и нереспираторных воспалительных и метаболических заболеваниях (в частности, при сахарном диабете) [7].
Механизм действия рофлумиласта остается предметом тщательного изучения. Показано, что препарат повышал высвобождение сосудистого эндотелиального фактора роста (vascular endothelial growth factor, VEGF) как при взаимодействии с Е-простаноидными 2-рецепторами, так и с их агонистами, увеличивал уровень индуцированного простагландином Е2 цАМФ в цитоплазме и высвобождение VEGF под действием других агентов, которые используют сигнальный путь с участием цАМФ. Стимулирующее действие рофлумиласта на высвобождение VEGF воспроизводилось на фибробластах как здоровых людей, так и больных ХОБЛ [8].
Внедрение рофлумиласта в комплексную терапию ХОБЛ направлено на решение проблемы, связанной с прогрессированием болезни. Именно обострения ХОБЛ сопровождаются увеличением тяжести заболевания и смертности и способны ускорять прогрессирование болезни. Лучшим предиктором последующих обострений является наличие обострений в анамнезе. Это позволяет определить фенотип больного с частыми обострениями.
Группа английских ученых провела ретроспективный анализ эффективности рофлумиласта – препарата, способного снижать частоту обострений ХОБЛ, – в дозе 500 мкг 1 раз в день у пациентов с симптомным течением ХОБЛ и тяжелой обструкцией дыхательных путей. При этом использовались результаты двух годичных плацебоконтролируемых рандомизированных клинических исследований (РКИ) (M2-124 и M2-125, идентификаторы ClinicalTrials.gov – NCT00297102 и NCT00297115) с продолжительностью периода наблюдения 1 год. Среди 3091 больного, включенного в анализ, у 62,5% диагностирована ХОБЛ III стадии и у 29,2% – IV стадии по классификации GOLD (Global initiative for chronic Obstructive Lung Disease, Глобальная инициатива по диагностике и лечению хронической обструктивной болезни легких). На основании данных о частоте обострений в анамнезе пациенты были распределены в соответствии с фенотипом заболевания: с частыми (≥ 2 в год) и редкими (
После того как основные клинические исследования были завершены и рофлумиласт стали применять в повседневной практике лечения ХОБЛ, появилось несколько публикаций, посвященных нежелательным явлениям на фоне приема препарата [10, 11, 12] и положивших начало оживленной дискуссии [13].
В одной из работ [10] сообщалось, что система фармакобезопасности Испании получила несколько сообщений о развитии на фоне приема рофлумиласта нежелательных явлений со стороны желудочно-кишечного тракта (ЖКТ) и психических нарушений. В связи с этим было отмечено, что больные, получающие этот препарат, должны находиться под тщательным наблюдением. Авторы публикации описали единичный случай развития тяжелой диареи и выраженной потери веса вскоре после начала применения рофлумиласта. Возможные реакции со стороны ЖКТ в начале терапии отмечены и в инструкции по применению рофлумиласта. Однако следует признать, что для оценки эффективности и безопасности препарата экспертам Управления по контролю качества пищевых продуктов и лекарственных препаратов США (United States Food and Drug Administration, FDA) были представлены не только отдельные публикации, но и выборки более чем по 12 000 больных с анализом потенциальной значимости редких, но существенных явлений, которые трудно проанализировать в отдельных исследованиях. На основании этих данных регулирующие агентства 61 страны, включая США и Евросоюз, сделали заключение о том, что рофлумиласт имеет благоприятное соотношение «риск/польза» в случае применения по показаниям [14]. В отчете экспертов FDA сказано, что около 90% нежелательных явлений со стороны ЖКТ в клинических исследованиях были легкой и умеренной степени выраженности и купировались самостоятельно.
Другая критическая статья была представлена сотрудниками университета Миссури (США) [11]. На основании результатов восьми РКИ, отобранных по соответствующим критериям включения, авторы отметили, что рофлумиласт достоверно снижал частоту среднетяжелых обострений (ОР 0,85; 95% ДИ (доверительный интервал) 0,80–0,91) по сравнению с плацебо, но не влиял на тяжелые обострения (ОР 0,83; 95% ДИ 0,68–1,01). Тем не менее это не противоречит выводам публикации экспертов в области ХОБЛ, которые на основании результатов двух РКИ, включавших больных с тяжелым течением ХОБЛ, заключили, что рофлумиласт продемонстрировал эффективность в отношении снижения риска обострений у пациентов с тяжелым течением ХОБЛ, симптомами бронхита и обострениями в анамнезе [15].
В противовес выводам о рисках, связанных с назначением рофлумиласта, в статье S. Siddiqui [13] отмечено, что метаанализ Y. Oba, N.A. Lone (2013) не вполне объективен, поскольку сравнения и обобщения по рофлумиласту проведены за пределами целевой популяции пациентов, которой показан препарат, то есть популяции не были ориентированы на выявление нежелательных реакций. В то же время ученые из Миссури подтвердили, что рофлумиласт достоверно улучшал функцию легких по сравнению с плацебо.
Особое внимание в публикациях оппонентов уделено вопросам безопасности применения рофлумиласта – нарушениям со стороны ЖКТ, сердечно-сосудистой (ССС) и центральной нервной системы. Отмечено, что нежелательные явления (ОР 1,11; 95% ДИ 1,03–1,19) и прекращение лечения вследствие возникновения нежелательных явлений (ОР 1,63; 95% ДИ 1,45–1,84) были более частыми в группе рофлумиласта, чем в группе плацебо. Вместе с тем в популяции больных ХОБЛ для оценки безопасности (12 054 пациента) в целом не было различий по частоте серьезных нежелательных событий между группами [11].
Заметим, что любое сильное лекарственное средство характеризуется рядом установленных нежелательных явлений. Самые эффективные и необходимые препараты не раз становились объектом дискуссий. Как известно, диарея возникает на фоне приема многих антибиотиков. Даже у детей со средним отитом диарея встречалась в 17,5% случаев при применении амоксициллина и в 8,2% – при использовании азитромицина [16]. Тем не менее оба препарата считаются «золотым стандартом» в лечении бактериальных респираторных инфекций. Амоксициллин/клавуланат в 2008 г. стал лидером по гепатотоксическим реакциям среди пенициллинов (12,8–14% случаев) и наиболее частой причиной госпитализаций, связанных с поражением печени, вызванным лекарственными средствами [17]. Но это не повлияло на клиническую значимость препарата. Были созданы его дженерики и появились более совершенные формы бренда.
Эпидемиологические исследования показывают, что значительная доля смертей от ХОБЛ связана с нарушениями со стороны ССС [18]. Фибрилляция предсердий (0,4% против 0,2%; p = 0,02) чаще отмечалась в группе рофлумиласта, чем в группе плацебо [11]. Однако обратные данные о сердечно-сосудистом риске были получены в 2013 г. исследователями из США и Швейцарии: они провели метаанализ 14 плацебоконтролируемых РКИ продолжительностью 12 и 52 недели, чтобы оценить риск серьезных нежелательных явлений со стороны ССС при приеме рофлумиласта. Из 12 054 больных ХОБЛ среднетяжелого, тяжелого и очень тяжелого течения 6563 получали рофлумиласт, 5491 – плацебо. Все смерти и значимые несмертельные явления со стороны ССС оценивались независимым комитетом, не информированным о характере проводимой терапии. Среди получавших рофлумиласт было 52 больных с тяжелыми нежелательными явлениями со стороны ССС (14,3 на 1000 пациенто-лет), среди получавших плацебо количество таких пациентов составило 76 (22,3 на 1000 пациенто-лет). То есть общая частота тяжелых нежелательных явлений со стороны ССС была достоверно ниже в группе рофлумиласта по сравнению с группой плацебо (ОР 0,65; 95% ДИ 0,45–0,93; p = 0,019). Возможность положительного влияния рофлумиласта на ССС требует дальнейшей оценки в ходе РКИ [19]. Положительное влияние рофлумиласта на ССС может быть связано с уменьшением сосудистого воспаления.
Эти противоречивые данные также стали предметом обсуждения. Критикующие рофлумиласт отметили, что частота нефатального инсульта была единственным компонентом тяжелых явлений со стороны ССС, имевшим достоверную динамику. Таким образом, справедливо утверждать, что рофлумиласт уменьшает частоту цереброваскулярных, но не сердечно-сосудистых событий или смертности, поскольку частота последних не отличалась от частоты в группе плацебо. Было высказано предположение, что профиль безопасности рофлумиласта по влиянию на ССС может измениться, если в последующие исследования включить пациентов с высоким кардиальным риском [12].
В ответной статье [13] было сказано следующее. Несмотря на то что серьезные нежелательные события, такие как фибрилляция предсердий, чаще встречались в группе рофлумиласта, чем в группе плацебо, тщательное исследование больных ХОБЛ в популяции для оценки безопасности в отношении фибрилляции предсердий показало, что все случаи фибрилляции (плацебо (n = 9); рофлумиласт (n = 24)) были расценены исследователями как маловероятно связанные или не связанные с препаратом. Более того, результаты суточного холтеровского ЭКГ-мониторирования у 55 больных (РКИ M2-124) показали отсутствие различий между группами по частоте сердечных сокращений или возникновению аритмий [14]. FDA заключило, что рофлумиласт имеет приемлемое соотношение «риск/польза» для регистрации. В инструкции по применению препарата имеются все необходимые предупреждения [20]. Результаты холтеровского мониторирования подтверждают мнение ряда авторов о том, что эпизоды фибрилляции предсердий на фоне приема рофлумиласта, скорее всего, были случайным совпадением. Все смерти и значимые несмертельные реакции со стороны ССС в популяции для оценки безопасности рофлумиласта при ХОБЛ оценивались независимым комитетом экспертов, не информированным о проводимой терапии [19]. Этот анализ показал, что серьезные нежелательные явления со стороны ССС (смерть, несмертельные инфаркты миокарда и инсульты) встречались достоверно реже при лечении рофлумиластом по сравнению с плацебо (ОР 0,65; 95% ДИ 0,45–0,93; p = 0,019). Это свидетельствует не только об отсутствии опасности со стороны применения рофлумиласта, но и о потенциальной пользе данного лечения в отношении ССС, что целесообразно учесть в будущих РКИ.
Исследования кардиотропного действия ингибиторов ФДЭ-4 продолжаются на экспериментальном уровне. ФДЭ ограничивает положительный инотропный эффект стимуляции бета-адренорецепторов посредством разрушения цАМФ. Следовательно, ингибиторы ФДЭ повышают чувствительность к катехоламинам и могут использоваться как положительные инотропные средства. При этом положительный инотропный эффект сопровождается повышением расхода энергии, риска гибели клеток и аритмиями.
На протяжении многих лет ФДЭ-3 считалась основным изоферментом, ответственным за контроль силы сердечного сокращения и ритма. Однако в недавно проведенных исследованиях у грызунов было показано, что в этих процессах участвует и ФДЭ-4. При этом необходимо учитывать, что в кардиомиоцитах мышей цАМФ гидролитическая активность ФДЭ-4 составляет порядка 30–50%, а в кардиомиоцитах человека – не более 10%, что связано с высокой активностью других ФДЭ (1, 2 и 3-го типов) [21].
В исследовании у здоровых добровольцев было показано, что рофлумиласт (500 мкг внутрь) и сальбутамол (200 мкг 3 раза в день с помощью дозированных аэрозольных ингаляторов) в течение 7 дней не оказывали взаимного влияния на фармакокинетику и хорошо переносились. Увеличения частоты серьезных нежелательных явлений не отмечено [22]. Экспериментальные и клинические данные подтверждают хорошую сердечно-сосудистую безопасность ингибиторов ФДЭ-4.
Анализ частоты случаев госпитализации позволяет судить об изменении расходов на терапию больных ХОБЛ в случае применения рофлумиласта. В модели воздействия на бюджет оценка влияния включения рофлумиласта в проводимую терапию ХОБЛ показала сокращение медицинских затрат, что в значительной степени обусловлено снижением числа госпитализаций [23]. Ретроспективный анализ ключевых РКИ (M2-124/125) продемонстрировал, что рофлумиласт по сравнению с плацебо значительно снижает частоту тяжелых обострений, приводящих к госпитализации [24]. В настоящее время проводится дополнительный анализ медицинских исследований в реальной практике для оценки влияния рофлумиласта на снижение частоты госпитализаций и повторных госпитализаций [13].
Публикации 2013 г. свидетельствуют о рентабельности применения рофлумиласта у больных с тяжелой и очень тяжелой ХОБЛ с обострениями в анамнезе. Когортный анализ, проведенный в Швейцарии, с моделированием по Маркову показал, что включение рофлумиласта в комплексную терапию снижает затраты системы здравоохранения и является экономически эффективным методом терапии больных ХОБЛ с частыми обострениями [25]. В Германии была доказана рентабельность сочетания рофлумиласта с ДДБА при лечении ХОБЛ тяжелого и очень тяжелого течения [26]. Аналогичный анализ рентабельности применения рофлумиласта в качестве дополнения к ДДБА при лечении ХОБЛ тяжелого и очень тяжелого течения с клиническими признаками бронхита и частыми обострениями в анамнезе был проведен в Великобритании. Исходя из экономических установок страны, это сочетание было также признано рентабельным [25].
Ретроспективный анализ двух РКИ III фазы показал, что рофлумиласт уменьшает частоту обострений у больных ХОБЛ тяжелого и очень тяжелого течения, которые одновременно получали ИГКС, тогда как среди не получавших ИГКС этого влияния на частоту обострений не было выявлено [24]. В двух других РКИ с участием больных ХОБЛ тяжелого течения рофлумиласт снижал частоту обострений у пациентов, не получавших ИГКС [23]. То есть угнетения ФДЭ-4 было достаточно для реализации терапевтического эффекта. Исходя из того что рофлумиласт рекомендуется в качестве дополнительного средства при лечении ХОБЛ тяжелого течения, большинство таких больных должны будут получать комбинацию ДДБА/ИГКС. Канадские исследователи проверяли, способен ли рофлумиласт увеличивать действие ГКС посредством индукции генов с противовоспалительной активностью. С помощью элемента ГКС-ответа (GRE) репортера люциферазы, трансфицированного в эпителиальные клетки дыхательных путей человека (в гибридную культуру «бронхиальный эпителий + аденовирус 12-SV40» (BEAS-2B) и в первичную культуру), было показано, что рофлумиласт усиливал вызванную флутиказона пропионатом GRE-зависимую транскрипцию. Рофлумиласт также вызывал смещение влево кривой «концентрация – ответ», что было описано как усиление GRE-зависимой транскрипции генов под действием ДДБА формотерола. В клетках BEAS-2B и первичной культуре эпителия рофлумиласт при взаимодействии с формотеролом улучшал экспрессию нескольких ГКС-индуцибельных генов, имеющих противовоспалительный потенциал. Авторы сделали вывод, что комбинация рофлумиласта и формотерола обладает преимуществами по сравнению с монотерапией ИГКС, или только с ингибитором ФДЭ-4, или с ИГКС/ДДБА. Поэтому рофлумиласт может быть особенно эффективным у больных с ХОБЛ тяжелого течения [27]. Новый класс бронхолитиков с двойным фармакологическим действием, нацеленным на бета-2-адренорецепторы и ФДЭ-4, был разработан и синтезирован посредством комбинирования фармакофоров салметерола и рофлумиласта или фталазинона. Все компоненты характеризовались высокой активностью в отношении бета-2-адренорецепторов (pEC(50) = 8,47–9,20) по сравнению с референтным веществом салметерола (pEC(50) = 8,3) и хорошей подавляющей активностью в отношении ФДЭ-4B2 (IC(50) = 0,235–1,093 μM) [28].
Еще одним механизмом снижения частоты обострений ХОБЛ при лечении рофлумиластом может быть его влияние на респираторно-синцитиальный вирус. Испанские исследователи опубликовали результаты экспериментальной работы, в которой показали, что N-оксид рофлумиласта подавляет этот вирус в культуре клеток бронхиального эпителия и уменьшает связанные с ним цитопатологические изменения [29].
Таким образом, на основании большого количества проведенных исследований можно заключить, что появившийся недавно в клинической практике первый пероральный ингибитор ФДЭ-4 рофлумиласт обладает обнадеживающим профилем эффективности и безопасности. Последние публикации свидетельствуют как о позитивном эффекте включения рофлумиласта в комбинированную терапию ХОБЛ, так и о потенциальной пользе препарата в отношении ССС у больных ХОБЛ тяжелого и очень тяжелого течения с частыми обострениями.