Этанол
(этиловый спирт, метилкарбинол, винный спирт или алкоголь, часто в просторечии просто «спирт») — одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), рациональная формула: CH3-CH2-OH, аббревиатура
EtOH,
второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость.
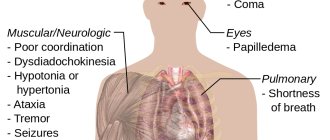
Действующий компонент алкогольных напитков является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека.
Этиловый спирт также используется как топливо, в качестве растворителя, как наполнитель в спиртовых термометрах и как дезинфицирующее средство (или как компонент его).
Содержание
- 1 Получение 1.1 Брожение 1.1.1 Промышленное производство спирта из биологического сырья
- 1.1.2 Гидролизное производство
- 2.1 Физические свойства
- 3.1 Топливо
- 5.1 Автомобильный парк, работающий на этаноле
- 9.1 Этимология термина «этанол»
2.Способы обозначения концентрации спирта этилового
В аптечной практике используется этанол различной концентрации. Исходной концентрацией является 95%, также используется 90%, 70% и 40%. Если концентрация спирта в рецепте не указано, готовим 90%.
Концентрацию этилового спирта выражают в процентах по объёму (%v) или в процентах по массе (%m).
Процент по объёму показывает содержание безводного (абсолютного) спирта в миллилитрах в 100 миллилитрах спиртового раствора при 20°С.
Процент по массе показывает содержание безводного (абсолютного) спирта в граммах в 100 граммах спиртового раствора.
В том случае, если концентрация спирта обозначена просто в %, подразумевают процент по объёму (%v).
Если возникает необходимость разбавить крепкий спирт этиловый или смешать спиртовые растворы различных концентраций, расчеты выполняют с использованием:
- Формулы разбавления;
- «Правила креста».
- Алкоголеметрических таблиц ГФ ХI;
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
См. также: Биоэтанол § Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
C6H12O6 → 2C2H5OH + 2CO2
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Промышленное производство спирта из биологического сырья
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
- Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы, яблок и т. п.
- Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
- Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в браге спирта.
- Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
- Альфа
- Люкс
- Экстра
- базис
- высшей очистки
- 1 сорт
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
Основная статья: Гидролизный спирт
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2 = CH2 + H2O → C2H5OH
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
CH2 = CH2 + H2SO4 → CH3CH2OSO2OH CH3CH2OSO2OH + H2O → CH3CH2OH + H2SO4
Эта реакция осложняется параллельной реакцией образования диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами, например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4.
Спирт этиловый как растворитель и экстрагент
- Является хорошим растворителем многих алкалоидов, гликозидов, эфирных масел, смол и других веществ, которые в воде растворяются в незначительных количествах.
- Значительно труднее, чем вода, проникает через стенки клеток. Отнимая воду у белков и слизистых веществ, спирт может превращать их в осадки, закупоривающие поры клеток и, таким образом, ухудшает диффузию. Чем ниже концентрация спирта, тем легче он проникает внутрь клеток.
- Чем крепче спирт, тем менее возможны гидролитические процессы. Спирт инактивирует ферменты.
- Является бактерицидной средой. В извлечениях, содержащих не менее 20% спирта, не развиваются ни микроорганизмы, ни плесени.
- Фармакологически неиндифферентен. Он оказывает как местное, так и общее действие.
- Достаточно летуч.
- Огнеопасен, потому при работе с ним должны соблюдаться установленные требования противопожарной безопасности.
- Является лимитированным продуктом, отпускаемым фармацевтическим производством в установленном порядке. Однако по стоимости-— это вполне доступный экстрагент.
Итак, спирт этиловый — экстрагент с еще более широким диапазоном, чем вода, причем его извлекающие способности зависят от его концентрации.
Свойства
Физические свойства
В обычных условиях представляет собой бесцветную, легкоподвижную, летучую жидкость с характерным запахом и сладковато-жгучим вкусом.
Плотность этилового спирта 0,7905 г/см3 при 20 °C, он легче воды.
Является хорошим растворителем многих органических веществ и некоторых неорганических солей.
Физические свойства абсолютированного этанола (100 %) немного отличаются от свойств спирта-ректификата с концентрацией 95,57 %. Их свойства почти одинаковы, но численные величины различаются на 0,1—0,01 %.
Физические свойства этанола
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10−4/°C, почти постоянный в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔH пл | 4,81 кДж/моль |
| Энтальпия кипения ΔH кип | 839,3 кДж/моль |
Уменьшение объёма смеси при смешивании этанола с водой при разных мольных долях этанола в растворе. При мольной доле в 40 % снижение объёма максимально.
Смесь по массе 95,57 % этанола и 4,43 % воды является азеотропной, т. е. не разделяется при перегонке, кипит при нормальном давлении при температуре 78,174 °C, в то время как абсолютированный этанол имеет более высокую точку кипения 78,39 °C.
С водой этанол смешивается в произвольном отношении, при смешивании наблюдается значительное, до нескольких процентов уменьшение объёма смеси относительно исходного суммарного объёма чистых веществ, например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Также смешивание сопровождается некоторым нагревом смеси.
Абсолютный этанол затвердевает при температуре −114,5 °C. Температура плавления смесей этанола с водой уменьшается при увеличении концентрации этанола в растворе и достигает минимума при массовой концентрации этанола в воде равной 93,5 % — эвтектики этанол-вода, имеющей температуру плавления −118 °C. При низких температурах, ниже −20 °С водный раствор этанола (96 %) практически не испаряется и превращается в вязкую жидкость. При −70 °C он становится ещё более вязким и по текучести напоминает густой мёд.
Химические свойства
Анимация трёхмерной модели молекулы этанола
Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя терминальные продукты окисления — диоксид углерода и воду:
C2H5OH + 3O2 → 2CO2 + 3H2O
Ещё энергичнее эта реакция протекает в атмосфере чистого кислорода.
При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов:
2C2H5OH + 2K → 2C2H5OK + H2 C2H5OH + NaH → C2H5ONa + H2
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров:
C2H5OH + RCOOH ⇄ RCOOC2H5 + H2O C2H5OH + HNO2 ⇄ C2H5ONO + H2O
С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения:
C2H5OH + HX ⇄ C2H5X + H2O
Без катализаторов реакция с HCl идет относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса.
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
3C2H5OH + PCl3 → 3C2H5Cl + H3PO3
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
C2H5OH + CH2 = CHCN → C2H5OCH2CH2CN
реагирует с альдегидами с образованием полуацеталей и ацеталей:
C2H5OH + RCHO → RCH(OH)OC2H5 C2H5OH + RCH(OH)OC2H5 → RCH(OC2H5)2 + H2O
При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир:
2C2H5OH → C2H5OC2H5
При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен:
C2H5OH → CH2 = CH2 + H2O
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удается реализовать одностадийный процесс получения окиси этилена:
2C2H5OH + O2 → 2C2H4O + 2H2O
В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция Лебедева):
2C2H5OH → CH2 = CH — CH = CH2 + 2H2O + O2
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука.
В слабощелочной среде образует иодоформ:
C2H5OHA + 4I2 + 6NaHCO3 → CHI3 + HCOONa + 5NaI + 5H2O + 6CO2
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствии других веществ, дающих подобную реакцию.
Пожароопасные свойства
Легковоспламеняющаяся бесцветная жидкость; давление насыщенного пара, кПа: lg p = 7.81158-1918.508/(252.125+t) при температуре от −31 до 78°С; теплота сгорания — 1408 кДж/моль; теплота образования −239,4 кДж/моль; температура вспышки 13°С (в закрытом тигле), 16°С (в открытом тигле); температура воспламенения 18°С; температура самовоспламенения 400°С; концентрационные пределы распространения пламени 3,6—17,7 % объёма; температурные пределы распространения пламени: нижний 11°С, верхний 41°С; минимальная флегматизирующая концентрация, % объёма: CO2 — 29.5, H2O — 35.7, N2 — 46; максимальное давление взрыва 682 кПа; максимальная скорость нарастания давления 15,8 МПа/с; скорость выгорания 0,037 кг/(м2•с); максимальная нормальная скорость распространения пламени — 0,556 м/с; минимальная энергия зажигания — 0,246 МДж; минимальное взрывоопасное содержание кислорода 11,1 % объёма.
3.Особенности разбавления спирта этилового, расчеты
Формулы разбавления
Разбавление по объёму.
Если разбавление производят водой, расчёты делают по формуле(1):
(1), где
Х – объём крепкого спирта (мл);
V – объём спирта желаемой крепости (мл);
b – концентрация спирта желаемой крепости, %(v);
a — концентрация крепкого спирта, %(v);
Если разбавление крепкого спирта производят спиртом более низкой концентрации, расчёты производят по формуле(2):
(2) , где
с – концентрация слабого спирта, % (v)
Так как объём зависит от температуры, измерение жидкостей проводят при стандартной температуре (20±2°С).
Разбавление по массе.
Если разбавление производят водой, расчёты делают по формуле(3):
(3),где
Х – масса крепкого спирта (г);
Р – масса спирта желаемой крепости (г);
b – концентрация спирта желаемой крепости, % (m);
а – концентрация крепкого спирта, % (m).
Если разбавление крепкого спирта производят спиртом более низкой концентрации, расчеты делают по формуле:
Х = Р (4) , где
с – концентрация слабого спирта, %(m).
«Правило креста»
Если требуется приготовить раствор b % концентрации путем смешения растворов в концентрации а % и с %, при условии, что a>b>c, возникает вопрос, в каком соотношении a % и c % растворы должны быть использованы? Обозначив эти объёмы через х и у, получим уравнение:
ax + cy = b (x + y) , отсюда
Приравняв соответственные члены отношений, получим:
х = в – с
у = а — в
Следовательно, условие задачи и полученный результат можно записать следующим образом:
а b – с (5)
b
с а — b
В том случае, если концентрация спирта выражена в процентах по объёму, размерность величин, получаемых арифметическим вычитанием, выражена в объёмных единицах (мл). Если концентрация спирта выражена в процентах по массе, то и размерность величин в единицах массы (г).
Алкоголеметрические таблицы
В ГФ СССР ХI издания включены пять алкоголеметрических таблиц, позволяющие оперативно произвести необходимые расчёты по разбавлению спирта. (Более подробно о данных таблицах читайте в реферате, который можете скачать по ссылке после текста)
Применение
Топливо
Первым использовал этанол в качестве моторного топлива Генри Форд, который в 1880 г. создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 г., когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином.
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, 75%-й водный этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
- служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- является компонентом антифризов и стеклоомывателей;
- в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
В медицине этиловый спирт в первую очередь используется как растворитель, экстрагент и антисептик
См. также: Медицинский антисептический раствор
- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 97%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции лёгких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания);
- компонент общей анестезии в ситуации дефицита медикаментозных средств;
- как пеногаситель при отёке лёгких в виде ингаляции 33 % раствора;
- этанол является противоядием при отравлении некоторыми токсичными спиртами, такими, как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного
(почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты).
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2 %.
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Зарегистрирован в качестве пищевой добавки E1510
.
Энергетическая ценность этанола — 7,1 ккал/г.
Рецепт спирта на латинском: пошаговая инструкция
Рецепт спирта на латинском начинается, как и любой другой рецепт на латинском, со слова Recipe (во всех рецептах пишется сокращенно — Rp.), что означает «возьми».
Rp.
Далее, после двоеточия, необходимо указать лекарственную форму вещества в родительном падеже и в единственном числе. В нашем случае это всегда будет раствор, так как спирт применяется только в растворе. На латинском это выглядит так: Solutionis — (сокращенно — Sol.). Читайте подробнее рецепт раствора на латинском.
Rp.: Sol.
Затем пишем слово спирт на латинском языке в единственном числе и в родительном падеже: Spiritus aethylici. Да, в родительном падеже он не меняется.
Rp.: Sol. Spiritus aethylici
После чего необходимо указать процентное содержание нашего спирта и объем в миллилитрах, например возьмем раствор 70% — 200 ml.
Rp.: Sol. Spiritus aethylici 70% — 200 ml
С новой строки пишем Da tales doses numero (сокращенно — D.t.d. N), что означает «выдай таким количеством» и указываем сколько (например, 12 штук) и в чем (во флаконах — in flacconis — in flacc.) нужно выдать: D.t.d. N 12 in flacc. Указывать «во флаконах» не обязательно и даже нежелательно, об этом подробнее Вы узнаете в статье рецепт флаконов на латинском.
Rp.: Sol. Spiritus aethylici 70% — 200 ml D.t.d. N 12
С новой строки пишем Signa (сокращенно S.), что переводится как «обозначь» ставим двоеточие и пишем как применять наш спирт пациенту.
Rp.: Sol. Spiritus aethylici 70% — 200 ml D.t.d. N 12 S. Применять для дезинфекции
Также спирт может выписываться в составе других лекарственных средств, например:
Rp.: Lotionis Zinci spirituosae 100.0 (цинк-спиртовой лосьон) D.S. для протирания опрелых участков кожи
5.Отпуск спирта этилового из аптек
Отпуск спирта из аптек амбулаторным больным производится в соответствии с требованиями приказа МЗ РФ № 110 от 2007 г.:
- в чистом виде – до 50 грамм по рецептам с надписью «Для наложения компрессов» (с указанием необходимого разведения) или «Для обработки кожи»;
- в смеси с другими ингредиентами при индивидуальном изготовлении лекарственных препаратов – не более 50 грамм;
- больным с хроническим течением болезни – до 100 грамм по рецептам с надписью «По специальному назначению», отдельно скрепленной подписью врача и печатью лечебно-профилактического учреждения «Для рецептов».
Рецепты приготовления вина в домашних условиях
Вино – изысканный и приятный на вкус алкогольный напиток. К тому же умеренное его употребление полезно для здоровья всего организма. Спиртной шедевр можно приготовить не только из свежего винограда. Его легко сделать в домашних условиях даже среди зимы.
Для этого потребуется:
- 4 литра обычного виноградного сока;
- 1 кг сахара;
- 1 литр спирта.
Для начала следует смешать сок с сахаром и поставить его на медленный огонь. Когда сладкий ингредиент растворится, снять жидкость с плиты и полностью остудить. Затем нужно установить водяной затвор, поставив винную заготовку в теплое место для брожения на две недели
Очень важно один раз в несколько дней добавлять сахар и тщательно его размешивать
По истечению срока необходимо пропустить напиток через сито или марлю. Добавить в него спирт в количестве, не превышающем 20% от общего объема жидкости. Полученную смесь следует поставить в затемненное прохладное место на 14 дней. От накопившегося на дне осадка легко избавиться при помощи специального шланга. Такой алкогольный напиток должен настаиваться пять месяцев.
В качестве основы, вместо классического виноградного сока, можно использовать малиновый или вишневый заменитель. Полученное вино будет обладать оригинальным и приятным вкусом.
Требования к помещению
При проектировании спиртовых предприятий нужно объединить в одном здании все отделения и производственные цехи, которые взаимосвязаны между собой одним технологическим процессом. На общей огороженной территории, но отдельно от основного здания, размещаются ремонтно-механические мастерские, материальные склады и прочее. Как вариант, отделить их от взрывоопасного производства глухими противопожарными стенами.
Отдельно проектируются бродильное отделения, помещение для подготовки ароматического продукта. Там обязательно нужно установить приточно-вытяжную вентиляцию. Процесс брожения запрещен в полуподвальных и подвальных помещениях.
За всеми технологическими процессами наблюдают операторы, рабочие места которых находятся в аппаратном зале.
Каждый год осуществляется покраска и побелка производственных цехов. Стены покрыты краской, устойчивой к влаге, или облицованы глазурованной плиткой на высоту от 1,8 м. Полы в помещениях, где используются кислоты и щелочи, должны быть непроницаемыми при случайном контакте с агрессивными веществами. Для вспомогательных помещений допускается использование водоэмульсионной краски для покрытия стен.
Помещения должны быть сухими, отапливаться. Минимально допустимая температура воздуха составляет 8 градусов по Цельсию. Подведены все необходимые системы коммуникаций. Непищевые вещества не хранятся в отделениях с пищевыми продуктами. На территории предприятия обязательно находятся средства пожаротушения: песок, огнетушители, асбестовое одеяло.
В целом, рабочие зоны распределены следующим образом:
- производственный цех, состоящий из нескольких отделений, включая аппаратный зал;
- офисы;
- служебные помещения (количество санузлов устанавливается из расчета на количество человек в смене);
- складские помещения (для хранения готовой продукции и сырья);
- столовая или специально выделенное помещение для приема пищи (лучше сделать отдельным зданием) и прочее.
Оборудование может быть настолько высоким, что оно займет сразу два этажа. Суммарная площадь помещений составит от 150 м2.
Список литературы
- Фармацевтическая технология. Технология лекарственных форм: учеб. для студ. высш. учеб. заведений / [И.И.Краснюк, С.А.Валевко, Г.В.Михайлова и др.] ; под ред. И.И.Краскнюка, Г.В.Михайловой. – 3-е изд., перераб. и доп. – М.: Издательский , 2007. – 592 с.
- Государственная Фармакопея СССР. – 11-е изд. – Т.1. – М.: Медицина, 1987. – 336 с. Т.2. – М.: Медицина, 1987. – 400 с.
- ХII Государственная фармакопея российской федерации / «Издательство «Научный центр экспертизы средств медицинского применения», 2008. – 704 с.: ил.
- Приказы МЗ РФ №№ 308 от 1997 г., 214 от 1997 г., 305 от 1997 г., 309 от 1997 г., 110 от 2007 г.
Все формулы приведены в документе, который можете скачать по ссылке >>>
Также по данному реферату есть презентация >>>
Что необходимо знать о фильтрации вина?
- Фильтрация важна. Проходя процесс фильтрования вино становиться не только чистым, прозрачным. Во время приготовления в напиток попадет пыль, грибки, косточки и другие мелкие частицы. Ведь по правилам виноград и другие плоды не моют, сохраняя природные дрожжи. Если не провести фильтрацию, вино может стать непригодным для употребления.
- Виноделы уверяют, что место для фильтрации можно найти на любом этапе приготовления. Тогда вопрос нужно ставить по-другому: какое вино получится после прохождения через фильтр на определенном этапе?
- Существует грубая, мелкая, острая и конечная гарантийная фильтрация. Опытные виноделы процеживают результат труда специальными аппаратами.
- Процеживая вино, нужно следить за количеством осадка. Не всегда требуется столько этапов, сколько описано в рецепте. Предварительно нужно узнать, как процедить домашнее вино в домашних условиях.
Можно ли спирт разбавлять, мешать с газированной или дистиллированной водой?
Стоит знать:
- Хотя везде пишут, что дистиллированную воду нельзя употреблять для питья, но спирт разводят дистиллятом достаточно часто. Основной вред дистиллированной воды — отсутствие в ней основной массы полезных веществ, что способствует вымыванию, а не насыщению полезных веществ в организме.
- Дистиллированная вода обладает неприятным запахом и специфическим привкусом, поэтому ее не стоит применять. Других ограничений для разбавления ею спирта нет. Хотя, если человек не обладает особо чувствительным вкусом, то может и не ощутить. Но некоторые любители наоборот предпочитают использовать исключительно дистиллированную воду, поскольку без дополнительных добавок водка с нею получается мягче и приятнее.
- Спирт не разводят газированной водой, нужного эффекта — вкусного приятного напитка не добиться. Углекислый газ повышает всасываемость алкоголя, раздражает стенки желудка. Для того, чтоб ускорить всасываемость алкоголя, лучше просто запивать готовую водку газированным напитком.
Наслаждение вкусом!