Пантопразол Канон, 28 шт., 20 мг, таблетки, покрытые кишечнорастворимой оболочкой
Внутрь.
Таблетку следует проглатывать целиком, не разжевывая и не разламывая, запивая небольшим количеством жидкости, перед едой, обычно перед завтраком. При двукратном приеме вторую дозу препарата рекомендуется принимать перед ужином.
Язвенная болезнь желудка и двенадцатиперстной кишки, эрозивный гастрит (в т.ч. связанные с приемом НПВС)
Рекомендуемая доза по 40–80 мг в сут. Курс лечения 2 нед при обострении язвенной болезни двенадцатиперстной кишки и 4–8 нед при обострении язвенной болезни желудка.
Противорецидивное лечение язвенной болезни желудка и двенадцатиперстной кишки — по 20 мг/сут.
Эрадикация Helicobacter pylori
В качестве тройной терапии применяют следующие комбинации:
1. Пантопразол Канон по 20–40 мг 2 раза в сут + амоксициллин по 1000 мг 2 раза в сут + кларитромицин по 500 мг 2 раза в сут. Курс лечения 7–14 дней.
2. Пантопразол Канон по 20–40 мг 2 раза в сут + метронидазол по 500 мг 2 раза в сут + кларитромицин по 500 мг 2 раза в сут. Курс лечения 7–14 дней.
3. Пантопразол Канон по 20–40 мг 2 раза в сут + амоксициллин по 1000 мг 2 раза в сут + метронидазол по 500 мг 2 раза в сут. Курс лечения 7–14 дней.
После окончания комбинированной терапии прием препарата Пантопразол Канон может быть продолжен с целью заживления язвы. При язве двенадцатиперстной кишки прием препарата Пантопразол Канон может быть продлен от 1 до 3 нед.
Пациентам с тяжелой степенью нарушения функции почек (Cl креатинина <20 мл/мин) или находящимся на гемодиализе эрадикационная терапия Helicobacter pylori
не назначается.
Лечение симптомов ГЭРБ легкой степени выраженности (таких как изжога, тошнота, кислая отрыжка)
Рекомендуемая доза препарата — 20 мг/сут. Для достижения положительной динамики в устранении симптомов может потребоваться прием препарата в течение 2–3 дней, однако для полного устранения симптомов может потребоваться прием препарата в течение 7 дней. При ухудшении состояния в течение первых 3 дней лечения рекомендуется консультация специалиста. Прием препарата следует прекратить сразу после исчезновения симптомов.
Синдром Золлингера-Эллисона
Рекомендуемая доза 40–80 мг в сут. У пациентов с выраженными нарушениями функции печени дозу следует уменьшить до 40 мг 1 раз в 2 дня. В этом случае необходимо контролировать биохимические показатели крови. При увеличении активности печеночных ферментов следует прекратить применение препарата.
Пожилые пациенты
Коррекция дозы не требуется. Тем не менее, пожилым пациентам не следует превышать суточную дозу 40 мг. Исключением является применение комбинированной антимикробной терапии в отношении Helicobacter pylori
, когда и пожилые пациенты должны применять препарат Пантопразол Канон по 40 мг 2 раза в сут.
Пациенты с почечной недостаточностью
Пациентам с тяжелой степенью нарушения функции почек (Cl креатинина <20 мл/мин) или находящимся на гемодиализе не следует превышать суточную дозу 40 мг. По этой причине эрадикационная терапия Helicobacter pylori
таким пациентам не назначается.
Не следует принимать препарат Пантопразол Канон в целях профилактики.
Эффективность и безопасность пантопразола в лечении кислотозависимых заболеваний
К кислотозависимым заболеваниям (КЗЗ) относят функциональные и органические заболевания органов пищеварения, в патогенезе которых важнейшую роль играет уровень кислотообразования в желудке. Соответственно, эффективное лечение этих заболеваний возможно лишь при значительном и длительном снижении кислотности желудочного сока.
При приеме антацидов для необходимого уровня нейтрализации соляной кислоты необходим их прием с интервалом в 2–3 часа. Быстродействующие антациды при взаимодействии с соляной кислотой образуют углекислоту, что вследствие растяжения желудка и повышения в нем давления увеличивает опасность регургитации и аспирации желудочного содержимого с возможным развитием синдрома острого повреждения легких (острого респираторного дистресс-синдрома), а также может быть причиной вторичного увеличения выделения соляной кислоты. Наряду с этим все антациды не имеют антипепсиновой активности, не снижают секрецию соляной кислоты, следовательно, не эффективны для профилактики и купирования кровотечений из стресс-язв и эрозий. Неприемлем их одновременный пероральный прием с другими препаратами из-за нарушения всасывания этих лекарственных средств [1].
Блокаторы Н2-рецепторов являются конкурентными антагонистами гистамина. Эти препараты способны значительно блокировать базальную секрецию, однако их активность в отношении стимулированной секреции намного ниже, чем у ингибиторов протонной помпы (ИПП) [1]. Кроме того, Н2-блокаторы связываются с рецептором обратимо, поэтому для обеспечения стойкого эффекта необходимо, чтобы в крови постоянно поддерживалась их значительная концентрация. Препараты блокируют только гистаминовый путь активации секреции, оставляя альтернативно способными в активации холиновые, гастриновые и др. рецепторы. После применения Н2-блокаторов о секреции, что может привести к рецидиву заболевания. При применении Н2-блокаторов развивается феномен «усталости рецепторов» (эффект тахифилаксии), что сопровождается быстрой потерей ими антисекреторной активности и требует увеличения дозы с повышением риска побочных эффектов [1–5].
У 7% госпитализированных больных при назначении Н2-блокаторов отмечаются беспокойство, дезориентация, делирий, галлюцинозы, что крайне нежелательно у больных с энцефалопатией [1]. Применение блокаторов Н2-рецепторов может привести к отрицательному хроно- и инотропному эффектам, нарушениям ритма и проводимости, вызывать лейкопению, тромбоцитопению, агранулоцитоз, панцитопению, гипоплазию и аплазию костного мозга.
Наиболее эффективными и безопасными ингибиторами секреции в настоящее время считаются ИПП, которые обеспечивают оптимальный уровень снижения секреции (рН > 4,0) и длительное сохранение достигнутого эффекта (более 18 ч) и вызывают наименьшее число нежелательных побочных явлений.
Все ИПП представляют собой 2-пиридилметилсульфонилбензимидазолы, различающиеся природой и положением заместителей, расположенных в пиридиновом и бензольном кольцах. Исключение составляет эзомепразол, который представляет собой чистый S-омепразол. Изменение положения и структуры заместителей в молекулах ИПП приводит к изменениям в пиридиновом кольце, что сказывается на значении рК (рК — это величина рН, при которой 50% соединения протонируется) азота этого кольца.
Все замещенные бензимидазолы являются слабыми основаниями, то есть они способны связывать Н+ в кислой среде. Механизм действия ИПП независимо от их структуры одинаков — соединения, образующиеся из них, в кислой среде ковалентно связываются с SH-группами альфа-субъединицы H+/К+-АТФазы за счет образования S–S-связи.
S–S-связь ковалентна; по этой причине замещенные бензимидазолы являются необратимыми ИПП. Устранение ингибирования после ковалентного связывания тетрациклического сульфенамида происходит лишь после того, как молекула протонной помпы элиминируется путем протеолиза.
Лекарственные формы ИПП покрыты кислотоустойчивой оболочкой и начинают всасываться в тонком кишечнике. Молекулы замещенных бензимидазолов не имеют заряда и гидрофобны, поэтому они довольно легко проникают через мембраны клеток. Попав в кровь, замещенные бензимидазолы быстро перераспределяются между различными тканями. При попадании в раствор, значение рН которого ниже рК азота пиридинового кольца, они протонируются, причем Н+ связывается с атомом азота пиридинового кольца. Связывание Н+ делает молекулу положительно заряженной, вследствие этого она не способна проникать через мембраны. Вследствие этого протонированные ИПП накапливаются в тех компартментах клеток, которые имеют рН ниже значения рК для данного ИПП. В клеточных канальцах рН составляет 0,8–1,0, поэтому ИПП в первую очередь накапливаются в секреторных канальцах париетальных клеток, их концентрации там может в 1000 раз превышать их концентрацию в крови.
Концентрирование ИПП в секреторных канальцах париетальных клеток является фактором обеспечения избирательности их действия и объясняет их высокую безопасность, которая является специфичным свойством, характерным для данного класса лекарственных средств, поскольку они являются предшественниками лекарства, то есть они неактивны в той форме, в которой употребляются.
Напомним, что, накапливаясь в секреторных канальцах париетальной клетки, ИПП конвертируются в сульфенамидные производные, необратимо блокируя фермент, связываясь посредством ковалентной связи в 813-й позиции с молекулами цистеина H+/K+-АТФазы. Блокада протонной помпы приводит к приостановлению синтеза соляной кислоты вне зависимости от природы и силы стимулирующих париетальную клетку факторов. Установлено, что пантопразол связывается с двумя молекулами цистеина протонной помпы (813 и 822), оказывая гораздо более интенсивное воздействие на Н+/К+-АТФазу. Цистеин 822, который глубже погружен в транспортный домен желудочного кислотного насоса, является важнейшим звеном в обеспечении устойчивости связывания и времени ингибирования протонной помпы, что ведет напрямую к блокаде продукции соляной кислоты [6]. Возможно, именно поэтому в результате более прочной связи с Н+/К+-АТФазой у человека полупериод угнетения секреции кислоты после приема пантопразола составляет около 46 часов, лансопразола — около 15 часов, омепразола и рабепразола — около 30 часов [7, 8]. Следовательно, пантопразол вызывает самое длительное угнетение секреции кислоты по сравнению с другими препаратами этого класса. Этот эффект пантопразола делает его весьма надежным средством лечения КЗЗ [1–5, 9].
В эксперименте на крысах, которым вводили различные ИПП, прекращение действия препаратов определяли по восстановлению активности протонной помпы после инкубации в течение 1 часа с такими восстановителями, как дитиотреитол или глутатион. Полная реактивация АТФазной активности после ее угнетения in vivo омепразолом, эзомепразолом и рабепразолом происходила через 1 час, на 60–70% восстанавливалась активность после ее угнетения лансопразолом. Однако за этот срок реактивации после введения пантопразола отмечено не было [9]. Возможно, это обусловлено связыванием пантопразола с цистеином 822.
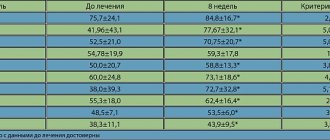
Другим эффектом, обеспечивающим длительный и выраженный антисекреторный эффект пантопразола, является достоверно (р < 0,05) наибольшая величина площади под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC) по сравнению с другими ИПП [10]. Так, для пантопразола величина данного показателя — 12,0 ± 3,5 моль/(л×ч), для рабепразола — 2,0 ± 0,8; для лансопразола — 5,0 ± 1,7; для омепразола — 1,3 ± 0,3; для эзомепразола — 5,2 ± 1,4 моль/(л×ч) соответственно. Благодаря высоким значениям AUC создается возможность ингибировать пантопразолом протонную помпу в течение дня.
В большом числе случаев больные страдают полиорганной патологией, принимают большое число часто жизненно важных препаратов. Эта ситуация существенно увеличивает потенциал для их различных взаимодействий, которые являются распространенной причиной неудачного лечения и побочных реакций препарата. Потенциальный риск нежелательного лекарственного взаимодействия при одновременном приеме двух лекарств составляет 6%, при 5 — 50%, а при 8 он достигает 100% [11].
В результате одновременного применения ИПП и ряда лекарственных средств отмечено повышение концентрации препаратов в плазме крови и снижение их выведения, в результате чего могут развиваться симптомы токсического действия медикаментозных средств, с которым взаимодействует ИПП. В то же время одновременное применение ИПП и лекарственных средств может снизить абсорбцию препарата, с которым взаимодействует ИПП, с другой стороны, в ряде случаев совместный прием может привести к повышению концентрации ИПП и возникновению побочных эффектов или передозировки ИПП [12].
Различия в метаболизме ИПП могут играть весомую роль в эффективности лечении КЗЗ. Около 98% пантопразола связывается с белками плазмы крови. Значительное количество его метаболизируется в печени. Однако по сравнению с другими ИПП аффинитет пантопразола к метаболизирующей системе цитохрома Р450 очень низкий [13]. Метаболизм ИПП происходит в печени при участии двух изоформ цитохрома Р450 — CYP2С19 и CYP3А. Большая часть омепразола метаболизируется посредством фермента CYP2C19, а меньшая (около 10%) через CYP3A4 [14]. У последующих генераций ИПП эта зависимость также сохраняется, но выражена меньше, так, например, у рабепразола имеется неферментативный путь. Пантопразол метаболизируется в основном CYP2C19 (подсемейство цитохрома Р450) и меньшей степени CYP 3А4, 2D6 и 2С9. В ряде проведенных на людях исследований было показано отсутствие фармакокинетического или фармакодинамического взаимодействия пантопразола и медикаментов, метаболизирующихся в основном CYP2C19, CYP2C9, CYP3А, CYP3А4 или другими изоферментами CYP [1–3, 15]. Соответственно, способность пантопразола взаимодействовать с другими одновременно введенными препаратами очень мала из-за его низкого аффинитета к метаболизирующему изоферменту цитохрома Р450 [13], что выгодно отличает данный ИПП от других препаратов этой группы (табл.). Так, лекарственные взаимодействия с пантопразолом не были выявлены в ходе более 50 исследований [15].
При удвоении дозы ИПП, имеющих нелинейную фармакокинетику, их концентрация в сыворотке крови непредсказуема. Это может привести к неадекватному контролю секреции кислоты или оказать влияние на безопасность использования препарата. Применение пантопразола, обладающего линейной фармакокинетикой, дает возможность оптимального лечения, которое соответствует тяжести заболевания и общему состоянию больного. Препарат не требует коррекции дозы у пожилых лиц, при печеночной и почечной недостаточности, в отличие от омепразола и эзомепразола не аккумулируется в организме после приема повторных доз. Пантопразол имеет лекарственную форму для парентерального введения [1–3].
Вероятно, именно эти свойства пантопразола и определили большую клиническую эффективность и безопасность данного ИПП в ряде исследований, проведенных с позиций доказательной медицины. В мультицентровом, рандомизированном, двойном слепом исследовании сравнивали эффективность лечения пантопразолом (40 мг/сут) и эзомепразолом (40 мг/сут) у 247 больных с разной степенью (от умеренной до тяжелой) выраженности желудочно-пищеводного рефлюкса. После 4 недель приема ослабление выраженности симптомов было сопоставимым для обоих препаратов, однако при лечении пантопразолом оно наступало значительно раньше (3,7 против 5,9 дня; p = 0,034) [16].
У больных с разной степенью (от умеренной до тяжелой) выраженности ГЭРБ было показано, что при лечении пантопразолом в дозе 40 мг/сут достигается очень высокий уровень излечения — более 70% больных через 4 недели и более 90% больных через 8 недель [17]. Следует отметить, что сопоставимые результаты были получены при лечении таких больных пантопразолом (40 мг/сут) и эзомепразолом (40 мг/сут).
Крайне интересными представляются результаты недавних исследований, посвященных эффективности использования пантопразола для коррекции внепищеводных проявлений ГЭРБ. В проспективном открытом многонациональном, многоцентровом исследовании, включившем 1888 пациентов с гастроэзофагеальной рефлюксной болезнью (ГЭРБ), выявлялись признаки синдрома раздраженного кишечника. На фоне лечения пантопразолом в дозе 40 мг в сутки в течение 8 недель отмечено выраженное и достоверное уменьшение степени проявлений не только ГЭРБ, но и синдрома раздраженного кишечника [18]. В открытом проспективном исследовании 33 пациента с ГЭРБ и проявлениями хронического фарингита и ларингита получали 80 мг/сут пантопразола ежедневно в течение 8 недель. Отмечено достоверное уменьшение продолжительности дистального закисления пищевода (19,4% против 7,2%), общего количества рефлюксов (62,7 против 28,4) и числа рефлюксов длительностью более 5 мин (10,4 против 3,9, p для всех случаев < 0,0001), исчезновение симптомов хронического фарингита и ларингита выявлено в 51,5% случаев [19]. Синдром ночного апноэ является грозным внепищеводным проявлением ГЭРБ, являясь в ряде случаев причиной фатальных и нефатальных кардиальных событий. Описаны результаты проспективного исследования, включившего 199 пациентов с ночным нарушением сна на фоне ГЭРБ. Назначение пантопразола способствовало не только значительному облегчению течения ГЭРБ, но и улучшению клинических и полисомнографических показателей сна у 78% пациентов [20].
Клинические исследования, выполненные с высоким уровнем доказательства, в том числе в нескольких метаанализах, показали, что эрадикационная терапия инфекции Helicobacter pylori препятствует повторному возникновению H. pylori-ассоциированной язвенной болезни (ЯБ) желудка и/или двенадцатиперстной кишки и уменьшает риск возникновения таких осложнений, как кровотечения [4, 5]. Ни одна из имеющихся схем антихеликобактерной терапии не приводит к 100-процентной эрадикации, большинство из них дают побочные эффекты. Консенсусом «Маастрихт-4» было подтверждено уменьшение эффективности тройной схемы эрадикационной терапии за последние 13 лет (с 1995 по 2008 гг.) с 90,6% до 74,8%.
Актуальной задачей на сегодняшний день представляется поиск более действенных режимов терапии инфекции H. pylori, зачастую именно выбор того или иного ИПП имеет значение для практического применения.
На нашей кафедре проведено исследование, в которое были включены 105 пациентов с ЯБ двенадцатиперстной кишки, ассоциированной с H. pylori, рандомизированные на две группы. В 1-й группе 35 пациентам были назначены пантопразол, амоксициллин, кларитромицин в стандартных дозировках в течение 7 дней. Во 2-й группе 70 пациентам были назначены омепразол, амоксициллин, кларитромицин в стандартных дозировках в течение 7 дней. В группе пантопрозола у 29 (82,9%) из 35 пациентов в контрольные сроки была достигнута эрадикация инфекции H. pylori. Тем самым превзойден минимально допустимый уровень эффективности антихеликобактерной терапии в 80% случаев. В группе омепразола частота эрадикации была значительно и достоверно ниже (47 из 70 пациентов, что составило 67,1%, p < 0,05) [4, 5].
В настоящее время большой интерес представляет последовательная терапия. Недавно проведено проспективное, контролируемое исследование, включившее 409 пациентов с инфекцией H. pylori. Первая группа получала 10-дневную последовательную терапию, включавшую прием пантопразола в дозе 40 мг в сутки и амоксициллина в дозе 1000 мг дважды в сутки в течение 5 дней с последующим приемом пантопразола, кларитромицина 500 мг и метронидазола дважды в сутки в течение последующих 5 дней. Во второй группе использовалась тройная терапия первой линии, включавшая пантопразол в дозе 40 мг в сутки, амоксициллин 1000 мг и кларитромицин 500 мг дважды в сутки в течение 14 дней. Отмечено существенное преобладание успешной эрадикационной терапии при использовании последовательной схемы. Показатель intention to treat был 85,9% (176/205) и 75,0% (153/205) соответственно (p = 0,006). Показатель per protocol равнялся 92,6% (175/205) и 85% (153/204) соответственно (p = 0,019) при отсутствии разницы частоты нежелательных побочных эффектов (18,9% и 13,3% соответственно, p = 0,143) [21]. Обращает на себя внимание, что применение пантопразола в стандартной тройной схеме также позволило превысить минимально допустимый уровень эффективности антихеликобактерной терапии при анализе per protocol.
Известно, что смертность, ассоциированная с осложнениями стресс-язв, высока, что требует проведения экстренных мероприятий для их профилактики и купирования. Причем сочетание выраженного и длительного антисекреторного действия с низким уровнем взаимодействия с другими лекарственными средствами, отсутствие кумулятивного эффекта, наличие лекарственной формы для парентерального введения позволяют использовать препарат в комплексе средств профилактики стресс-язв и кровотечений из них, способствуют их рубцеванию, улучшая выживаемость пациентов [2, 3, 22]. Так, после внутривенного введения пантопразол начинает действовать через 15 минут, причем введение 80 мг подавляет секрецию на 86% через 60 минут [23].
Соответственно вышеперечисленные качества делают лекарственную форму пантопразола для парентерального введения препаратом выбора для использования в комплексе средств профилактики язвенных кровотечений. В данном контексте мы хотим упомянуть два исследования, опубликованные в 2012 и 2010 гг., посвященные эффекту внутривенного введения различных доз пантопразола больным после эндоскопического гемостаза по поводу язвенного кровотечения. В ретроспективном исследовании «случай-контроль», включившем 413 пациентов, показано, что внутривенное введение пантопразола в невысоких дозах столь же эффективно для профилактики повторных кровотечений, как и использование высоких доз [24]. В рандомизированном контролируемом исследовании, включавшем 120 пациентов, показан близкий высокий профилактический эффект внутривенного введения пантопразола в дозе 192 мг и 40 мг 4 раза в сутки в течение 3 дней [25]. Подобный «парадокс», вероятно, связан с высокой эффективностью препарата в обычных дозах.
В ретроспективном и наблюдательном исследовании, включавшем 807 пациентов, перенесших язвенное кровотечение, отмечен одинаковый профилактический потенциал внутривенного введения пантопразола и омепразола в отношении повторного кровотечения. Однако использование пантопразола имело лучшие фармакоэкономические показатели [26].
Наблюдение за 164 пациентами, перенесшими кровотечение из верхних отделов пищеварительного тракта, не связанное с варикозным расширением вен пищевода, позволило сделать вывод, что эндоскопическое лечение в сочетании с внутривенным введением пантопразола 80 мг болюсом с последующим капельным введением со скоростью 8 мг в сутки в течение 3 дней имеет существенно более выраженный эффект, чем сочетание эндоскопического лечения и внутривенного введения омепразола в той же дозе. Так, повторное кровотечение было у 3,7% в группе пантопразола и у 10,2% в группе омепразола (р = 0,022), переливание крови проводилось в 25% и 50% случаев (p < 0,001), продолжительность пребывания в стационаре была 4,6 ± 1,2 и 7,1 ± 0,8 дней соответственно (p < 0,001). В хирургическом лечении по поводу неконтролируемого кровотечения нуждался 1 пациент из 81 и 4 из 83, летальный исход был в 1 и 2 случаях соответственно [27].
На наш взгляд, уместным было упомянуть о ряде исследований последних лет, подтверждающих описанные выше данные о высокой безопасности препарата, его низком метаболическом взаимодействии с другими лекарственными веществами.
В пилотном исследовании, выполненном по протоколу перекрестного, двойного слепого, рандомизированного, плацебо-контролируемого исследования 10 пациентов, находившихся на гемодиализе, получали пантопразол в дозе 40 мг в сутки или плацебо в течение 6 недель. У пациентов, получавших пантопразол, уровни в плазме фосфатов, кальция, гидрокарбонатов и паратгормона не отличались от таковых у пациентов, которым давалось плацебо [27], однако малое число больных в выборке не позволяет делать однозначных выводов.
Одним из важнейших компонентов первичной, вторичной и третичной профилактики в кардиологии и кардиохирургии является постоянный прием антитромботических средств. В то же время ряд ИПП могут ухудшать антитромботический эффект данных препаратов. Так, омепразол может значительно снижать ингибирующий эффект клопидогреля на рецепторы тромбоцитов P2Y12, увеличивая число пациентов, резистентных к клопидогрелю [28].
Безопасность сочетания антитромботических препаратов и пантопразола доказана при наблюдении за здоровыми волонтерами и кардиологическими больными. В проспективном, рандомизированном перекрестном исследовании, включившем 20 здоровых волонтеров, доза пантопразола составляла 80 мг в сутки, клопидогреля — 600 мг в качестве однократной нагрузочной дозы, затем 75 мг в сутки. Причем пантопразол, используемый в высоких дозах, совершенно не изменял фармакодинамические эффекты клопидогреля [28].
Продолжением вышеописанной работы явилось рандомизированное перекрестное исследование, включившее 34 пациента, перенесших за месяц до начала наблюдения острый инфаркт миокарда. После месяца «отмывки» больные получали в течение месяца 40 мг омепразола или пантопразола, после месяца «отмывки» — ИПП назначались в перекрестном дизайне. Наблюдалось значительное снижение эффекта клопидогреля на фоне приема омепразола, единицы реакции P2Y12 (PRU) увеличились с 202 ± 52 до 235 ± 58 (p < 0,001). На фоне приема пантопразола эффективность клопидогреля сохранялась (PRU = 215 ± 54, р = 0,16). В период без ИПП 26% пациентов были резистентны к клопидогрелю (PRU > 240), на фоне приема омепразола величина показателя у них увеличилась на 45% против 23% на фоне употребления пантопразола. Был сделан вывод, что, в отличие от омепразола, пантопразол не вступает в лекарственные взаимодействия с клопидогрелем [29].
В завершение темы необходимо упомянуть сравнительное исследование, включившее 44 пациента со стабильной стенокардией после чрескожной имплантации стентов, получавших стандартную двойную терапию Аспирином и клопидогрелем. 23 пациента наряду со стандартной терапией получали 20 мг пантопразола в течение месяца. 21 больному назначалась только стандартная двойная антитромботическая терапия. Функция тромбоцитов оценивалась с помощью импедансной агрегометрии. Анализ полученных данных вывил совершенное отсутствие влияния пантопразола на эффект антитромботической терапии [30].
В рандомизированном двойном слепом перекрестном исследовании изучалось взаимодействие однократно введенного внутривенно диазепама на фоне 11-дневного приема 40 мг/сут эзомепразола или пантопразола у здоровых. У лиц, получавших эзомепразол, величины AUC, Сmax и t1/2 диазепама были выше на 28,0%, 31,4% и 41,1% соответственно, по сравнению с принимавшими пантопразол. Фармакодинамические параметры, определенные окулодинамическим исследованием, в группе эзомепразола были значительно и достоверно хуже по сравнению с группой пантопразола. Авторы сделали вывод о возможности нежелательного взаимодействия эзомепразола и дилтиазема и высоком профиле безопасности пантопразола [31].
Вышеперечисленные данные позволяют нам сделать ряд выводов. Пантопразол является высокоэффективным и безопасным средством лечения кислотозависимых заболеваний. Длительный и выраженный антисекреторный эффект, наряду с обеспечением выраженного клинического эффекта, позволяет избежать такого «минуса», как ночной кислотный прорыв, или резкого повышения продукции соляной кислоты у забывчивых пациентов (пропуск планового приема препарата). Данный препарат можно расценивать как средство выбора у больных, получающих одновременно несколько препаратов, тяжелых больных, особенно при невозможности перорального приема лекарств, у пациентов с печеночной и почечной недостаточностью, пожилых лиц, для профилактики и купирования стресс-язв, язвенных кровотечений. Данный препарат не ухудшает антитромботический эффект у кардиологических больных, перенесших кардиохирургические вмешательства. Доказана высокая эффективность препарата для купирования не только пищеводных, но и внепищеводных проявлений ГЭРБ.
Литература
- Антоненко О. М. Место ингибиторов протонной помпы в профилактике стрессовых повреждений желудочно-кишечного тракта у больных в критических состояниях // Consillium medicum. 2009, № 1.
- Яковенко Э. П., Левчук А. Л., Яковенко А. В. и др. Стрессовые язвы: профилактика и лечение // Фарматека. 2009, № 2, с. 40–43.
- Яковенко Э. П., Яковенко А. В., Илларионова и др. Пантопразол в терапии кислотозависимых заболеваний // Фарматека. 2012, № 2, с. 45–50.
- Маев И. В., Кучерявый Ю. А., Оганесян Т. С. Пантопразол: значение и место в терапии кислотозависимых заболеваний // РМЖ. 2010, т. 18, № 28 (392), с. 1749–1753.
- Маев И. В., Оганесян Т. С., Кучерявый Ю. А. Сравнительная эффективность тройной антихеликобактерной терапии первой линии при использовании препаратов пантопразола и омепразола // Лечащий Врач. 2010; 2: 92–95.
- Modlin I. & Sachs G. Acid Related Diseases, Schnetztor-Verlag GmbH, Konstanz, 1998.
- Gedda K., Besancon M., Lorentzon P., Sachs G. Turnover of the gastric H+, K (+)-adenosine triphosphatase alpha subunit and its effect on inhibition of rat gastric acid secretion // Gastroenterology. 1995. Vol. 109, p. 1134–1141.
- Katashima M., Yamamoto K., Tokuma Y. et al. Comparative pharmacokinetic/pharmacodynamic analysis of proton pump inhibitors omeprazole, lansoprazole and pantoprazole, in humans // Eur. J. Drug Metab. Pharmacokinet. 1998. Vol. 23 (1), p. 19–26.
- Sachs G., Shin J. M., Pratha V., Hogan D. Synthesis or rupture: duration of acid inhibition by proton pump inhibitors // Drugs Today (Barc). 2003. Vol. 39, Suppl A, p. 11–14.
- Wolfe M. M., Welage L. S., Sachs G. Proton pump inhibitors and gastric acid secretion. Am J Gastroenterol // 2001. Vol. 96 (12), p. 3467–3468.
- Johnson A. G., Seidemann P., Day R. O. NSAID-related adverse drug interactions with clinical relevance. An update // Int. J. Clin. Pharmacol. Ther. 1994, Oct; 32 (10): 509–532.
- Фарбер А. В., Никонов Е. Л. Применение ингибиторов пртонного насоса off label // Фарматека. 2010, № 2, с. 94–99.
- Maton P., Burton M. Clinician’s Manual on Drug Interactions in Gastroenterology, Life Science Communication, 1996.
- Giannini E. G., Savarino V., Testa R. Monitoring cytochrome P–450 activity during rabeprazole treatment in patients with gastresophageal reflux disease // Dig. Dis. Sci. 2006. Vol. 51, p. 1602–1609.
- Blume H., Donath F., Warnke A., Schug B. S. Pharmacokinetic drug interaction profiles of proton pump inhibitors // Drug Safety. 2006. Vol. 29 (9), p. 769–784.
- Scholten T., Gatz G., Hole U. Once-daily pantoprazole 40 mg and esomeprazole 40 mg have equivalent overall efficacy in relieving GERD-related symptoms // Aliment Pharmacol Ther. 2003, Sep 15; 18 (6): 587–594.
- Bardhan K. D. Pantoprazole: a new proton pump inhibitor in the management of upper gastrointestinal disease // Drugs Today (Barc). 1999. Vol. 35 (10), p. 773–808.
- Monnikes H., Heading R. C., Schmittand H., Doerfler H. Influence of irritable bowel syndrome on treatment outcome in gastroesophageal reflux disease // World J. Gastroenterol. 2011. Vol. 17 (27), p. 3235–3241.
- Karoui S., Bibani N., Sahtout S. Effect of pantoprazole in patients with chronic laryngitis and pharyngitis related to gastroesophageal reflux disease: clinical, proximal, and distal pH monitoring results // Dis. Esophagus. 2010. Vol. 23 (4), p. 290–295.
- Modolell I., Esteller E., Segarra F., Mearin F. Proton-pump inhibitors in sleep-related breathing disorders: clinical response and predictive factors // Eur J Gastroenterol. Hepatol. 2011. Vol. 23 (10), p. 852–858.
- Kim Y. S., Kim S. J., Yoon J. H. Randomised clinical trial: the efficacy of a 10-ay sequential therapy vs. a 14-ay standard proton pump inhibitor-based triple therapy for Helicobacter pylori in Korea // Aliment Pharmacol Ther. 2011. Vol. 34 (9), p. 1098–1105.
- Золотовская Н. Б., Лейдерман И. Н. Профилактика стрессовых гастроинтестинальных кровотечений у пациентов с острым некротизирующим панкреатитом // Анестезиология и реаниматология. 2011. № 6, с. 74–78.
- Simon B., Muller P., Bliesath H. et al. Single intravenous administration of the H+, K (+)-ATPase inhibitor BY 1023/SK&F 96022— inhibition of pentagastrin-stimulated gastric acid secretion and pharmacokinetics in man // Aliment. Pharmacol. Ther. 1990. Vol. 4 (3), p. 239–245.
- Liang C. M., Lee J. H. Kuo Y. H. et al. Intravenous non-high-dose pantoprazole is equally effective as high-dose pantoprazole in preventing rebleeding among low risk patients with a bleeding peptic ulcer after initial endoscopic hemostasis // BMC Gastroenterol. 2012. Vol. 28, p. 12: 28.
- Hsu Y.-C., Perng C.-L., Yang T.-H. et al. A randomized controlled trial comparing two different dosages of infusional pantoprazole in peptic ulcer bleeding // Br. J. Clin. Pharmacol. 2010. Vol. 69 (3), p. 245–251.
- Serrano A. G., Colomino I. I., Franch E. S. et al. Prevalence of rebleeding from peptic ulcer in patients treated with proton pump inhibitors // Med. Clin. (Barc). 2010. Vol. 134 (13), p. 577–582.
- Chahin N. J., Meli M., Zaca F. Endoscopic injection plus continuous intravenous pantoprazole vs endoscopic injection plus continuous intravenous omeprazole for treatment of upper nonvariceal bleeding // Can. J. Gastroenterol. 2006. Vol. 20, Suppl A: 112.
- Lai B., Cervelli M. J. Effect of gastric acid suppression with pantoprazole on the efficacy of sevelamer hydrochloride as a phosphate binder in haemodialysis patients: a pilot study // Nephrology (Carlton). 2012. Vol. 17 (4), p. 402–406.
- Fontes-Carvalho R., Albuquerque F. Clopidogrel — proton pump inhibitors drug interaction: implications to clinical practice // Rev. Port. Cardiol. 2010. Vol. 29 (10), p. 1555–1567.
- Fontes-Carvalho R., Albuquerque A., Araujo C. et al. Omeprazole, but not pantoprazole, reduces the antiplatelet effect of clopidogrel: a randomized clinical crossover trial in patients after myocardial infarction evaluating the clopidogrel-PPIs drug interaction // Eur J Gastroenterol Hepatol. 2011. Vol. 23 (5), p. 396–404.
- Mizia-Stec K., Haberka M., Mizia M. et al. Effects of pantoprazole on dual antiplatelet therapy in stable angina pectoris patients after percutaneous coronary intervention // Pharmacol. Rep. 2012. Vol. 64 (2), p. 360–368.
- Drewelow B., Schaffler K., Reitmeir P., Bethke T. D. Effects of multiple-dose esomeprazole and pantoprazole on diazepam pharmacokinetic profile and pharmacodynamic effects on cognitive and psychomotor function in healthy volunteers // Arzneimittelforschung. 2010. Vol. 60 (8), p. 483–491.
А. Н. Казюлин, доктор медицинских наук, профессор, академик РАЕН И. Е. Калягин, кандидат медицинских наук
ГБОУ ВПО МГМСУ Минздравсоцразвития России, Москва
Контактная информация об авторах для переписки
Пантопразол: достойный среди сильнейших
Пять основных ИПП в практике врача – это омепразол, эзомепразол, рабепразол, лансопразол и пантопразол. ИПП различаются по скорости наступления и продолжительности антисекреторного действия, особенностям метаболизма, форме выпуска (в капсулах, таблетках, покрытых энтеросолюбильной оболочкой – МАПС (Multiple Unit Pellet System)), в виде раствора для внутривенного введения) [2]. После приема внутрь ИПП высвобождаются и всасываются в тонкой кишке. Действующее вещество накапливается в зонах с наиболее низкими значениями рН; в области секреторных канальцев париетальных клеток, где рН=1÷2, концентрация ИПП почти в 1000 раз превышает таковую в крови. В этих условиях происходит протонирование ИПП, и они превращаются в активную форму – сульфенамид. Последний необратимо связывается с цистеиновым остатком Н+/К+–АТФазы (протонной помпы) и блокирует ее функцию. Это сопровождается подавлением базальной и стимулированной секреции соляной кислоты (независимо от природы раздражителя). Кислотопродукция восстанавливается по мере встраивания вновь синтезированных молекул Н+/К+–АТФазы в мембрану париетальных клеток. Диапазон рН, при котором происходит активация ИПП, обусловлен особенностями их молекулы. Скорость активации пантопразола при повышении рН до 3 падает вдвое и практически прекращается при рН=4. Активация других ИПП продолжается при более высоком рН: так, скорость образования сульфенамида изомепразола, эзомепразола и лансопразола снижается в 2 раза при рН=4, рабепразола – при рН=4,9. Эта особенность позволяет рассматривать пантопразол как препарат, селективный для париетальных клеток желудка, в области которых рН достигает наиболее низких значений. Фармакодинамика пантопразола не предполагает возможности блокады Н+/К+–АТФаз и Н+/Na+–АТФаз клеток других типов – билиарного эпителия, гематоэнцефалического барьера, кишечного эпителия, почечных канальцев, эпителия роговицы, мышц, иммунокомпетентных клеток, остеокластов, а также влияния на органеллы с кислой средой – лизосомы, нейросекреторные гранулы и эндосомы, где рН=4,5–5,0. Избирательность действия предполагает меньшую вероятность нежелательных явлений, особенно при длительном применении [1,2]. ИПП метаболизируются в микросомах печени с участием субъединиц цитохрома Р450 – CYP2C9, CYP2C19, CYP2D6 и CYP3A4. При этом они в разной степени угнетают окислительную активность ферментов CYP. Наибольшее значение имеет их взаимодействие с CYP2C19 и CYP3A4. По результатам исследований in vitro, среди пяти наиболее часто применяющихся ИПП пантопразол в наименьшей степени подавляет CYP2C19 и в наибольшей степени – CYP3A4. По выраженности угнетения функции CYP2C19 за лансопразолом следуют омепразол, эзомепразол, рабепразол и пантопразол; по силе влияния на CYP3A4 за пантопразолом следуют омепразол, эзомепразол, рабепразол, лансопразол [1,2,3]. Ген CYP2C19 отличается полиморфностью, что оказывает влияние на терапевтический эффект ИПП. CYP2C19 участвует в метаболизме значительного количества лекарственных препаратов, поэтому большое практическое значение придают влиянию ИПП именно на эту субъединицу цитохрома Р450. Пантопразол обладает наименьшим потенциалом взаимодействия с лекарствами, детоксикация которых протекает с участием CYP2C19. CYP3A4 также играет важную роль в метаболизме лекарств; ее активность существенно варьирует. Эта субъединица цитохрома Р450 экспрессируется также на апикальной мембране кишечного эпителия, что может существенно влиять на биодоступность лекарств, внося свой вклад в «эффект первого прохождения». Вообще среди вышеперечисленных ИПП пантопразол имеет самую низкую аффинность к системе цитохрома Р450, поскольку сразу после I фазы детоксикации с участием CYP2C19 и CYP3A4 он вступает во 2–ю фазу – образование сульфата, протекающую в цитозоле и резко снижающую реактогенность молекулы. В исследованиях с участием здоровых добровольцев и пациентов с различной патологией не выявлено значимых взаимодействий между пантопразолом и антацидами, дигоксином, диазепамом, диклофенаком, этанолом, фенитоином, глибенкламидом, карбамазепином, кофеином, метопрололом, напроксеном, нифедипином, пироксикамом, теофиллином, пероральными контрацептивами, R–варфарином, кларитромицином, циклоспорином, такролимусом, натрия левотироксином [1,2,3]. При одновременном приеме пантопразола и кумариновых антикоагулянтов необходим более внимательный контроль МНО. Взаимодействие пантопразола с метотрексатом изучено недостаточно [3]. Пантопразол представлен на российском рынке препаратом Нольпаза® (компания KRKA, Словения) в форме таблеток, покрытых энтеросолюбильной оболочкой. Они малы по размеру и удобны в употреблении. Фармакокинетика пантопразола характеризуется быстрым всасыванием из желудочно–кишечного тракта; биодоступность при приеме внутрь составляет 77% и не зависит от приема пищи. Время достижения максимальной концентрации препарата в плазме (Cmax) при приеме внутрь составляет 2–2,5 ч. При регулярном приеме пантопразола значение Cmax сохраняется постоянным. Показатель площади под фармакокинетической кривой «концентрация–время» (AUC) и Cmax также не зависит от приема пищи. AUC отражает количество препарата, достигшее мишени действия – молекул протонной помпы, и коррелирует с выраженностью антисекреторного эффекта. Для пантопразола AUC составляет 9,93 ммоль/л.ч, что сопоставимо с AUC для 40 мг эзомепразола. Существует форма для внутривенного введения пантопразола. Пантопразол на 98% связывается белками плазмы. Период полувыведения (T1/2) составляет 1 ч. 80% метаболитов выводится почками, 20% – с желчью. При хронической почечной недостаточности (в том числе у пациентов, находящихся на гемодиализе) не требуется изменения доз препарата. При тяжелых заболеваниях печени T1/2 увеличивается до 3–6 ч, AUC возрастает в 3–5 раз, Cmax – в 1,3 раза по сравнению со здоровыми лицами, в связи с чем рекомендуется суточная доза пантопразола, не превышающая 20 мг. У пациентов пожилого возраста отмечается некоторое увеличение AUC и Cmax, которое не имеет клинического значения [4]. Помимо узкого диапазона рН, при котором наблюдается активация препарата, отличием пантопразола от других ИПП является более длительное связывание с протонной помпой вследствие образования ковалентной связи с дополнительным цистеиновым остатком (Цис 822). Как результат – период полувыведения препарата не коррелирует с продолжительностью антисекреторного эффекта, и после прекращения приема пантопразола желудочная секреция восстанавливается спустя 46 ч. Полагаем необходимым привести данные об эффективности и безопасности пантопразола по материалам исследований и обзоров самых последних лет. Эффективность пантопразола при ГЭРБ. ИПП прочно зарекомендовали себя как препараты первой линии в лечении ГЭРБ умеренно тяжелого и тяжелого течения. Эти препараты уменьшают объем желудочной секреции, повышают рН желудочного содержимого, препятствуя повреждению пищевода соляной кислотой, компонентами желчи и пищеварительными ферментами. Рекомендуемая доза пантопразола при рефлюксной болезни, в зависимости от выраженности эзофагита и чувствительности к лечению, составляет 20–80 мг в сутки (в один или два приема). Доза 20 мг чаще назначается при более легких формах ГЭРБ. Доза 40 мг в лечении умеренно выраженного и тяжелого рефлюкс–эзофагита сопоставима по эффективности с омепразолом, лансопразолом, эзомепразолом [9]. Поддерживающее лечение пантопразолом в дозе 20–40 мг в сутки продолжительностью до двух лет предотвращает рецидивы рефлюкс–эзофагита у подавляющего большинства больных [9]. Можно рекомендовать и прием 20–40 мг пантопразола «по требованию» – при возникновении изжоги и срыгивания [26]. В работе Scholten и соавт. показано, что применение «по требованию» пантопразола в дозе 20 мг или эзомепразола в дозе 20 мг одинаково эффективно в качестве длительного поддерживающего лечения неэрозивной ГЭРБ и стадий эзофагита А–В по Лос–Анджелесской классификации. На фоне приема пантопразола выраженность изжоги была меньше [27]. Пантопразол в дозе 40 мг обеспечивает достаточный контроль симптомов ночного рефлюкса и в этом отношении сопоставим с эзомепразолом [23]. В обзоре Lehmann FS. и Beglinger C. и других работах последних лет представлены данные о высокой эффективности пантопразола в лечении различных форм ГЭРБ и хорошей переносимости препарата [12,20,22,23,26]. На фоне лечения этим препаратом уменьшается частота осложнений и улучшается качество жизни больных рефлюксной болезнью [26]. Эффективность пантопразола зависит от генетически детерминированной активности CYP2C19 – S–мефенитоин 4’–гидроксилазы. В работе Sheu B.S. и соавт. 240 пациентов с рефлюкс–эзофагитом стадий С и D по Лос–Анджелесской классификации получали пантопразол в дозе 40 мг в сутки в течение полугода. Тем больным, у которых удалось достичь полного заживления эрозий и разрешения симптомов рефлюкса (n=200), было рекомендовано продолжить лечение пантопразолом 40 мг «по требованию» в течение года. Исходя из генотипа CYP2C19 выделяли «быстрых», «промежуточных» и «медленных метаболизаторов». Эффективность терапии «по требованию» оказалась выше у «медленных метаболизаторов»: они принимали в среднем 11,5 таблетки в месяц (против 16,3 у «промежуточных» и 18,6 у «быстрых метаболизаторов», р<0,05) [28]. У пациентов с избыточной массой тела назначение пантопразола в «двойной дозе» – по 40 мг 2 раза в сутки улучшает результаты лечения рефлюкс–эзофагита и позволяет быстрее перейти на режим приема «по требованию». Эффективность наращивания дозы особенно заметна у «быстрых метаболизаторов» [10]. В двух рандомизированных двойных слепых исследованиях оценивали скорость наступления клинического эффекта – облегчения симптомов неэрозивной рефлюксной болезни и рефлюкс–эзофагита 1 стадии по Savary–Miller – на фоне лечения пантопразолом в низкой дозе (20 мг в сутки) или блокаторами гистаминовых рецепторов 2 типа второго поколения (низатидином 150 мг 2 раза в сутки и ранитидином 150 мг 2 раза в сутки). Исследования проводились в параллельных группах, выраженность симптомов оценивалась по 4–балльной шкале. На фоне лечения пантопразолом значительно большая доля пациентов отмечала исчезновение изжоги уже на второй день лечения (39% против 14,5% в группе получавших низатидин, р<0,01). Достоверная разница в пропорции пациентов, которых изжога перестала беспокоить, сохранялась в течение первой недели, а затем препараты показали равную эффективность [14]. ГЭРБ нередко сопутствуют расстройства сна. В когортном исследовании изучалось влияние пантопразола на самочувствие пациентов с симптомами рефлюксной болезни и обструктивным апноэ во сне. Пациенты получали 40 мг пантопразола в сутки в течение 3 месяцев. На фоне терапии отмечено существенное улучшение состояния: уменьшение сонливости в дневное время (р=0,002), эпизодов пробуждения от симптомов рефлюкса (р<0,0001), выраженности храпа (р=0,03) [29]. В другой работе у 84% пациентов с ГЭРБ, не страдавших избыточной массой тела, зарегистрированы расстройства сна: симптомы рефлюкса в положении на спине и в утренние часы, трудность засыпания, прерывистый сон, утренняя слабость. На фоне лечения пантопразолом в течение в среднем 1,4 месяца у 75% обследованных существенно улучшилось качество сна; у подавляющего большинства исчезли симптомы рефлюкса в ночное время [18]. Modolell I. и соавт., помимо оценки клинических признаков нарушения сна у подобных больных (храпа, апноэ, сонливости), проводили полисомнографическое исследование. Клинический и полисомнографический эффект на фоне приема пантопразола подтвержден у 78% больных [20]. Пантопразол нашел применение и в анестезиологии. Одно из наиболее опасных осложнений общей анестезии – аспирация желудочного сока; pH содержимого желудка 2,5 и его объем 25 мл (0,4 мл/кг массы тела) перед хирургическим вмешательством рассматриваются как показатели высокого риска. В двойном слепом исследовании показано, что пантопразол в дозе 40 мг существенно более эффективен, чем прокинетик эритромицин в дозе 250 мг, в снижении риска аспирационных осложнений (при однократном приеме, как минимум, за 1 час до анестезии) [8]. Вопрос об эффективности и безопасности ИПП у детей остается недостаточно изученным (накоплено недостаточно доказательных данных). Поэтому в инструкции к назначению пантопразола среди противопоказаний может фигурировать детский возраст [31]. Однако в педиатрии этому препарату посвящены некоторые исследования. При изучении фармакокинетики и безопасности пантопразола в суточной дозе 20–40 мг у детей 6–16 лет, страдающих ГЭРБ, не получено данных в пользу кумуляции пантопразола и не зафиксировано серьезных нежелательных явлений [32]. В двух работах изучались эффективность и безопасность различных доз препарата в лечении ГЭРБ у детей в возрасте от 1 месяца до 5 лет, включая недоношенных. Показана хорошая переносимость пантопразола, купирование симптомов и заживление эрозивных изменений пищевода к 8–й неделе лечения. Частота нежелательных явлений не нарастала с повышением дозы [17, 30]. Пантопразол в лечении язвенной болезни, функциональной диспепсии, лекарственной гастропатии. При язвенной болезни желудка и 12–перстной кишки пантопразол применяется в дозе 40 мг 1–2 раза в сутки. В составе эрадикационной терапии (как правило, в комбинации с метронидазолом, кларитромицином или амоксициллином), без предварительного исследования устойчивости к антибиотикам, пантопразол в дозе по 40 мг 2 раза в сутки обеспечивает частоту эрадикации Helicobacter pylori 71–93,8% (анализ intent–to–treat). Тройная схема эрадикации с пантопразолом не уступает по эффективности таковой, включающей омепразол или лансопразол [9]. В малазийском исследовании оценивали частоту эрадикации, переносимость и приверженность пациентов к тройной антихеликобактерной терапии с пантопразолом. Среди участников были 26 пациентов с язвенной болезнью и 165 – с неязвенной диспепсией, инфицированных H. pylori. Больные в течение 7 дней получали стандартную тройную антихеликобактерную терапию с пантопразолом по 40 мг 2 раза в сутки. Эффективность эрадикации оценивали с помощью дыхательного уреазного теста. Лечение по протоколу завершили 84,4% больных, частота эрадикации составила 71,2%. В период лечения нежелательные явления зафиксированы у 68 (42,5%) участников: диспепсия, жидкий стул, головокружение, кожная сыпь. Ни в одном случае нежелательное явление не было заявлено как серьезное. Авторы делают вывод об очень хорошей переносимости тройной эрадикационной схемы с пантопразолом [25]. Пантопразол в суточной дозе 20 мг внутрь эффективен в профилактике гастропатии, ассоциированной с приемом нестероидных противовоспалительных препаратов (НПВП) [9]. Для лечения лекарственных эрозивно–язвенных поражений желудка и 12–перстной кишки пантопразол назначают по 40 мг 1–2 раза в сутки. В двойном слепом плацебо–контролируемом исследовании с общим числом участников 800 изучалась эффективность пантопразола в контроле симптомов при приеме НПВП и оценивалось влияние разных факторов (таких как пол, возраст, употребление алкоголя, курение, инфекция Helicobacter pylori) на лечебную эффективность. Пантопразол назначался в дозе 20 мг в сутки, длительность терапии – 4 недели. Выраженность диспепсических симптомов была существенно ниже в группе получавших пантопразол (p<0,0001); эффект препарата стал наиболее отчетливым через 7 дней лечения, независимо от влияния основных факторов риска [15]. При высокой желудочной гиперсекреции, включая синдром Золлингера–Эллисона, пантопразол назначают в дозах от 80 до 160–240 мг в сутки внутрь или внутривенно; длительность лечения подбирается индивидуально [9]. Пантопразол безопасен при длительном применении [4]. В британском исследовании изучалась эффективность и переносимость 5–летнего применения пантопразола у 150 пациентов, страдающих кислото–зависимыми заболеваниями (язвенной болезнью или эрозивным рефлюкс–эзофагитом), протекавшими с частыми обострениями и устойчивыми к лечению Н2–блокаторами. При обострении заболеваний суточная доза пантопразола составляла 80 мг, при ее неэффективности в течение 12 недель дозу увеличивали до 120 мг, а при заживлении снижали до 40 мг. В числе прочих оценивались такие параметры, как гистологические изменения, уровень гастрина в сыворотке крови, популяция энтерохромаффинных клеток в слизистой оболочке. Доля пациентов в состоянии стойкой ремиссии по истечении одного года составила 82%, двух лет – 75%, трех лет – 72%, четырех лет – 70%, пяти лет – 68%. Продолжительность ремиссии при рефлюксной болезни не зависела от инфицированности H. pylori. В процессе лечения уровень сывороточного гастрина увеличился в 1,5–2 раза (особенно высокие значения отмечались при хеликобактерной инфекции). У отдельных больных зарегистрированы эпизодические подъемы гастрина >500 нг/л. У пациентов, инфицированных H. pylori, отмечалось уменьшение выраженности гастрита в антруме и нарастание – в теле желудка, с появлением признаков атрофии. Количество энтерохромаффинных клеток в антруме за 5 лет изменилось незначительно, но в теле желудка уменьшилось примерно на треть. Нежелательные явления, определенно связанные с приемом пантопразола, зафиксированы у 4 пациентов. Таким образом, переносимость длительного лечения пантопразолом в целом соответствует таковой при приеме других ИПП [7]. Пантопразол и клопидогрел. В последние годы остро встал вопрос о лекарственном взаимодействии ИПП и клопидогрела, которое сопровождается уменьшением лечебного и профилактического действия антиагреганта, повышением наклонности к артериальным тромбозам у больных групп риска. ИПП нередко назначают таким больным для предотвращения лекарственной гастропатии и кровотечения. Основанием для тревоги послужили, в частности, результаты когортного ретроспективного исследования, в котором проанализировано течение болезни у 16 690 пациентов, перенесших стентирование коронарных артерий и получавших терапию клопидогрелом (9862 больных) или клопидогрелом в сочетании с ИПП (6828 больных) с высокой приверженностью к лечению. В качестве первичной конечной точки оценивалась частота «больших сердечно–сосудистых событий» (инсульт, транзиторная ишемическая атака с госпитализацией, острый коронарный синдром, коронарная реваскуляризация, смерть вследствие сердечно–сосудистой патологии) за 12 месяцев после стентирования. В когорте больных, получавших только клопидогрел, частота «больших сердечно–сосудистых событий» составила 17,9%, в когорте получавших клопидогрел и ИПП – 25% (скорректированное отношение опасности 1,51, 95%–й доверительный интервал (ДИ) 1,39–1,64, p<0,0001). В данной работе не обнаружено существенных различий риска при приеме отдельных ИПП [19]. Пролекарство клопидогрел превращается в активный метаболит с участием CYP2C19 печени. Поскольку большинство ИПП подавляет активность этой субъединицы цитохрома Р450, это может уменьшать лечебный и профилактический эффект клопидогрела: сопровождаться повышением реактивности тромбоцитов и наклонности к артериальным тромбозам. Так, омепразол снижает AUC активного метаболита клопидогрела на 50% [1,2]. Возможно также существование других механизмов влияния ИПП на активность клопидогрела. В рекомендациях Всероссийского научного общества кардиологов (ВНОК) у больных со стабильными проявлениями атеротромбоза подчеркивается, что хотя клиническое значение взаимодействия ИПП и клопидогрела окончательно не определено, производитель оригинального клопидогрела не рекомендует его одновременный прием с препаратами, подавляющими CYP2C19 [5]. На конгрессе Европейского общества кардиологов в августе 2011 года в Париже были представлены новые рекомендации по лечению ОКС без подъема сегмента ST, согласно которым для лечения ОКС рекомендовано применение новых антитромбоцитарных препаратов прасугрела и тикагрелора. Лечение клопидогрелом обосновано только в тех случаях, когда назначение первых двух препаратов невозможно. Больным, получающим двойную антитромбоцитарную терапию, показано лечение ингибитором протонной помпы (предпочтительно не омепразолом) при наличии желудочно–кишечного кровотечения или язвенной болезни в анамнезе, а также при наличии нескольких факторов риска желудочно–кишечного кровотечения. Следует отметить, что влияние пантопразола на активность CYP2C19 существенно слабее, чем у других ИПП. Его нейтральность по отношению к клопидогрелу продемонстрирована в популяционном исследовании по типу «случай–контроль», включавшем 13 636 больных, которым после перенесенного инфаркта миокарда был рекомендован прием этого антиагреганта. В исследовании изучались частота рецидивирующего или повторного инфаркта в пределах 90 дней после выписки из стационара и ее связь с приемом ИПП. Статистический анализ показал, что одновременный (в пределах 30 предшествующих дней) прием ИПП ассоциирован с повышенным риском рецидивирующего/повторного инфаркта миокарда (отношение шансов 1,27, 95% ДИ 1,03–1,57). Не обнаружено связи с приемом ИПП более чем за 30 дней до повторного коронарного события. При стратифицированном анализе показано, что прием пантопразола не подавлял профилактическое действие клопидогрела и не повышал риск рецидивирующего/повторного инфаркта миокарда (отношение шансов 1,02, 95% ДИ 0,70–1,47) [16]. Для более углубленного изучения взаимодействия клопидогрела, омепразола и пантопразола проведено 4 рандомизированных плацебо–контролируемых исследования с перекрестным дизайном; в них участвовали 282 здоровых добровольца. Клопидогрел назначали в нагрузочной дозе 300 мг, затем в поддерживающей дозе 75 мг в сутки, омепразол 80 мг одновременно (исследование 1); затем с интервалом в 12 ч (исследование 2). Изучались также эффект повышения дозы клопидогрела до 600 мг (нагрузочная) и 150 мг (поддерживающая) (исследование 3) и взаимодействие с пантопразолом (в дозе 80 мг) (исследование 4). Исследование показало, что присоединение омепразола приводило к снижению площади под фармакокинетической кривой (AUC) для активного метаболита клопидогрела, а также повышению агрегации тромбоцитов в присутствии аденозиндифосфата, повышало реактивность тромбоцитов. Пантопразол не оказывал влияния на фармакодинамику и эффект клопидогрела [6]. Изучению взаимодействия клопидогрела и пантопразола в двойной дозе посвящено другое рандомизированное исследование с перекрестным дизайном. 20 здоровых добровольцев в течение недели получали клопидогрел (600 мг – нагрузочная доза и 75 мг в сутки – поддерживающая доза) и пантопразол (80 мг в сутки). Пантопразол назначали одновременно с клопидогрелом или с разрывом в 8 или 12 ч. До процедуры рандомизации обследуемые в течение недели получали только клопидогрел. Различными методами оценивалась функция тромбоцитов в разные временные точки. Было показано, что пантопразол в высокой дозе не оказывает влияния на фармакодинамические эффекты клопидогрела, независимо от режима приема [13]. Таким образом, пантопразол (Нольпаза®) характеризуется высокой эффективностью в лечении кислотозависимых заболеваний, сопоставимой с эффективностью других современных ИПП, хорошей переносимостью даже при длительном применении. Высокая селективность рН–опосредованной активации пантопразола предполагает меньшее системное действие препарата. Этот вопрос требует проведения специальных сравнительных исследований. Препарат безопасен в пожилом возрасте; не противопоказан при тяжелой патологии печени и почек. Несомненным преимуществом пантопразола служит низкий потенциал взаимодействия с другими лекарственными веществами, что особенно важно в лечении пожилых пациентов, которые могут принимать несколько препаратов или получать лекарства с узким «терапевтическим коридором» [3]. У больных, принимающих клопидогрел, пантопразол зарекомендовал себя как средство, существенно не влияющее на действие антиагреганта [2].
Литература 1. Бордин Д.С. Безопасность лечения как критерий выбора ингибитора протонной помпы больному гастроэзофагеальной рефлюксной болезнью // Consilium Medicum. – 2010. – Том 12. – № 8. 2. Бордин Д.С. Что следует учитывать при выборе ингибитора протонной помпы больному ГЭРБ? // Медицинский альманах. – 2010. – № 1(10) март. – С. 127–130. 3. Блюме Х., Донат Ф., Варнке А., Шуг Б.С. Фармакокинетические лекарственные взаимодействия с участием ингибиторов протонной помпы. Русский медицинский журнал. 2009; том 17; № 9 ; стр. 622–631. 4. Исаков В.А. Безопасность ингибиторов протонного насоса при длительном применении // Клиническая фармакология и терапия. – 2004. – №13(1). 5. Национальные рекомендации по антитромботической терапии у больных со стабильными проявлениями атеротромбоза. Кардиоваскулярная терапия и профилактика 2009; 8(6), Приложение 6. 6. Angiolillo DJ, Gibson CM, Cheng S et al. Differential effects of omeprazole and pantoprazole on the pharmacodynamics and pharmacokinetics of clopidogrel in healthy subjects: randomized, placebo–controlled, crossover comparison studies. Clin Pharmacol Ther. 2011 Jan;89(1):65–74. 7. Bardhan KD., Bishop AE., Polak JM. et al. Pantoprazole in severe acid–peptic disease: the effectiveness and safety of 5 years’ continuous treatment. Digestive and Liver Disease 2005; 37 (1); 10–22. 8. Bhatia N, Palta S, Arora K. Comparison of the effect of a single dose of erythromycin with pantoprazole on gastric content volume and acidity in elective general surgery patients. J Anaesthesiol Clin Pharmacol. 2011 Apr;27(2):195–8. 9. Cheer SM, Prakash A, Faulds D, Lamb HM. Pantoprazole: an update of its pharmacological properties and therapeutic use in the management of acid–related disorders. Drugs. 2003;63(1):101–33. 10. Chen WY, Chang WL, Tsai YC, Cheng HC, Lu CC, Sheu BS. Double–dosed pantoprazole accelerates the sustained symptomatic response in overweight and obese patients with reflux esophagitis in Los Angeles grades A and B. Am J Gastroenterol. 2010 May;105(5):1046–52. 11. Cummins CL, Jacobsen W, Benet LZ. Unmasking the dynamic interplay between intestinal P–glycoprotein and CYP3A4. J Pharmacol Exp Ther 2002; 300: 1036–45. 12. de Bortoli N, Martinucci I, Piaggi P et al. Randomised clinical trial: twice daily esomeprazole 40 mg vs. pantoprazole 40 mg in Barrett’s oesophagus for 1 year. Aliment Pharmacol Ther. 2011 May;33(9):1019–27. 13. Ferreiro JL, Ueno M, Tomasello SD et al. Pharmacodynamic evaluation of pantoprazole therapy on clopidogrel effects: results of a prospective, randomized, crossover study. Circ Cardiovasc Interv. 2011 Jun;4(3):273–9. 14. Haag S, Holtmann G. Onset of relief of symptoms of gastroesophageal reflux disease: post hoc analysis of two previously published studies comparing pantoprazole 20 mg once daily with nizatidine or ranitidine 150 mg twice daily. Clin Ther. 2010 Apr;32(4):678–90. 15. Holtmann G, van Rensburg C, Schwan T et al. Improvement of Non–Steroidal Anti–Inflammatory Drug–Induced Gastrointestinal Symptoms during Proton Pump Inhibitor Treatment: Are G–Protein β3 Subunit Genotype, Helicobacter pylori Status, and Environmental Factors Response Modifiers? Digestion. 2011 Oct 26;84(4):289–298]. 16. Juurlink DN, Gomes T, Ko DT et al. A population–based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ 2009; 180 (7): 713–8. 17. Kierkus J, Furmaga–Jablonska W, Sullivan JE et al. Pharmacodynamics and safety of pantoprazole in neonates, preterm infants, and infants aged 1 through 11 months with a clinical diagnosis of gastroesophageal reflux disease. Dig Dis Sci. 2011 Feb;56(2):425–34. 18. Kindt S, Imschoot J, Tack J. Prevalence of and impact of pantoprazole on nocturnal heartburn and associated sleep complaints in patients with erosive esophagitis. Dis Esophagus. 2011 Mar 18 . 19. Kreutz RP, Stanek EJ, Aubert R et al. Impact of proton pump inhibitors on the effectiveness of clopidogrel after coronary stent placement: the clopidogrel Medco outcomes study. Pharmacotherapy. 2010 Aug;30(8):787–96. 20. Modolell I, Esteller E, Segarra F, Mearin F. Proton–pump inhibitors in sleep–related breathing disorders: clinical response and predictive factors. Eur J Gastroenterol Hepatol. 2011 Oct;23(10):852–8. 21. Morgan D, Pandolfino J, Katz PO, Goldstein JL, Barker PN, Illueca M. Clinical trial: gastric acid suppression in Hispanic adults with symptomatic gastro–oesophageal reflux disease – comparator study of esomeprazole, lansoprazole and pantoprazole. Aliment Pharmacol Ther. 2010 Jul;32(2):200–8. 22. Lehmann FS., Beglinger C. Role of pantoprasole in the treatment of gastro–oesophageal reflux disease. Expert opinion pharmacother., 2005; 6: 93–104. 23. Orr WC. Night–time gastro–oesophageal reflux disease: prevalence, hazards, and management. Eur J Gastroenterol Hepatol. 2005 Jan;17(1):113–20. 24. Pauli–Magnus C, Rekersbrink S, Klotz U, et al. Interaction of omeprazole, lansoprazole and pantoprazole with Plycoprote–in. Naunyn Schniedebergs Arch Pharmacol 2001; 364: 551–7. 25. Qua Ch.–S., Manikam J., Goh Kh.–L. Efficacy of 1–week proton pump inhibitor triple therapy as rst–line Helicobacter pylori eradication regimein Asian patients: Is it still effective 10 years on? Journal of Digestive Diseases 2010; 11; 244–248. 26. Scholten T. Long–term management of gastroesophageal reflux disease with pantoprazole. Ther Clin Risk Manag. 2007 Jun;3(2):231–43. 27. Scholten T, Teutsch I, Bohuschke M, Gatz G. Pantoprazole on–demand effectively treats symptoms in patients with gastro–oesophageal reflux disease. Clin Drug Investig. 2007;27(4):287–96. 28. Sheu BS, Cheng HC, Yeh YC, Chang WL.CYP2C19 Genotypes Determine the Efficacy of On–demand Therapy of Pantoprazole for Reflux Esophagitis as Los–Angeles Grade C & D. J Gastroenterol Hepatol. 2011 Jul 20 . 29. Steward DL. Pantoprasole for sleepness associated with acid reflux and obstructive sleep disordered breathing. Laryngoscope 2004; 114: 1525–8. 30. Tammara BK, Sullivan JE, Adcock KG, Kierkus J, Giblin J, Rath N, Meng X, Maguire MK, Comer GM, Ward RM. Randomized, open–label, multicentre pharmacokinetic studies of two dose levels of pantoprazole granules in infants and children aged 1 month through <6 years with gastro–oesophageal reflux disease. Clin Pharmacokinet. 2011 Aug 1;50(8):541–50. 31. van der Pol RJ, Smits MJ, van Wijk MP et al. Efficacy of proton–pump inhibitors in children with gastroesophageal reflux disease: a systematic review. Pediatrics. 2011 May;127(5):925–35. 32. Ward RM, Kearns GL, Tammara B et al. A multicenter, randomized, open–label, pharmacokinetics and safety study of pantoprazole tablets in children and adolescents aged 6 through 16 years with gastroesophageal reflux disease. J Clin Pharmacol. 2011 Jun;51(6):876–87.
Состав
| Таблетки, покрытые пленочной кишечнорастворимой оболочкой | 1 табл. |
| активное вещество: | |
| пантопразол натрия сесквигидрат | 22,57 мг |
| (в пересчете на пантопразол — 20 мг) | |
| вспомогательные вещества: магния гидроксикарбонат тяжелый — 7,53 мг; макрогол (полиэтиленгликоль) — 1,2 мг; маннитол — 63 мг; кальция стеарат — 1,2 мг; кремния диоксид коллоидный — 1 мг; кросповидон — 20 мг; повидон К30 — 3,5 мг | |
| оболочка пленочная: Opadry прозрачный (гипромеллоза (гидроксипропилметилцеллюлоза) — 1,920 мг, макрогол (полиэтиленгликоль) — 0,48 мг) — 2,4 мг; Акрил-Из зеленый (метакриловой кислоты и этилакрилата сополимер (1:1) — 5,676 мг, кремния диоксид коллоидный — 0,086 мг, натрия гидрокарбонат — 0,086 мг, натрия лаурилсульфат — 0,043 мг, железа оксид желтый — 0,06 мг, краситель индигокармин — 0,069 мг, краситель бриллиантовый голубой — 0,026 мг, тальк — 1,419 мг, титана диоксид — 1,135 мг) — 8,6 мг; триэтилцитрат — 1 мг |
| Таблетки, покрытые пленочной кишечнорастворимой оболочкой | 1 табл. |
| активное вещество: | |
| пантопразол натрия сесквигидрат | 45,14 мг |
| (в пересчете на пантопразол — 40 мг) | |
| вспомогательные вещества: магния гидроксикарбонат тяжелый — 15,06 мг; макрогол (полиэтиленгликоль) — 2,4 мг; маннитол — 126 мг; кальция стеарат — 2,4 мг; кремния диоксид коллоидный — 2 мг; кросповидон — 40 мг; повидон К30 — 7 мг | |
| оболочка пленочная: Opadry прозрачный (гипромеллоза (гидроксипропилметилцеллюлоза) — 3,84 мг, макрогол (полиэтиленгликоль) — 0,96 мг) — 4,8 мг; Акрил-Из зеленый (метакриловой кислоты и этилакрилата сополимер (1:1) — 11,352 мг, кремния диоксид коллоидный — 0,172 мг, натрия гидрокарбонат — 0,172 мг, натрия лаурилсульфат — 0,086 мг, железа оксид желтый — 0,12 мг, краситель индигокармин — 0,138 мг, краситель бриллиантовый голубой — 0,052 мг, тальк — 2,838 мг, титана диоксид — 2,27 мг) — 17,2 мг; триэтилцитрат — 2 мг |