Не путать с Соматокринин или же Соматомедин.
| SST | |||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||
| Псевдонимы | SST, SMST, соматостатин, соматостатин, соматостатин | ||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 182450 MGI: 98326 ГомолоГен: 819 Генные карты: SST | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||||||||||||
| Entrez |
| ||||||||||||||||||||||||||||||||||
Производство
Пищеварительная система
Соматостатин секретируется дельта-клетки в нескольких местах пищеварительной системы, а именно пилорический антральный отдел, то двенадцатиперстная кишка и островки поджелудочной железы.[13]
Соматостатин выпущен в пилорический антральный отдел проходит через портальную венозную систему к сердцу, затем попадает в большой круг кровообращения и достигает тех мест, где будет оказывать тормозящее действие. Кроме того, высвобождение соматостатина из дельта-клеток может действовать в паракринный манера.[13]
В желудке соматостатин действует непосредственно на производящие кислоту париетальные клетки через рецептор, связанный с G-белком (который ингибирует аденилатциклазу, таким образом эффективно противодействуя стимулирующему эффекту гистамина), чтобы уменьшить секрецию кислоты.[13] Соматостатин также может косвенно снижать выработку кислоты в желудке, предотвращая высвобождение других гормонов, в том числе гастрин и гистамин который эффективно замедляет процесс пищеварения.
Мозг
| Sst экспрессируется в интернейронах конечного мозга мыши на 15.5-й день эмбриона. Атласы мозга Аллена | Sst экспрессия у взрослой мыши. Атласы мозга Аллена |
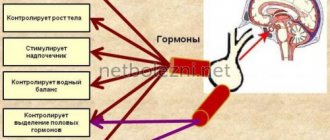
Соматостатин производится нейроэндокринный нейроны вентромедиальное ядро из гипоталамус. Эти нейроны проецируются на срединное возвышение, где соматостатин высвобождается из нервных окончаний в гипоталамо-гипофизарная система через аксоны нейронов. Затем соматостатин переносится в передняя доля гипофиза, где он подавляет секрецию гормон роста из соматотроп клетки. Нейроны соматостатина в перивентрикулярном ядре опосредуют эффекты отрицательной обратной связи гормон роста по собственному выпуску; нейроны соматостатина реагируют на высокие циркулирующие концентрации гормона роста и соматомединов, увеличивая высвобождение соматостатина, тем самым снижая скорость секреции гормона роста.
Соматостатин также продуцируется несколькими другими популяциями, которые проецируются центрально, то есть в другие области мозга, а рецепторы соматостатина экспрессируются во многих различных участках мозга. В частности, популяции нейронов соматостатина встречаются в дугообразное ядро,[нужна цитата
] то гиппокамп,[
нужна цитата
] и ствол мозга ядро одиночного тракта.[
нужна цитата
]
Клинические наблюдения
Октреотид пролонгированного действия купирует клинические проявления у пациентов с НЭО и обладает противоопухолевой активностью у пациентов с метастатическими НЭО кишечника, но остается неясным, обладает ли он антипролиферативным действием у пациентов с запущенными НЭО поджелудочной железы. H. Kitade et al. (2018) сообщили о 71-летнем мужчине с множественными метастазами в печень НЭО поджелудочной железы, который получал лечение эверолимусом по 10 мг и сунитинибом по 25 мг ежедневно в течение 3 нед. Однако терапия была прекращена из-за прогрессирования заболевания и серьезных побочных эффектов. Октреотид пролонгированного действия исходно вводился одновременно с эверолимусом; уровень опухолевых маркеров заметно снизился, и метастазы печени уменьшились в размерах. Иммуногистохимическое исследование образцов опухолей, полученных до лечения, показало высокий уровень экспрессии соматостатинового рецептора 2 типа. Клиническое наблюдение позволило предположить, что октреотид пролонгированного действия может быть вариантом лечения прогрессирующих НЭО поджелудочной железы после отмены эверолимуса и сунитиниба [30].
T. Arao et al. (2017) представили 54-летнюю женщину, госпитализированную для лечения акромегалии. Уровень гормона роста (ГР) составлял 39,8 нг/мл, инсулиноподобного фактора роста-1 (ИФР-1) — 717 нг/мл, уровень ГР не подавлялся (22,9 нг/мл) при проведении перорального глюкозотолерантного теста. МРТ показала, что опухоль размером 21×17 мм распространяется в правую супраселлярную область и проникает в кавернозный синус. Начато лечение октреотидом пролонгированного действия в дозе 20 мг каждые 4 нед. После введения трех доз уровни ГР и ИФР-1 снизились до 2,19 нг/мл (до 1,69 после проведения глюкозотолерантного теста) и 205 нг/мл соответственно. Снижение уровней ГР и ИФР-1, уменьшение размеров опухоли и инвазии кавернозного синуса позволили выполнить оперативное лечение без последующих осложнений. Предоперационное введение октреотида пролонгированного действия улучшило результаты лечения акромегалии [31].
Беременность при акромегалии возникает редко и протекает благоприятно, но в этот период может произойти увеличение размеров опухоли. Коррекция роста опухоли во время беременности сложна из-за потенциальных осложнений возможного хирургического вмешательства и побочных эффектов противоопухолевых препаратов. A.M. Hannon et al. (2019) описали уникальный случай применения октреотида у 32-летней женщины с акромегалией, выявленной на 11-й нед. беременности. Имела место крупная макроаденома, проникающая в супраселлярную цистерну, на 20-й нед. беременности развилась битемпоральная гемианопсия. Пациентка отказалась от операции, ей было назначено лечение октреотидом 100 мкг 3 р./сут подкожно, приведшее к нормализации полей зрения после 2 нед. терапии. Дальнейшее уменьшение полей зрения на 24-й нед. беременности заставило увеличить дозу октреотида до 150 мкг 3 р./сут; зрение оставалось стабильным до конца беременности. На сроке 14 нед. был диагностирован гестационный диабет, а с 22-й нед. назначен инсулин. Других акушерских осложнений не было, рост плода продолжался до конца беременности. Проведено плановое кесарево сечение на сроке 34 нед., масса тела плода при рождении составляла 3,2 кг, 9 баллов по шкале Aпгар, врожденных аномалий не выявлено. Менструальный цикл после родов регулярный. Женщине назначили октреотид пролонгированного действия в дозе 40 мг и направили на операцию. Через 2 года после родов ребенок развивался нормально. Впервые было описано возникновение акромегалии во время беременности и улучшение параметров периметрии октреотидом [32].
Гигантские аденомы гипофиза представляют собой доброкачественные опухоли диаметром ≥4 см. Они проявляются симптоматикой, обусловленной гиперсекрецией одного или нескольких гормонов гипофиза и вовлечением в рост окружающих структур, а сдавление гипофиза может привести к гипопитуитаризму. F. Dicuonzo et al. (2019) сообщили о молодой женщине с акромегалией с неоперабельной гигантской секретирующей ГР аденомой гипофиза, распространяющейся до кавернозного синуса, орбитальной полости, верхнечелюстного синуса, клиновидного синуса и височной ямки справа. Лечение октреотидом пролонгированного действия помогло быстро снять головную боль и двустороннюю гемианопсию, возникшую вследствие вовлечения в процесс перекреста зрительных нервов, уменьшить клинические проявления акромегалии и со временем контролировать рост опухоли, усилить фертильность, позволило пациентке забеременеть. Терапию отменили во время беременности. Пациентка родила здорового сына. Размер опухоли в конце беременности и при последующем наблюдении не увеличивался. Данный случай подтверждает возможность благоприятного исхода беременности у пациентки, страдающей акромегалией [33].
Синдром эктопической продукции адренокортикотропного гормона (АКТГ) — редкое заболевание, часто сопровождается тяжелым гиперкортицизмом, требующим хирургического вмешательства. P. Rodrigues et al. (2012) описали 33-летнего пациента, госпитализированного в 1993 г. с клиническими проявлениями синдрома Кушинга. У него отмечались высокие уровни АКТГ в плазме и резко повышенное выделение свободного кортизола с мочой, которые не подавлялись высокими дозами дексаметазона. Гипофиз на МРТ выглядел нормально, но КТ грудной клетки выявила 1,7 см образование в левом легком. Инструментальные исследования показали наличие АКТГ-продуцирующей нейроэндокринной карциномы с отдаленными метастазами. Пациент получал химиотерапию вкупе с октреотидом, что привело к благоприятному клиническому и биохимическому результату. Авторы подчеркивают долгосрочный ответ на медикаментозную терапию октреотидом с превосходным антипролиферативным эффектом [34].
A. Kanno et al. (2017) представили случай инсулиномы у женщины 80 лет с приступами гипогликемии. Пациентка отказалась от хирургического лечения, подкожное введение 50 мкг октреотида перед сном предотвращало гипогликемию в ночное время. Препарат способен подавлять секрецию инсулина, хотя не существует конкретного протокола для его использования в таких случаях. Пациентка не могла сама ежедневно вводить препарат, ей назначили октреотид пролонгированного действия, что предотвратило эпизоды гипогликемии в течение 4 нед., и качество жизни пациентки существенно улучшилось [35].
Функции
Ячейка D отображается вверху справа, а соматостатин представлен средней стрелкой, указывающей влево
Соматостатин классифицируется как тормозящий гормон,[6] и вызывается низким pH.[нужна цитата
] Его действие распространяется на разные части тела. Высвобождение соматостатина ингибируется Блуждающий нерв.[14]
Передний гипофиз
в передняя доля гипофиза, эффекты соматостатина:
- Подавление высвобождения гормона роста (GH)[15] (таким образом противодействуя эффектам гормон роста, высвобождающий гормон (GHRH))
- Запрещение выпуска тиреотропный гормон (ТТГ)[16]
- Подавление аденилилциклаза в париетальных клетках
- Запрещение выпуска пролактин (PRL)
Желудочно-кишечная система
- Соматостатин гомологичен кортистатин (видеть семья соматостатина) и подавляет выпуск желудочно-кишечные гормоны
- Уменьшает скорость опорожнения желудка и уменьшает сокращение гладких мышц и кровоток в кишечнике.[15]
- Подавляет выброс гормонов поджелудочной железы Высвобождение соматостатина запускается бета-клеточным пептидом урокортином3 (Ucn3) для ингибирования инсулин релиз.[17][18]
- Тормозит высвобождение глюкагона[17]
Синтетические заменители
| Эта секция нужны дополнительные цитаты для проверка . Пожалуйста помоги улучшить эту статью к добавление цитат в надежные источники. Материал, не полученный от источника, может быть оспорен и удален |
Октреотид (торговая марка Сандостатин, Novartis Pharmaceuticals) является октапептид который фармакологически имитирует натуральный соматостатин, но является более сильным ингибитором гормона роста, глюкагона и инсулина, чем природный гормон, и имеет гораздо более длительный период полураспада (около 90 минут по сравнению с 2–3 минутами для соматостатина). Поскольку он плохо всасывается из кишечника, его вводят парентерально (подкожно, внутримышечно или внутривенно). Это указано для симптоматическое лечение из карциноидный синдром и акромегалия. Он также находит все большее применение при поликистозных заболеваниях печени и почек.
Ланреотид (Соматулин, Ipsen Pharmaceuticals) — это лекарство, используемое для лечения акромегалии и симптомов, вызванных нейроэндокринными опухолями, в первую очередь карциноидного синдрома. Это длительное действие аналог соматостатина, как октреотид. Он доступен в нескольких странах, включая Великобританию, Австралию и Канаду, и был одобрен для продажи в США Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов 30 августа 2007 года.
Пасиреотид, продаваемый под торговой маркой Signifor, является орфанный препарат одобрен в США и Европейском Союзе для лечения Болезнь Кушинга у пациентов, которые не прошли или не подходят для хирургического лечения. Он был разработан Новартис. Пасиреотид — это соматостатин
аналог с 40-кратным увеличением сродства к рецептор соматостатина 5 по сравнению с другими аналогами соматостатина.
Введение
В последние десятилетия заболеваемость нейроэндокринными опухолями (НЭО) неуклонно растет. НЭО — относительно редкая гетерогенная группа новообразований с ежегодной заболеваемостью 35 случаев на 100 000 человек. Обновленная ВОЗ классификация гастроэнтеропанкреатических (ГЭП) опухолей верифицирует их в зависимости от локализации, клинических проявлений и степени дифференцировки. Из-за медленного роста и отсутствия ранних симптомов большинство НЭО часто диагностируют на поздних стадиях, когда варианты лечебного воздействия ограничены [1].
НЭО возникают в любых органах, где имеются эндокринные клетки. Эти новообразования могут не давать клинической симптоматики, однако в случае их функциональности развиваются эндокринные синдромы, представляющие угрозу здоровью и жизни пациентов.
Задачей лечения больных с НЭО являются ликвидация самой опухоли и подавление симптомокомплекса, обусловленного карциноидным синдромом. Единственным радикальным методом лечения остается хирургический, а при невозможности его использования торможение опухолевого роста и подавление гормональной экспрессии аналогами соматостатина (в частности, октреотидом) позволяют продлить жизнь и улучшить ее качество у больных.
Эволюционная история
Шесть генов соматостатина были обнаружены в позвоночные. Предлагаемая в настоящее время история возникновения этих шести генов основана на трех событиях полногеномной дупликации, которые имели место в эволюции позвоночных, наряду с локальными дупликациями у позвоночных. костистость рыбы. Родовой ген соматостатина был продублирован во время первого событие дупликации всего генома (1R) создать SS1
и
SS2
. Эти два гена были дублированы во время второго события дупликации всего генома (2R), чтобы создать четыре новых гена соматостатина:
SS1, SS2, SS3
, и один ген, утраченный в ходе эволюции позвоночных. Четвероногие сохранил
SS1
(также известный как
СС-14
и
СС-28
) и
SS2
(также известный как кортистатин) после раскола в Саркоптеригии и Актиноптеригии родословная разделена. В костистость рыбы,
SS1, SS2
, и
SS3
были дублированы во время третьего события дупликации всего генома (3R) для создания
SS1, SS2, SS4, SS5,
и два гена, которые были потеряны во время эволюции костистых рыб.
SS1
и
SS2
прошли через локальное дублирование, чтобы вызвать
SS6
и
SS3
.[8]
Рекомендации
- ^ абc
ГРЧ38: Ансамбль выпуск 89: ENSG00000157005 — Ансамбль, Май 2017 - ^ абc
GRCm38: выпуск ансамбля 89: ENSMUSG00000004366 — Ансамбль, Май 2017 - «Справочник человека по PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США
. - «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США
. - «соматостатин». Encyclopdia Britannica. Энциклопедия Britannica Online. Энциклопедия Britannica Inc., 2021. Интернет. 04 mag. 2016 https://www.britannica.com/science/somatostatin>.
- ^ аб
Костофф А. «Раздел 5, Глава 4: Структура, синтез и секреция соматостатина».
Эндокринология: эндокринная поджелудочная железа
. Медицинский колледж Джорджии. п. 16. Архивировано из оригинал 5 апреля 2008 г.. Получено 2008-02-19. - «препропротеин соматостатина «. Контрольная последовательность NCBI
. Национальный центр биотехнологической информационной поддержки (NCBI). - ^ абc
Лю И, Лю Д, Чжан И, Ли С., Лю Х, Линь Х (сентябрь 2010 г.). «Эволюция соматостатина у позвоночных».
Ген
.
463
(1–2): 21–8. Дои:10.1016 / j.gene.2010.04.016. PMID 20472043. - Гахете, доктор медицины, Кордова-Чакон Дж, Дюран-Прадо, М., Малагон, М.М., Мартинес-Фуэнтес, А.Дж., Грасиа-Наварро, Ф., Луке, Р.М., Кастаньо, JP (июль 2010 г.). «Соматостатин и его рецепторы от рыб до млекопитающих». Летопись Нью-Йоркской академии наук
.
1200
: 43–52. Дои:10.1111 / j.1749-6632.2010.05511.x. PMID 20633132. S2CID 23346102. - «Энтрез Джин: соматостатин».
- Шен LP, Пикте Р.Л., Раттер В.Дж. (август 1982 г.). «Соматостатин I человека: последовательность кДНК». Труды Национальной академии наук Соединенных Штатов Америки
.
79
(15): 4575–9. Дои:10.1073 / пнас.79.15.4575. ЧВК 346717. PMID 6126875. - Шен LP, Раттер WJ (апрель 1984 г.). «Последовательность гена соматостатина I человека». Наука
.
224
(4645): 168–71. Дои:10.1126 / science.6142531. PMID 6142531. - ^ абc
Бор WF, Boulpaep EL (2012).
Медицинская физиология
(2-е изд.). Филадельфия, Пенсильвания: Эльзевир. ISBN 9781437717532 . - Холст Дж. Дж., Скак-Нильсен Т., Орсков С., Зайер-Поульсен С. (август 1992 г.). «Блуждающий контроль высвобождения соматостатина, вазоактивного кишечного полипептида, гастрин-высвобождающего пептида и HCl из неантрального желудка свиньи». Скандинавский журнал гастроэнтерологии
.
27
(8): 677–85. Дои:10.3109/00365529209000139. PMID 1359631. - ^ аб
Боуэн Р. (2002-12-14). «Соматостатин».
Биомедицинские гипертексты
. Государственный университет Колорадо. Получено 2008-02-19. - Первая помощь для USMLE Step 1, 2010. Стр. 286.
- ^ аб
Костофф А. «Раздел 5, Глава 4: Структура, синтез и секреция соматостатина».
Эндокринология: эндокринная поджелудочная железа
. Медицинский колледж Джорджии. п. 17. Архивировано из оригинал 31 марта 2008 г.. Получено 2008-02-19. - ван дер Меулен Т., Дональдсон С.Дж., Касерес Э., Хантер А.Е., Кауинг-Цитрон С., Фунт Л.Д., Адамс М.В., Зембжицки А., Гроув К.Л., Хейзинг, МО (июль 2015 г.). «Урокортин3 опосредует соматостатин-зависимый контроль секреции инсулина с отрицательной обратной связью». Природа Медицина
.
21
(7): 769–76. Дои:10,1038 / нм.3872. ЧВК 4496282. PMID 26076035.
дальнейшее чтение
- Флорио Т., Скеттини Дж. (Сентябрь 2001 г.). «[Соматостатин и его рецепторы. Роль в контроле пролиферации клеток]». Минерва Эндокринологика
.
26
(3): 91–102. PMID 11753230. - Ямада Ю., Ризин Т., Ло С.Ф., Ихара Ю., Кубота А., Кагимото С., Сейно М., Сейно Ю., Белл Г.И., Сейно С. (декабрь 1992 г.). «Рецепторы соматостатина, расширяющееся семейство генов: клонирование и функциональная характеристика человеческого SSTR3, белка, связанного с аденилатциклазой». Молекулярная эндокринология
.
6
(12): 2136–42. Дои:10.1210 / me.6.12.2136. PMID 1337145. - Ямада Y, Post SR, Wang K, Tager HS, Bell GI, Seino S (январь 1992 г.). «Клонирование и функциональная характеристика семейства рецепторов соматостатина человека и мыши, экспрессируемых в головном мозге, желудочно-кишечном тракте и почках». Труды Национальной академии наук Соединенных Штатов Америки
.
89
(1): 251–5. Дои:10.1073 / pnas.89.1.251. ЧВК 48214. PMID 1346068. - Бразо П., Вейл В., Бургус Р., Линг Н., Мясник М., Ривье Дж., Гийемин Р. (январь 1973 г.). «Гипоталамический полипептид, подавляющий секрецию иммунореактивного гормона роста гипофиза». Наука
.
179
(4068): 77–9. Дои:10.1126 / science.179.4068.77. PMID 4682131. S2CID 10997771. - Шен LP, Пикте Р.Л., Раттер В.Дж. (август 1982 г.). «Соматостатин I человека: последовательность кДНК». Труды Национальной академии наук Соединенных Штатов Америки
.
79
(15): 4575–9. Дои:10.1073 / пнас.79.15.4575. ЧВК 346717. PMID 6126875. - Шен LP, Раттер WJ (апрель 1984 г.). «Последовательность гена соматостатина I человека». Наука
.
224
(4645): 168–71. Дои:10.1126 / science.6142531. PMID 6142531. - Montminy MR, Goodman RH, Horovitch SJ, Habener JF (июнь 1984). «Первичная структура гена препросоматостатина крысы». Труды Национальной академии наук Соединенных Штатов Америки
.
81
(11): 3337–40. Дои:10.1073 / пнас.81.11.3337. ЧВК 345502. PMID 6145156. - Забель Б.У., Нейлор С.Л., Сакагути А.Ю., Белл Г.И., Показывает ТБ (ноябрь 1983 г.). «Хромосомная локализация с высоким разрешением человеческих генов амилазы, проопиомеланокортина, соматостатина и фрагмента ДНК (D3S1) путем гибридизации in situ». Труды Национальной академии наук Соединенных Штатов Америки
.
80
(22): 6932–6. Дои:10.1073 / pnas.80.22.6932. ЧВК 390100. PMID 6196780. - Панетта Р., Гринвуд М.Т., Варшинская А., Демчишин Л.Л., Дэй Р., Низник Х.Б., Срикант С.Б., Патель Ю.С. (март 1994 г.). «Молекулярное клонирование, функциональная характеристика и хромосомная локализация рецептора соматостатина человека (рецептор соматостатина типа 5) с преимущественным сродством к соматостатину-28». Молекулярная фармакология
.
45
(3): 417–27. PMID 7908405. - Демчишин Л.Л., Срикант С.Б., Сунахара Р.К., Кент Дж., Симан П., Ван Тол Х. Х., Панетта Р., Патель Ю. К., Низник Х. Б. (июнь 1993 г.). «Клонирование и экспрессия варианта рецептора соматостатина-14 человека (рецептор соматостатина 4), расположенного на хромосоме 20». Молекулярная фармакология
.
43
(6): 894–901. PMID 8100352. - Каупманн К., Брунс С., Хойер Д., Сеувен К., Любберт Х. (сентябрь 1993 г.). «Распределение и вторичный мессенджер четырех подтипов рецепторов соматостатина, экспрессируемых в мозге». Письма FEBS
.
331
(1–2): 53–9. Дои:10.1016/0014-5793(93)80296-7. PMID 8405411. S2CID 22557713. - Агила М.К., Родригес А.М., Агила-Мансилья HN, Ли В.Т. (май 1996 г.). «Соматостатин-антисмысловой олигодезоксинуклеотид-опосредованная стимуляция пролиферации лимфоцитов в культуре». Эндокринология
.
137
(5): 1585–90. Дои:10.1210 / en.137.5.1585. PMID 8612489. - Шарма К., Патель Ю.К., Срикант CB (декабрь 1996 г.). «Подтип-селективная индукция р53 дикого типа и апоптоза, но не остановка клеточного цикла рецептором соматостатина 3 человека». Молекулярная эндокринология
.
10
(12): 1688–96. Дои:10.1210 / мэ.10.12.1688. PMID 8961277. - Dournaud P, Boudin H, Schonbrunn A, Tannenbaum GS, Beaudet A (февраль 1998 г.). «Взаимосвязь между рецепторами sst2A соматостатина и аксонами, содержащими соматостатин, в головном мозге крыс: данные о регуляции рецепторов клеточной поверхности эндогенным соматостатином». Журнал неврологии
.
18
(3): 1056–71. Дои:10.1523 / JNEUROSCI.18-03-01056.1998. ЧВК 6792775. PMID 9437026. - Барни А., Робертс Дж., Хо Р.Х. (январь 1999 г.). «Доказательства синергического действия белка оболочки ВИЧ-1 gp120 и нейротрофического фактора мозга (BDNF), приводящего к усиленной экспрессии нейронов соматостатина в совокупных культурах, происходящих из коры человеческого плода». Исследование мозга
.
815
(2): 349–57. Дои:10.1016 / S0006-8993 (98) 01098-1. PMID 9878821. S2CID 21793593. - Ferone D, van Hagen PM, van Koetsveld PM, Zuijderwijk J, Mooy DM, Lichtenauer-Kaligis EG, Colao A, Bogers AJ, Lombardi G, Lamberts SW, Hofland LJ (январь 1999 г.). «Исследование in vitro рецепторов соматостатина в тимусе человека и влияние соматостатина и октреотида на культивируемые эпителиальные клетки тимуса». Эндокринология
.
140
(1): 373–80. Дои:10.1210 / en.140.1.373. PMID 9886848. - Бракч Н., Лазар Н., Панчал М., Аллеманду Ф., Буало Г., Коэн П., Ролам М. (февраль 2002 г.). «Последовательность соматостатин-28 (1-12) -NPAMAP: важный спиральный мотив, управляющий процессингом просоматостатина на одно- и двухосновных участках». Биохимия
.
41
(5): 1630–9. Дои:10.1021 / bi011928m. PMID 11814357. - Оомен С.П., ван Хенник П.Б., Антониссен К., Лихтенауэр-Калигис Е.Г., Хофланд Л.Дж., Ламбертс С.В., Левенберг Б., Тоув И.П. (февраль 2002 г.). «Соматостатин представляет собой селективный хемоаттрактант для примитивных (CD34 (+)) гематопоэтических клеток-предшественников». Экспериментальная гематология
.
30
(2): 116–25. Дои:10.1016 / S0301-472X (01) 00772-X. PMID 11823046. - Симонетти М., Ди BC (февраль 2002 г.). «Структурные мотивы в процессе созревания пептидных гормонов. Предшественник соматостатина. I. Конформационное исследование CD». Журнал пептидной науки
.
8
(2): 66–79. Дои:10.1002 / psc.370. PMID 11860030. S2CID 20438890.
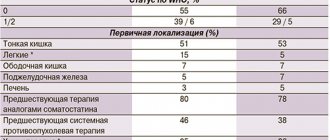
Представлены данные по экспрессии рецепторов к соматостатину 1, 2, 3 и 5 типов в 48 функционирующих (инсулинома – 45, гастринома – 3) и 18 нефункционирующих нейроэндокринных опухолях поджелудочной железы (НЭО ПЖ). Показано, что в функционирующих НЭО преобладала экспрессия рецепторов 3 типа, в нефункционирующих – 2 типа. Отмечены изменения «профиля» экспрессии соматостатиновых рецепторов 1, 2 и 3 типов с увеличением степени злокачественности НЭО ПЖ.
Somatostatin receptors expression 1, 2, 3, and 5 types in pancreatic neuroendocrine tumors
It was examined the expression of somatostatin receptors 1, 2, 3 and 5 types in 56 pancreatic neuroendocrine tumors: 48 function (45 insulinomas and 3 gastrinomas) and 18 non-function tumors. Twenty of 56 tumors were malignant (6 insulinomas, 9 non-function tumors, 3 gastrinomas). In function tumors dominated expression of receptor of 3 type (48%), and in non-function tumors — type 2 (63.2%). In tumors with metastases the number of cells expressing the receptor type 2 and 3 increased, and receptor type 1 — decreased.
Нейроэндокринные опухоли (НЭО) поджелудочной железы считаются относительно редкими новообразованиями. Вместе с тем, за последние годы отмечается тенденция к увеличению частоты их обнаружения как в связи с внедрением в клиническую практику различных методов лучевой диагностики, так и с совершенствованием морфологической верификации. Единственным методом радикального лечения локализованных НЭО поджелудочной железы является хирургический [1, 2]. Нерезектабельные и диссеминированные НЭО требуют индивидуального подхода к лечению, при этом рекомендации по выбору оптимального метода (химио- либо биотерапия) основываются на морфологических особенностях опухоли [3].
В настоящее время в первой линии лекарственной терапии НЭО (особенно функционирующих) поджелудочной железы наиболее часто применяют синтетические аналоги соматостатина [4, 5, 6, 7]. Противоопухолевая активность этих препаратов обусловлена подавлением пролиферации опухолевых клеток, стимуляцией их апоптоза, подавлением продукции ими факторов роста и основана на связывании специфических мишеней на опухолевых клетках – рецепторов к соматостатину (РС) [8].
В этой связи определение профиля экспрессии РС в опухолевых клетках является важнейшим фактором прогноза эффективноcти данного метода лечения. К настоящему времени известны 5 типов РС. Впервые экспрессия клетками НЭО поджелудочной железы (ПЖ) всех пяти типов этих рецепторов была продемонстрирована в исследованиях J.C. Reubi и соавт. [9], однако, данные литературы последних лет, касающиеся иммуно-гистохимического (ИГХ) определения РС разных типов в НЭО поджелудочной железы, противоречивы, что и послужило основанием для проведения данного исследования.
Цель исследования: изучить особенности экспрессии соматостатиновых рецепторов 1, 2, 3 и 5 типов в НЭО поджелудочной железы различной степени злокачественности.
Материалы и методы
Проведено гистологическое и ИГХ исследование биоптатов опухоли (в ряде случаев биоптатов их метастазов) 56 больных с НЭО ПЖ. Во всех случаях диагноз верифицирован в патологоанатомическом отделении МОНИКИ им. М.Ф. Владимирского. Больные обследованы и/или оперированы в отделении хирургической эндокринологии МОНИКИ им. М.Ф. Владимирского и в клинике факультетской хирургии им. Н.Н. Бурденко I МГМУ им. И.М. Сеченова. При ИГХ использовали широкий спектр маркеров-антител (АТ): к хромогранину А, синаптофизину, CD56, ядрам пролиферирующих клеток — Ki67; гормонам — инсулину, гастрину, глюкагону, соматостатину, панкреатическому полипептиду; рецепторам к соматостатину 1 типа (поликлональные, Abbiotic, США), 2 типа (кроличьи моноклональные ID-EPR3340, Эпитомикс, США), 3 типа (поликлональные, Thermoscientific, США) и 5 типа (кроличьи моноклональные ID-UMB4, Эпитомикс, США). Анализ экспрессии РС проводили в соответствии с методикой, разработанной Volante М. et al. [10]. Положительной («++» и «+++») реакцией считали преимущественно мембранную или мембранно-цитоплазматическую экспрессию РС в 50-100% опухолевых клеток. Слабо положительная («+») или очаговая реакция расценивалась как негативная. Степень злокачественности НЭО поджелудочной железы определяли по классификации ВОЗ (2010 г.), в соответствии с критериями которой их подразделяли на высокодифференцированные НЭО 1 и 2 степени злокачественности. Низкодифференцированных нейроэндокринных карцином 3 степени злокачественности среди исследованных опухолей не было.
Результаты и их обсуждение
Экспрессия РС 1, 2, 3 и 5 типов обнаружена во всех исследованных НЭО поджелудочной железы. При сравнительном анализе экспрессии РС 1, 2, 3 и 5 типов установлено, что в гормонально-активных и в нефункционирующих НЭО поджелудочной железы экспрессия РС-1 наблюдалась в 17,9% и 21,4%, РС-2 – в 41,9% и 63,2%, РС-3 – в 48% и 25%, РС-5 – в 15,4% и 11%, соответственно (табл. 1).
Таблица 1.
Экспрессия РС в НЭО поджелудочной железы в зависимости от их функциональной активности
| Типы РС | Гормонально-активные НЭО, % | Нефункционирующие НЭО, % |
| РС-1 | 17,9 | 21,4 |
| РС-2 | 41,9 | 63,2 |
| РС-3 | 48,0 | 25,0 |
| РС-5 | 15,4 | 11,0 |
Также отмечено, что с увеличением злокачественного потенциала опухолей меняется профиль экспрессии РС (табл. 2): в функционирующих и в нефункционирующих НЭО без метастазов (1 степень злокачественности) экспрессия РС-1 выявлялась в 16,7% и 25% по сравнению с опухолями с метастазами (2 степень злокачественности) – 10% и 19,4%, соответственно.
Таблица 2.
Экспрессия РС в НЭО поджелудочной железы в зависимости от их злокачественного потенциала
| Типы РС | Гормонально-активные НЭО | Нефункционирующие НЭО | ||
| С метастазами, % | Без метастазов, % | С метастазами, % | Без метастазов, % | |
| РС-1 | 10,0 | 16,7 | 19,4 | 25,0 |
| РС-2 | 70,0 | 37,1 | 66,7 | 60,0 |
| РС-3 | 66,7 | 47,6 | 33,0 | 20,0 |
| РС-5 | 11,0 | 10,0 | 33,0 | 20,0 |
Число опухолей, экспрессирующих РС-2 и РС-3, напротив, увеличивалось. Так, экспрессия РС-2 в гормонально-активных НЭО поджелудочной железы без метастазов и с метастазами выявлялась соответственно в 37,1% и 70%, экспрессия РС-3 – в 47,6% и 66,7%. Среди нефункционирующих НЭО без метастазов число опухолей, экспрессирующих РС-2 и РС-3, составило 60% и 20%, среди нефункционирующих опухолей с метастазами – 66,7% и 33%. Значимых различий в экспрессии РС-5 выявлено не было: в гормонально-активных НЭО поджелудочной железы с метастазами и без метастазов РС-5 позитивные клетки выявлялись в 11% и 10%, соответственно, в нефункционирующих опухолях (как с метастазами, так и без метастазов) – в 11%.
Большинство функционирующих НЭО поджелудочной железы составили инсулиномы, в которых экспрессия РС 1, 2, 3 и 5 типов отмечена в 17,9%, 41,9%, 48% и 15,4%, соответственно (рис. 1).
Рисунок 1. Экспрессия РС в инсулиномах
Инсулиномы с метастазами экспрессировали эти рецепторы в 12,5%, 62,5%, 50% и 12,5%. Число инсулином без метастазов, экспрессирующих РС, составило 19,4%, 38,2%, 47,6% и 16,1% соответственно (рис. 2).
Рисунок 2. Экспрессия РС в инсулиномах разной степени злокачественности
Данные литературы об ИГХ определении экспрессии РС разных типов в НЭО поджелудочной железы противоречивы. Это объясняется целым рядом факторов: отсутствием до недавнего времени достаточно специфичных и чувствительных антител к этим рецепторам, большой гетерогенностью и небольшим числом исследованных опухолей, отсутствием стандартной методики определения и оценки РС. В настоящее время такие стандарты разработаны [10, 11]. Более того показано, что только мембранный, а не цитоплазматический тип экспрессии РС коррелирует с позитивным ответом на лечение аналогами соматостатина [12]. Именно этот тип экспрессии отмечался в проведенном исследовании с использованием новых, высокоспецифичных моноклональных кроличьих АТ [13, 14].
Использование аналогов соматостатина для лечения нерезектабельных либо диссеминированных НЭО поджелудочной железы увеличивает продолжительность и качество жизни больных. Важнейшим фактором прогноза эффективноcти этой терапии является определение профиля экспрессии РС в опухолевых клетках, и, в первую очередь, определение экспрессии РС-2. Наряду с этим, экспрессия РС-2 может ассоциироваться и с потенциалом злокачественности НЭО поджелудочной железы, что подтверждают результаты проведенного исследования. Так, с увеличением степени злокачественности инсулином, экспрессия РС-2 увеличивалась почти в 2 раза в опухолях с метастазами по сравнению с опухолями без метастазов. С другой стороны, отсутствие экспрессии РС-2 и наличие РС других типов могут объяснить резистентность инсулином высокой степени злокачественности к лечению аналогами соматостатина. Полученные нами результаты подтверждают этот факт: почти 50% исследованных инсулином экспрессировали РС-3, а 18% — РС-1. В настоящее время разработаны препараты (в частности, SOM-230), способные связывать более широкий спектр РС, в том числе и РС-1 и РС-3, что дает более широкие возможности лечения НЭО ПЖ [15].
Заключение
НЭО поджелудочной железы экспрессируют РС 1, 2, 3 и 5 типов, при этом в функционирующих опухолях наиболее высокий уровень экспрессии характерен для РС-3, а в нефункционирующих – для РС-2. Увеличение потенциала злокачественности инсулин-продуцирующих НЭО поджелудочной железы коррелирует с повышением уровня экспрессии в опухолевых клетках РС-2. Определение профиля экспрессии РС в НЭО поджелудочной железы позволяет индивидуализировать их прогноз и оптимизировать тактику лечения путем обоснованного назначения больным аналогов соматостатина.
Л.Е. Гуревич, Е.И. Пантелеева, Н.А. Корсакова, И.А. Казанцева, А.В. Егоров,
Т.А. Бритвин, И.А. Васильев, Е.И. Устинова
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Первый Московский государственный медицинский университет им. И.М. Сеченова
Бритвин Тимур Альбертович — доктор медицинских наук, ведущий научный сотрудник отделения хирургической эндокринологии
Литература:
1. Егоров А.В., Мусаев Г.Х., Кондрашин С.А. и др. Факторы, определяющие непосредственные результаты хирургического лечения инсулинпродцирующих опухолей поджелудочной железы // Хирургия. Журнал им. Н.И. Пирогова. — 2011. — № 6. — С. 1-6.
2. Бритвин Т.А., Гуревич Л.Е., Древаль А.В. и др. Диагностика и лечение нейроэндокринных опухолей поджелудочной железы. Пособие для врачей. — М.: Линко Групп, 2012. — 23 с.
3. Гуревич Л.Е. Нейроэндокринные опухоли желудочно-кишечного тракта и поджелудочной железы // Кн. «Руководство по иммуногистохимической диагностике опухолей человека», 4-е издание, дополненное и переработанное. — 2012. — Гл. 34. — С. 469-489.
4. Горбунова В.А., Орел Н.Ф., Кузьминов А.Е. Современные направления лечения нейроэндокринных опухолей //Современная онкология. — 2010. — № 1. — С. 7-12.
5. Guillermet-Guibert J., Lahlou H., Pyronnet S. et al. Somatostatin receptors as tools for diagnosis and therapy: molecular aspects // Best Practice and Research Clinical Gastroenterology. — 2012. — Vol. 1, № 4. — P. 535-551.
6. Oberg K.E., Reubi J.C., Kwekkeboom D.J., Krenning E.P. Role of somatostatins in gastroentrohancreatic neuroendocrine tumor development and therapy // Gastroenterology. — 2010. — Vol. 139, № 3. — P. 742-75.
7. Jais P., Terris B., Ruszniewski P. et al. Somatostatin receptor subtype gene expression in human endocrine gastroentero-pancreatic tumours // Eur. J. Clin. Invest. — 1997. — Vol. 27, № 8. — P. 639-64.
8. Strosberg J., Kvols L. Antiproliferative effect of somatostatin analogs in gastroenteropancreatic neuroendocrine tumors // World J. Gastroenterol. — 2010. — Vol. 16, № 24. — P. 2963-2970.
9. Reubi J.C. Somatostatin receptors in the gastrointestinal tract in health and disease // Yale Journal of biology and medicine. — 1992. — Vol. 65, № 5. — P. 493-536.
10. Volante M., Brizzi M., Faggiano A. et al. Somatostatin receptor type 2a immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy // Mod. Pathol. — 2007. — Vol. 20. — P. 1172-1182.
11. Papotti M., Bongiovanni M., Volante M. et al. Expression of somatostatin receptor types 1-5 in 81 cases of gastrointestinal and pancreatic endocrine tumors. A correlative immunohistochemical and reverse-transcriptase polymerase chain reaction analysis // Virchows Arch. — 2002. — Vol. 440, № 5. — P. 461-475.
12. Bertherat J., Tenenbaum F., Perlemoine K. et al. Somatostatin receptors 2 and 5 are the major somatostatin receptors in insulinomas: an in vivo and in vitro study // J.Clin. Endocrinol.Metab. — 2003. — Vol. 88. — P. 5353-5360.
13. Korner M., Waser B., Schonbrunn A. et al. Somatostatin receptor subtype 2a immunohistochemistry using a new monoclonal antibody selects tumors suitable for in vivo somatostatin receptor targeting // Am. J. Surg. Pathol. — 2012. — Vol. 36. — P. 242-252.
14. Schmida H.A., Lambertinib C., van Vugta H.H. et al. Monoclonal antibodies against the human somatostatin receptor subtypes 1-5: development and immunohistochemical application in neuroendocrine tumors // Neuroendocrinol. — 2012. — Vol. 95. — P. 232-247.
15. Appetecchia M., Baldelli R. Somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine tumours, current aspects and new perspectives // J. Exp. Clin. Canc. Res. — 2010. — Vol. 29, № 1. — P. 19-31