ТАМОКСИФЕН ГЕКСАЛ
Побочные эффекты
По данным Всемирной организации здравоохранения (ВОЗ) нежелательные реакции классифицированы в соответствии с их частотой развития следующим образом: очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10000, <1/1000) и очень редко (<1/10000); частота неизвестна — по имеющимся данным установить частоту возникновения не представлялось возможным.
Нарушения со стороны иммунной системы: гиперчувствительность.
Со стороны крови и лимфатической системы часто: анемия;
нечасто: лейкопения, тромбоцитопения; редко: агранулоцитоз, нейтропения; очень редко: панцитопения.
Со стороны эндокринной системы
часто: гиперкальциемия (особенно у пациентов с метастазами в кости в начале терапии).
Со стороны обмена веществ ы питания
очень часто: задержка жидкости в организме;
| часто: увеличение концентрации триглицеридов в плазме; |
очень редко: значительное повышение плазменной концентрации
триглицеридов иногда в сочетании с панкреатитом;
частота неизвестна: увеличение массы тела, анорексия.
Со стороны нервной системы часто: головная боль, головокружение;
частота неизвестна: депрессия, спутанность сознания, светобоязнь,
сонливость.
Со стороны органа зрения
часто: нарушение зрения (иногда обратимое, включая катаракту, ретинопатию, изменения роговицы);
редко: нейропатия зрительного нерва, неврит зрительного нерва (в редких случаях с развитием слепоты).
Со стороны сосудов
часто: судороги ног, транзиторные ишемические атаки, тромбоэмболия в т.ч. тромбоэмболия легочных артерий (риск развития тромбоэмболических осложнений повышается при комбинированной терапии с другими цитотоксическими препаратами), тромбоз глубоких вен нижних конечностей; нечасто: инсульт.
Со стороны дыхательной системы, органов грудной клетки и средостения
нечасто: интерстициальный пневмонит.
Со стороны желудочно-кишечного тракта очень часто: тошнота; часто: рвота, диарея, запор.
Со стороны печени и желчевыводящих путей
часто: увеличение активности «печеночных» трансаминаз, жировая
дистрофия печени; нечасто: цирроз печени;
очень редко: холестаз, гепатит, желтуха, некроз клеток печени, печеночная недостаточность (в т. ч. с летальным исходом).
Со стороны кожи и подкожных тканей очень часто: сыпь;
часто: крапивница, алопеция, реакции гиперчувствительности (включая ангионевротический отек); редко: васкулит;
очень редко: системная красная волчанка, полиморфная эритема, синдром Стивенса-Джонсона, буллезный пемфигоид.
Со стороны костно-мышечной и соединительной ткани часто: миалгия;
очень редко: оссалгия (боль в костях).
Со стороны половых органов и молочных желез
очень часто: вагинальное кровотечение, выделения из влагалища, нарушение менструального цикла (включая аменорею у женщин в предменопаузальном периоде);
часто: зуд в области гениталий, увеличение фиброидов матки,
пролиферативные изменения эндометрия (неоплазия, гиперплазия, полипы, редко эндометриоз); нечасто: рак эндометрия;
редко: поликистоз яичников, саркома матки (чаще злокачественная
смешанная опухоль Мюллера), полипоз влагалища, снижение либидо у мужчин, импотенция у мужчин.
Врожденные, семейные и наследственные изменения очень редко: поздняя кожная порфирия.
Общие расстройства и нарушения в месте введения
очень часто: приступообразные ощущения жара («приливы») (вследствие антиэстрогенного эффекта тамоксифена);
редко: боль в области пораженных тканей (особенно вначале терапии); частота неизвестна: повышение температуры тела, повышенная утомляемость.
| В начале лечения возможно местное обострение болезни — увеличение размера мягкотканых образований, иногда сопровождающееся выраженной эритемой пораженных участков и прилегающих областей — которое обычно проходит в течение 2-х недель. |
Как принимать тамоксифен от гинекомастии у мужчин
Препарат принимается внутрь, где вещество всасывается в ткани, а его максимальная концентрация в организме наступает через 4-7 часов. Для получения эффекта его необходимо принимать минимум 3-4 недели.
Как принимать тамоксифен при гинекомастии должен объяснить врач, и он же назначает необходимую дозировку, количество приемов в сутки и длительность приема.
К общим нормам приема, можно отнести: таблетку тамоксифена необходимо проглатывать с небольшим количеством воды не разжевывая во время еды. В зависимости от состояния пациента, может назначаться как прием один раз в сутки, так и два раза.
Консультация специалиста
Для получения положительного эффекта от приема тамоксифена при гинекомастии у мужчин лучше обратиться к врачу-эндокринологу, который будет работать с пациентом в индивидуальном порядке, сможет собрать анамнез, помочь с определением дозировки, объяснит с какими препаратами можно совмещать, а с какими нет и информация, полученная от специалиста, будет намного полезнее, чем отзывы на препарат в интернете и от знакомых.
Я, Романов Георгий Никитич, оказываю услуги платной онлайн консультации. Более двадцати лет назад я получил высшее медицинское образование и стал практикующим врачом-эндокринологом. На сегодняшний день я являюсь кандидатом медицинских наук, принимаю пациентов в своей клинике, и провожу консультации онлайн. За годы работы я приобрел колоссальный опыт и помог вернуться к нормальной жизни многим своим пациентам.
Записаться на мою консультацию можно в любом из представленных мессенджеров: Viber, Telegram, Instagram, WhatsApp, Skype, Вконтакте.
Эндокринная терапия рака молочной железы: канцерогенные эффекты тамоксифена
Основным антиэстрогенным препаратом для лечения больных гормонозависимым раком молочной железы (РМЖ) на протяжении многих десятилетий остается тамоксифен. Применение этого селективного модулятора эстрогеновых рецепторов при РМЖ обусловлено конкурентным связыванием с рецептором эстрогена. Между тем, несмотря на доказанную антиэстрогенную активность, тамоксифен характеризуется рядом побочных эффектов, в частности вызывает патологическую пролиферацию эндометрия, включая полипы, гиперплазию и рак тела матки. В статье проанализированы канцерогенные свойства тамоксифена. Необходимы дальнейшие исследования возможности персонализированного подхода к эндокринной терапии РМЖ тамоксифеном в целях снижения риска развития патологических пролиферативных процессов эндометрия. Выделение групп высокого риска развития патологии эндометрия может способствовать снижению риска возникновения серьезных нежелательных явлений на фоне терапии тамоксифеном.
Введение
В настоящее время тамоксифен является стандартом лечения гормонозависимого рака молочной железы (РМЖ) у женщин с сохраненной функцией яичников. На фоне пятилетнего приема препарата риск рецидива снижается на 41%, риск смерти от РМЖ – на 34%. В то же время тамоксифен эффективен при метастатическом РМЖ в пре-, пери- и постменопаузе [1, 2]. Тамоксифен долгое время считался безопасным лекарственным средством с небольшим количеством серьезных побочных эффектов. Однако впоследствии выяснилось, что длительное применение препарата в целях адъювантной терапии РМЖ опасно развитием вторичных злокачественных новообразований. Природа гормональной активности тамоксифена сложна и зависит от многих факторов, в том числе особенностей органа-мишени, уровней эндогенных эстрогенов и фармакогенетики. В основе противоопухолевого действия препарата лежит процесс образования комплекса с эстрогеновым рецептором. Это в свою очередь приводит к угнетению пролиферации опухолевых клеток и, как следствие, уменьшению вероятности рецидивирования и метастазирования гормонозависимой опухоли молочной железы. Установлено, что, несмотря на снижение риска рецидива гормонопозитивного РМЖ, а также риска развития контралатерального РМЖ, тамоксифен увеличивает риск развития опухолей других локализаций более чем в четыре раза. Сказанное особенно актуально для пациенток в постменопаузе, для которых прием тамоксифена в течение пяти лет и более ассоциируется с развитием рака и саркомы матки, характеризующихся неблагоприятным прогнозом [3].
Механизмы тамоксифен-ассоциированного канцерогенеза
Тамоксифен-ассоциированный канцерогенез основан на его эстрогенном, эпигенетическом и генотоксическом влиянии. Эстрогенный механизм характеризуется стимуляцией пролиферации клеток эндометрия, экспрессирующих атипичные варианты рецептора эстрогенов альфа, а также мембранного рецептора GPR30 (GPER, GPER1), активирующего G-белки [4, 5]. Тамоксифен способен оказывать стимулирующее действие на рост клеток при патологии эндометрия за счет частичного агонизма рецепторов эстрогенов альфа или через GPER1, который сверхэкспрессируется после длительного лечения тамоксифеном [5]. Этот процесс способствует активации MMP-2/9, что приводит к трансактивации EGFR. Рецептор GPER также может последовательно активировать MAPK и PI3K/Akt, вызывая экспрессию нескольких генов, связанных с выживанием, пролиферацией, дифференцировкой, миграцией и инвазией клеток. Скорее всего посредством данного механизма реализуется эстрогеноподобный эффект тамоксифена [6].
В научной литературе уже появились данные о корреляции продолжительности гормонотерапии тамоксифеном и экспрессии GPER. Кроме того, тамоксифен способствует ремоделированию цитоскелета и миграции клеток рака эндометрия [7].
Эпигенетический механизм основан на способности тамоксифена вызывать гиперметилирование промотора MGMT (O6-метилгуанин-ДНК-метилтрансферазы). В результате формируются мутации K-RAS и P53, обусловливающие неблагоприятный прогноз течения опухолей, развившихся на фоне приема тамоксифена [4]. Высокочастотные мутации Р53, которые выступают в качестве промоутеров генов-драйверов спорадических злокачественных новообразований (PTEN и K-RAS), связаны с изменениями в ДНК в виде микросателлитной нестабильности [8].
Данные о том, что Р53-положительные опухоли эндометрия встречаются чаще в группе пациенток, получающих тамоксифен (31,4 против 18,2%; p = 0,05), и реже экспрессируют рецепторы эстрогена (60,8 против 26,2%; p ≤ 0,001), подтверждают эпигенетический механизм тамоксифен-индуцированного канцерогенеза [9]. Тем не менее не исключено, что преимущество в росте и пролиферации имеют клетки эндометрия с уже существующими мутациями [10]. Это объясняет тот факт, что женщины в постменопаузе и женщины с типичными факторами риска, включая ожирение, подвержены более высокому риску развития тамоксифен-ассоциированного рака эндометрия, чем женщины в пременопаузе без факторов риска.
Генотоксический механизм канцерогенного действия тамоксифена основан на образовании производных аддуктов ДНК [4]. Тамоксифен является пролекарством, которое при попадании в организм расщепляется до активных метаболитов N-десметил-тамоксифена, 4-гидрокси-N-десметил-тамоксифена (эндоксифен) и 4-гидрокси-тамоксифена с участием системы цитохрома P450 (CYP) [11]. В ряде исследований в эндометрии обнаруживались полиморфные формы Р450, способные генерировать реактивные метаболиты тамоксифена, которые связываются с ДНК в эндометрии, вызывая генотоксический эффект и соответственно провоцируя развитие рака эндометрия [12].
Результаты исследований противоречивы. Анализ аддуктов ДНК в тканях эндометрия женщин с РМЖ, принимающих тамоксифен в качестве эндокринной терапии, не показал убедительных результатов. Образование аддуктов ДНК в тканях эндометрия было обнаружено на крайне низких уровнях и только у единичных пациентов [10]. Однако S. Shibutani и соавт., а также E.A. Martin и соавт. удалось обнаружить в эндометрии женщин, получавших терапию тамоксифеном, вещества, идентифицированные как транс- и цис-эпимеры R- (N2-дезоксигуанозинил) тамоксифена [13, 14]. Такие реактивные метаболиты могут выявляться в тканях эндометрия, миометрия и молочной железы в небольших количествах даже после однократного приема тамоксифена [15].
Таким образом, описанные механизмы свидетельствуют о том, что тамоксифен является канцерогеном, потенциально способным повышать риск развития метахронных опухолей.
Данные клинических исследований
Частота развития рака эндометрия на фоне пятилетнего применения тамоксифена не превышает 0,3% [16]. Тем не менее, согласно некоторым данным, больные раком эндометрия, индуцированным тамоксифеном, могут иметь более низкие показатели выживаемости [9].
Первые исследования канцерогенного действия тамоксифена на эндометрий появились в конце 1980-х гг., но то были единичные наблюдения или анализ относительно небольших групп больных.
B. Fisher и соавт. в 1998 г. опубликовали данные исследования NSABP-P-1 (National Surgical Adjuvant Breast and Bowel Project P-1 Study) в отношении химиопрофилактики РМЖ. В исследовании тамоксифен снижал риск развития РМЖ почти на 50% у 13 388 рандомизированных женщин (умеренно высокого риска) и в то же время увеличивал риск развития рака эндометрия (отношение рисков (ОР) 2,53; 95%-ный доверительный интервал (ДИ) 1,35–4,97). Повышенный риск развития рака эндометрия имел место преимущественно у женщин в возрасте 50 лет и старше. Во всех наблюдениях рак эндометрия в группе тамоксифена был выявлен на стадии I, случаев смерти от рака эндометрия не зарегистрировано. В данном исследовании не отмечалось увеличения частоты выявления рака печени, опухолей толстой кишки, яичников или других локализаций [17].
В рандомизированном исследовании ATLAS (Adjuvant Tamoxifen: Longer Against Shorter), включавшем 12 894 больных РМЖ, при десятилетнем периоде лечения тамоксифеном также отмечалось увеличение риска развития рака эндометрия (ОР 1,74). Кумулятивный риск развития рака эндометрия в течение 5–14 лет составил 3,1%, риск смерти – 0,4% для женщин, которым была назначена пролонгированная терапия тамоксифеном. В контрольной группе аналогичные показатели составили 1,6 и 2% соответственно (абсолютное увеличение смертности 0,2%). Но в целом клиническое преимущество пролонгированного применения тамоксифена с точки зрения эффективности лечения РМЖ оказалось существенно выше риска побочных эффектов. Максимальную пользу от пролонгированного приема тамоксифена в виде снижения риска смерти от РМЖ на 2,8% получили пациентки в пременопаузе. У них зафиксирован несоизмеримо более низкий риск смерти от рака эндометрия (0,4% у женщин, принимавших тамоксифен десять лет, 0,2% – у тех, кто принимал тамоксифен пять лет) [18].
Увеличение частоты развития рака эндометрия также стало наиболее серьезным побочным эффектом длительного лечения тамоксифеном в исследовании aTTom (adjuvant Tamoxifen – To offer more?). Всего в исследовании участвовало 6934 больных. Анализ результатов исследования проводился дважды: в 2008 и 2013 гг. Первая оценка частоты развития рака эндометрия показала двукратное увеличение показателей при десятилетнем приеме тамоксифена по сравнению с пятилетним (76 против 35 случаев соответственно) [19]. По результатам второго анализа зарегистрировано 102 случая рака эндометрия при десятилетнем лечении и 45 случаев – при пятилетнем (ОР 2,2). Таким образом, при десятилетнем периоде использования препарата риск смерти возрастал (р = 0,02). Смерть от рака эндометрия зафиксирована у 37 (1,1%) и 20 (0,6%) больных соответственно [20]. Очевидно, что продолжительность терапии тамоксифеном достоверно влияет на риск развития рака эндометрия.
В крупном исследовании STAR (Study of Tamoxifen and Raloxifene), проведенном группой по изучению рака молочной железы и колоректального рака NSABP, 19 747 женщин в постменопаузе (средний возраст – 58,5 года) с повышенным риском развития РМЖ получали перорально тамоксифен (20 мг/сут) или антиэстроген ралоксифен (60 мг/сут) в течение пяти лет. В группе больных, принимавших тамоксифен, случаев рака эндометрия зарегистрировано больше, чем в группе ралоксифена (ОР 0,62; 95% ДИ 0,35–1,08). Ежегодная заболеваемость раком тела матки составила 1,99% при приеме тамоксифена и 1,25% при использовании ралоксифена (ОР 0,62; 95% ДИ 0,35–1,08). Кумулятивная заболеваемость в течение семи лет составила 14,7% в группе тамоксифена и 8,1% в группе ралоксифена (р = 0,07). При этом гиперплазия эндометрия, фактор риска развития рака эндометрия, встречалась гораздо чаще в группе тамоксифена, причем разница была статистически значимой (ОР 0,16; 95% ДИ 0,09–0,29). Пациенток, перенесших гистерэктомию по причинам, не связанным со злокачественным новообразованием, в группе ралоксифена было значительно меньше (ОР 0,39; 95% ДИ 0,30–0,50). Примечательно, что в исследовании не описаны клинические исходы гиперплазии эндометрия. Более того, не зафиксировано повышения риска ее трансформации в рак эндометрия. При этом различие между группами пациенток, подвергшихся гистерэктомии по причинам, не связанным с опухолью, вероятно, привело к недооценке истинного риска развития патологии тела матки, ассоциированного с тамоксифеном, и уменьшению значимости различий между группами [21, 22].
В рандомизированное плацебоконтролируемое исследование IBIS-I было включено 7154 женщины как в пременопаузе, так и в постменопаузе в возрасте 35–70 лет с повышенным риском развития РМЖ. Установлено, что риск развития рака эндометрия возрастал в группе тамоксифена по сравнению с группой плацебо в течение первых пяти лет наблюдения (ОР 3,76; 95% ДИ 1,20–15,56). Однако после прекращения лечения риск развития рака эндометрия снижался до нормы (для 5–10-летнего наблюдения ОР 0,64; 95% ДИ 0,21–1,80; для периода наблюдения ≥ 10 лет ОР 1,40; 95% ДИ 0,38–5,61) [23]. Таким образом, кумулятивный канцерогенный эффект тамоксифена очевиден.
Несмотря на некоторую неуверенность в данных о гинекологической токсичности в описанных исследованиях, риск развития рака тела матки можно считать серьезным нежелательным эффектом терапии тамоксифеном. В метаанализе, включавшем 32 исследования тамоксифена в качестве эндокринотерапии РМЖ (n = 52 929), относительный риск развития рака эндометрия у женщин, получавших тамоксифен, составил 2,7 по сравнению с пациентками контрольной группы (ОР 2,70; 95% ДИ 1,94–3,75). Развитие рака эндометрия зафиксировано у больных в 23 исследованиях. Всего зарегистрировано 185 случаев рака эндометрия за средний период наблюдения 5,4 года. Наибольшему риску подвергались пациентки в постменопаузе. Изучение риска развития опухолей других локализаций, кроме РМЖ и рака эндометрия, не показало статистически значимой роли тамоксифена (ОР 1,04; 95% ДИ 0,92–1,17). Согласно данным 16 исследований, небольшое статистически значимое увеличение риска развития опухолей выявлено в отношении желудочно-кишечного тракта (ОР 1,31; 95% ДИ 1,01–1,69). В остальных исследованиях, в том числе единственном крупнейшем испытании (NASBP P-1), не сообщалось о существенном увеличении риска развития опухолей желудочно-кишечного тракта [24].
Один из последних крупных метаанализов S. Mocellin и соавт. был посвящен оценке эффективности химиопрофилактики у 50 927 женщин с повышенным риском развития РМЖ. Ученые проанализировали результаты использования селективных модуляторов эстрогеновых рецепторов (тамоксифена и ралоксифена) и ингибиторов ароматазы (экземестана и анастрозола). В трех исследованиях с участием 22 832 женщин в группе тамоксифена зарегистрировано снижение риска развития РМЖ по сравнению с группой плацебо (ОР 0,68; 95% ДИ 0,62–0,76). Что касается побочных эффектов, в двух исследованиях с участием 20 361 женщины в отличие от плацебо тамоксифен вызывал увеличение частоты нежелательных явлений (ОР 1,28; 95% ДИ 1,12–1,47). В частности, пациентки группы тамоксифена достоверно имели более высокую частоту рака эндометрия (ОР 2,26; 95% ДИ 1,52–3,38) [25].
Согласно имеющимся данным, помимо рака эндометрия тамоксифен ассоциируется с повышением риска развития саркомы матки [26]. Результаты ряда исследований показали, что тамоксифен значительно увеличивает риск развития неэндометриоидных опухолей. Смертность, связанная с этими морфологическими вариантами, в 2,3–5,4 раза выше, чем при эндометриоидном раке тела матки [8, 27].
Большинство сарком, связанных с тамоксифеном, о которых сообщалось в литературе, имели структуру МММТ (злокачественная смешанная мезодермальная опухоль) [28].
Аденофибромы, аденосаркомы и карциносаркомы (злокачественные смешанные мюллеровы опухоли) также были описаны при использовании тамоксифена [29, 30]. Вероятно, существует связь между карциносаркомой матки и терапией тамоксифеном, особенно длительной. Однако не ясно, существует ли подобная корреляция с аденофибромой и аденосаркомой, поскольку зарегистрировано только несколько случаев. Высказывается предположение, что перигландулярная стромальная конденсация, часто обнаруживаемая в полипах эндометрия на фоне лечения тамоксифеном по поводу РМЖ, в ряде случаев может трансформироваться в аденосаркому [31]. Несмотря на это, геномный анализ показал, что нет глобальных достоверных различий между опухолями, индуцированными тамоксифеном, эндометриоидными или неэндометриоидными и опухолями, возникающими у пациенток, не принимающих тамоксифен [32, 33].
Выводы
Итак, очевидно, что увеличение частоты патологических изменений органов репродуктивной сферы у женщин и развитие вторичных опухолей различных локализаций относятся к проявлениям канцерогенного эффекта тамоксифена. Представленные данные могут быть полезны при гинекологическом наблюдении и консультировании во время лечения тамоксифеном пациенток с РМЖ в целях раннего выявления вторичных опухолей женской репродуктивной системы и, возможно, профилактики гинекологического рака у данной группы больных. Однако по-прежнему не решен вопрос выявления групп пациенток с максимальным риском развития патологии эндометрия, что исключает возможность персонализации терапии антиэстрогенами.
Использование тамоксифена при РМЖ, особенно назначение пролонгированной эндокринотерапии или эндокринопрофилактики этим антиэстрогеном, требует тщательного обсуждения всех потенциальных преимуществ и рисков. В силу гинекологической токсичности необходимо найти способ прогнозирования канцерогенных эффектов, определить, какие женщины с наибольшей вероятностью получат максимальную пользу при минимальных побочных эффектах терапии тамоксифеном. Представляется необходимым поиск дополнительных данных для выделения групп больных – кандидатов на этот вид терапии. Важным вопросом остается выбор оптимальной дозы тамоксифена с учетом метаболизма каждой конкретной пациентки.
Таким образом, проблема достижения баланса между вредом и пользой от той или иной терапии активно обсуждается мировым онкологическим сообществом и требует дальнейшего изучения.
Заключение
Тамоксифен характеризуется наличием побочных эффектов, но его клиническая значимость от этого не снижается. Вместе с тем любое потенциальное негативное влияние терапии на общую выживаемость больных при условии, что излечение от гормонопозитивного РМЖ возможно, требует активного выявления жизнеугрожающих нежелательных явлений, таких как вторичные злокачественные новообразования. Это чрезвычайно важно при наблюдении за больными во время или после эндокринотерапии и принятии решений об использовании тамоксифена не только в лечебных, но и профилактических целях.
Несмотря на длительную историю изучения канцерогенных свойств тамоксифена, особенно в отношении развития патологии органов женской репродуктивной системы, способ их предотвращения не найден. Очевидно, что пациентки, принимающие тамоксифен, должны быть проинформированы о рисках гиперплазии эндометрия, рака эндометрия и саркомы матки, а также о любых аномальных вагинальных кровотечениях, кровянистых выделениях из влагалища. Женщины в постменопаузе, принимающие тамоксифен, должны находиться под тщательным наблюдением онкологов и гинекологов.
Необходимо разработать стратегию оценки рисков развития патологии эндометрия у больных РМЖ, получающих терапию тамоксифеном. Подобная тактика предполагает изучение исходного состояния гормонального статуса больных, их индивидуальных, а также структурных и молекулярно-генетических характеристик, особенностей метаболизма препарата.
Тамоксифен на ПКТ: как принимать
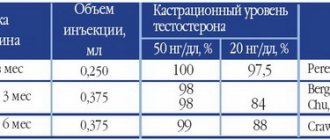
Дозировки препарата на восстановительном этапе зависят от длительности стероидного цикла. Тамоксифен цитрат в бодибилдинге используют после любых анаболиков за исключением Нандролона и Тренболона.
Схема приема Тамоксифена для мужчин после 6-недельного курса:
- 20 дней: по 20 мг.
- 10 дней: по 10 мг + 50 мг цинка + 10 мг витамина B6.
Общее количество Тамоксифена: 50 таб. на 10 мг. Длительность ПКТ: 30 суток.
Прием Тамоксифена после курса на 8-12 недель.
- 10 дней: по 40 мг.
- 25 дней: по 20 мг + 50 мг цинка + 10 мг витамина B6.
- 10 дней: по 10 мг + 50 мг цинка + 10 мг витамина B6.
Итого Тамоксифена: 100 таб. на 10 мг. Продолжительность ПКТ: 45 суток.
Восстановительная терапия Тамоксифеном после курса на 16 недель и более:
- 10 дней: по 60 мг.
- 30 дней: по 40 мг.
- 10 дней: по 20 мг.
- 10 дней: по 10 мг + 50 мг цинка + 10 мг витамина B6.
Общее количество Тамоксифена: 210 таб. по 10 мг. Длительность применения: 60 суток. После отмены антиэстрогена на протяжении 30 дней принимают цинк по 25-30 мг + витамин B6 по 10 мг + витамин Е по 200 МЕ/день. Спустя 2 месяца для контроля эффекта необходимо сдать анализы на гормоны: ЛГ, ФСГ, эстрадиол, пролактин, тестостерон общий, ГСПГ, прогестерон.
Отзывы спортсменов и специалистов
Как видите, дозировки препарата в обоих случаях одинаковы. А вот начало приема существенно отличается.
По наблюдениям спортсменов и тренеров, выбор схемы применения зависит от индивидуальных особенностей организма.
Если у бодибилдера есть склонность к гинекомастии, то ему обязательно надо использовать Тамоксифен вместе с приемом стероидов. Причем чем раньше, тем лучше.
Обычно такие спортсмены начинают употребление препарата уже с конца первой недели стероидного курса.
Если склонности к гинекомастии нет, то желательно не добавлять Тамоксифен в стероидный цикл.
Дело в том, что ряд специалистов категорически против совмещения анаболических стероидов и препаратов, подавляющих ароматизацию (Тамоксифен и Кломид).
Они утверждают, что для максимально быстрого мышечного роста ароматизация в небольших количествах просто необходима!
В качестве аргумента приводятся результаты исследований, где было показано замедление темпов роста мышц в 1,5 раза при совмещении анаболиков и антиэстрогенов.
Поэтому для людей, не склонных к гинекомастии, специалисты рекомендуют строить стероидные циклы на препаратах, не поддающихся ароматизации. Чтобы пресечь проблему в корне.
Самые популярные стероиды из этой группы:
- Дека-дураболин (нандролона деканоат)
- Параболан (тренболона ацетат)
- Примоболан
- Анавар (оксандролон)
- Туринабол
- Болденон/Эквипойз
- Винстрол (станозолол)
Побочные эффекты
Тамоксифен при гинекомастии у мужчин при правильном приеме, отсутствии непереносимости действующего вещества и соблюдении прописанной врачом дозировки не должен давать каких-либо серьезных побочных эффектов.
Редко, но у мужчин могут встречаться такие побочные эффекты:
- отсутствие аппетита, приступы тошноты и рвоты, болевые ощущения в области живота;
- может увеличиться количество печеночных ферментов и даже дойти до нарушения функции печени;
- появление головной боли, утомленного состояния, головокружения, деформация в роговице, нарушение функции зрения;
- в индивидуальном порядке может появиться сыпь на кожных покровах;
- при недостаточном или слишком высоком уровне некоторых микронутриентов, может развиться гиперкальциемия;
- повышенная температура тела;
- облысение различного вида;
- боли в костях.
Если в период приема препарата появляются побочные эффекты, то необходимо прекратить прием лекарственного средства и обратиться к врачу.
Тамоксифен: польза в бодибилдинге
Препарат относится к средствам с антиэстрогенным эффектом, т.е. блокирующим рецепторы эстрогенов. Зачем это нужно спортсмену? Дело в том, что стероиды, увеличивая выработку тестостерона, одновременно повышают и уровень женских гормонов, в частности эстрадиола. Если с симптоматикой не бороться использованием ингибиторов ароматазы (анастрозол, летрозол) или их применение оказывается недостаточным, и развиваются первые стадии гинекомастии, то мужчина вместо эффектной мускулистой фигуры рискует приобрести обвисшую грудь и бедра, заполучить проблемы с жизненным тонусом, а заодно и множество других малоприятных последствий. Для предупреждения таких реакций в случае, когда ингибиторов ароматазы и пролактина недостаточно – используют дополнительно Тамоксифен (на курсе с надролоном и тренболоном не подходит), который блокирует действие эстрогенов в организме.
При этом по стоимости Тамоксифен доступнее, чем его главный конкурент Фарестон, что делает его более популярным среди культуристов, однако, Тамоксифен нельзя использовать на курсе с Надролонами и Тренболоном, чего нельзя сказать о Фарестоне. Преимуществом препарата является также мягкое воздействие на организм. Если не злоупотреблять им, вероятность развития неприятных реакций минимальна. Для контроля состояния рекомендуется регулярно сдавать анализы на гормоны.
Тамоксифен и ПКТ
Многие используют тамоксифен после курса стероидов за счет дешевизны. Использование позволяет яичкам работать быстрее и выделять собственный тестостерон. В результате: собственная выработка мужского гормона нормализуется, за счет этого мышечная масса сохраняется. Но вот в чем загвоздка. Прямая функция тамоксифена – это погашение уровня эстрогена в организме. А среди его недостатков выделяют замедленную работу яичек, что говорит о не лучшем выборе препарата на ПКТ. Для послекурсовой терапии есть очень эффективный препарат – кломифен цитрат, который отлично справляется со своей задачей и считается более рекомендуемым на ПКТ. Правда, его стоимость в 2-3 раза выше, чем у тамоксифена, но и результат значительно лучше.