Что такое антибиотики?
Антибиотики – вещества, способные подавлять рост микроорганизмов или уничтожать их. Согласно определению ГОСТа, к антибиотикам относятся вещества растительного, животного или же микробного происхождения. В настоящее время это определение несколько устарело, так как создано огромное количество синтетических препаратов, однако прообразом для их создания послужили именно природные антибиотики.
Классификация антибиотиков:
- Антибактериальные антибиотики угнетают развитие бактерий. Некоторые из них, напр, бензил пенициллин, Макролиды, ристомицин (ристоцетин, спонтин), новобиоцин и другие, активны в основном лишь в отношении грамположительных микробов, другие, как, например, полимиксин, подавляют развитие главным образом грамотрицательных бактерий, третьи, например, тетрациклины, левомицетин (хлорамфеникол, хлоромицетин), аминоглюкозиды (стрептомицин, мономицин, канамицин, неомицин и гентамицин), так называемые антибиотики широкого спектра действия, задерживают рост как многих грамположительных, так и грамотрицательных бактерий.
- Противогрибковые антибиотики оказывают специфическое угнетающее действие на рост грибков. Широкое применение в медицинской практике нашли антибиотики нистатин и леворин, используемые для лечения кандидоза и других заболеваний, вызываемых дрожжеподобными грибами. Антибиотик амфотерицин Б применяется для лечения генерализованных и глубоких микозов.
- Противоопухолевые антибиотики. Установлено, что некоторые антибиотики угнетают развитие не только бактерий и грибков, но способны также задерживать размножение клеток злокачественных опухолей. Некоторые из этих препаратов нашли применение в медицинской практике.
Антибиотики, или, как их еще называют, противомикробные препараты, подавляют патогенные микроорганизмы — бактерии или грибки. А вирусы — это не организмы, они живут внутри клеток человека.
Амоксиклав при лечении бронхолегочных инфекций
О статье
62859
0
Регулярные выпуски «РМЖ» №5 от 16.03.2005 стр. 264
Рубрика: Общие статьи
Авторы: Ленкова Н.И. 1 , Евдокимова С.А. , Демченкова Е.Ю. 1 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Для цитирования:
Ленкова Н.И., Евдокимова С.А., Демченкова Е.Ю. Амоксиклав при лечении бронхолегочных инфекций. РМЖ. 2005;5:264.
Бактериальные инфекции органов дыхания являются одной из серьезных медико–социальных проблем. Основное направление в лечении инфекций верхних и нижних отделов дыхательных путей заключается в использовании антибактериальных препаратов, приводящих к подавлению жизнедеятельности микроорганизмов в результате угнетения специфического для них метаболического процесса (связывание антибиотика с ферментом или структурной молекулой бактерий) [11].
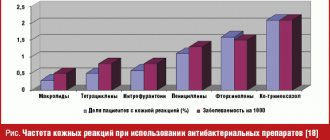
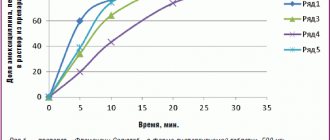
Несмотря на наличие большого количества современных антибиотиков, перед каждым лечащим врачом всегда стоит проблема выбора оптимального препарата. При выборе антибактериального препарата для лечения пневмоний и обострений хронического бронхита необходимо учитывать возраст, тяжесть состояния больного, наличие сопутствующих заболеваний, условий развития болезни. Одной из групп антибактериальных препаратов, хорошо зарекомендовавших себя для лечения инфекций органов дыхательной системы, являются полусинтетические защищенные пенициллины. К представителям данной группы относится Амоксиклав® (амоксициллин/клавулант, Лек, Словения), высокая эффективность и безопасность которого доказана многочисленными исследованиями. Амоксиклав – антибиотик широкого спектра действия, который представляет собой комбинацию полусинтетического пенициллина амоксициллина и ингибитора b–лактамаз – клавулановой кислоты. Соотношения компонентов препарата для приема внутрь – 2:1, 4:1, 7:1, для парентеральной формы – 5:1 [10]. Амоксиклав обладает высокой бактерицидной активностью, в том числе в отношении штаммов микроорганизмов, резистентных к одному амоксициллину [6]. Активность данного препарата наблюдается в отношении [2,10]: • аэробных грамположительных бактерий (включая штаммы, продуцирующие b–лактамазы): Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus anthracis, Streptococcus pneumoniae, Strepto– coccus viridans, Enterococcus faecalis, Corynebacterium spp., Listeria monocytogenes; • анаэробных грамположительных бактерий: Clostri– dium spp., Peptococcus spp., Peptostreptococcus spp.; • аэробных грамотрицательных бактерий (включая штаммы, продуцирующие b–лактамазы): Escherichia coli, Proteus mirabilis, Proteus vulgaris, Klebsiella spp., Salmonella spp., Shigella spp., Bordetella pertussis, Yersinia enterocolitica, Gardnerella vaginalis, Neisseria meningitidis, Neisseria gonorrhoeae, Moraxella catarrhalis, Haemophilus influenzae, Haemophilus ducreyi, Yersinia multocida (ранее Pasteurella), Campylobacter jejuni; * анаэробных грамотрицательных бактерий (включая штаммы, продуцирующие b–лактамазы): Bacteroides spp., включая Bacteroides fragilis. Клавулановая кислота подавляет II, III, IV и V типы b–лактамаз, неактивна в отношении b–лактамаз I типа, продуцируемых Enterobacter spp., Pseudomonas aeruginosa, Serratia spp., Acinetobacter spp. Клавулановая кислота обладает высокой тропностью к пенициллиназам, благодаря чему образует стабильный комплекс с ферментом, что предупреждает ферментативную деградацию амоксициллина под влиянием b–лактамаз [2,4,9]. Широкий спектр антимикробного действия и активность в отношении амоксициллинрезистентных штаммов делают Амоксиклав незаменимым в лечении бронхолегочной инфекции, особенно при высоком риске наличия возбудителей, продуцирующих b–лактамазы, преимущественно у больных с иммунодефицитом, при внутрибольничной инфекции [1,5,8]. Фармакологические характеристики амоксициллина и клавулановой кислоты очень похожи. При внутривенном введении концентрации в сыворотке обоих веществ многократно превосходят необходимые лечебные концентрации. При пероральном приеме они быстро всасываются в кровь. Пиковые уровни обоих соединений в сыворотке достигаются примерно через час после приема препарата. Одновременное употребление пищи не влияет на абсорбцию. Препарат хорошо распределяется в органах и тканях, создавая достаточные концентрации для уничтожения штаммов чувствительных бактерий. Помимо плазмы крови, высокая концентрации Амоксиклава наблюдается в мокроте, бронхиальном секрете, ткани легкого, плевральной жидкости. По степени проникновения в легочную ткань амоксициллин/клавуланат превосходит ампициллин [9]. Концентрации амоксициллина в мокроте в два раза превышают концентрации ампициллина при приеме одинаковых доз препарата. Причем концентрации первого средства значительно дольше сохраняются в мокроте на терапевтическом уровне. Оба компонента препарата метаболизируются в печени: амоксициллин – на 10% от введенной дозы, клавулановая кислота – на 50% [2,4,9]. Препарат выводится в основном почками (клубочковая фильтрация и канальцевая секреция): 50–78% дозы амоксициллина и 25–40% клавулановой кислоты выводятся в неизмененном виде в течение первых 6 ч после приема [2,4,9]. Побочные эффекты при применении препарата в большинстве случаев слабые и преходящие. Представлены в основном изменениями со стороны пищеварительного тракта и аллергическими реакциями [2,4,9]. Амоксиклав разрешен к применению во все триместры беременности. Препарат имеет несколько лекарственных форм: для приема внутрь: Амоксиклав в таблетках в дозах 375 мг, 625 мг и 1000 мг, что позволяет использовать его в амбулаторной практике, и для парентерального введения – флаконы по 600 мг и 1200 мг (табл. 1). Амоксиклав можно сочетать с антибактериальными препаратами других групп. Наличие различных форм Амоксиклава подразумевает возможность как парентеральной терапии, так и приема per os. В лечении нетяжелых (амбулаторных) форм внебольничных пневмоний и обострений хронического бронхита предпочтение следует отдавать пероральным формам антибиотика. При тяжелом течении инфекции антибиотик необходимо вводить парентерально. Высокоэффективной является и ступенчатая терапия, которая предполагает переход с парентерального пути введения препарата на пероральный – при условии стабилизации состояния больного или улучшения течения заболевания [3]. Обычно это осуществляется на 2–3–й день от начала лечения. Ступенчатая антибактериальная терапия может обеспечить эффективную терапию пневмоний и обострений хронических бронхитов [3]. Средняя продолжительность парентерального применения антибиотиков составляет 2–3 дня, а пероральная терапия проводится 5–7 дней. Нами проводилось изучение эффективности Амоксиклава. Группу наблюдения составили 20 больных с рентгенологически подтвержденной пневмонией, средний возраст пациентов – 60,7 лет. Состояние 6 больных было расценено как средней тяжести, остальных – как удовлетворительное. Лечение всех пациентов начато с внутривенного капельного введения препарата по 1,2 г каждые 8 часов в течение 2–3–х дней. После достигнутого клинического улучшения внутривенная терапия заменена на пероральную. Амоксиклав назначался в дозе 625 мг каждые 8 часов внутрь с приемом пищи. Общая продолжительность лечения препаратом составила в среднем 9 суток. Клиническая эффективность Амоксиклава оказалась высокой (100%), выздоровление констатировано у всех 20 наблюдавшихся. Бактериологическая эрадикация достигнута у 16 больных (80%). Группу сравнения составили 20 больных пневмониями, получавших цефотаксим по традиционной схеме парентерально: по 1 г внутримышечно каждые 8 часов, в среднем 8 суток. Выздоровление в этой группе отмечалось в 80% случаев, у 10% больных – уменьшение инфильтративных изменений при полном купировании признаков бактериальной инфекции. Бактериологическая эффективность составила 82,6%. Таким образом, клиническая эффективность Амоксиклава была выше, а бактериологическая – сопоставима с эффективностью цефотаксима. Стоимость 7–дневного курса терапии Амоксиклавом по ступенчатой схеме составляет 42,51 у.е. Стоимость 7–дневного курса терапии цефотаксимом при внутримышечном введении (включая расходные материалы) составляет 49,77 у.е. (при внутривенных инфузиях стоимость увеличивается в 1,3 раза). К числу важнейших преимуществ ступенчатой терапии по сравнению с парентеральной относится удобство применения и улучшение экономических показателей. Они складываются из снижения затрат в связи с меньшей стоимостью лекарственных форм антибиотика для приема внутрь по сравнению с парентеральными, меньшими затратами на парентеральный антибиотик, применяемый коротким курсом, снижением расходов на шприцы, растворы для внутривенного введения, сокращением затрат рабочего времени медперсонала и уменьшением риска и числа постинъекционных осложнений. Ступенчатая терапия является экономически обоснованным режимом, обеспечивающим преимущества как для пациента, так и для стационара. При ее использовании стоимость лечения снижается на 30–60% [7]. Тяжелое течение пневмоний требует применения парентерального пути введения препаратов, а в ряде случае – комбинированной терапии с использованием антибиотиков других групп. Литература 1. Авдеев С.Н., Чучалин А.Г. «Роль бактериальной инфекции и выбор антибиотиков при обострении хронического бронхита». // Consilium, №2, 2000 г. 2. «Антибактериальные лекарственные средства. Методы стандартизации препаратов» под редакцией Хабриева Р.У. // Медицина, 2004 г. 3. Буданов С. В. «Ступенчатая антибиотикотерапия инфекций». // Клинический вестник, №4, 1996 г. 4. Государственный реестр лекарственных средств, 2004 г. 5. Иоффе Л.Ц., Бейсебаев Н.А., Шацких В.В., Салимова С.С., Ауельбекова Г.А., Есетова Г.У. «Амоксиклав в лечении инфекций нижних дыхательных путей». // 12 Национальный конгресс по болезням органов дыхания, 2002 г. 6. Кривциов Е.В., Прохорович Е.А., Алексанян А.А., Макарян А.С., Чибикова А.А. «Сравнительная характеристика полусинтетических пенициллинов (ампициллина и амоксициллина/клавулановой кислоты) и фторхинолонов (пефлоксацина и ципрофлоксацина) при лечении больных внебольничной пневмонией». // Медицинская картотека, №2, 1999 г. 7. Ноников В.Е., Константинова Т.Д., Ленкова Н.И., Аргеткина И.Н. «Фармакоэкономические аспекты антибактериальной терапии пневмоний». // Инфекция и антимикробная терапия, №2, 1999 г. 8. Ноников В. Е., Константинова Т. Д., Ленкова Н. И., Минаев В. И., Ритчик Л. А. «Эффективность амоксициллин/клавуланата калия при лечении бронхолегочных инфекций в стационаре». // Антибиотики и химиотерапия, №10, 1997 г. 9. Справочник Видаль, 2003 г. 10. Страчунский Л.С., Козлов С.Н. «Пенициллины, часть 2. Ингибиторозащищенные и комбинированные пенициллины». // Русский медицинский журнал, №2, 2000 г. 11. Страчунский Л.С., Белоусов Ю.Б., Козлов С.Н. «Антибактериальная терапия. Практическое руководство». // РЦ «Фармедининфо», 2000 г.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Почему антибиотики не убивают коронавирус?
Новый китайский коронавирус негативно воздействует на дыхательную систему и приводит к развитию пневмонии. Известно, что при таком поражении легких в обычных случаях для лечения назначают как раз антибиотики. Однако в случае с COVID 19 никакой пользы от них не будет.
Антибиотики не убивают коронавирус, так как они целенаправленно действуют на клеточную оболочку бактерии. Если пациент решит самостоятельно принимать препарат или вводить его в уколах при коронавирусной инфекции, то никакого улучшения не будет, но резко возрастает риск возникновения побочных реакций.
Применение амоксициллина при внебольничной пневмонии у детей
Внебольничная пневмония (ВП) является одной из самых актуальных проблем современной медицины и состоит из целого ряда эпидемиологических, клинических, фармакологических и, наконец, социальных аспектов. Парадокс пневмонии состоит в том, что, с одной стороны, достигнуты впечатляющие результаты в понимании патогенеза инфекционного процесса, повышении эффективности химиотерапии, а с другой — происходит увеличение числа больных с тяжелой формой болезни и смертности [3]. За год диагноз «пневмония» в РФ ставится более 17 млн человек. К группе риска следует отнести детей до 5 лет и пожилых людей в возрасте старше 65 лет [4]. Пневмония является главной причиной смертности детей во всем мире. Ежегодно пневмония уносит жизни около 1 млн детей в возрасте до пяти лет (в 2015 г. — 920 136 детей, 15% всех от всех случаев смерти детей в мире) [1]. В России заболеваемость ВП ежегодно растет. Так, в 2021 г. заболеваемость внебольничной пневмонией взрослых и детей составила 418,02 на 100 тыс. населения, что на 24% выше, чем в предыдущем 2015 г. (337,1 соответственно) (рис.).
Как и в предыдущие годы, в 2021 г. максимальный показатель заболеваемости ВП наблюдался у детей в возрастной группе 1–2 лет (1456,7 на 100 тыс.). Показатель смертности от пневмонии в 2021 г. в РФ составил 4,9 на 100 тыс. населения, а некоторых регионах достигал 18,8–22,1 на 100 тыс. населения (в Республике Алтай, Тюменской, Сахалинской, Кировской, Амурской обл.) [19]. По данным Минздрава РФ, болезни органов дыхания у детей в возрасте 0–17 лет занимают третье место в структуре причин смерти после внешних причин и пороков развития. В 2021 г. смертность детей до 17 лет от внебольничной пневмонии составила 0,4 на 100 тыс. населения, при этом за последние 5 лет существенных изменений данного показателя для детей до 17 лет не зарегистрировано [19].
Под внебольничной пневмонией следует понимать острое заболевание, возникшее вне стационара или диагностированное в первые 48 ч от момента госпитализации, или развившееся у пациента, не находившегося в домах сестринского ухода/отделениях длительного медицинского наблюдения более 14 сут, проявляющееся симптомами системного воспаления (лихорадка, одышка, тахикардия, лейкоцитоз), нарушением самочувствия (отказ от еды, сонливость, неадекватность поведения), признаками инфекционного поражения нижних отделов дыхательных путей (кашель, выделение мокроты, боль в грудной клетке на высоте вдоха) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы [3].
Пневмония является инфекционным заболеванием, связанным с проникновением микроорганизмов в респираторную систему. Возникающая при этом воспалительная реакция в паренхиме легких зависит от количества и вирулентности микроорганизма, состояния защитных механизмов дыхательных путей и организма в целом. Основной путь проникновения микроорганизма в легочную ткань — аэрогенный. Микроорганизм, преодолев защитные барьеры дыхательных путей, может попасть непосредственно в альвеолы и там интенсивно размножаться. Под действием токсинов микроба нарушается проницаемость капилляров, развивается серозный отек. Отечная жидкость, содержащая большое количество бактерий, быстро распространяется через альвеолярные поры на всю долю легкого, нередко вовлекая в воспалительный процесс плевру. Экссудат из серозного быстро превращается в фибринозный, пораженная часть легкого становится плотной. Нарушения проходимости бронхов, расстройства микроциркуляции, воспалительная инфильтрация, интерстициальный отек легочной паренхимы и снижение воздушности легочной паренхимы приводят к нарушению перфузии газов и гипоксемии; последняя сопровождается респираторным ацидозом, гиперкапнией, компенсаторной одышкой и появлением клинических признаков дыхательной недостаточности [5].
В соответствии с МКБ-10 и «Классификацией клинических форм бронхолегочных заболеваний у детей» по этиологии выделяют следующие формы пневмонии: бактериальная, вирусная, грибковая, паразитарная, хламидийная, микоплазменная, смешанная [6, 7]. Заболеваемость бактериальной пневмонией в 2021 г. была в 16,5 раз выше, чем вирусной (112,4 и 6,8 на 100 тыс. населения соответственно).
По морфологическим формам выделяют: очаговую, очагово-сливную, сегментарную, полисегментарную, лобарную и интерстициальную пневмонию. При очаговой форме возникает один или несколько очагов пневмонической инфильтрации размером 1–2 см.
- Очагово-сливная (псевдолобарный инфильтрат) — неоднородная массивная пневмоническая инфильтрация, состоящая из нескольких очагов. Может осложняться деструктивными процессами и экссудативным плевритом. Сегментарная — пневмония, границы которой повторяют анатомические границы 1-го сегмента.
- Полисегментарная — пневмония, границы которой повторяют анатомические границы нескольких сегментов. Часто протекает с уменьшением размеров пораженного участка легкого (ателектатический компонент).
- Лобарная (долевая) пневмония — воспалительный процесс охватывает долю легкого. Вариантом течения долевой пневмонии является крупозная пневмония.
- Интерстициальная — наряду с негомогенными инфильтратами легочной паренхимы имеются выраженные, иногда преобладающие изменения в интерстиции легких. Редкая форма пневмонии, которая развивается у больных с иммунодефицитными состояниями.
По течению выделяют ВП с острым течением (длительностью до 6 недель) или затяжным (длительностью более 6 недель). Хронический вариант течения пневмонии в настоящее время не рассматривается и не включен в «Классификацию клинических форм бронхолегочных заболеваний у детей» [6, 7].
По тяжести различают ВП средней тяжести и тяжелую. Тяжесть ВП определяется выраженностью клинических проявлений и наличием осложнений. Осложнения — плевральные (плеврит), легочные (полостные образования, абсцесс), легочно-плевральные (пневмоторакс, пиопневмоторакс), инфекционно-токсический шок [6, 7].
У детей 3 мес — 5 лет чаще всего ВП вызывает S. pneumoniae (по данным отдельных исследований, их доля составляет 70–88% случаев [8, 9]). Из типичных бактерий также определенную роль играет H. influenzae типа b (до 10% случаев, преимущественно у детей до 2 лет).
Диагностика ВП на основании клинических симптомов сопряжена с существенными трудностями. Диагноз пневмонии необходимо выставить у постели больного, но он считается достоверным только при выявлении на рентгенограмме грудной клетки инфильтрации легочной ткани и наличии не менее двух из нижеследующих критериев [11]:
1) лихорадка выше 38 °C в течение трех и более суток; 2) кашель с мокротой; 3) физикальные симптомы пневмонии (локальное ослабление дыхания и мелкопузырчатые влажные хрипы); 4) лейкоцитоз > 15 × 109/л и/или число палочкоядерных нейтрофилов > 10%.
Для решения вопроса о госпитализации и определения необходимого объема медицинской помощи необходимо оценить степень тяжести ВП. В табл. 2 представлены ключевые критерии для оценки тяжести ВП у детей в зависимости от возраста, предлагаемые Европейским респираторным обществом (European Respiratory Society, ERS) [13].
Факторы риска летального исхода от пневмонии у детей [10]:
- возраст до 5 лет и мужской пол;
- неблагоприятный преморбидный фон детей;
- низкий социально-экономический статус семьи;
- позднее обращение за медицинской помощью;
- позднее поступление в стационар.
В подавляющем большинстве случаев (около 80%) дети с ВП могут эффективно лечиться в домашних условиях. Показаниями для госпитализации являются [11]:
- возраст до 6 месяцев жизни;
- тяжелая форма болезни;
- наличие тяжелых фоновых заболеваний — врожденный порок сердца, хронические болезни легких, сопровождающиеся инфекцией (бронхолегочная дисплазия, муковисцидоз, бронхоэктатическая болезнь и др.), иммунодефицит, сахарный диабет;
- проведение иммуносупрессивной терапии;
- отсутствие условий для лечения на дому или гарантий выполнения рекомендаций — социально неблагополучная семья, плохие социально-бытовые условия (общежитие, дом ребенка, пункт временного размещения и др.);
- отсутствие ответа на стартовую антибактериальную терапию (АБТ) в течение 48 ч (сохранение высокой лихорадки, нарастание дыхательной недостаточности, появление возбуждения или угнетения сознания).
АБТ оказывает решающее влияние на прогноз пневмонии [5, 12]. Выбор АБТ в каждом случае ВП проводится индивидуально с учетом природной активности препаратов в отношении возбудителя и его возможной приобретенной резистентности, тяжести и течения заболевания, наличия у пациента противопоказаний к использованию тех или иных антибиотиков. Принцип выбора АБТ в зависимости от возбудителя ВП представлен в табл. 3.
В клинической практике, особенно в амбулаторных условиях, чаще проводится эмпирическая АБТ, с учетом наиболее вероятного возбудителя и его чувствительности в регионе, возраста больного, наличия фоновых заболеваний, токсичности и переносимости антибактериальных препаратов (АБП) для конкретного пациента.
Проведенные доказательные исследования показали, что применение амоксициллина перорально при неосложненной ВП у детей в возрасте от 3 мес до 5 лет не уступает по эффективности бензилпенициллину или ампициллину, введенному внутривенно [15, 16]. В связи с этим у всех детей с ВП, не имеющих показаний к госпитализации, а также у госпитализированных детей со среднетяжелой ВП целесообразно использование пероральной АБТ.
У детей в возрасте старше 3 мес основным АБП для лечения ВП является амоксициллин (в стандартной дозе — 45–50 мг/кг в сутки), поскольку данный антибиотик обладает высокой стабильной активностью в отношении самого частого и опасного возбудителя — S. pneumoniae, а также в большинстве случаев активен в отношении H. influenzae [13, 15, 17]. Уровень амоксициллина в тканях (в том числе в легких) значительно выше, чем равных доз феноксиметилпенициллина и ампициллина. Имеет больший период полувыведения, поэтому назначается 2–3 раза в сутки. Пища не влияет на биодоступность амоксициллина, что важно при назначении детям: в отличие от перорального пенициллина, амоксициллин можно давать ребенку как до еды, так и после нее.
При выборе лекарственной формы следует учитывать, что капсула обладает лучшей биодоступностью по сравнению с амоксициллином в виде таблеток (93% и 70–80% соответственно), что способствует повышению эффективности и снижению риска нежелательных явлений со стороны кишечника.
Амосин® (амоксициллин) — АБП широкого спектра действия из группы полусинтетических пенициллинов. Нарушает синтез пептидогликана клеточной стенки бактерий в периоде деления и роста, вызывает лизис бактерий. Через 1–2 часа после приема достигает максимальной концентрации в плазме, мокроте, бронхиальном секрете, плевральной жидкости. Терапевтические концентрации амоксициллина поддерживаются в плазме в течение 8 часов после перорального приема. Амосин® выпускается в форме капсул по 250 мг, таблеток по 250 и 500 мг и порошка для приготовления суспензии для приема внутрь по 125, 250 и 500 мг. Также появилась новая форма таблеток Амосин® №20 (250 мг) и №20 (500 мг) Форма однодозовых пакетиков облегчает процесс приготовления суспензии и значительно расширяет возможности использования препарата у детей: удобна в применении (не требуется хранить приготовленную суспензию в холодильнике), лучше усваивается, позволяет подобрать оптимальную дозу в зависимости от массы тела и обладает приятным фруктовым вкусом. Форма саше удобна для людей с затрудненным глотанием.
Детям младше 5 лет Амосин® назначают в форме суспензии. Доза для детей в возрасте до 2 лет составляет 20 мг/кг/сут в 3 приема. Детям в возрасте от 2 до 5 лет Амосин® назначают по 125 мг 3 раза/сут; в возрасте от 5 до 10 лет — по 250 мг 3 раза/сут. Взрослым и детям старше 10 лет с массой тела более 40 кг назначают по 500 мг 3 раза/сут Максимальная доза при выраженной манифестации клинических симптомов составляет 0,75–1 г 3 раза/сут.
Чувствительность S. pneumoniae к амоксициллину сохраняется на очень высоком уровне — 99,6%, тогда как к пенициллину уровень резистентности превысил критическое значение — 10%, к ципрофлоксацину и цефтибутену — более 6%, к цефиксиму — 5% [14].
При ВП, вызванной типичными бактериями, длительность терапии обычно составляет 7–10 дней, атипичными бактериями — 10–14 дней [13, 15, 17, 18]. АБТ может быть завершена через 3–4 дня после стойкой нормализации температуры тела [18].
20 детей с внебольничной пневмонией в возрасте от 5 до 14 лет находились на амбулаторном лечении в поликлиническом отделении ГБУЗ НСО ДГКБ № 6 г. Новосибирска в 2016–2017 гг., из них мальчиков было 12 (60%) и девочек 8 (40%). Дети обращались за медицинской помощью на 1–5 день от начала пневмонии, в среднем первый визит к врачу состоялся на 2,3 дня от появления клинических симптомов.
Всем детям при объективном осмотре поставлен диагноз «внебольничная пневмония», из них у 18 (90%) выявлена типичная рентгенологическая картина, заключающаяся в очаговом поражении легких, у остальных 2 детей (10%) пневмония оказалась рентген-негативной, диагноз подтвержден данными компьютерной томографии легких.
В комплекс лечебных мероприятий включили антибактериальную терапию препаратом Амосин®, муколитические средства, физиолечение и лечебную гимнастику. Амосин® применялся в качестве монотерапии в возрастной дозе с частотой применения 3 раза в день согласно отечественным рекомендациям в течение 7–10 дней. Средняя продолжительность приема препарата Амосин® составила 8,3 дня. При этом стабилизация клинического состояния (эффективная терапия) была достигнута у 90% детей, получавших Амосин®. У них наступил регресс клинических симптомов, рентгенологический контроль при острой очаговой пневмонии детям не проводится, так как при положительной клинической динамике обычно спустя 2–3 недели наступает полное рассасывание инфильтрата. Отмены препарата Амосин® в связи с развитием нежелательных явлений не было.
Таким образом, клиническая эффективность медикаментозной терапии, включающей прием препарата Амосин®, была оценена как выздоровление у большинства детей с диагнозом «внебольничная пневмония». Вышеизложенное позволяет рекомендовать Амосин® (амоксициллин) для использования в амбулаторной педиатрической практике в качестве препарата выбора при острой очаговой пневмонии.
Литература
- Бюллетени ВОЗ И ЮНИСЕФ. Электронный ресурс: https://www.who.int/mediacentre/factsheets/fs331/ru/.
- Вовк Е. И., Верткин А. Л. Внебольничная пневмония в начале ХХI века: плата за жизнь в большом городе // Лечащий Врач. 2008. № 8. С. 63–65.
- Мустафин Т. И., Кудояров Р. Р. Актуальные вопросы внебольничной пневмонии // Медицинский вестник Башкортостана, 2014. № 5. С. 39–41.
- World health statistics 2015. World Health Organization 2015. 164 с.
- Внебольничная пневмония у детей. Клинические рекомендации, М., 2015. 64 с.
- Геппе Н. А., Розинова Н. Н., Волков И. К., Мизерницкий Ю. Л. Рабочая классификация основных клинических форм бронхолегочных заболеваний у детей. Российское респираторное общество, 2009. 18 с.
- Геппе Н. А., Розинова Н. Н., Волков И. К., Мизерницкий Ю. Л. Современная классификация клинических форм бронхолегочных заболеваний у детей. // Педиатрия. 2010; 89 (4): 6–15.
- Crawford S. E., Daum R. S. Bacterial pneumonia, lung abscess and empyema/Pediatric respiratory medicine/Ed. Taussig L. M., Landau L. I. Mosby, Inc., 2008: 501–553.
- Таточенко В. К. Клинические рекомендации. Педиатрия (Пневмония у детей) / Под ред. А. А. Баранова. М.: ГЭОТАР-Медиа, 2005. 28 с.
- Мизерницкий Ю. Л., Сорокина Е. В., Ермакова И. Н. и др. Организация медицинской помощи детям с пневмонией в Российской Федерации // Рос. вестн. перинатол. и педиатрии. 2005; 3: 4–8.
- Внебольничная пневмония у детей. Клинические рекомендации. М.: Оригинал-макет, 2015. 64 с.
- Punpanich W., Groome M., Muhe L. et al. Systematic review on the etiology and antibiotic treatment of pneumonia in human immunodefi ciency virusinfected children // Pediatr. Infect. Dis. J. 2011. Vol. 30. № 10. Р. 192–202.
- Esposito S., Patria M. F., Tagliabue C. et al. CAP in children/European respiratory monograph 63: Community-acquired pneumonia/Ред. J. Chalmers, M. Pletz, S. Aliberti. 2014. Р. 130–139.
- Козлов Р. С. Пневмококки: уроки прошлого — взгляд в будущее. Смоленск: МАКМАХ, 2010. 128 с.
- Harris M., Clark J., Coote N. et al. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011 // Thorax. 2011. Vol. 66, Suppl. 2–23.
- Das R. R., Singh M. Treatment of severe community-acquired pneumonia with oral amoxicillin in under-fi ve children in developing country: a systematic review // PLoS One. 2013. Vol. 25. № 6. e66232.
- Bradley J. S., Byington C. L., Shah S. S. et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America // Clin. Infect. Dis. 2011. Vol. 53. № 7. e25–76.
- Чучалин А. Г., Синопальников А. И., Козлов Р. С., Тюрин И. Е., Рачина С. А. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: пособие для врачей. М., 2010. 106 с.
- О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2021. 220 с.
В. В. Проворова1, кандидат медицинских наук Е. И. Краснова, доктор медицинских наук, профессор Л. М. Панасенко, доктор медицинских наук, профессор В. Г. Кузнецова, доктор медицинских наук, профессор Н. Г. Патурина, кандидат медицинских наук
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
1 Контактная информация
В каких случаях могут назначить антибиотики?
Пациентам с развитием пневмонии может быть дополнительно назначено антибактериальное лечение. Препараты подбираются на основе тяжести течения болезни, результатов микробиологической диагностики и анализе факторов риска встречи с микроорганизмами.
При критическом состоянии назначают препараты с защищенными аминопенициллинами, цефтаролина фосамила, респираторные фторхинолоны. Бета-лактамные антибиотики назначаются вместе с макролидами для внутривенного введения.
Использование же антибиотиков без показаний и рекомендаций врача — прямой путь к выработке резистентности, т. е. устойчивости к такого рода препаратам. В результате при реальной необходимости организм человека попросту не справится с бактериальной инфекцией и затянет ее течение, а также получит серьезные осложнения.