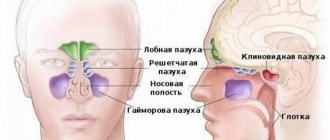
Причины возникновения Ключевые признаки болезни Диагностика и инновационные методы выявления Лечение лимфомы Беркитта в Израиле Преимущества лечения заболевания в Израиле Прогноз и реабилитация
В медицине под термином «Лимфома Беркитта
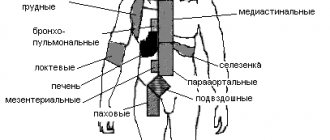
» подразумевают злокачественную опухоль, которая может появиться практически в любой лимфатической ткани человеческого организма. Данное образование имеет ярко выраженную тенденцию стремительного распространения за пределы лимфатической системы, поражая соседние органы и вызывая болезненные ощущения. Изначально представленный недуг диагностировался только в государствах Океании или Центральной Африки, однако в последнее время случаи заболевания
лимфомой Беркитта
были зафиксированы и на европейском континенте.
Причины возникновения
Сегодня специалисты затрудняются дать четкий ответ, что именно провоцирует возникновение лимфом. Вместе с тем, в перечень главных факторов, влияющих на появление злокачественных образований, включают:
- плохую наследственность;
- воздействие ионизирующей радиации;
- неблагоприятные условия окружающей среды;
- попадание в организм химических токсинов или канцерогенных веществ.
Дополнительно в список причин появления лимфом Беркитта
можно включить определенные инфекции. Так, например, научно установлено, что у 95% африканских детей, страдающих рассматриваемым недугом, изначально была зафиксирована болезнь, вызываемая вирусом Эпштейна-Барр. Он способствовал развитию фатальной опухоли, в особенности у тех, кто страдал от иммунного дефицита или постоянного переутомления.
Обсуждение
Как отмечалось ранее, ввиду редкости ЛБ количество исследований по терапии этого заболевания невелико, отсутствуют рандомизированные исследования, в большинстве представленных работ включено небольшое число пациентов. Основные международные результаты терапии ЛБ представлены в табл. 8 [9—27]. Данные исследования условно можно разделить на 3 группы: неинтенсивные программы [5—14], интенсивные протоколы (LMB, Hyper-CVAD, CODOX-M/IVAC, LMB, CALGB, NHL-BFM-83/86) без включения ритуксимаба [13—21] и интенсивные программы ХТ с ритуксимабом [22—27]. Как видно из представленных данных, несмотря на интенсификацию терапии и включение в протоколы ритуксимаба, ОВ и БРВ значительно не изменились.
Таблица 8. Мировые данные лечения ЛБ Примечание. н/д — нет данных.
В наиболее крупном проспективном исследовании по оценке терапии ЛБ взрослых включены 363 больных из 98 центров. Лечение проводилось по протоколу GMALL-B-ALL/NHL2002, представляющему модифицированную улучшенную версию протоколов немецкой группы B-NHL83, B-NHL86 и B-NHL90. Основными особенностями протокола явились включение ритуксимаба и уменьшение дозы метотрексата до 1500 мг/м2 для пациентов в возрасте 55 лет или моложе, до 500 мг/м2 — для больных старше 55 лет. Ремиссия достигнута у 88% больных, 5-летняя ОВ составила 80%. В то же время у пациентов старшей возрастной группы (старше 55 лет) ОВ существенно ниже — 62% (по сравнению с ОВ пациентов в возрасте 55 лет или моложе, составившей 86%) [26]. T. Intermesoli и соавт. [24] провели исследование по оценке эффективности лечения пациентов ЛБ по аналогичному протоколу GMALL-B-ALL/NHL2002. В исследование включены 105 больных в возрасте от 17 до 78 лет, медиана возраста составила 47 лет. 3-Летняя ОВ и БРВ составила 67 и 75% соответственно. Как видно, по результатам нашей исследовательской группы, 5-летняя ОВ, достигающая 85%, и 5-летняя БРВ — 95%, являются оптимистичными.
Как и в нашем исследовании, в работе D. Hoelzer и соавт. [26] показано, что в старшей возрастной группе наблюдалась более высокая летальность по сравнению с таковой у молодых пациентов — 11 и 2% соответственно; при этом 90% смертей обусловлено инфекционными осложнениями в период проведения Х.Т. Аналогичные результаты приводит T. Intermesoli и соавт. [24]: ранняя летальность, связанная с лечением, составила 13% и наблюдалась преимущественно у пациентов старше 45 лет с генерализованными стадиями заболевания (III—IV или лейкоз Беркитта). В нашем исследовании летальность, связанная с лечением, составила 8,6% (умерли 6 пациентов), 3 пациента были старше 40 лет. Стоит отметить, что медиана возраста наших пациентов была несколько ниже — 31 год. J. Hong и соавт. [27] отмечают, что помимо высокой летальности в группе больных старшего возраста именно у этих пациентов не удается провести лечение в полном объеме. У 25,6% пациентов не выполняется программа протокола (R-Hyper-CVAD) ввиду его высокой токсичности.
J. Kelly и соавт. [28] проанализированы данные SEER database (Surveillance, Epidemiology и End Results) с 1973 по 2004 г., а также публикации по данным PubMed, Web of Science, Cochrane Library с 1989 по 2007 г. В анализ вошли исследования, в которые включены 10 пациентов и более с впервые выявленной ВИЧ-негативной ЛБ. J. Kelly отобраны 13 публикаций (543 пациента). Пациенты старше 40 лет составили 42,2% (n
=229). ОВ больных старше 40 лет в исследованиях до 2000 г. составила 40%, после 2000 г. — 60%, что существенно ниже, чем ОВ молодых пациентов.
Факторы неблагоприятного прогноза.
В исследовании D. Hoelzer и соавт. [26] факторами неблагоприятного прогноза, влияющими на ОВ (однофакторный анализ), являлись женский пол, содержание лейкоцитов >30·109/л, тромбоцитов <25·109/л, поражение КМ, вовлечение ЦНС, III—IV стадии заболевания, активность ЛДГ >250 ед/л, высокие IPI и aaIPI. При проведении многофакторного анализа статистически значимыми факторами неблагоприятного прогноза оказались возраст старше 55 лет, поражение КМ и женский пол [26]. По данным T. Intermesoli и соавт. [24], возраст старше 60 лет и оценка по ECOG >1 балла влияют на ОВ и БРВ. В исследовании J. Hong и соавт. [27] при проведении многофакторного анализа выявлено, что возраст старше 60 лет, оценка соматического статуса по ECOG 2 балла и более, абсолютное число лимфоцитов менее 1,2·109/л, высокий IPI являются независимыми прогностическими факторами, влияющими на выживаемость. По нашим данным, КМ, плохой соматический статус (оценка по ECOG 3—4 балла), лейкоз Беркитта являются факторами неблагоприятного прогноза, влияющими на ОВ (по данным многофакторного анализа). Наши результаты полностью соответствуют данным зарубежных авторов.
Ключевые признаки болезни
Внешне лимфома Беркитта
представляет собой единичные или множественные новообразования, появляющиеся на почках, яичнике, брюшинной полости, поджелудочной железе, кишечнике, а также прочих жизненно важных органах. Опухоль быстро увеличивается в размерах, поражая мягкие ткани или разрушая кости, вследствие чего у пациента могут наблюдаться затруднения дыхания, головокружение, повышение температуры тела. Дальнейшее развитие
лимфомы Беркитта
приводит к сдавливанию корешков спинного мозга, постоянным переломам костей или параличам. Среди других немаловажных признаков этой болезни можно отметить:
- деформацию носовой перегородки;
- нарушение глотательной функции;
- кишечную непроходимость или боли в животе;
- присутствие новообразований в области челюсти и т. д.
В зависимости от формы развития заболевания симптоматика лимфомы Беркитта
может быть дополнена рядом других болезненных ощущений, при появлении которых следует незамедлительно обратиться к врачу.
Лечение
Злокачественная лимфома Беркитта отличается высокой чувствительностью к химиотерапии. В 80% случаев интенсивная высокодозная полихимиотерапия обеспечивает продолжительную ремиссию (https://cyberleninka.ru/article/n/limfoma-berkitta-klinika-diagnostika-lechenie/viewer). Но рецидивы ЛБ плохо поддаются лечению.
Основным методом лечения ЛБ являются интенсивные режимы ПХТ. Дополнительно назначают симптоматическое лечение, чтобы откорректировать электролитные нарушения и устранить другие симптомы. При острой почечной недостаточности ежедневно проводят сеансы гемодиализа.
Хирургическое лечение лимфомы Беркетта нецелесообразно. Оно не только не улучшает состояние, но и приводит к потере времени и ухудшению прогноза из-за продолжительной реабилитации после операции и быстрого повторного роста опухоли.
Хирургическое вмешательство оправдано только при угрожающих жизни состояниях (желудочно-кишечных кровотечениях, перфорации органов, кишечной непроходимости
Диагностика и инновационные методы выявления
В клиниках Израиля такое заболевание диагностируют на основании нескольких факторов, главными из которых считаются увеличение лимфатических узлов и структурные изменения эпителиального состава пораженных участков. Для исследования у больного под общим или местным наркозом проводится биопсия ткани, после чего выявляется наличие злокачественных клеток. Кроме того, проводится еще ряд исследований, помогающих определить стадию развития лимфомы Беркитта
и присутствие других патологий в организме.
Если увеличение лимфатических узлов нельзя обнаружить визуальным осмотром или путем пальпации, то назначается компьютерная томография, которая дает возможность увидеть труднодоступные области малого таза, брюшной полости, грудной клетки. Установить стадию развития заболевания также помогает уникальная система «St Jude/Murphy», в которой на основании специальных исследований отображается состояние иммунной системы пациента.
Материалы и методы
С 2003 по 2014 г. в ФГБУ ГНЦ М.З. России, Федеральном медицинском исследовательском центре им. П.А. Герцена, Медицинском радиологическом научном центре им. А.Ф. Цыба, Оренбургской областной клинической больнице наблюдались 70 больных с диагнозом ЛБ: 45 мужчин и 25 женщин в возрасте от 15 до 62 лет, медиана возраста 31 год. Стадию заболевания определяли на основании классификации S. Murphy. I стадия заболевания диагностирована у 4 (5,7%) больных, II — у 9 (12,9%), III — у 25 (35,7%), IV — у 11 (15,7%), лейкоз Беркитта — у 21 (30%). У 23 (32,9%) пациентов отмечено вовлечение в опухолевый процесс КМ, у 15 (21,4%) — ЦНС (нейролейкемия у 12, интратумор спинного мозга у 3, интратумор головного мозга у 3). В-симптомы выявлялись у 56 (80%) пациентов, повышение активности лактатдегидрогеназы (ЛДГ) — у 50 (78,1%) из 64, при этом у 34 (56,2%) из 64 отмечено повышение активности ЛДГ более чем в 2 раза по сравнению с референсными значениями. Медиана уровня ЛДГ составила 2398 (238—20 300) ед/л. Острая почечная недостаточность (ОПН) в дебюте заболевания определялась у 17 (24,2%) больных, 8 химиотерапия (ХТ) начата на фоне терапии, замещающей функцию почек. Механическая желтуха вследствие вовлечения в опухолевый процесс головки поджелудочной железы и желчных протоков выявлена у 3 больных. В качестве первого этапа лечения пациентам проведено дренирование желчных протоков (у 1 — эндоскопическая ретроградная панкреатохолангиография, назобилиарное дренирование, у 1 — минилапаротомия, чреспузырное дренирование желчных протоков, у 1 — лапаротомия, интраоперационная холангиография, холецистостомия). У 6 больных на момент поступления в гематологическую клинику диагностировано состоявшееся желудочное кровотечение, у 1, помимо желудочного кровотечения, выявлены множественные субдуральные гематомы, кровоизлияния в склеру. В связи с постренальной анурией, обусловленной сдавливанием опухолью малого таза мочеточников, у 1 больного до поступления в клинику выполнена нефростомия.
Диагноз ЛБ устанавливали в соответствии с критериями ВОЗ 2008 г. на основании биопсии опухолевого новообразования, последующего гистологического, иммуногистохимического и цитогенетического исследований. Протокол обследования больного включал сбор анамнеза и физическое обследование, общий анализ крови, общий анализ мочи, биохимический анализ крови, коагулограмму, миелограмму, иммунохимическое исследование сыворотки крови и мочи, компьютерную томографию (КТ) грудной, брюшной полостей и органов малого таза, электрокардиограмму, биопсию лимфатического узла — ЛУ (опухолевого новообразования), гистологическое, иммуногистохимическое и цитогенетическое исследования, трепанобиопсию, люмбальную пункцию с цитологическим и биохимическим исследованиями ликвора. У всех больных оценивали ВИЧ-статус, наличие HBsAg (качественный тест), антител к антигену вируса гепатита С. По показаниям выполняли фиброгастродуоденоскопию, колоноскопию с множественной биопсией слизистых оболочек желудка и кишечника, КТ мягких тканей шеи и головного мозга, магнитно-резонансную томографию головного мозга, мягких тканей шеи, малого таза с внутривенным болюсным контрастированием, диагностическую лапароскопию или лапаротомию с биопсией опухолевого образования. Все женщины консультированы гинекологом, по показаниям назначалась овариопротекция на период проведения Х.Т. Иммуногистохимическая панель включала антитела к CD20, CD3, CD10, BCL2, BCL6, с-MYC, Ki-67, MUM1, cyclin D1, в отдельных случаях — TdT. Цитогенетическое исследование выполнено 70 больным. Стандартное цитогенетическое исследование (G-дифференциальная окраска хромосом) выполнено 8 больным, в 4 случаях исследовали клетки опухоли (ЛУ), в 4 — клетки КМ. У 29 пациентов проведено цитогенетическое исследование методом флуоресцентной гибридизации in situ
(FISH): в 9 случаях в качестве материала использовали суспензию опухолевые клетки, в 5 — суспензию клеток КМ, в 13 — отпечатки опухоли (гастробиоптата у 6, колонобиоптата у 1, миндалины у 1, трепанобиоптата у 1, ЛУ у 4), в 2 — мазки КМ. У 33 больных исследовали гистологические срезы парафиновых блоков [5]. FISH-исследование проводили с ДНК-зондами Vysis LSI IGH/MYC, CEP 8 Tri-color, Dual Fusion Translocation Probe («Abbott Molecular») для определения t (8;14)(q24;q32), Vysis LSI MYC Dual color, Break Apart Rearrangement Probe («Abbott Molecular») для выявления перестройки локуса гена
MYC
. Для исключения наличия перестроек генов
BCL2
и
BCL6
использовали зонды Vysis LSI BCL2 Dual color, Break Apart Rearrangement Probe («Abbott Molecular») и Vysis LSI BCL6 (ABR) Dual color, Break Apart Rearrangement Probe («Abbott Molecular») соответственно. Транслокация t (8;14)(q24;q32) выявлена в 56 из 63 случаев, t (8;22)(q24;q11) — у 2 из 63 больных, вариантные транслокации (наличие перестройки локуса гена
MYC
при отсутствие транслокации t (8;14)(q24;q32)) — у 6 из 63. В 7 случаях выявлена перестройка локуса гена
MYC
, FISH для выявления t (8;14)(q24;q32) не проводилась. Во всех случаях отсутствовали перестройки генов
BCL2
и
BCL6
.
Лечение проводили по протоколу ЛБ-М-04±R, (4 последовательных блока А-С-А-С) [4]. С 2011 г. больным с поражением КМ проводили 6 блоков А-С-А-С-А-С с ритуксимабом. Блок, А включал внутривенное введение 10 мг/м2 дексаметазона в 1—5-е дни, 1500 мг/м2 метотрексата за 12 ч в 1-й день, 800 мг/м2 ифосфамида в 1—5-й дни, 1 мг/м2 винкристина в 1-й день, 50 мг/м2 доксорубицина в 3-й день, 150 мг/м2 цитарабина в 4—5-й дни и 100 мг/м2 этопозида в 4—5-й дни; блок С состоял из внутривенного введения 10 мг/м2 дексаметазона в 1—5-й дни, 1500 мг/м2 метотрексата за 12 ч в 1-й день, 5 мг/м2 винбластина в 1-й день, 2000 мг/м2 цитарабина 2 раза в день во 2—3-й дни, 150 мг/м2 этопозида в 3—5-й дни. Ритуксимаб вводили внутривенно в день 0 курса в дозе 375 мг/м2. Всем пациентам проводили профилактику нейролейкемии в 1-й день каждого блока путем интратекального введения 3 препаратов: 30 мг преднизолона, 30 мг цитарабина и 15 мг метотрексата. При выявлении нейролейкемии люмбальные пункции с интратекальным введением химиопрепаратов выполняли 2 раза в неделю до полной санации ликвора и получения 3 нормальных анализов спинномозговой жидкости. При прогрессировании заболевания больного выводили из протокола. Трем пациентам с вовлечением в опухолевый процесс миндалин, рото- и носоглотки в связи с угрозой асфиксии лечение начато в условиях реанимационного отделения на фоне искусственной вентиляции легких (ИВЛ) [6].
У 29 (41%) больных в анамнезе имелись хирургические вмешательства, связанные с основным заболеванием (табл. 1). Основная цель таких вмешательств, как правило, проводимых в хирургических стационарах широкого профиля, заключалась в уменьшении объема опухолевой массы или радикальное удаление случайно выявленной опухоли. Срочное гистологическое исследование не проводилось. Врачи и пациент узнавали о диагнозе лимфомы спустя 10—14 дней. За этот период в большинстве случаев отмечался продолженный быстрый рост опухоли.
Таблица 1. Хирургические вмешательства у 29 больных ЛБ до начала ХТ по протоколу ЛБ-М-04
Осложнения ХТ оценены в соответствии с CTCAE (Common Terminology Criteria for Adverse Events) 2009 г. [7].
Статистический анализ данных.
При статистическом анализе данных с помощью одно- и многофакторного анализов (регрессионного анализа Кокса) обнаружили и оценили ассоциированные с ЛБ неблагоприятные прогностические факторы. Основным критерием оценки факторов неблагоприятного прогноза выбрана общая выживаемость (ОВ), дополнительным — безрецидивная выживаемость (БРВ). Наряду со значениями выживаемости приводим стандартную ошибку (
SE
), отношение рисков (ОР) и соответствующий 95% доверительный интервал (ДИ). Пороговый уровень статистической значимости
р
выбран равным 0,05. Для расчетов использовали лицензионный статистический пакет SAS 9.1.
Лечение лимфомы Беркитта в Израиле
Отлично зарекомендовал себя в процессе избавления от лимфомы Беркитта
метод химиотерапии, предполагающий введение в организм пациента различных сильнодействующих веществ, которые убивают злокачественные клетки. Одним из таких препаратов стал циклофосфан, вводимый внутривенно в количестве 30-40 мг/кг. Курс терапии, как правило, предусматривает 2-3 инъекции каждые 10-14 дней (не чаще). Помогает в борьбе с
лимфомой Беркитта
эмбихин, также вводимый внутривенно по 0,2-0,3 мг/кг/день. Курс лечения упомянутым медикаментом составляет не более 5-6 дней по усмотрению лечащего врача.
В последние годы в медучреждениях Израиля химиотерапию совмещают с противовирусными лекарствами. Дело в том, что во время лечения организм пациент истощен и подвержен всевозможным вирусным инфекциям, которые вызывают серьезные осложнения со здоровьем, а также замедляют процесс реабилитации. Так, например, при комплексном приеме циклофосфана и ганцикловира (иногда фоскарнета) снижается вероятность возникновения различного рода патологий у пациента.
Инновационным способом борьбы с описываемым заболеванием, применяемым в израильских клиниках, считается внедрение гемопоэтических клеток в пораженные очаги. Этот метод позволяет закрепить достигнутый при помощи химиотерапии эффект и восстановить функции поврежденных органов в кратчайший период.
100% точная диагностика – визитная карточка Ихилов
Еще до приезда пациента в клинику, программа его обследования тщательно планируется, чтобы в кратчайшие сроки получить нужную информацию об особенностях заболевания и вовремя приступить к лечению. Обычно диагностический процесс занимает всего три дня.
Первый день
Сразу же по прибытию в клинику пациент попадает на консультацию к лечащему врачу, который проводит осмотр, уточняет симптомы, беспокоящие пациента, изучает медицинскую документацию, которую предоставил пациент. В конце консультации врач принимает решение о том, какие именно диагностические процедуры пациент пройдет в Ихилов, чтобы подтвердить диагноз.
Второй день
Обычно диагностика лимфомы в Израиле проводится с помощью следующих методов:
- Компьютерная томография. Посредством метода проверяется состояние лимфатических узлов.
- Анализ крови. Оценивается количество лимфоцитов и отклонения по другим параметрам.
- Позитронно-эмиссионная томография. Этот высокочувствительный метод способен показать степень распространения болезни.
- Биопсия. По результатам теста можно сделать точные выводы о наличии лимфомы, а также о ее типе и размере.
- Пункция костного мозга с цитогенетическим анализом. Позволяет определить состояние тканей костного мозга и выявить необходимость трансплантации костного мозга.
- Сцинтиграфия с галлием. Пациенту вводят радиоизотоп галлия и проводят сканирование с помощью гамма-камеры.
Третий день
После получения результатов обследования собирается врачебный консилиум. В этот день врачи оценивают общий прогноз и коллегиально выбирают наиболее перспективную схему лечения.
Преимущества лечения заболевания в Израиле
Сегодня израильская медицина достигла заметного прогресса в области лечения лимфомы Беркитта.
Высокотехнологичное оборудование позволяет своевременного диагностировать и эффективно лечить эту болезнь на любых стадиях развития. В список ключевых достоинств лечения в упомянутой стране входят:
- качественный уход и просторные палаты;
- использование новейших лекарственных препаратов;
- круглосуточное наблюдение высококвалифицированных докторов;
- возможность консультации с ведущими специалистами в своей области.
При появлении первичных признаков лимфомы Беркитта
не стоит затягивать с визитом к врачу, ведь вероятность выздоровления напрямую зависит от того, насколько быстро человек обратился за помощью.
Преимущества Топ Ихилов
- Онкологи и онкогематологи клиники — первоклассные врачи, эксперты в области терапии разнообразных лимфом. Они прошли многолетнюю подготовку и обладают исключительным опытом.
- Диагностические исследования проводятся с применением новейшей лабораторной техники и высокоточной аппаратуры.
- Для лечения используются уникальные методики, начиная от высокоэффективных схем химиотерапии и заканчивая применением иммунных препаратов.
- Пациенты клиники проживают в удобных палатах, окружены атмосферой уюта, а взаимодействием с врачами и переводом медицинской документации занимается персональный куратор-переводчик.
- 5
- 4
- 3
- 2
- 1
(12 голосов, в среднем: 4.4 из 5)