Гидрокарбонат натрия
(лат. Natrii hydrocarbonas), другие названия:
бикарбонат натрия
,
чайная сада
,
питьевая
или
пищевая сода
,
двууглекислый натрий
— неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Химические свойства
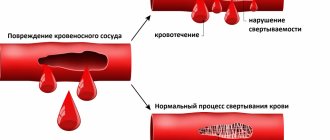
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
NaHCO3 + HCl → NaCl + H2CO3 H2CO3 → H2O + CO2↑ 2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2↑
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Растворяется ли пищевая сода в воде?
Есть 2 важные момента в растворении натрия гидрокарбоната в воде. Если мы растворяем соду притемпературе до 50 °С, происходит реакция гидролиза соли. Это обратимое взаимодействие соли с водой. Приводит к образованию слабого электролита.
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет сильнощелочную реакцию. Отсюда вывод: растворимость гидрокарбоната натрия в воде невелика, но при повышении температуры и она повышается.
При взаимодействии с водой двууглекислый натрий распадается на гидроксид натрия NaOH , который придает щелочность воде, угольную кислоту H2CO3, которая, в свою очередь, сразу же распадается на воду и углекислый газ H2O + CO2.
Химическая формула растворения соды в воде:
NaHCO3 + H2O ↔ H2CO3 (H2O + CO2) + NaOH
Водный раствор соды пищевой на растительные и животные ткани практически не действует.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
NH3 + CO2 + H2O → NH4HCO3 NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Сода пищевая кулинарная
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя
в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl-, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Сода пищевая (бикарбонат натрия)
Когда профессиональным велосипедистам во время 4-минутного сайклинг теста дали 0,3г/кг бикарбоната (разделенные на 5 доз в течение 60 минут), тогда как другая группа к тому моменту уже принимала бикарбонат на в течение 3 дней (0,4г/кг 3 раза в день), то у всех участников эксперимента повысилась выносливость и производительность (на 2,2-3,1%) и увеличилась максимальная начальная скорость VO2 max (на 1,2-2%). Подобные результаты были получены в ходе другого сайклинг-теста (с отягощением; прием 300мг/кг бикарбоната натрия способствовал увеличению показателя «время до истощения» с 61,5+/-2 to 75,3+/-8; 22,4%), а в ходе другого исследования (500мг/кг х 5 дней; 60с сайклинга) — 14,2%,[174] однако, в противовес этим трем экспериментом, можно привести множество провальных экспериментов, в которых бикарбонат никак не повлиял на производительность и выносливость велосипедистов в ходе 2-3-минутного заезда при 110% VO2 max,43) 3 -минутного спринта у велосипедистов-любителей, 90-секундного сайклинга с препятствиями, серии кратковременных заездов (60с) у женщин и BMX-велосипедистов. Что касается продолжительных (и/или средней продолжительности) заездов, то и здесь бикарбонат не теряет своей эффективности (у здоровых мужчин; 14-секундный спринт, за которым следуют 16с отдыха; всего 60 заездов в течение 30 минут), повышая выносливость спортсменов на 11,5+/-5% (в среднем), при 4-секундных заездах (100с педаляжа и 20с отдыха) общей длительностью 36 минут, бикарбонат также эффективно повышает выносливость велосипедистов (400мг/кг у профессиональных велосипедисток), то же можно сказать и о 5 заездах по 6с каждый с 30-секундными перерывами (5%) и при удвоении длительности каждого заезда (2%), о 5 отдельных 60-секундных заездах, из которых только в последнем использовали контроль плацебо (протяженность дистанции, которую велосипедист проезжает за 1 минуту, увеличилась на 42%), а также о 10 отдельных 10 — секундных заездах с 50-секундными перерывами (с единичными случаями повышения пиковой мощности на 0.9-2%). Впечатляющие результаты исследования не подтвердились в другом эксперименте с участием мужчин со слабой физической подготовкой, которые участвовали в 5-минутных велосипедных заездах (с 70, 80 и 90% VO2 max), после чего был еще один спринт со 100% VO2 max (на выносливость), при этом предварительно принятый бикарбонат натрия (300мг/кг) не оказал существенного влияния ни на один из показателей.44) В ходе дифференцированного сайклинг-теста (каждые 4 минуты велосипедистам усложняли задачу, чтобы в итоге они полностью выдохлись, либо крутили педали до той поры, пока количество оборотов в минуту не снизится до 60) с участием женщин, которым на фоне тренировок в течение 8 недель ежедневно давали 200мг/кг бикарбоната натрия, ученые заметили, что участницы стали в значительной степени более выносливыми (на 164%), тогда как у женщин, которые все это время под видом бикарбоната принимали плацебо, выносливость повысилась на 123%.45) Если говорить о кратковременных заездах, то, в большинстве случаев, от бикарбоната нет никакой пользы. И, тем не менее, при многократных спринтах (непродолжительных заездах, которые повторяются много раз) он чаще помогает, чем нет. В ходе 3-километрового заезда с участием профессиональных велосипедистов, которым предварительно дали 300мг/кг бикарбоната натрия, было установлено, что прием препарата сокращает длительность заезда на 1,2% (подобно действию 3мг/кг кофеина), повышая при этом производительность и выносливость велосипедистов, в среднем, на 2.6%, тогда как в ходе заезда на 60м средняя производительность и выносливость участников увеличились на 13.7%, тогда как максимальное значение данного показателя практически не изменилось. Диетологи рекомендуют принимать бикарбонат натрия при продолжительных аэробных нагрузках (около 60 минут), поскольку он стимулирует выработку энергии на поздних стадиях тренировки, повышая тем самым ее качество. Результаты экспериментов с участием гребцов, которые принимали 300мг/кг бикарбоната натрия (или, в одном из тестов, 500мг/кг) либо разово за 60-90 до тренировки, либо на протяжении трех дней до этого, свидетельствуют о том, что на фоне приема бикарбоната у гребцов повышается выносливость (незначительно) и, как следствие, они начинают грести быстрее (то есть если раньше на 2000-метровый спринт они тратили 6 минут 16 секунд, то после приема бикарбоната — 6м 1с, то есть на 1,3% быстрее), что подтвердилось в ходе других экспериментов (время на спринт сократилось, в среднем, 1,8%). И, тем не менее, в большинстве случаев, эти эксперименты не приносят ожидаемых результатов.46) Все из них представляли собой 2000-метровый спринт, если не считать один 2-метровый тест на выносливость. При включении бикарбоната натрия в рацион с повышенным содержанием жидкости (в результате чего человек сбрасывает 4% веса, чтобы прийти в форму перед тренировкой) также не происходит каких-либо существенных положительных изменений, как и при более длительном (4 недели) ежедневном приеме 300мг/кг бикарбоната (эффект не отличается от плацебо). Эксперименты с участием профессиональных гребцов, которым перед началом спринта на 2000м давали бикарбонат натрия, в большинстве своем не результативны, то есть бикарбонат чаще всего не способствует повышению выносливости и производительности, лишь у некоторых (по их собственным словам, то есть чисто субъективно).