Можно ли научить наш мозг искусственно вырабатывать «гормон счастья» — серотонин? Эта задача непростая, но осуществимая, ведь, управление тонким гормональным балансом под силу любому человеку. Нужно лишь захотеть – и буквально через 5 минут у вас будет отличное настроение и готовность «свернуть горы». В этом стремлении вам помогут гормоны удовольствия и счастья:
- серотонин – его называют гормоном счастья, который дарит чувство эйфории;
- дофамин – он отвечает за наслаждение и закрепляет положительный опыт;
- окситоцин – он рождает такие чувства, как любовь, нежность и привязанность.
Чаще всего эта «троица» работает в связке, формируя все наши позитивные эмоции. Но сейчас мы будет говорить именно о серотонине. Многие люди уже знают, как называется этот гормон радости и счастья. Но далеко не все понимают, как он работает. И еще меньше людей знают, как регулировать уровень этого гормона в организме.
Как научиться управлять серотонином?
Этот нейромедиатор, регулирующий наше с вами настроение, не так прост, как может показаться на первый взгляд. Наверняка вы думаете, что серотонин – еще один гормон, который вырабатывается в человеческом мозге. Это так, но лишь отчасти. Вот вам сухие факты: 95% серотонина вырабатывается в кишечнике. И только 5% — в мозге.
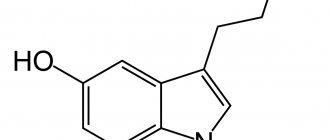
Так неужели путь к нашему счастью лежит через желудок? И это не совсем так. Серотонин – сложное химическое вещество, производная аминокислоты триптофана и, по совместительству, менеджер нашего мозга. Этот гормон отвечает за обширный ряд процессов как в самом мозге, так и во всем организме человека:
- Серотонин в мозге помогает нервным клеткам лучше взаимодействовать.
- Гормон радости влияет на сон и аппетит, состояние мышц и работу организма, характер и настроение.
- Важнейший нейромедиатор оказывает воздействие на когнитивные функции (внимание, память, общение и пр.).
- Серотонин отвечает за нормальную свертываемость крови и стабильную работу кровеносной системы.
- Гормон радости помогает нам испытывать интерес и влечение к противоположному полу.
Катехоламины
В середине ХХ века J. Shildkraut (1961) была сформулирована, так называемая, катехоламиновая теория происхождения депрессии. Данная теория предполагала нарушение регуляции системы мозга, чувствительной к норадреналину в качестве одного из важных звеньев патогенеза депрессии во время депрессии (Praag H., 1994; Ашмарин И.П., с соавт., 1999).
В настоящее время известно, что содержание норадреналина в клетках мозга контролируется особыми окончаниями нервной клетки — пресинаптическими адренорецепторами. Стимуляция этих рецепторов тормозит высвобождение норадреналина, что в свою очередь, приводит к его недостатку в синапсе и уменьшению нейротрансмиссии. Блокада данных рецепторов антидепрессантами, напротив, приводит к усилению процесса выделения норадреналина.
Фундаментальные исследования ретикулярной формации мозга показали, антидепрессанты, действие которых направлено на изменения содержания норадреналина, обладают общим активирующим или психостимулирующим эффектом. Эти препараты поддерживают уровень бодрствования, способствуют улучшению процессов восприятия, мышления, памяти и повышают концентрацию внимания. Однако, несмотря на то, что прием антидепрессантов практически сразу же повышает уровень норадреналина, клинический эффект препарата проявляется значительно позже.
Согласно катехоламиновой гипотезе J. Schildkraut. (1978) развитие депрессий, особенно эндогенных, обусловлено снижением содержания катехоламинов, главным образом норадреналина, в определенных структурах мозга. Также предполагалось, что функциональную активность норадренергических систем во время депрессии можно косвенно оценить по содержанию в моче такого метаболита норадреналина, как МОФЭГ (З-метокси-4-оксифенилэтилленгликоль).
На основании целого ряда наблюдений (Schildkraut J., 1978, Beckmann H., Goodwin F., 1980), было высказано предположение, что уровень МОЭФГ может служить предиктором эффективности терапии для различных антидепрессантов. У депрессивных больных с более низким содержанием МОФЭГ возможен положительный терапевтический эффект от имипрамина и дезипрамина, но они устойчивы к терапии амитриптилином.
Было высказано предположение, что у данной группы больных первично доминируют нарушение метаболизма норадреналина. Напротив, депрессивные больные с высоким суточным уровнем экскреции МОФЗГ лучше реагируют на терапию амитриптилином. В то же время, было показано, что у психически здоровых людей суточная экскреция МОФЭГ колеблется в четыре раза, и эти колебания перекрывают параметры сдвигов, отмеченных у пациентов, страдающих депрессией (Hollister L. с соавт., 1978). Кроме того, было выявлено, что в период клинической ремиссии обнаруженные у больных депрессией сдвиги катехоламинов не нормализуются и даже во время тяжелой депрессии содержание катехоламинов может быть в пределах нормы. (Cazzulo С., Sacchetti E. с соавт., 1982).
На основе данных, полученных J. Costa, E. Silva (1980) возникла теория предполагающая наличие двух вариантов возникновения депрессии, один, связанный с истощением норадреналина и более чувствительный к лечению одними антидепрессантами (дезимипрамин или имипрамин) и другой — связанный с дефицитом серотонина и реагирующий на терапию другими препаратами (амитриптилин). Допускалось, что антидепрессанты оказывают свое терапевтическое влияние путем облегчения передачи, как норадреналина, так и серотонина (Haefely W., 1985).
Последние исследования в области физиологии мозга показали, что система мозга, чувствительная к норадреналину обладает выраженным влиянием на систему, чувствительную к серотонину. Оказалось, что нервные клетки, чувствительные к норадреналину контролируют скорость высвобождения серотонина посредством влияния на окончания нейронов, расположенных на телах серотонинергических нейронов. Увеличение же возбудимости серотонинергических нейронов в свою очередь усиливает выброс серотонина в нервных окончаниях (De Boer T., с соавт., 1994).
Что случится, если уровень серотонина нарушится?
Очень часто мы слышим о том, как низкий уровень гормона счастья – это плохо. Но организму человека вредит не только недостаток, но и избыток серотонина. Другими словами, любые нарушения выработки этого нейромедиатора провоцируют целый список негативных последствий и состояний:
- плохое настроение и хроническую депрессию;
- резкое снижение сексуального влечения;
- проблемы с пищеварением и сном;
- тягу к сладкому и набор веса;
- понижение активности.
Перечисленные проблемы – лишь вершина айсберга. Работа серотонина, основанная на двух веществах – аминокислоте триптофан и ее производном 5-гидрокситриптофан, очень сложная. Иногда гормональный дисбаланс настолько выражен, что специалистам не остается ничего другого, как прописать антидепрессанты – ингибиторы обратного захвата серотонина.
Дофамин
В основе патогенеза депрессии может также лежать недостаток еще одного биологического вещества, в какой-то мере, являющегося предшественником норадреналина — дофамина. Предполагается, что он принимает участие в регуляции функции моторной сферы, обладает психостимулирующим эффектом и отвечает за формирование определенного поведения (Мосолов С.Н., 2002). Доказательством этой гипотезы служит способность препарата L-ДОФА,являющегося предшественником дофамина и норадреналина, способствовать переходу депрессии в состояние повышенной активности (Bunney W. С соавт., 1970; Van Praag H., 1977). При использовании L-ДОФА у пациентов, страдающих депрессией, достаточно часто отмечался положительный эффект в виде изменения активности. Так, в частности, Р.Я. Бовин, И.О. Аксенова (1982) при использовании L-ДОФА у терапевтически-резистентных депрессивных больных отметили положительный эффект в виде повышения психомоторной активности в 25% случаев.
Кроме того, к депрессии может привести прием медикаментов, понижающих содержание дофамина, например, препаратов раувольфии. Снижение уровня дофамина наблюдается при ряде неврологических и соматических заболеваний, также сопровождающихся депрессией, например, таких как болезнь Паркинсона.
Но стоит ли сразу пускать в ход «тяжелую артиллерию»?
Мы знаем, что антидепрессанты действуют быстро. Но также мы знаем, что у них хватает недостатков, важнейшими из которых являются привыкание и различные побочные эффекты, способные серьезно пошатнуть и без того ослабленное здоровье. На изображении ниже показано, как «жестко работают» антидепрессанты. Стоит задуматься нужны ли такие радикальные меры???
Есть ли безопасная альтернатива таблеткам? Есть. Это правильный образ жизни и умение смотреть на мир позитивно. «Рецепт» вашего счастья будет состоять не из набора лекарств, а из совершенно других компонентов:
- Питание. В здоровой пище есть все, что нужно для выработки гормона серотонина в достаточном количестве. Откажитесь от быстрых углеводов и вредной еды в пользу полезных углеводов и продуктов, содержащих триптофан. Серотонин «растет» на разнообразии: злаках и крупах, овощах и фруктах, яйцах и молочной продукции, нежирном мясе и жирной рыбе, орехах, семенах и сухофруктах.
На изображении показаны продукты богатые триптофаном.
- Движение. Ученые не раз доказывали, что любая физическая активность быстро (буквально за 30-40 минут) повышает уровень серотонина в крови. Танцы, пешие прогулки, бассейн, езда на велосипеде, утренняя пробежка – активностей много, не обязательно идти в спортзал. Но есть одно «но»: активным нужно быть постоянно, а не время от времени.
- Сон и медитация. Счастливый человек умеет вовремя «выключаться» и отпускать негатив из своей жизни. Иногда сделать это сложно. И тогда на помощь приходят медитация и здоровый сон, во время которых уровень гормона счастья также повышается. Приучите себя ложиться и вставать в одно и то же время – и у вас не будет проблем с серотонином.
- Больше солнца. В нашем климате солнечные деньки – нечастое явление. Но даже в пасмурный день наша кожа все равно получает свою порцию ультрафиолета. А, значит, ответ на вопрос «как повысить серотонин» прост: чаще гуляйте. Прогулки подарят организму максимум гормона счастья и полезного витамина D.
- Омега-3. Нам сложно поддерживать оптимальный уровень незаменимых полиненасыщенных жирных кислот, которые в избытке содержатся только в мясе жирной рыбы северных морей. Но сейчас уже есть достойная альтернатива – комплексы БАДов с Омега-3. Такие добавки – настоящее «лакомство» для мозга и профилактика целого ряда заболеваний.
- Удовольствие. Серотонин отвечает за удовольствие и наслаждение. А как получить больше таких эмоций? Идей масса: например, влюбиться, найти новое увлекательное хобби, чаще встречаться с друзьями, больше времени проводить с близкими. Чем больше в вашей жизни будет ярких эмоций и позитива, тем выше будет и уровень гормона счастья.
- «Помощники». К сожалению, даже при правильном питании не удается получить из пищи 100% необходимых для питания мозга и организма веществ. И тогда на помощь приходит «серотонин в таблетках». Это специальные растительные витаминные комплексы, которые помогают гормону счастья вырабатываться правильно и в необходимом объеме.
Роль серотониновых рецепторов в моторно-эвакуаторной функции желудочно-кишечного тракта
Основными классами рецепторов, участвующих в регуляции моторно-эвакуаторной функции желудочно-кишечного тракта (ЖКТ), являются холинергические, адренергические, допаминергические, серотониновые, мотилиновые и холецистокининовые. Препараты, применяемые при депрессивных и тревожных расстройствах, панических атаках и других вегетативных дисфункциях, действуют на те же рецепторы, которые отвечают за моторно-эвакуаторную функцию желудочно-кишечной трубки. Регулирование деятельности гладкой мускулатуры и подвижности кишечника происходит на нескольких уровнях. Гормоны и нейротрансмиттеры являются доминирующими компонентами, которые прямо или косвенно воздействуют на гладкомышечные клетки. Постпрандиальный эндокринный ответ включает в себя выработку инсулина, нейротензина, холецистокинина (ХХК), гастрина, глюкагоноподобных пептидов (ГПП-1 и ГПП-2), глюкозозависимый инсулинотропный полипептид (ГИП, ранее известный как желудочный ингибиторный пептид) [1], данные об эффектах нейромедиаторов и гормонов представлены в табл. 1. Например, ХХК выделяется в проксимальных отделах тонкой кишки и непосредственно влияет на сокращение мышечных клеток желчного пузыря и нейромедиированную релаксацию мышц клеток сфинктера Одди, которая опосредуется через ГИП нервно-мышечные соединения.
В настоящей статье особое внимание уделено серотонинергическим рецепторам, которые являются одними из важных регуляторов кишечной перистальтики. Серотонин, или 5-гидрокситриптамин (5-HT), — моноаминовый нейромедиатор, который является главным посредником в физиологии психологического состояния и настроения человека, а также одним из регуляторов функции сосудов и желудочно-кишечной моторики. 5-HT, как известно, представлен в тромбоцитах, ЖКТ и центральной нервной системе человека и животных [2–5]. Серотонин вырабатывается в организме человека из поступившей с пищей аминокислоты триптофана — так как именно она нужна для непосредственного синтеза серотонина в синапсах; второй путь выработки серотонина связан с поступлением глюкозы с углеводной пищей, которая стимулирует выброс инсулина в кровь, далее происходит катаболизм белка в тканях, что также приводит к повышению уровня триптофана в крови.
На основе биохимических и фармакологических критериев 5-HT-рецепторы подразделяются на семь основных подтипов, пять из которых находятся в кишечных нейронах, энтерохромаффинных (ЭХ) клетках и в гладкой мускулатуре ЖКТ — это 5-HT1, 5-HT2, 5-HT3, 5-НТ4 и 5-HT7 [6, 7]. Около 80% от общего количества 5-НТ-рецепторов находятся в ЭХ-клетках кишечника, где они принимают участие в кишечной перистальтике через несколько подтипов 5-HT-рецепторов [8, 9]. За исключением 5-HT3-рецепторов, лиганда закрытого ионного канала, все 5-HT-рецепторы связываются с рецепторами G-белка, которые активируют внутриклеточные реакции второго каскада, стимулируя возбуждающие или тормозные реакции в ЖКТ [10]. Серотонин обладает хорошо изученным воздействием на кишечную моторику, секрецию и сенситивность через центральные и периферические нейромедиаторные пути, что делает его ключевым фармакологическим средством, применяемым в лечении моторных нарушений ЖКТ [11]. Серотонин высвобождается из ЭХ-клеток в ответ на химическое или механическое раздражение слизистой оболочки [12] или в ответ при экспериментальных моделях стресса [13]. Серотонин синтезируется и хранится не только в ЭХ-клетках (90%), но и в нейронах кишечника (10%). Как говорилось выше, 5-HT выделяется в кровь после приема пищи и в ответ на изменения давления в кишечной стенке, а также при воздействии вредных раздражителей [13], а затем поступает в просвет кишечника и далее в его стенки из базолатерального депо ЭХ-клеток [14]. 5-HT стимулирует круговые и продольные мышцы желудка, двенадцатиперстной кишки и тощей кишки [15]. Важно стратегическое расположение ЭХ-клеток в непосредственной близости от сенсорных нервных окончаний слизистой оболочки кишечника, интерганглионарных нейронов и синапсов двигательных возбуждающих и тормозных нейронов. Серотонин увеличивает сокращение амплитуды мышц желудка, двенадцатиперстной кишки, тощей кишки и подвздошной кишки [16]. В тонкой кишке 5-HT стимулируют круговые сокращения мышц в течение первой манометрической фазы, вызываемые сокращения распространяются, становятся более частыми и активируют быстрые моторные комплексы [17]. В толстой кишке серотонин стимулирует подвижность на протяжении всей длины, вызывая фазовые сокращения, но не гигантские двигательные комплексы [18]. Кишечные гладкомышечные ритмические колебания определяются спонтанной активностью интерстициальных клеток Кахаля, которые работают как кардиостимулятор для клеток в ЖКТ [19–22]. Кишечная нервная система (КНС) состоит из полуавтономных эффекторных систем, которые связаны с центральной вегетативной системой. При освобождении серотонина из энтерохромаффинных клеток происходит инициация вагусных рефлексов — перистальтических, выделительных, сосудорасширяющих, ноцицептивных. Парасимпатический и симпатический отделы вегетативной нервной системы образуют КНС через афферентные и эфферентные связи. Текущие двунаправленные отношения рефлекторной дуги «мозг–кишка» с участием 5-HT оказывают существенное влияние на эффекторные системы. Нарушенная 5-HT-трансмиссия может привести к возникновению как кишечных, так и внекишечных проявлений синдрома раздраженного кишечника (СРК) [23].
Степень участия в функциональной перистальтической активности ЖКТ различных 5-HT подразделяется следующим образом — 5-HT3 — 65%, 5-НТ4 — 85% и 5-HT7 — 40%. В сочетании антагонисты этих рецепторов, приведенные в парах, способны уменьшить перистальтическую активность кишечника примерно на 16% (5-HT3 + 5-HT4), на 70% (5-HT3 + 5-HT7) и на 87% (5-HT4 + 5-HT7), а одновременное введение всех трех антагонистов неизбежно блокирует всю перистальтическую активности. Таким образом, 5-HT-рецепторы играют ключевую роль в модуляции кишечной перистальтики с одновременной блокадой трех рецепторов и подавляют перистальтическую активность. Среди 5-HT-рецепторов ЖКТ подтип 5-HT4 наиболее функционально важен для перистальтики, а 5-HT3- и 5-HT7-рецепторы играют несколько менее активную роль в этом процессе, что отражено в табл. 2 и на рис. 1 [24].
5-HT4-агонисты были доступны с введением в клиническую практику метоклопрамида в 1964 г. Этот препарат является антагонистом дофаминовых D2- и 5-HT3-рецепторов, а также агонистом 5-HT4-рецепторов и до сих пор широко используется во всем мира. Его успех привел к разработке альтернативных молекул, которые не влияют на D2-рецепторы, устраняя тем самым такие неблагоприятные события, как акатизия и экстрапирамидные двигательные расстройства.
Серотониновые рецепторы, в частности, 5-HT3 и 5-НТ4, участвуют в сенсорных и рефлекторных реакциях на раздражители при гастроинтестинальных расстройствах, обусловливая такие проявления, как рвота, запор или диарея, нарушения пищевого поведения, боли в животе, измененные сенсомоторные рефлексы [25]. Было высказано предположение, что селективные ингибиторы обратного захвата серотонина (СИОЗС) могут влиять на функцию 5-HT3-рецепторов, а также могут улучшить симптоматику СРК и сопутствующей депрессии у пациентов. Согласно ряду исследований и обзоров [26–29], трициклические антидепрессанты (амитриптилин, Мелипрамин), антидепрессанты ряда СИОЗС, такие как флуоксетин, пароксетин, циталопрам, кломипрамин, литоксетин, тразодон, и ряда селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН) (дулоксетин) улучшают симптомы СРК. Долгосрочные побочные эффекты данной терапии являются общими для лечения антидепрессантами и связаны с антихолинергическим, серотонинергическим, седативным, антигистаминым и альфа-адренергическим эффектами. Эти эффекты необходимо учитывать при выборе подхода к лечению, поскольку описанные выше препараты влияют на моторику кишечника, функция кишечника пациента также должна учитываться при выборе серотонинергических препаратов (рис. 2) [30].
Как указывалось ранее, 5-HT1-, 5-HT3- и 5-НТ4-подтипы рецепторов играют важную роль в двигательных, чувствительных и секреторных функциях ЖКТ. Препараты, непосредственно влияющие на 5-HT-рецепторы, в отличие от трициклических антидепрессантов и СИОЗС, модулируют 5-гидрокситриптамин (5-HT) путем связывания с 5-HT-рецепторами, их характеристики отражены в табл. 3. Кишечные функции 5-HT-рецепторов связаны с гладкими мышцами, увеличением количества дефекаций, а также со снижением кишечного транзитного времени [31, 32]. Блокада 5-НТ3-рецепторов, в частности противорвотными средствами типа ондансетрона, приводит к запорам [33]. В течение последнего десятилетия были разработаны и испытаны блокаторы 5-НТ3-рецепторов — алосетрон и силансетрон при СРК-Д (СРК с диареей). Недавний систематический обзор и метаанализ 11 рандомизированных контролируемых исследований (РКИ) сравнения этих двух 5-НТ3-антагонистов с плацебо выявили положительный эффект препаратов [34]. Тем не менее, ряд редких побочных эффектов, включая ишемический колит и тяжелые запоры, привел к тому, что производство алосетрона и исследования по силансетрону были приостановлены [35]. Алосетрон сегодня доступен только по строгим показаниям (в США) для пациенток с тяжелым резистентным СРК с диареей, которые не ответили на первую или вторую линии терапии.
5-HT4-агонисты доказали свой терапевтический потенциал для лечения больных с нарушениями моторики ЖКТ. Препараты, у которых отсутствует селективность к 5-HT4-рецепторам, имеют ограниченный клинический успех в гастроэнтерологической практике. Например, наряду со сродством к 5-HT4-рецепторам, такие препараты, как цизаприд и тегасерод, имеют заметное сродство и к другим рецепторам, каналам или белкам-трансмиттерам. Неблагоприятные кардиоваскулярные события, наблюдаемые при применении этих средств, связаны с их неселективностью и перекрестными эффектами. Систематический обзор и метаанализ показали, что тегасерод превосходит плацебо при лечении запоров, в том числе и при СРК. Большинство исследований, относящихся к тегасероду, проводились с участием женщин, и в результате препарат первоначально был одобрен для лечения СРК-З (СРК с запором) только у женщин. Тем не менее, маркетинг тегасерода был также приостановлен, когда стали сообщаться данные о возможном росте сердечно-сосудистых и цереброваскулярных событий на фоне приема препарата [6].
Важным событием в клинической фармакологии стало открытие селективного лиганда (лиганд, от лат. ligare — связывать, атом, ион или молекула, связанные с неким центром (акцептором), термин применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами — рецепторами, иммуноглобулинами и др.) к 5-HT4-рецептору — прукалоприда (prucalopride). Избирательность этого нового препарата значительно отличает его от старших поколений альтернативных препаратов благодаря сведению к минимуму возможностей побочных эффектов. Кроме того, концепция поиска аналогичных лигандов открывает широкие возможности для дальнейшей разработки лекарственных препаратов и создания агонист-специфических эффектов в различных типах клеток, тканей или органов. Селективный агонист 5-HT4-рецепторов прукалоприд является инновационным препаратом с привлекательным профилем безопасности для лечения пациентов, страдающих гипомоторными расстройствами ЖКТ [36]. Прукалоприд имеет высокое сродство и избирательность к 5-HT4-рецепторам ЖКТ. За время существования препарата прукалоприд было проведено несколько крупных и долгосрочных исследований, которые позволили в полной мере оценить риски и преимущества использования прукалоприда при хронических запорах [36–38]. В целом прием прукалоприда был связан с последовательным и значительным улучшением удовлетворенности пациентов в их лечении, по оценке опросника качества жизни при запорах (Patient Assessment of Constipation Quality of Life questionnaire — PAC-QOL). Доля участников, получавших прукалоприд в дозе 2 мг в сутки, которые отметили улучшение ≥ 1 пункт по 5-балльной подшкале PAC-QOL, составила 45,3%, по сравнению с 21,3% среди тех больных, кто получал плацебо (р ≤ 0,001), но число ответчиков почти во всех исследованиях было менее 50%. В ходе других испытаний — PRU-США-11 и PRU-США-13 — не было выявлено никакого существенного различия между прукалопридом и плацебо во всех суррогатных точках. Общая частота нежелательных явлений была статистически достоверно чаще у пациентов, получавших прукалоприд (72%), по сравнению с пациентами, принимавшими плацебо (59%) (отношение рисков (ОР) 1,21, 95% доверительный интервал (ДИ): 1,06, 1,38). Неблагоприятные события, которые наиболее часто сообщали пациенты, получавшие прукалоприд, были головная боль (до 30%), тошнота (до 24%), диарея (до 5%), боли в животе и метеоризм (до 23%), головокружение (до 5%) и инфекции верхних дыхательных путей [39]. R. Cinca и соавт. сравнили эффективность, безопасность и влияние на качество жизни макрогола и прукалоприда у 240 женщин с хроническими запорами, которым другие слабительные не обеспечивали адекватную помощь. В этом исследовании макрогол оказался более эффективным для лечения хронического запора, чем прукалоприд, и лучше переносился [40]. В итоге можно сделать вывод, что прукалоприд может назначать врач, имеющий опыт в лечении хронических запоров, женщинам от 18 до 75 лет в том случае, если в их лечении не были эффективны другие слабительные средства.
Важно знать, что не всегда у пациентов бывает дефицит серотонина, в ряде случаев врач может сталкиваться с его избытком. У беспокойных гастроэнтерологических пациентов, которые имеют повышенное содержание серотонина, развивается аэрофагия, что вызывает увеличение воздушного пузыря в желудке и приводит к раздражению рецепторного аппарата [41]. Повышенный уровень серотонина обуславливает частую тошноту и рвоту вследствие активации блуждающего нерва, диарею или спастический запор, гастроинтестинальные панические атаки, головную боль, тремор, гипергидроз, волнение и тревогу, сердцебиение, нестабильное артериальное давление, бессонницу.
Серотонин играет важную роль не только в регуляции моторики и секреции в ЖКТ, усиливая его перистальтику и секреторную активность, но и является фактором роста для некоторых видов симбиотических микроорганизмов, усиливает бактериальный метаболизм в толстой кишке. Сами бактерии толстой кишки также вносят некоторый вклад в секрецию серотонина кишечником, поскольку многие виды симбиотических бактерий обладают способностью декарбоксилировать триптофан. При дисбиозе и ряде других заболеваний толстой кишки продукция серотонина кишечником значительно снижается. Массивное высвобождение серотонина из погибающих клеток слизистой желудка и кишечника при воздействии цитотоксических химиопрепаратов является одной из причин возникновения тошноты и рвоты, а также диареи при химиотерапии злокачественных опухолей [42, 43].
Трудно переоценить роль серотонина в организме человека. В передней части мозга под воздействием серотонина стимулируются области, ответственные за процесс познавательной активности, а повышение серотонинергической активности создает в коре головного мозга ощущение подъема настроения. Поступающий в спинной мозг серотонин положительно влияет на двигательную активность и тонус мышц, это состояние можно охарактеризовать фразой «горы сверну». Кроме настроения, серотонин «отвечает» за самообладание или эмоциональную устойчивость. Серотонин контролирует восприимчивость мозговых рецепторов к стрессовым гормонам адреналину и норадреналину. У людей с пониженным уровнем серотонина малейшие поводы вызывают обильную стрессовую реакцию. Отдельные исследователи считают, что доминирование особи в социальной иерархии обусловлено именно высоким уровнем серотонина [42, 43].
Заключение
Когда в организм поступает пища, в том числе содержащая триптофан, увеличивается выработка серотонина, что повышает настроение. Мозг быстро улавливает связь между этими явлениями и, в случае депрессии (серотонинового голодания), незамедлительно «требует» дополнительного поступления пищи с триптофаном или глюкозой. Наиболее богаты триптофаном продукты, которые почти целиком состоят из углеводов, например, хлеб, бананы, шоколад, инжир, курага, финики, изюм, арбузы и т. п. Перечисленные продукты давно известны и как регуляторы кишечной перистальтики. Их дефицит в питании приводит к депрессиям и проблемам ЖКТ, что можно часто наблюдать у людей, соблюдающих строгую низкокалорийную диету. По этой причине прежде чем назначать пациенту лекарственные препараты, повышающие уровень серотонина, необходимо уточнить причину его дефицита. Знание о деталях строения серотониновых рецепторов, несомненно, найдет применение в лечении пациентов некардиотоксичными аналогами серотонина или препаратами, повышающими уровень серотонина, которые будут выполнять свою целебную функцию и окажутся приятны во всех отношениях, например, такие как шоколад [44]. Препараты, повышающие уровень серотонина в синаптической щели и способствующие усилению его эффектов, относятся к группе антидепрессантов. Сегодня они являются одними из самых назначаемых лекарств врачами общей медицинской практики многих стран мира, в том числе Европы и Северной Америки. Своевременное назначение антидепрессантов как в монотерапии, так и в схемах лечения различных заболеваний, позволяет повысить эффективность лечения основного заболевания и улучшить качество жизни пациентов, особенно у пациентов гастроэнтерологического профиля.
Литература
- Medhus A. W., Sandstad O., Naslund E. at al. The influence of the migrating motor complex on the postprandial endocrine response // Scand J Gastroenterol. 1999. 34. Р. 1012–1018.
- Buchheit K. H., Engel G., Mutschler E., Richardson B. Study of the contractile effect of 5-hydroxytryptamine (5-HT) in the isolated longitudinal muscle strip from guinea-pig ileum. Evidence for two distinct release mechanisms // Naunyn Schmiedebergs Arch Pharmacol. 1985. 329. Р. 36–41.
- Kim D. Y., Camilleri M. Serotonin: a mediator of the brain-gut connection // Am J Gastroenterol. 2000. 95. Р. 2698–2709.
- Woollard D. J., Bornstein J. C., Furness J. B. Characterization of 5-HT receptors mediating contraction and relaxation of the longitudinal muscle of guinea-pig distal colon in vitro // Naunyn Schmiedebergs Arch Pharmacol. 1994. 349. Р. 455–462.
- Yamano M., Ito H., Miyata K. Species differences in the 5-hydroxytryptamine-induced contraction in the isolated distal ileum // Jpn J Pharmacol. 1997. 74. Р. 267–274.
- De Maeyer J. H., Lefebvre R. A., Schuurkes J. A. 5-HT4 receptor agonists: similar but not the same // Neurogastroenterol Motil. 2008. 20. Р. 99–112.
- Hannon J., Hoyer D. Molecular biology of 5-HT receptors // Behav Brain Res. 2008. 195. Р. 198–213.
- Kim D. Y., Camilleri M. Serotonin: a mediator of the brain-gut connection // Am J Gastroenterol. 2000. 95. Р. 2698–2709.
- Berger M., Gray J. A., Roth B. L. The expanded biology of serotonin // Annu Rev Med. 2009. 60. Р. 355–366.
- Hannon J., Hoyer D. Molecular biology of 5-HT receptors // Behav Brain Res. 2008. 195. Р. 198–213.
- Crowell M. D. Role of serotonin in the pathophysiology of the irritable bowel syndrome // Br J Pharmacol. 2004. 141. Р. 1285–1293.
- Gershon M. D. Plasticity in serotonin control mechanisms in the gut // Curr Opin Pharmacol. 2003. 3. Р. 600–607.
- Bearcroft C. P., Perrett D., Farthing M. J. Postprandial plasma 5-hydroxytryptamine in diarrhoea predominant irritable bowel syndrome: a pilot study // Gut. 1998. 42. Р. 42–46.
- Hansen M. B. Small intestinal manometry // Physiol Res. 2002. 51. Р. 541–556.
- Fishlock D. J., Parks A. G., Dewell J. V. Action of 5-hydroxytryptamine on the human stomach, duodenum, and jejunum in vitro // Gut. 1965. 6. Р. 338–342.
- Hopkinson G. B., Hinsdale J., Jaffe B. M. Contraction of canine stomach and small bowel by intravenous administration of serotonin. A physiologic response? // Scand J Gastroenterol. 1989. 24. Р. 923–932.
- Hansen M. B., Gregersen H., Husebye E., Wallin L. Effect of serotonin and ondansetron on upper GI manometry in healthy volunteers // Neurogastroenterol Motil. 2000. 12. Р. 281.
- Boerckxstaens G. E., Pelckmans P. A., Rampart M. at al. Pharmacological characterization of 5-hydroxytryptamine receptors in the canine terminal ileum and ileocolonic junction // J Pharmacol ExpTher. 1990. 254. Р. 652–658.
- Alberti E., Mikkelsen H. B., Larsen J. O., Jimenez M. Motility patterns and distribution of interstitial cells of Cajal and nitrergic neurons in the proximal, mid- and distal-colon of the rat // Neurogastroenterol Motil. 2005. 17. Р. 133–147.
- Sanders K. M. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract // Gastroenterology. 1996. 111. Р. 492–515.
- Thomsen L., Robinson T. L., Lee J. C. at al. Interstitial cells of Cajal generate a rhythmic pacemaker current // Nat Med. 1998. 4. Р. 848–851.
- Park S. Y., Je H. D., Shim J. H., Sohn U. D. Characteristics of spontaneous contraction in the circular smooth muscles of cat ileum // Arch Pharm Res. 2010. 33. Р. 159–165.
- Crowell M. D. Role of serotonin in the pathophysiology of the irritable bowel syndrome // Br J Pharmacol. 2004. 141 (8). Р. 1285–1293.
- Balestra B., Vicini R., Pastoris O. at al. 5-HT receptors and control of intestinal motility: expression and hierarchic role // Poster Session, Bologna. 2011.
- Read N. W., Gwee K. A. The importance of 5-hydroxytryptamine receptors in the gut // Pharmacol Ther. 1994. Apr-May; 62 (1–2). Р. 159–173.
- Lucchelli A., Santagostino-Barbone M. G., Barbieri A. at al. The interaction of antidepressant drugs with central and peripheral (enteric) 5-HT3 and 5-HT4 receptors // Br J Pharmacol. 1995. Mar; 114 (5). Р. 1017–1025.
- Ford A. C., Talley N. J., Schoenfeld P. S., Quigley E. M., Moayyedi P. Efficacy of antidepressants and psychological therapies in irritable bowel syndrome: systematic review and meta-analysis // Gut. 2009. Mar; 58 (3). Р. 367–378.
- Friedrich M., Grady S. E., Wall G. C. Effects of antidepressants in patients with irritable bowel syndrome and comorbid depression // Clin Ther. 2010. Jul; 32 (7). Р. 1221–1233.
- Chial H. J., Camilleri M., Burton D. at al. Selective effects of serotonergic psychoactive agents on gastrointestinal functions in health // Am J Physiol Gastrointest Liver Physiol. 2003. 284. G130-G137.
- Turvill J. L., Connor P., Farthing M. J. The inhibition of cholera toxin-induced 5-HT release by the 5-HT (3) receptor antagonist, granisetron, in the rat // Br J Pharmacol. 2000. 130. Р. 1031–1036.
- Ruckebusch Y., Bardon T. Involvement of serotonergic mechanisms in initiation of small intestine cyclic motor events // Dig Dis Sci. 1984. 29. Р. 520–527.
- Haus U., Spath M., Farber L. Spectrum of use and tolerability of 5-HT3 receptor antagonists // Scand J Rheumatol Suppl. 2004. 119. Р. 12–18.
- Ford A. C., Brandt. L. J., Young C. at al. Efficacy of 5-HT3 antagonists and 5-HT4 agonists in irritable bowel syndrome: Systematic review and metaanalysis // Am J Gastroenterol. 2009. 104. Р. 1831–1843.
- US Food and Drug Administration. Glaxo Wellcome withdraws irritable bowel syndrome medication // FDA Consum. 2001. 35. Р. 3.
- Johanson J. F., Drossman D. A., Panas R., Wahle A., Ueno R. Clinical trial: phase 2 study of lubiprostone for irritable bowel syndrome with constipation // Aliment. Pharmacol. 2008. 27. Р. 685–696.
- Camilleri M., Kerstens R., Rykx A., Vandeplassche L. A Placebo-Controlled Trial of Prucalopride for Severe Chronic Constipation // N Engl J Med. 2008. 358. Р. 2344–2354.
- Tack J., van Outryve M., Beyens G., Kerstens R., Vandeplassche L. Prucalopride (Resolor) in the treatment of severe chronic constipation in patients dissatisfied with laxatives // Gut. 2009; 58: 357–565.
- Quigley E. M., Vandeplassche L., Kerstens R., Ausma J. Clinical trial: the efficacy, impact on quality of life, and safety and tolerability of prucalopride in severe chronic constipation a 12-week, randomized, double-blind, placebo-controlled study // Aliment Pharmacol Ther. 2009; 29: 315–328.
- https://www.pbs.gov.au/industry/listing/elements/pbac-meetings/psd/2012–7/prucalopride.pdf.
- Cinca R., Chera D., Gruss H. J., Halphen M. Randomised clinical trial: macrogol/PEG 3350+electrolytes versus prucalopride in the treatment of chronic constipation — a comparison in a controlled environment // Aliment Pharmacol Ther. 2013. May; 37 (9). Р. 876–886.
- Буров Н. Е. Тошнота и рвота в клинической практике (этиология, патогенез, профилактика и лечение) // Российский медицинский журнал. 2002. № 16. С. 390–395.
- Баринов Э. Ф., Сулаева О. Н. Роль серотонина в физиологии и патологии желудочно-кишечного тракта // РЖГГК. 2012. Т. 21. № 2. С. 4–13.
- Ашмарин И. П., Ещенко Н. Д., Каразеева Е. П. Нейрохимия в таблицах и схемах. М.: «Экзамен», 2007. 143 с.
- Palczewski K., Kiser P. D. As good as chocolate // Science. 2013. 340. Р. 562–563.
Е. Ю. Плотникова1, доктор медицинских наук, профессор О. А. Краснов, доктор медицинских наук, профессор
ГБОУ ВПО КемГМА МЗ РФ, Кемерово
1 Контактная информация
Как работают витамины для хорошего настроения?
В отличие от антидепрессантов, которые ингибируют обратный захват серотонина, витамины на растительной основе действуют иначе – более мягко. Они приводят все нейромедиаторы в баланс и помогают гормону счастья вырабатываться в нужном количестве, не причиняя серьезного вреда организму человека:
- борются с усталостью и раздражительностью;
- повышают память, внимание и концентрацию;
- устраняют бессонницу и другие нарушения сна;
- защищают от депрессии и нервных расстройств;
- возвращают интерес к жизни и нормализуют аппетит.
Постоянные стрессы на работе и дома не позволяют всегда быть на пике активности. Но теперь эта проблема решается легко: всего одна капсула растительных витаминов в день – и вам уже намного легче справляться с вызовами, которые подготовил для вас этот мир. Забывчивость, рассеянность и апатичность сменятся бодростью и позитивным настроением.
Эндорфины и другие нейромедиаторы
Кроме медиаторов при депрессии могут быть изменения со стороны эндорфинов — нейропептидов, биологически активных веществ, обладающих свойствами гормона и медиатора одновременно. Эндорфины отвечают за восприимчивость человека к болевым ощущениям. Низкое содержание эндорфинов при дистимии объясняет плохую переносимость боли у людей, страдающих депрессией.
При расстройствах депрессивного спектра выявляются нарушения синаптической передачи, преимущественно относящиеся к тормозным ГАМК-эргическимсистемам мозга (отмечено снижение гамма-аминомасляной кислоты во время депрессии). Выделяясь в кровь гамма-аминомасляная кислота понижает уровень тревоги. Она также принимает участие в регуляции потока нервных импульсов, блокируя высвобождение других медиаторов, например, дофамина и норадреналина. Вследствие этого, происходит дезорганизация взаимодействия нервных клеток, осуществляющих обработку сенсорной (экстра- и интероцептивной) информации и интеграцию моторной и регуляторной активности. При этом возникают различные расстройства психической деятельности с соответствующими неврологическими и вегетативными проявлениями (Экклс Дж., 1971; Гусельников В.И., Изнак А.Ф., 1983; Глезер В.Д., 1985).
При депрессии происходит изменение концентрации биологически активных веществ не только между нервными клетками, но и внутри нейронов. Эти вещества в стенке нервной клетки расщепляются на более мелкие составные части, которые повышают активность нейронов, путем изменения направления движения медиаторов к центру нейрона, к его ядру.
Вернуться к Содержанию
Управлять гормонами счастья легко!
Секрет эффективность растительных витаминов для настроения – в идеальном составе. В них нет ничего лишнего помимо активных компонентов – экстрактов лекарственных трав. Например, это могут быть:
- трава зверобоя и клевера;
- родиола розовая и валериана;
- володушка и кора муиры пуамы.
Такие витамины даже при длительном применении часто оказываются более эффективными и безопасными в сравнении с синтетическими препаратами и антидепрессантами, вызывающими привыкание, эффект отмены, сонливость и другие побочные эффекты.
Теперь вы знаете, как правильно повышать уровень серотонина в организме, чтобы положительный результат не заставил себя ждать. Позвольте гормону счастья вырабатываться в полном объеме – и ваша жизнь станет яркой, а каждый день будет приносить максимум пользы и удовольствия.