Содержание
- 1 Гонадотропные гормоны
- 2 Секреция гонадотропных гормонов 2.1 Регуляция секреции гонадолиберина
- 2.2 Механизм действия гонадолиберина
- 5.1 Диагностическое применение
- 6.1 Тест на беременность
- 7.1 Женское бесплодие
В каких случаях рекомендуют укол ХГЧ?
Врачи советуют прибегнуть к инъекции гормона после получения результатов теста на его уровень. Обычно введение эффективных препаратов рекомендуют в следующих случаях:
- Дисменорея,
- Проблемы в работе яичников,
- Недостатки процесса овуляции,
- Проблемы, связанные с желтым телом,
- Перспектива выкидыша,
- Неприспособленность организма к вынашиванию ребенка,
- Терапия перед экстракорпоральным оплодотворением,
- Формирование плацентарной ткани.
Медикаменты, в состав которых входит ХГЧ, используют при проведении репродуктивных процедур различной специфики, так как гормон позитивно влияет на работу яичников.
Гонадотропные гормоны[править | править код]
К гонадотропным гормонам гипофиза относят фолликул-стимулирующий гормон (ФСГ)
и
лютеинизирующий гормон (ЛГ)
.
Хорионический гонадотропин (ХГ)
тоже влияет на половые железы, но синтезируется плацентой. Эти три гормона вместе с тиреотропным гормоном (ТТГ) сходны по строению и образуют семейство гликопротеидных гормонов. Все они состоят из двух субъединиц: а-субъединица у всех одинаковая, а β-субъединицы различаются и обеспечивают специфическую активность. При этом β-субъединицы всех гормонов достаточно схожи, за исключением β-субъединицы ХГ, которая содержит дополнительный участок из 30 аминокислотных остатков на С-конце и несколько дополнительных углеводных остатков. Углеводные остатки увеличивают период полувыведения (Т1/2) этих гормонов в сыворотке, а также участвуют в их связывании с рецепторами. У человека ген, кодирующий β-субъединицу ФСГ, локализуется в сегменте 11р13, а β-субъединицу ЛГ — в сегменте 19ql2.32, по соседству по меньшей мере с 7 генами, кодирующими β-субъединицу ХГ. Ген, кодирующий а-субъединицу этих гормонов, локализуется в сегменте 6q21—q23.
Секреция гонадотропных гормонов[править | править код]
Рисунок 56.4. Гипогаламо-гипофизарно-гонадная система
Регуляция секреции гонадотропных гормонов подробно описана в статье — половые гормоны. ЛГ и ФСГ синтезируются гонадотропными клетками, которые составляют около 20% секретирующих клеток аденогипофиза. ХГ, который обнаружен только у человека, приматов и лошадей, синтезируется клетками синцитиотрофобласта. Синтез ФСГ и ЛГ стимулируется гонадолиберином и регулируется по принципу обратной связи половыми гормонами (рис. 56.4 и 58.2).
Рисунок 58.2. Нейроэндокринная регуляция секреции гонадотропных гормонов у женщины.
Регуляция секреции гонадолиберина[править | править код]
Гонадолиберин и его аналоги
Гонадолиберин — это гормон, который стимулирует синтез и секрецию ФСГ и ЛГ гонадотропными клетками аденогипофиза. Гонадолиберин образуется в результате протеолитического расщепления полипептида, содержащего 92 аминокислотных остатка, который Кодируется геном, расположенным в сегменте 8р21. Сам гонадолиберин представляет собой декапептид с амидной группой на С-конце и остатком пироглутаминовой кислоты на N-конце (табл. 56.3). Секреция гонадолиберина происходит импульсно в результате синхронизированной ритмической активности группы нейронов, расположенных в области ядра воронки. Активность этих нейронов начинается еще до рождения и продолжается примерно в течение года после него; затем она значительно снижается, вероятно, в результате тормозного действия ЦНС. Незадолго до начала полового развития тормозное действие ЦНС снижается, а частота и амплитуда импульсов секреции гонадолиберина увеличиваются, особенно сильно повышаясь во сне. По мере полового развития секреция гонадолиберина продолжает возрастать, пока не достигнет значений, характерных для взрослых. Импульсный характер секреции гонадолиберина необходим для нормального синтеза и секреции гонадотропных гормонов, секреция которых также происходит импульсно. Постоянное введение гонадолиберина приводит к десенситизации и снижению числа рецепторов гонадолиберина на гонадотропных клетках аденогипофиза. Это явление лежит в основе клинического применения аналогов гонадолиберина длительного действия, которые подавляют секрецию гонадотропных гормонов (см. ниже). После их введения секреция ЛГ и ФСГ кратковременно возрастает, но затем происходит десенситизация рецепторов, и секреция снижается.
Механизм действия гонадолиберина[править | править код]
Рецептор гонадолиберина относится к рецепторам, сопряженным с G-белками; его ген находится в сегменте 4q21. При связывании гонадолиберина или его аналогов с рецептором происходит активация белков Gq и GM, которые, в свою очередь, активируют фосфолипазу С, что приводит к увеличению внутриклеточной концентрации кальция. Это в итоге стимулирует синтез и секрецию ЛГ и ФСГ. Хотя цАМФ не принимает заметного участия в передаче сигнала от рецептора гонадолиберина, активация этого рецептора увеличивает активность аденилатциклазы. Рецепторы гонадолиберина присутствуют также в яичниках и яичках, однако их физиологическое значение остается неизвестным.
Половые гормоны также регулируют синтез ЛГ и ФСГ, воздействуя на гипоталамус и в меньшей степени — на гипофиз. Эта регуляция по-разному осуществляется у мужчин и женщин и зависит от возраста и фазы менструального цикла. У женщин низкие концентрации эстра-диола и прогестерона подавляют синтез гонадотропных гормонов за счет опосредованного опиоидами действия на нейроны, отвечающие за импульсную секрецию гонадолиберина. Однако длительное повышение концентрации эстрадиола действует по принципу положительной обратной связи, приводя к предовуляторному выбросу ЛГ. У мужчин синтез гонадотропных гормонов подавляется тестостероном, причем частично это обусловлено его прямым действием, а частично — превращением в эстрад иол.
Ингибин — пептидный гормон, образующийся в половых железах и играющий важную роль в регуляции секреции гонадотропных гормонов. Он синтезируется клетками гранулярного слоя фолликулов в яичниках и клетками Сертоли в яичках в ответ на стимуляцию гонадотропными гормонами и местными факторами роста. Ингибин действует непосредственно на гипофиз, избирательно подавляя секрецию ФСГ, но не Л Г. Ингибин относится к тому же семейству гликопротеидов, что и трансформирующий фактор роста |3 и фактор регрессии мюллеро-вых протоков.
Гонадотропины и антигонадотропины в гинекологии
Авторы: Майоров М.В.
«Fortuna comprobat hominis consilium»(«Успех подтверждает правильность планов», лат.).
Более 70 лет назад немецкие учёные Aschheim и Zondek привели убедительные доказательства гонадотропной функции передней доли гипофиза. Вскоре последовало разделение эффектов введения экстракта передней доли гипофиза на фолликулостимулирующий и лютеинизирующий. В 1932 г. Нohlweg и Junkmann но только в 1960 г. McCann и соавт. выявили ЛГ — рилизинг — фактор в гипоталамусе крысы. Впоследствии Schally и Guillemin установили, что гонадротропин — рилизинг — гормон (ГнРГ) является декапептидом и расшифровали его структуру.
Как известно, в передней доле гипофиза образуется два различных гонадотропных гормона, отличающихся по химической структуре и иммунологическим свойствам: фолликулостимулирующий гормон (ФСГ), или фоллитропин, лютеинизирующий гормон (ЛГ), или лютропин. Кроме того, здесь продуцируются адренокортикотропный гормон (АКТГ), или кортикотропин, тиреотропный гормон (ТТГ) или тиреотропин, соматотропный гормон (СТГ), или гормон роста, а также пролактин (ПРЛ), угнетающий продукцию гонадотропных гормонов. Относительная молекулярная масса ФСГ и ЛГ человека составляет около 32000. Эти гормоны могут существовать в виде мономеров, димеров и тетрамеров (10). Выделение ФСГ, ЛГ и ПРЛ регулируется рилизинг — и рилизинг — ингибирующими факторами гипоталамуса.
Регуляция овуляции у женщин и сперматогенеза у мужчин является результатом довольно сложного взаимодействия гипоталамуса, аденогипофиза и половых гормонов, образующихся в половых железах. Данная система контролируется тремя механизмами обратной связи: 1. «длинной обратной связи» — действие половых гормонов на гипоталамус осуществляется по механизму отрицательной (эстрогены, прогестерон и тестостерон) и положительной (эстрогены и прогестерон) обратной связи; 2. «короткой обратной связи», определяющей прямое регулирующее действие половых гормонов на выделение аденогипофизом ФСГ и ЛГ; 3. «ультракороткой обратной связи», представляющей собой регуляцию выделения гонадотропин — рилизинг — гормона (ГнРГ) под действием ФСГ и ЛГ гипофиза.
По-видимому, выделение ГнРГ зависит от дофамина, содержащегося в нервных окончаниях гипоталамуса; в свою очередь, ГнРГ действует на ФСГ- и ЛГ- секреторные клетки аденогипофиза. Секреторная активность гипоталамуса и гипофиза модулируется эстрогенами, прогестероном и тестостероном по — разному. Полагают, что ГнРГ оказывает сходное действие у мужчин и женщин, за исключением цикличности его выделения (у женщин), определяемой гипоталамусом. Регуляторная активность ГнРГ сосредоточена в двух центрах: тоническом (в вентро-медиальном и дугообразном ядрах) и циклическом (в преоптической супрахиазмальной области). У мужчин тонический центр доминирует, активизируя гипофиз и, вследствие этого, деятельность яичек, что вызывает сперматогенез и синтез тестостерона.
У женщин отсутствие андрогенов, по-видимому, определяет появление так называемых «гипоталамических часов», необходимых для циклического выброса гонадотропинов (т. е. доминирует циклический центр). Он чувствителен к внешним и внутренним воздействиям, в присутствии женских половых гормонов активизируется (или наоборот, — подавляется) и непрямым образом стимулирует тонический центр, вызывая повышение выделения ЛГ (преимущественно, аденогипофизом) и последующую овуляцию. Выделенный из гипоталамуса свиней, овец и крупного рогатого скота, ГнРГ является декапептидом; его функциональные части у человека и свиней имеют одинаковое строение.
Регуляция репродукции и функция гонад осуществляется, преимущественно, гонадотропными гормонами, секретируемыми аденогипофизом, — ФСГ, ЛГ и ПРЛ (12). ФСГ вызывает пролиферацию гранулёзных клеток, стимулируя рост фолликулов, ЛГ – активизирует синтез андрогенов и совместно с ФСГ способствует овуляции. Секреция ФСГ и ЛГ регулируется ГнРГ по принципу обратной связи, осуществляется в циклическом режиме, но зависит также от уровня эстрогенов и андрогенов.
По химической структуре ЛГ и ФСГ — гликопротеиды, состоящие из двух полипептидных субъединиц α и β. Субъединица α этих гормонов является общей для каждого гликопротеида и имеет одинаковую последовательность аминокислот; β — субъединица отличается среди гликопротеидов по последовательности входящих в неё аминокислот. Именно β- субъединица отвечает за гормональную специфичность. В отдельности друг от друга обе субъединицы биологически неактивны.
Подобно стероидам, гонадотропины оказывают биологический эффект на ткани — мишени посредством активации специфических рецепторов. Однако, в отличие от стероидных гормонов, рецепторы гонадотропинов связаны с мембраной клеток — мишеней. Поверхностные клеточные рецепторы к пептидным гликопротеиновым гормонам являются белками, входящими в структуру клеточной мембраны. После связывания с гонадотропином мембранные рецепторы стимулируют выработку растворимых внутриклеточных мессенджеров, которые, в свою очередь, обеспечивают клеточный ответ (12).
Согласно современным представлениям, регуляторами выработки ФСГ, помимо гипоталамических либеринов, являются ингибин и активин, продуцируемые гранулёзными и лютеиновыми клетками яичников, а также клетками цитотрофобласта. На синтез и выделение ФСГ оказывает влияние также фоллистатин, выделенный из фолликулярной жидкости. Существует три типа секреции гонадотропинов: тонический, циклический и эпизодический (пульсирующий). Тоническая (базальная) секреция гонадотропинов регулируется посредством отрицательной обратной связи, циклическая — механизмом положительной обратной связи (с участием эстрогенов), пульсирующая секреция — обусловлена активностью гипоталамуса и высвобождением гонадолиберинов.
Развитие фолликула в первой фазе цикла происходит, благодаря тонической секреции ФСГ и ЛГ. Повышение секреции эстрадиола приводит к торможению образования ФСГ. Следовательно, ФСГ приводит к синтезу в определённом фолликуле эстрогенов, которые, увеличивая количество рецепторов к ФСГ, способствуют его накоплению (путём связывания рецепторами), дальнейшему созреванию фолликула и увеличению секреции эстрадиола; другие фолликулы в это время подвергаются атрезии. Концентрация эстрадиола в крови достигает максимума в крови в предовуляторный период, что приводит к высвобождению большого количества гонадолиберина. За этим следует пик предовуляторного повышения ЛГ и ФСГ, стимулирующий разрыв граафова пузырька и овуляцию.
ЛГ является основным регулятором синтеза стероидов в яичниках. Рецепторы к ЛГ локализуются на лютеальных клетках, а влияние ЛГ опосредуется через стимуляцию аденилат — циклазы и внутриклеточного повышения уровня цАМФ. Активируются ферменты, участвующие в биосинтезе прогестерона, под влиянием ЛГ в яичниках увеличивается количество холестерина, необходимого для синтеза гормонов, повышается активность ферментов семейства цитохромов Р450 и других ферментов, участвующих в синтезе прогестерона, а также и других стероидов. Таким образом, в жёлтом теле под влиянием ЛГ усиливаются процессы стероидогенеза.
Регуляция секреции гонадотропинов обеспечивается за счёт «короткой» и «ультракороткой» цепей обратной связи: повышение уровня ЛГ и ФСГ приводит к торможению их синтеза и высвобождения, а повышенная концентрация гонадолиберина в гипоталамусе — угнетает эти процессы. На высвобождение гонадолиберина стимулирующее влияние оказывают катехоламины дофамин, адреналин и норадреналин, угнетающее действие — холецистокинин, гастрин, нейротензин, опиоиды и соматостатин.
Гонадотропные гормоны применяют для индукции овуляции, что имеет большое значение для лечения так называемого функционального женского бесплодия, в генезе которого существенное место занимают ановуляторные нарушения.
Перед началом лечения необходимо проведение соответствующих гормональных исследований, позволяющих провести дифференциальную диагностику первичной гипоталамо — гипофизарной недостаточности с первичной овариальной. Например, нормальный или часто пониженный уровень ФСГ, позволяет думать о первичных нарушениях в гипоталамо — гипофизарной области. На этой стадии диагностики нередко появляется необходимость исключения опухоли гипофиза. Невозможность вызвать менструацию после лечения высокими дозами эстрогенов, может свидетельствовать о маточной форме аменореи.
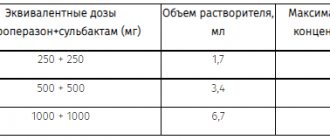
В медицинской практике в качестве препаратов, обладающих активностью ФСГ, применяют гонадотропин менопаузный (менотропины), а также его гомологи (урофоллитропин, фоллитропин — альфа, фоллитропин — бета) – табл. 1. Гонадотропин менопаузный получают из мочи женщин, находящихся в менопаузе. Препаратом, обладающим активностью ЛГ, является гонадотропин хорионический, получаемый из мочи беременных женщин. Все гонадотропины, как известно, представляют собой полипептиды, разрушающиеся ферментами при приёме внутрь, посему эффективны только при парентеральном введении.
Табл. 1 Препараты гонадотропинов (2)
| Наименование | Формы выпуска | Показания | Дозирование |
| Менопаузные гонадотропины человека (Human Menopausal Gonadotropins — HMG) Препараты: Menotropine, Pergonal, Humegon, Pergogrin | Каждая ампула содержит по 75 МЕ ФСГ и 75 МЕ ЛГ и 10 мг лактозы. К каждой ампуле прилагается ампула с растворителем (1 мл). | Бесплодие, обусловлен-ное ано-вуляцией и аменореей. Гипогонадо-тропный гипо-гонадизм у мужчин. | Для индукции роста и развития фолликулов в яичнике и стимуляции овуляции вводят по 2 мл внутримышечно 1 раз в день в течение 9 — 12 дней, после чего однократно вводится 10 000 МЕ хорионического гонадотропина человека (ХГЧ – HСG). Курс можно повторить дважды с месячным перерывом (в случае, если стимуляция произошла, но беременность не наступила). При повторном курсе доза может быть увеличена в 2 раза (по 150 МЕ ФСГ и 150 МЕ ЛГ); инъекции производят в течение 3 — 12 дней, а затем вновь однократно вводится 10 000 ХГЧ. |
| Урофоллитропин (Urofollitropin) Препараты Metrodin и др. | Порошок для инъекций в ампулах по 75 МЕ и 150 МЕ ФСГ; к каждой ампуле прилагается ампула с растворителем (1 мл 0,9 % раствора хлорида натрия) | Стимуляция созревания фолликулов и овуляции при гипоталамо – гипофизарной дисфункции (аменорея, олигомено- рея) и для подготовки яичников к осуществле-нию экстра-корпораль-ного оплодо-творения (ЭКО). | По 75 — 150 МЕ ФСГ внутримышечно или подкожно 1 раз в день в течение 7 — 12 дней; через 24 — 48 часов после последней инъекции метродина вводится 10 000 МЕ ХГЧ. |
| Человеческий хорионический гонадотропин (Human Chorionic Gonadotropin – HCG) Препараты: Profasi, Pregnyl LH, Choriogonin, Entromon, Follutein, Chorex, Gonic, Chorigon, Primogonyl и др. | Порошок для инъекций в ампулах по 500, 1000. 2000, 5000 и 10 000 МЕ HCG. Прилагается ампула с растворителем (1 мл 0,9 % раствора хлорида натрия). | Ановуляция. Подготовка яичников к осуществле-нию ЭКО. Гипогонадо-тропный гипогонадизм и криптор-хизм у мужчин | Для стимуляции овуляции вводится подкожно или внутримышечно через 24 – 48 часов после последней инъекции пергонала или метродина. |
Наряду с гонадотропными препаратами, в медицинской практике достаточно широко используются препараты антигонадотропного действия — угнетающие синтез и секрецию гонадотропинов непосредственно или путём угнетения высвобождения в гипоталамусе рилизинг — гормона ЛГ (2). Антигонадотропины используют, в частности, при лечении эндометриоза (особенно, с сопутствующим бесплодием), доброкачественных новообразований молочной железы, предменструального синдрома, гинекомастии и других заболеваний, при которых показана блокада гонадотропинов.
Характерным представителем группы антигонадотропинов является даназол (данол, дановал), представляющий собой синтетический стероид, по структуре близкий к этистерону. Основной механизм его действия заключается в обратимом подавлении продукции гипофизом ЛГ и ФСГ (как у женщин, так и у мужчин). Эстрогенным или гестагенным действием даназол не обладает, но проявляет слабую андрогенную и анаболическую активность и особенно активен при эндометриозе, при преждевременном половом созревании, гинекомастии, доброкачественных опухолях молочной железы. Он эффективно уменьшает размеры грудных желез и чувство напряжения в них при идиопатической или индуцированной лекарствами гинекомастии, уменьшает или устраняет боли при выраженной циклической мастальгии, даже не купируемой анальгетиками.
При эндометриозе начальная суточная доза составляет 400 мг, разделённых на 4 приёма; затем (при необходимости) её можно увеличить до 600 — 800 мг, причём курс лечения не должен превышать 6 месяцев. Начало приёма — в первый день менструального цикла. Препарат выпускается в капсулах по 100 и 200 мг. Побочные эффекты даназола частично обусловлены его андрогенным и анаболическим действием (угри, акне, усиленная секреция сальных желез, огрубение голоса, гирсутизм, гипертрофия клитора, задержка жидкости в организме), а также антиэстрогенным действием («приливы», эмоциональная лабильность, приступы обильного потоотделения, уменьшение размеров грудных желез), иногда — головная боль, головокружение, тахикардия, тошнота, выпадение волос, кожная сыпь.
Противопоказан даназол при беременности и порфирии; особенную осторожность следует проявлять при наличии болезней почек, печени, сердца, сахарного диабета (повышается потребность в инсулине), а также в случаях одновременного приёма противосудорожных средств и антикоагулянтов. Во многих странах даназол и его аналоги признаны основным средством, применяемым при эндометриозе, так как оказывает довольно быстрый лечебный эффект (ослабление болей и устранение других симптомов), во многих случаях способствуя регрессу эндометриодных гетеротопий.
К группе препаратов, обладающих антигонадотропным действием, относится гестринон (неместран) — синтетический стероидный гормон, производное 19 — норстероидов, обладающий сильным антипрогестиновым действием. Он не только уменьшает высвобождение гонадотропина, угнетая синтез стероидов в яичниках, но и проявляет прямое антагонистическое действие непосредственно в эндометриодной ткани в отношении эстрогенов и прогестерона – путём блокирования их рецепторов. Гестринон применяется только для лечения больных эндометриозом, характерные побочные эффекты его обусловлены андрогенным действием. Также возможны транзиторное повышение активности трансфераз (АСТ и АЛТ), нарушения либидо, нервозность и депрессия, изменение аппетита, головная боль, желудочно — кишечные расстройства. Противопоказан при беременности, лактации, болезнях печени, почек и сердца. Выпускается в капсулах по 2,5 мг, лечение начинают в первый день менструального цикла, назначают по 2,5 мг 2 раза в неделю (второй приём — на 4-й день цикла). Длительность курса лечения — 6 месяцев.
В последние годы на фармацевтическом рынке нашей страны появились синтетические аналоги природного ГнРГ (люлиберина), в частности, госерелин ацетат (золадекс). Вызывая блокирование высвобождения ГнРГ, госерелин приводит к уменьшению синтеза эстрадиола и понижению его концентрации в крови. Это способствует улучшению течения эндометриоза и даже его регрессу, поскольку рост и развитие эндометриодной ткани являются эстроген — зависимыми процессами. Также отмечается замедление прогрессирования гормонозависимых форм рака молочной железы и миом матки.
Основными показаниями к применению аналогов ГнРГ являются: эндометриоз, гормоночувствительные формы рака молочной железы у женщин в предклимактерическом и климактерическом периодах, симптомные миомы матки (при противопоказаниях к хирургическому лечению, или в качестве предоперационной подготовки), а также рак предстательной железы у мужчин.
К характерным побочным эффектам госерелина относятся симптомы, являющиеся следствием «выпадения» действия половых гормонов: «приливы», приступы обильного потоотделения, сухость слизистой оболочки влагалища, диспареуния, головные боли, эмоциональная лабильность, депрессия, остеопороз, иногда уменьшение размеров молочных желез. Препарат противопоказан при беременности, лактации и в детском возрасте. Выпускается в виде депо — препарата, однократная доза которого (3,6 мг) находится в одноразовом шприце — аппликаторе, вводится подкожно, желательно в переднюю брюшную стенку, 1 раз каждые 28 дней, в течение не более 6 месяцев.
Подобным действием обладают синтетические аналоги ГнРГ лейпрорелин ацетат (простап), диферелин (трипторелин) и нафарелина ацетат (синарел).
Последний препарат применяется только при эндометриозе и выпускается в виде раствора (0,002 г/мл) во флаконах по 10 мл (на 30 дней лечения). Суточная доза (400 мкг) вводится интраназально 2 раза в день — утром и вечером по 200 мкг, лечение следует начинать между 2-м и 4-м днями менструального цикла и продолжать в течение 6 мес. Нафарелин ацетат противопоказан при беременности, лактации и при гормонозависимых новообразованиях различной локализации.
Применение в медицинской практике гонадотропинов и антигонадотропинов, безусловно, позволяет значительно повысить эффективность лечения многих заболеваний, успешность терапии которых ранее была довольно проблематичной. Однако результативное лечение этими достаточно непростыми (и недешёвыми!) препаратами нередко весьма сложных пациенток требует от врача глубоких знаний, а также определённой смелости и осторожности. Ибо «Fortitudo circumsistitur hinc audacia, inde timiditate» («Храбрость обретается между безрассудной отвагой и робостью», из Апулея, лат.).
ЛИТЕРАТУРА
1. Бодяжина В. И., Сметник В. П., Тумилович Л. Г. Неоперативная гинекология, Москва, Медицина, 1990, 544 с. 2. Бороян Р. Г. Клиническая фармакология для акушеров — гинекологов, Москва, МИА, 1999, 224 с. 4. Зилва Дж. Ф., Пэнелл П. Р. Клиническая химия в диагностике и лечении, пер. с англ., Москва, Медицина, 1988, 528 с. 5. Коханевич Е. В. (ред.) Актуальные вопросы гинекологии, Киев, Книга-плюс, 1998, 53 с. 6. Майоров М. В. Эндометриоз: загадочное заболевание, бросающее вызов клиницистам// Провизор, 2002, № 18, с. 25 – 28 7. Майоров М. В. Синдром поликистозных яичников: современный взгляд // Провизор, 2002, № 16, с. 39 – 41. 8. Малевич К. И., Русакевич П. С. Лечение и реабилитация при гинекологических заболеваниях, Минск, Вышэйшая школа, 1994, 368 с. 9. Пауэрстейн К. Дж. (ред.) Гинекологические нарушения, пер. с англ., Москва, Медицина, 1985, 592 с. 10. Сатоскар Р. С., Бандаркар С. Д. Фармакология и фармакотерапия, в 2 — х томах, пер. с англ., Москва, Медицина, 1986. 11. Суслопаров Л. А. (ред.) Гинекология. Новейший справочник, Москва — Санкт-Петербург, ЭКСМО, 2003, 688 с. 12. Татарчук Т. Ф., Сольский Я. П. Эндокринная гинекология (клинические очерки), часть 1, Киев, 2003, 300 с. 13. Тейлор Р. Б. Трудный диагноз, в 2 — х томах, пер. с англ., Москва, Медицина, 1988. 14. Тронько М. Д (ред..) . Стандарти діагностики та лікування ендокринних захворювань, Київ. 2005, 312 с. 15. Тиц Н. У. (ред.) Клиническая оценка лабораторных тестов, пер. с англ., Москва, Медицина, 1986, 480 с. 16. Шамбах Х., Кнаппе Г., Карол В. Гормонотерапия, пер с нем., Москва, Медицина, 1988, 416 с. 17. Cry S. J. Clinical uses of luteinizing hormone-releasing hormone (LHRH), Fertil. And Steril.,1983, 39, 577. 18. Groot – Wassink K. Gonadotropine und Gonadotropin – Releasing – Hormon, DDR-Med. Rep., 1981, 10, 531.
Консультации Марка Вениаминовича Майорова в КлубКоме
опубликовано 08/11/2013 16:58 обновлено 30/11/2013 — Акушерство, гинекология, маммология, Женское здоровье
Механизм действия гонадотропных гормонов[править | править код]
ЛГ и ХГ связываются с рецептором Л Г (ген этого рецептора находится в сегменте 2р21), а ФСГ — со своим рецептором (ген этого рецептора находится на длинном плече 2-й хромосомы). Оба рецептора сопряжены с G-белками и обладают большим внеклеточным гликозилированным доменом, ответственным за распознавание гормона. При связывании рецептора с лигандом G,-белок активирует аденилатциклазу, что ведет к повышению концентрации цАМФ. При высокой концентрации лиганда рецепторы через Gq-белок активируют также протеинкиназу С и увеличивают концентрацию кальция за счет активации фос-фолипазы С. Все или почти все эффекты гонадотропных гормонов можно воспроизвести введением в клетку аналогов цАМФ, поэтому значение протеинкиназы С и Са2+ во внутриклеточной передаче сигнала остается неясным.
Физиологические эффекты гонадотропных гормонов[править | править код]
ЛГ и ФСГ были названы в соответствии с их действием на яичники; функция этих гормонов у мужчин была изучена позднее. У мужчин ЛГ действует на клетки Лейдига, стимулируя синтез андрогенов, в основном тестостерона. Тестостерон обеспечивает половое влечение, развитие вторичных половых признаков и сперматогенез в извитых семенных канальцах. ФСГ действует на клетки Сертоли, стимулируя образование ими белков и питательных веществ, необходимых для созревания сперматозоидов.
У женщин действие ФСГ и ЛГ более сложно. ФСГ стимулирует рост и развитие фолликулов, а также индуцирует экспрессию гена рецептора ЛГ на текоцитах и клетках гранулярного слоя в яичниках. Кроме того, ФСГ активирует ароматазу в клетках гранулярного слоя, стимулируя синтез эстрадиола. ЛГ действует на текоциты, стимулируя образование в них андростендиона, основного предшественника эстрадиола в яичниках у женщин детородного возраста. ЛГ необходим также для разрыва фолликула при овуляции и для синтеза прогестерона желтым телом. Наконец, связывание ЛГ со своим рецептором на клетках гранулярного слоя увеличивает экспрессию гена рецептора ФСГ, что усиливает действие последнего.
Значение гонадотропных гормонов в регуляции функций половых органов отчетливо выявляется при мутациях генов самих гормонов или их рецепторов (Achermann and Jameson, 1999). У женщин с мутациями генов рецептора ФСГ или β-субъединицы самого ФСГ наблюдаются первичная аменорея и бесплодие, у них не созревают фолликулы, отсутствуют желтые тела и не развиваются молочные железы. Эти данные, а также эффективность ФСГ при некоторых формах бесплодия (см. ниже) красноречиво свидетельствуют о важной роли ФСГ в функционировании яичников. У мужчин при таких же мутациях уменьшен размер яичек и наблюдается олигозооспермия, хотя в некоторых случаях сохраняется фертильность.
Описан только один случай мутации с потерей функции гена β-субъединицы Л Г: у 46-летнего мужчины отсутствовало половое развитие, наблюдались гипоплазия клеток Лейдига и бесплодие. Наружные половые органы у него были развиты по мужскому типу, что, видимо, объясняется синтезом андрогенов под действием ХГ во время внутриутробного развития. Проявления мутаций с потерей функции гена рецептора ЛГ при мужском кариотипе варьируют от мужского гипогонадизма до развития наружных половых органов по женскому типу и отсутствия полового развития. Вероятно, вирилизации наружных половых органов не происходит из-за нарушения действия как ЛГ, так и ХГ во время внутриутробного развития. У женщин, гомозиготных по мутантным аллелям гена рецептора Л Г, отмечаются первичная аменорея или олигоменорея и бесплодие, а при гистологическом исследовании выявляются множественные кисты яичников.
Мутации, ведущие к постоянной активации рецептора ЛГ, возникают преимущественно у мужчин и наследуются аутосом-но-доминантно. Они ведут к преждевременному половому развитию из-за неуправляемого синтеза тестостерона во внутриутробном и в препубертатном периодах. При некоторых из этих мутаций высок риск опухолей яичка.
ТЕСТОСТЕРОН
Основная часть тестостерона (мужской половой гормон) вырабатывается семенниками; меньшее количество — клетками сетчатого слоя коры надпочечников и при трансформации из предшественников в периферических тканях. У женщин тестостерон образуется в процессе периферической трансформации, а также при синтезе в клетках внутренней оболочки фолликула яичников и сетчатого слоя коры надпочечников. Тестостерон обеспечивает у мужчин формирование половой системы по мужскому типу, развитие мужских вторичных половых признаков в период полового созревания, отвечает за поддержание половой функции (либидо и потенция), созревание сперматозоидов, развитие скелета и мышечной массы, стимулирует костный мозг, деятельность сальных желез, модулирует синтез b-эндорфинов («гормонов радости»), инсулина. У женщин участвует в механизме регрессии фолликула в яичниках и в регуляции уровня гонадотропных гормонов гипофиза. Биологически активен только свободный тестостерон, растворенный в плазме, который в организме человека играет роль белкового анаболика, то есть стимулирует синтез белка. Именно по этой причине мужчины, как правило, крупнее женщин и более мускулистые. Во многих структурах, локализованных (находящихся) в коже, поступающий с кровью тестостерон определяет мужской тип волосяного покрова (рост бороды и т.п.) и избыточные сальные выделения (себорею). Уровень тестостерона у мужчин повышается в период полового созревания и сохраняется на высоком уровне в среднем до 60 лет. В течение суток концентрация гормона в плазме крови колеблется (max. – в утренние часы, min. – в вечерние). У женщин максимальная концентрация тестостерона определяется в лютеиновой фазе и в период овуляции. У беременных женщин нарастает к III триместру, превышая почти в 3 раза концентрацию у небеременных женщин. Показания к назначению анализа: У обоих полов: бесплодие, облысение, угревая сыпь, жирная себорея, опухоли надпочечников. У женщин: гирсутизм, ановуляция, аменорея, олигоменорея, дисфункциональные маточные кровотечения, невынашивание беременности, синдром поликистозных яичников, миома матки, эндометриоз, новообразования молочной железы, гипоплазия (недоразвитие) матки и молочных желез. У мужчин: нарушение потенции, снижение либидо, мужской климакс, первичный и вторичный гипогонадизм, хронический простатит, остеопороз. Повышение уровня тестостерона в крови может говорить о преждевременном половом созревании (у мальчиков), гиперплазии коры надпочечников, опухолях, продуцирующих половые гормоны. Уровень тестостерона обычно снижен при синдроме Дауна, почечной, печеночной недостаточности, недостаточности половых желез. Подготовка к исследованию: накануне исследования необходимо исключить физические нагрузки (спортивные тренировки) и курение. У женщин анализ производится на 6-7 день менструального цикла, если другие сроки не указаны лечащим врачом.
Применение гонадолиберина и его аналогов[править | править код]
В табл. 56.3 перечислены синтетические аналоги гонадолиберина, применяемые в клинике. Синтетический гонадолиберин называется гонадорелином. Замена аминокислотного остатка в положении 6 защищает аналоги гонадолиберина от протеолиза, а замена С-концевого остатка повышает сродство к рецептору. Такие аналоги обладают большей активностью и более длительным действием по сравнению с нативным гонадолиберином, Т1/2 которого составляет всего 2—4 мин.
Антагонисты гонадолиберина, в отличие от его аналогов длительного действия, не вызывают кратковременного повышения уровней гонадотропных гормонов в сыворотке. Современные антагонисты гонадолиберина, по-видимому, не приводят к местному и системному выбросу гистамина и анафилакгоидным реакциям, что ограничивало применение первых препаратов этой группы. Два антагониста гонадолиберина гаиреликс и цетрореликс применяют при искусственном оплодотворении для подавления выброса ЛГ во время стимуляции яичников. Ганиреликс доступен в США, а цетрореликс—только в Европе. Теоретически быстрое подавление выброса ЛГ дает возможность лучше контролировать стимуляцию яичников (см. ниже) и тем самым сокращает цикл искусственного оплодотворения. Однако практическую ценность этих препаратов при искусственном оплодотворении еще предстоит уточнить в клинических испытаниях.
Диагностическое применение[править | править код]
Один из препаратов гонадорелина (гонадорелина гидрохлорид) применяют для дифференциальной диагностики гипофизарного и гипоталамического поражения при вторичном гипогонадизме. Уровень ЛГ в сыворотке измеряют до введения гонадорелина в дозе 100 мкг п/к или в/в и в течение 2 ч (через 15,30,45,60 и 120 мин) после введения. Увеличение секреции ЛГ свидетельствует о наличии функционирующих гонадотропных клеток аденогипофиза. При длительном дефиците гонадолиберина чувствительность гонадотропных клеток к нему может снижаться, поэтому низкий уровень ЛГ при проведении пробы с гонадолиберином не обязательно говорит о поражении гипофиза. Пробу с гонадолиберином можно также использовать для дифференциальной диагностики истинного (связанного с секрецией гонадолиберина) и ложного преждевременного полового развития.
Лечение бесплодия[править | править код]
Другой препарат гонадорелина (гонадорелина ацетат) используют при нарушениях репродуктивной функции, связанных с дефицитом гонадолиберина. Препарат вводят в/в с помощью специального инфузионного насоса в импульсном режиме, имитирующем физиологическую секрецию, 2,5 мкг каждые 60—90 мин. Если овуляция не наступает, доза, вводимая за один импульс, может быть постепенно увеличена до 10 мкг. Принципы введения и дозы указаны в инструкции изготовителя. Гонадорелин реже, чем гонадотропные гормоны, вызывает многоплодную беременность. При лечении гона-дорелином не требуется столь тщательно контролировать уровень эстрогенов в сыворотке и проводить УЗИ яичников. Побочные реакции возникают редко, чаще всего развивается флебит в месте введения. При лечении гонадорелином у женщин восстанавливается физиологическая секреция половых гормонов, устанавливается менструальный цикл и происходит овуляция. Однако из-за технической сложности этот метод лечения применяют только в специализированных клиниках (Hayes et al., 1998).
При бесплодии у мужчин с помощью гонадорелина можно добиться роста яичек, нормальной секреции половых гормонов и сперматогенеза. Однако метод относительно дорог и требует постоянного ношения инфузионного насоса. К тому же гонадорелин не одобрен ФДА для лечения мужского бесплодия. Поэтому обычно предпочтение отдают гонадотропным гормонам.
Аналоги гонадолиберина длительного действия применяют также при индукций овуляции. Эти препараты подавляют предовуляторный выброс ЛГ и предотвращают лютеинизацию неовулирующего фолликула. Разработано несколько схем лечения, при которых длительно или краткосрочно вводят аналоги гонадолиберина совместно с гонадотропными гормонами, обеспечивающими созревание фолликула (см. ниже), а затем для индукции овуляции назначают ХГ (Lunenfeld, 1999).
Подавление секреции гонадотропных гормонов[править | править код]
Как уже говорилось, аналоги гонадолиберина длительного действия ведут к десенситизации рецепторов гонадолиберина, в результате чего секреция гонадотропных, а соответственно и половых, гормонов резко снижается. Такая «медикаментозная кастрация» оказалась очень удобной в тех случаях, когда нужно сократить выработку половых гормонов. Очевидное показание к подобному лечению — истинное преждевременное половое развитие у детей, при котором длительное введение аналогов гонадолиберина очень эффективно и почти не сопровождается побочными реакциями.
Аналоги гонадолиберина длительного действия используют для паллиативного лечения гормонально-зависимых опухолей (например, рака предстательной или молочной желез); поскольку в начале лечения эти препараты резко усиливают секрецию половых гормонов, одновременно назначают препараты, нарушающие синтез или блокирующие действие половых гормонов. Кроме того, аналоги гонадолиберина длительного действия используют при других гормонально-зависимых заболеваниях (эндометриозе, миоме матки и острой перемежающейся порфирии). Наконец, для медикаментозной кастрации при таких психических расстройствах, как педофилия, когда очень высок риск несоблюдения врачебных предписаний, особенно удобен гозерелин, который вводят в дозе 10,8 мг п/к 1 раз в 3 мес.
Аналоги гонадолиберина длительного действия в целом хорошо переносятся и вызывают вполне предсказуемые побочные эффекты, обусловленные нарушением синтеза половых гормонов: приливы, сухость влагалища, атрофический вагинит, снижение плотности костной ткани. В связи с этим при таких заболеваниях, как эндометриоз и миома матки, лечение обычно продолжают не более 6 мес или дополнительно назначают эстрогены для поддержания плотности костной ткани.
ЛГ (лютеотропный гормон)
У женщин лютеотропный гормон стимулирует синтез эстрогенов; регулирует секрецию прогестерона и формирование желтого тела. У мужчин, стимулируя образование глобулина, связывающего половые гормоны (ГСПГ), повышает проницаемость семенных канальцев для тестостерона. Тем самым увеличивается концентрация тестостерона в плазме крови, что способствует созреванию сперматозоидов. В свою очередь, тестостерон повторно сдерживает выделение ЛГ. Выделение гормона носит пульсирующий характер и зависит у женщин от фазы овуляционного цикла. В период полового созревания уровень ЛГ повышается, приближаясь к значениям, характерным для взрослых. В менструальном цикле у женщин пик концентрации ЛГ приходится на овуляцию, после которой уровень гормона падает и держится всю лютеиновую фазу на более низких, чем в фолликулярной фазе, значениях. Во время беременности концентрация снижается. В период постменопаузы происходит повышение концентрации ЛГ, как и ФСГ (фолликулостимулирующего гормона). У женщин концентрация ЛГ в крови максимальна в промежуток от 12 до 24 часов перед овуляцией и удерживается в течение всего дня, достигая концентрации в 10 раз большей по сравнению с неовуляционным периодом. У мужчин уровень ЛГ увеличивается к 60-65 годам. Показания к назначению анализа: гирсутизм, снижение либидо и потенции, ановуляция, олигоменорея, аменорея, бесплодие, дисфункциональные маточные кровотечения, невынашивание беременности, преждевременное половое развитие или его задержка, половой инфантилизм, эндометриоз, контроль эффективности гормонотерапии. Повышение уровня ЛГ наблюдается при недостаточности функции половых желез, синдроме поликистозных яичников, опухоли гипофиза, почечной недостаточности, атрофии гонад у мужчин после воспаления яичек. Снижение уровня ЛГ происходит при вторичной аменорее; гипофункции гипофиза и гипоталамуса, генетических синдромах, нервной анорексии, синдроме поликистозных яичников, недостаточности лютеиновой фазы, хирургических вмешательствах. Подготовка к исследованию: за 3 дня до взятия крови необходимо исключить спортивные тренировки. За 1 час до взятия крови — курение. Непосредственно перед забором крови необходимо успокоиться. Забор крови производится натощак, лежа. Анализ делается на 6-7 день менструального цикла, если другие сроки не указаны лечащим врачом.
Диагностическое применение гонадотропных гормонов[править | править код]
Тест на беременность[править | править код]
В крови и моче беременных в больших количествах присутствует ХГ, поэтому в качестве теста на беременность можно использовать иммунохимическое выявление β-субъединицы ХГ. Качественное определение β-субъединицы ХГ в моче лежит в основе тестов на беременность для домашнего применения, продаваемых в США без рецепта. Эти тесты позволяют быстро выявить беременность уже через несколько дней после задержки менструации.
Количественное определение концентрации ХГ в плазме в клинических и научных целях проводят с помощью РИА. Обычно это делают для оценки прогрессирования беременности, а также при подозрении на внематочную беременность, пузырный занос или хориокарциному.
Определение времени овуляции[править | править код]
Овуляция происходит через 36 ч после начала выброса ЛГ и через 10—12 ч после достижения пика его концентрации. Поэтому по концентрации ЛГ в моче можно предсказать время овуляции. Для домашнего использования выпускают наборы, позволяющие при помощи специфических антител полуколичественно оценить уровень ЛГ в моче. Тест проводят каждые 12 или 24 ч начиная с 11 -го дня цикла (при 28-дневном цикле) и по увеличению уровня Л Г определяют предполагаемое время овуляции. Это дает возможность повысить вероятность зачатия путем правильного выбора времени для полового сношения.
Диагностика расстройств репродуктивной функции[править | править код]
Количественное измерение уровня ФСГ и ЛГ в плазме методом РИА (по уровню β-субъединиц) используют для диагностики некоторых нарушений репродуктивной функции. Низкие или неопределяемые уровни ФСГ и ЛГ свидетельствуют о вторичном гипогонадизме и о поражении гипофиза или гипоталамуса. При первичном гипогонадизме уровни этих гормонов, наоборот, высокие. При аменорее у женщин или задержке полового развития у мужчин и женщин определение уровня ФСГ и ЛГ позволяет отличить поражение половых желез от поражения гипоталамо-гипофизарной системы.
По уровню ФСГ на 3-й день менструального цикла можно судить о фертильности. Даже при нормальном менструальном цикле уровень ФСГ 15 МЕ/мл и более говорит о низкой фертильности, и успех искусственного оплодотворения при этом маловероятен (см. ниже).
Проба с ХГ используется у мужчин для оценки функции клеток Лейдига по степени стимуляции синтеза тестостерона. Эту пробу попользуют при подозрении на нарушение функции клеток Лейдига (например, при задержке полового развития). Уровень тестостерона в сыворотке определяют после нескольких инъекций ХГ. Сниженная секреция тестостерона говорит о патологии клеток Лейдига, а нормальная — о поражении гипоталамо-гипофизарной системы.
ФСГ (фолликулостимулирующий гормон)
ФСГ — гормон гипофиза, регулирующий работу половых желез. У мужчин выделяется постоянно равномерно, у женщин — циклически, повышаясь в первую фазу менструального цикла. ФСГ способствует образованию и созреванию половых клеток: яйцеклеток и сперматозоидов. Яйцеклетка в яичнике растет в составе фолликула, состоящего из фолликулярных клеток. Эти клетки при росте фолликула, под влиянием ФСГ, синтезируют женские половые гормоны — эстрогены, которые, в свою очередь, подавляют выделение ФСГ (принцип отрицательной обратной связи). Показания к назначению анализа: снижение либидо и потенции, бесплодие, ановуляция, олигоменорея, аменорея, дисфункциональные маточные кровотечения, невынашивание беременности, преждевременное половое развитие или его задержка, синдром поликистозных яичников, эндометриоз, задержка роста, синдром хронического воспаления внутренних половых органов. Повышение уровня ФСГ может свидетельствовать о недостаточности функции половых желез, опухоли гипофиза, первичном гипогонадизме (у мужчин), синдроме истощения яичников (у женщин), почечной недостаточности, дисфункциональных маточных кровотечениях и других состояниях. Анализ покажет снижение уровня ФСГ при гипофункции гипофиза или гипоталамуса, беременности, вторичной аменорее, синдроме поликистозных яичников, гиперпролактинемии. Подготовка к исследованию: Анализ делается на 6-7 день менструального цикла, если другие сроки не указаны лечащим врачом. За 3 дней до взятия крови необходимо исключить спортивные тренировки. За 1 час до взятия крови — курение. Непосредственно перед забором крови необходимо успокоиться. Взятие крови из вены производится натощак, лежа.
Лечебное применение гонадотропных гормонов[править | править код]
Изначально гонадотропные гормоны для клинического применения получали из человеческих гипофизов (трупный материал) и из мочи женщин. Препараты гипофиза сейчас не используют из-за риска передачи возбудителя болезни Крейтцфельдта—Якоба. Из мочи получают несколько препаратов. ХГ, который по действию аналогичен Л Г, получают из мочи беременных. Из мочи женщин в постменопаузе получают препарат менотропин, который содержит примерно одинаковые количества ЛГ и ФСГ, а также другие белки мочи. Поскольку менотропин относительно плохо очищен, во избежание аллергических реакций его вводят в/м. Другой препарат — урофоллитропин — представляет собой очищенный ФСГ, получаемый путем удаления ЛГ иммунологическими методами. Урофоллитропин сверхвысокой очистки получают при помощи моноклональных антител к ФСГ. Он очищен настолько, что его можно вводить п/к.
Методами генной инженерии получена линия клеток млекопитающих, синтезирующая а- и р-субъединицы ФСГ. Получающийся при этом рекомбинантный ФСГ близок по характеру гликозилирования к нативному ФСГ. Сегодня выпускается два препарата рекомбинантного ФСГ — фоллитропин а и фоллитропин Р; их углеводные структуры слегка различаются. Оба эти препарата вводят п/к, поскольку они намного чище препаратов, получаемых из мочи, и значительно лучше стандартизованы. Рекомбинантные препараты стоят намного дороже нативных, однако данных за то, что они эффективнее или реже вызывают такие побочные реакции, как синдром гиперстимуляции яичников, пока нет. Вероятно, в будущем методами генной инженерии удастся получить аналоги гонадотропных гормонов более длительного действия и с более высокой активностью.
Женское бесплодие[править | править код]
Бесплодием страдают около 10% супружеских пар детородного возраста. Для лечения бесплодия все шире применяют гонадотропные гормоны (Vollenhoven and Healy, 1998); часто их используют при искусственном оплодотворении. Хотя основным показанием к их назначению служит хроническая ановуляция в результате вторичного гипогонадизма (группа 1 по классификации ВОЗ), гонадотропные гормоны используют и для индукции овуляции при синдроме поликистозных яичников (группа II по классификации ВОЗ) в том случае, когда кломифен неэффективен (гл. 58). Кроме того, гонадотропные гормоны применяют при бесплодии на фоне нормальной овуляции, хотя в этих случаях сначала пробуют лечение кломифеном. Назначать гонадотропные гормоны должны врачи с достаточным опытом лечения бесплодия и эндокринных расстройств.
При хронической ановуляции назначение одного ФСГ в большинстве случаев вызывает овуляцию. Обычно ФСГ назначают в дозе 75 МЕ/сут в течение первых 6—7 дней цикла, после чего при помощи влагалищного УЗИ оценивают число и размер созревающих фолликулов. УЗИ обычно проводят каждые 2—3 сут. Созревание фолликула считается адекватным, если обнаружен фолликул диаметром 18 мм. Если обнаружено три и более фолликула диаметром более 16 мм, ФСГ отменяют из-за опасности синдрома гиперстимуляции яичников (см. ниже) и применяют барьерные методы контрацепции для предотвращения многоплодной беременности. Определяют также концентрацию эстрадиола, которая должна находиться в диапазоне 500—1500 пг/мл. Более низкие значения указывают на недостаточную стимуляцию яичников, а более высокие — на опасность синдрома гиперстимуляции яичников. При недостаточной стимуляции яичников доза ФСГ может быть увеличена до 150 МЕ/сут.
Для завершения созревания фолликула и индукции овуляции на следующий день после отмены ФСГ назначают ХГ в дозе 5000—10 000 ME. При лечении гонадотропными гормонами в 10—20% случаев развивается многоплодная беременность, что связано с развитием нескольких третичных фолликулов и выходом нескольких яйцеклеток.
Гонадотропные гормоны используют при искусственном оплодотворении, в том числе при экстракорпоральном оплодотворении и микроинъекции сперматозоидов в цитоплазму яйцеклетки. С помощью ФСГ стимулируют развитие фолликулов, а для окончательного их созревания назначают ХГ, после чего зрелые яйцеклетки извлекают из третичных фолликулов хирургическим путем. Затем производят экстракорпоральное оплодотворение полученных яйцеклеток с помощью спермы или микроинъекции сперматозоидов в цитоплазму яйцеклетки. Эмбрионы переносят в полость матки или в маточную трубу. При искусственном оплодотворении риск многоплодной беременности зависит от числа перенесенных эмбрионов.
Помимо многоплодной беременности и ее возможных осложнений основным побочным эффектом гонадотропных гормонов является синдром гиперстимуляции яичников. Для этого синдрома характерно быстрое накопление жидкости в полости брюшины, плевральной полости и даже перикарде. Считается, что причина этого синдрома — выделение яичниками вещества, повышающего сосудистую проницаемость. Синдром гиперстимуляции яичников проявляется вздутием живота, болью в животе, тошнотой, рвотой, поносом, выраженным увеличением яичников, одышкой и олигурией. Синдром гиперстимуляции яичников может осложниться гиповолемией, водно-электролитными нарушениями, гемоперитонеумом, РДСВ, тромбоэмболиями и нарушением функции печени. При подозрении на развитие этого синдрома ХГ не назначают.
В некоторых исследованиях выдвигалось предположение, что гонадотропные гормоны увеличивают риск рака яичников, однако это осталось недоказанным. Важно отметить, что при стимуляции яичников ФСГ и менотропином не возрастает риск пороков развития у детей, рожденных из стимулированных яйцеклеток.
Мужское бесплодие[править | править код]
Лечение гонадотропными гормонами может быть эффективно, если причина бесплодия — их дефицит. Поскольку гонадотропные гормоны относительно дороги, а при длительном приеме может развиться резистентность к ним, обычно половое развитие стимулируют андрогенами, а гонадотропные гормоны применяют позже, для достижения собственно фертильности.
Лечение, как правило, начинают с введения ХГ в дозе 1000— 5000 ME в/м 3 раза в неделю до нормализации синтеза половых гормонов, о чем судят по клиническим признакам и уровню тестостерона в плазме. После этого дозу ХГ снижают до 2000 ME 2 раза в неделю и дополнительно вводят менотропин в дозе по 75—150 ME ЛГ и ФСГ 3 раза в неделю. Наиболее частое побочное действие гонадотропных гормонов — гинекомастия; она возникает почти у каждого третьего больного и, вероятно, связана с повышенной продукцией эстрогенов: Для созревания яичек требуется примерно 6 мес, а для установления полноценного сперматогенеза лечение приходится продолжать до 2 лет. После начала сперматогенеза или его возобновления (при вторичном гипогонадизме, возникшем после полового созревания) для продукции спермы достаточно поддерживающей терапии I ХГ. Как уже говорилось, все большую роль в лечении бесплодия, вероятно, будут играть рекомбинантные гонадотропные гормоны.
Крипторхизм[править | править код]
При крипторхизме одно или оба яичка не , опускаются в мошонку. У доношенных новорожденных мальчиков он встречается в 3% случаев, но с возрастом его распространенность заметно снижается. При крипторхизме нарушается сперматогенез и повышается риск герминогенных опухолей яичка. Поэтому считается, что низведение яичка в мошонку следует производить как 3 можно раньше, обычно в возрасте года и уж во всяком случае до 2 лет. Поскольку опущение яичка стимулируется андрогенами, в отсутствие анатомического препятствия можно использовать ХГ. Обычно назначают 6 инъекций ХГ по 500 МЕ/м2 в/м через день. При неэффективности такого лечения производят орхипексию.
Проведение укола ХГЧ
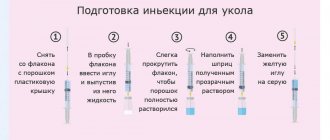
Внутримышечное введение препарата предполагает возможность самостоятельного осуществления инъекции, в случае, если женщина обладает необходимыми опытом и знаниями, но может осуществляться и в условиях медицинского учреждения. Можно также вызвать медсестру на дом. Стоит принимать во внимание, что уколы ХГЧ осуществляются курсом, поэтому подготовиться к терапии стоит заранее.
Укол ХГЧ делают в живот. Для многих женщин это пугающий факт, так как многие привыкли к инъекциям в ягодицу и не очень понимают смысл подобных предписаний. Укол в живот является более эффективным. Для его проведения отмеряют расстояние в два пальца от пупка в левую сторону или правую. Затем пальцами кожа живота собирают в небольшую складочку и в нее вводят иглу. Она входит в кожу не до конца. Самым актуальным инструментом будет инсулиновая игла, которую используют для уколов при сахарном диабете. Предварительно иглу нужно стерилизовать в спиртовом растворе.
Дозы препаратов, рекомендованные для инъекций, могут варьироваться в зависимости от врачебных предписаний и индивидуальности ситуации. Наиболее популярными дозировками вещества, которые можно приобрести в аптеке являются стандарты в 500,1 000, 1 500, 5 000 и 10 000 единиц.
В зависимости от показаний могут рекомендовать и разное количество уколов ХГЧ, направленное на создание необходимых условий беременности. Стандартной нормой препарата для каждого применения считается 5 -10 тысяч единиц. Оценивая изменение ситуации, врач может назначить меньшую дозу спустя несколько уколов. Проводя гормональную терапию, учитывают размеры фолликулов, чтобы не мотивировать чрезмерную стимуляцию яичников.
Главным показанием к уколу ХГЧ является диагностированное бесплодие. Спустя некоторое время после гормональной терапии проводят УЗИ, которое дает возможность уточнить наличие позитивных изменений. Если ожидания оправдываются, делают укол ХГЧ, стимулирующий овуляцию. Положительное воздействие гормона заключается еще и в том, что он не дает фолликулам возможностей для регрессии.
При стимуляции суперовуляции в рамках репродуктивной программы пациентке однократно вводят около 10 тысяч единиц хорионического гонадотропина, чем обеспечивают рост сразу нескольких фолликулов, которые впоследствии станут яйцеклетками. Спустя 36 часов после инъекции можно выбирать яйцеклетку, максимально отвечающую требованиям для проведения искусственного зачатия.
Если врачи диагностируют угрозу выкидыша, посредством укола ХГЧ вводят максимальную дозу, а затем два раза в неделю вводят 5 тысяч единиц гормона. Для того, чтобы гормональная терапия сохраняла свою актуальность и действенность, необходимо начинать ее проведение до восьмой недели беременности, а ее окончание стоит назначать ближе к 14 неделе срока.