| 53 | Йод |
| I 126,9045 | |
| 4d105s25p5 | |
Йод
(тривиальное (общеупотребительное) название —
йод
; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м.. Обозначается символом
I
(от лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество
йод
при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высокотоксичен. Молекула простого вещества двухатомна (формула I2).
| |
| Название, символ, номер | Йод / Iodum (I), 53 |
| Атомная масса (молярная масса) | 126,90447(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Радиус атома | 136 пм |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность | 2,66 (шкала Полинга) |
| Электродный потенциал | +0,535 В |
| Степени окисления | +7, +5, +3, +1, 0, −1 |
| Энергия ионизации (первый электрон) | 1008,3 (10,45) кДж/моль (эВ) |
| Плотность (при н. у.) | 4,93 г/см³ |
| Температура плавления | 113,5 °C |
| Температура кипения | 184,35 °C |
| Уд. теплота плавления | 15,52 (I—I) кДж/моль |
| Уд. теплота испарения | 41,95 (I—I) кДж/моль |
| Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| Молярный объём | 25,7 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a=7,18 b=4,71 c=9,81 |
| Отношение c / a | — |
| Теплопроводность | (300 K) (0,45) Вт/(м·К) |
| ГОСТ | ГОСТ 4159-79 ГОСТ 545-76 |
| Номер CAS | 7553-56-2 |
Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства 4.1 Изотопы
- 6.1 В медицине
- 7.1 Йод и щитовидная железа
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом
, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод
. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента
J
был заменен на
I
.
Метаболизм
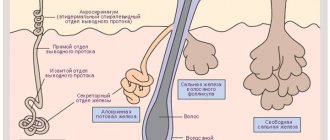
Всасывание иода происходит в верхних отделах тонкого кишечника, куда он поступает в виде органических и неорганических соединений – йодидов, йодированных аминокислот, и жирных кислот. Большая часть всосавшегося йода связывается со специфическим белком-переносчиком, и в таком виде разносится по органам и тканям.
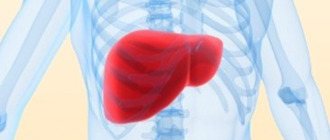
При этом он поступает в печень, в почки, в яичники у женщин, и в предстательную железу у мужчин. Определенное количество микроэлемента поглощается кожей и ее придатками, волосами и ногтями.
Но основным потребителем I является, конечно же, щитовидная железа. Функциональная ткань этой железы состоит из множества мельчайших пузырьков, фолликулов. Фолликулы изнутри выстланы клетками-тиреоцитами, и заполнены коллоидом. Эта вязкая субстанция содержит белки-тиреоглобулины, которые поступают сюда из тиреоцитов.
В образовании тиреоглобулинов участвует аминокислота L -тирозин. Тиреоглобулины – это сырье для образования трийодтиронина и тироксина.
Йод вначале поступает из крови в тиреоциты, а затем – в коллоид. Здесь при участии железа и специфического фермента тиреоидной пероксидазы происходит последовательное йодирование, присоединение атомов I к молекуле тиреоглобулина.
Присоединяется 1 молекула – образуется монойодтиронин, 2 – дийодтиронин. Правда, эти вещества не активны. Но с дальнейшим присоединением йода образуются трийодтиронин или Т3, и тироксин или Т4.
Эти вещества уже обладают гормональной активностью. Правда эта активность, как и их содержание, неодинакова. Содержание Т4 в несколько раз больше, чем Т3. Зато Т3 более активен, чем Т4. Установлено, что Т3 образуется из Т4 в ходе дейодирования, отщепления молекулы йода. Щитовидные гормоны, тироксин и трийодтиронин, выбрасываются в кровь.
В плазме крови они связываются другим переносчиком, тироксинсвязывающим глобулином, и в таком виде разносятся по органам и тканям. Выполнив свою функцию, они частично разрушаются, а частично выводятся в неизмененном виде. Свободный йод, и йод в составе тиреоидных гормонов, покидает наш организм в основном с мочой, и в меньшей степени – с калом.
Определенное количество I выводится со слюной и с потом. Примечательно, что по выведению йода с мочой (йодурии) можно судить о наличии йода в организме. Чем больше йода поступает в организм, тем больше его выводится с мочой, и наоборот.
Поэтому низкая йодурия свидетельствует о нехватке I. И по той же причине определение йода в моче используют для выявления йододефицитных состояний.
Нахождение в природе
Йод.
Йод — редкий элемент. Его кларк — всего 400 мг/т. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals
производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Физические свойства
Жидкий йод на дне химического стакана
Природный йод состоит только из одного изотопа — йода-127 (см. Изотопы йода). Конфигурация внешнего электронного слоя — 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома йода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома йода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность йода — 2,66, йод принадлежит к числу неметаллов.
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅107 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Hg + I2 → HgI2
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
H2 + I2 → 2HI
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
I2 + H2S → S + 2HI I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По «Началам Химии» Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
I2 + H2O → HI + HIO , pK
c=15,99
- Реакция образования нитрида трийода:
3I2 + 5NH3 → 3NH4I + NH3 ⋅ NI3↓
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
KI + I2 → KI3
Источники поступления
ДО 60% йода поступает к нам в составе животных продуктов, до 30% — растительных, а остальное – с водой. Некоторое количество микроэлемента мы получаем в составе вдыхаемого воздуха. Общепризнанные лидеры по содержанию I – рыба и морепродукты.
Содержание I в 100 г продуктов:
| Продукт | Содержание, мг/100 г |
| Сушеная ламинария (морская капуста) | 2500-3000 |
| Приготовленная морская капуста | 300 |
| Кальмары | 290 |
| Креветки, крабы, устрицы | 90-100 |
| Мясо ластоногих | 130 |
| Треска, путассу | 130 |
| Лосось | 200 |
| Минтай, хек | 150-160 |
| Окунь, судак, сом, щука, камбала, судак, мойва | 50 |
| Анчоусы, скумбрия | 45 |
| Мидии | 190 |
| Шампиньоны | 18 |
| Яичный желток | 35 |
| Молоко и кисломолочные продукты | 8-18 |
| Бобовые, овощи, свежая зелень | 6-15 |
| Ягоды, фрукты, злаки | 2-10 |
| Кедровые орехи | 400 |
| Твердые сорта сыра | 11 |
При термической обработке продукты теряют до 50% и более находящегося в них йода. Чтобы свести потери микроэлемента к минимуму, продукты следует варить целыми или нарезанными крупными кусками на слабом огне, в небольшом объеме воды, непродолжительное время, и в посуде, накрытой крышкой.
Еще один искусственный пищевой источник йода – йодированная соль. Это поваренная соль, натрия хлорид, с добавлением йодистых соединений – иодидов и иодатов натрия и калия. Употребление йодированной соли рекомендовано лицам, проживающим в эндемичных йододефицитных районах.
При этом следует учитывать некоторые факты. Йодированная соль придает продуктам специфический горьковатый привкус, и при нагревании количество йода снижается. По этим причинам ее не стоит использовать при кипячении, варке, и консервировании продуктов. Добавляют ее в пищу непосредственно перед употреблением. Срок годности такой соли в сравнении с обычной, без йода, небольшой, и составляет 6 мес. Хранить ее следует в защищенном от света месте.
Применение
В медицине
5 % спиртовой раствор йода
«Раствор йода» ссылается сюда. На эту тему нужна отдельная статья.
Основная статья: Раствор Люголя
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод
» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода (125I, 132I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
Суточная потребность
Потребность в йоде составляет от 2 до 4 мкг на 1 кг массы тела. По возрастным категориям этот показатель выглядит так:
| Категория | Суточная норма, мкг |
| Дети до 2 лет | 50 |
| Дети 3-5 лет | 60-90 |
| Дети 6-8 лет | 90-120 |
| Дети 9-13 | 120 |
| Подростки-юноши | 150 |
| Подростки-девушки | 150 |
| Взрослые мужчины | 180 |
| Взрослые женщины | 150 |
| Беременные и кормящие | До 300 |
Потребность в йоде повышается при: стрессовых ситуациях (физических нагрузках, заболеваниях), приеме препаратов, угнетающих функцию щитовидной железы. Среди этих препаратов:
- некоторые нестероидные противовоспалительные средства
- глюкокортикоиды
- интерфероны
- бета-адреноболокаторы
- гепарин
- соли лития
- специфические средства, назначаемые при гипертиреозе, избыточной функции щитовидной железы: Тиамазол (Мерказолил), Пропилтиоурацил.
При этом потребность в микроэлементе может достигать 400 мкг. В любом случае, суточное поступление I не должно превышать токсический порог 500 мкг.
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
- Тиреоидит