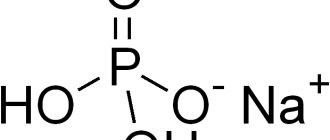
Регулятор кислотности и консервант “натрия ацетаты” получил в промышленности кодовое обозначение Е262. Он является недорогой, безопасной для человека и окружающей среды добавкой, и используется не только в производстве продуктов питания, а имеет значительно более широкий спектр применения. Хозяйки в домашних условиях самостоятельно могут получить это вещество, готовя тесто на выпечку – его даёт гашёная уксусом сода. Если полученный раствор выпарить и кристаллизировать, получится эдакий домашний аналог пищевого консерванта Е262. В производственных целях его добывают другими способами.
Источники информации:
Алф. указатель: 1-9 A-Z
Еще по теме:
- НАТРИЯ АЦЕТАТ — химическая энциклопедия
- Натрия ацетат — лекарственные препараты
Характеристика химических свойств и способа получения добавки Е262
По своей структуре ацетаты натрия – это соли уксусной кислоты, так как именно из этого сырья её и получают: карбонаты или гидроксиды натрия подвергают реакции с кислотой. Как ни странно, часть производство вещества связано с перегонкой и обработкой древесины.
Содержание:
- Характеристика химических свойств и способа получения добавки Е262
- Области применения вещества человеком
- Требования к упаковке добавки Е262
- Влияние на здоровье человека
Добавка имеет вид кристаллического порошка, которое имеет слабый запах уксуса. Может иметь белесоватый, светло-жёлтый или коричневый оттенок. Вещество хорошо растворимо в воде, хуже – в спиртах и эфире. Кроме того, оно не подвержено горению.
Основные свойства ацетатов натрия, за которые его так ценят промышленники – это способность к регуляции уровня кислотности химической среды, консервации и стабилизации веществ. Добавка помогает сохранить форму и текстуру продуктов, их вкусовые и ароматические характеристики, способна улучшить консистенцию сырья.
Немногие добавки могут похвастаться тем, что они встречаются в живой природе. Как раз ацетаты натрия могут: они существуют как элемент клеток животных и растений, как составляющая кислот во фруктах, присутствует в кисломолочных продуктах как результат ферментации бактерий.
Ссылки [ править ]
- «Ацетат натрия» . Международные карты химической безопасности
. Национальный институт охраны труда и здоровья. 2018-09-18. - ^ a b c «тригидрат ацетата натрия» . chemister.ru
. - Seidell, Atherton; Линке, Уильям Ф. (1952). Растворимость неорганических и органических соединений
. Ван Ностранд. - ^ a b c d e f «ацетат натрия» . chemister.ru
. - ^ a b c Sigma-Aldrich Co. , Ацетат натрия . Проверено 7 июня 2014.
- ^ a b Уксусная кислота, натриевая соль в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69
, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), https://webbook.nist.gov (получено 25 мая 2014 г.) - Уксусная кислота, натриевая соль, гидрат (1: 1: 3) в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69
, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), https://webbook.nist.gov (получено 25 мая 2014 г.) - Клейден, Джонатан ; Гривс, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия
(1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0. - «Картофельные чипсы увеличивают долговечность бетона» . Science Daily
. 8 августа 2007 г. - AG, Jungbunzlauer Suisse. «Диацетат натрия — Юнгбунцлауэр» . www.jungbunzlauer.com
. - «Пищевая добавка» Ацетат натрия (безводный) «| Продукты» . Mitsubishi Chemical Corporation
. Проверено 16 сентября 2021 года . - Mohammadzadeh-Агдаш, Хоссейн; Сохраби, Юсеф; Мохаммади, Али; Шанехбанди, Дариуш; Дехган, Парвин; Эззати Нажад Долатабади, Джафар (15 августа 2021 г.). «Оценка безопасности пищевых добавок ацетата натрия, диацетата натрия и сорбата калия» . Пищевая химия
.
257
: 211–215. DOI : 10.1016 / j.foodchem.2018.03.020 . ISSN 0308-8146 . PMID 29622200 . Проверено 16 сентября 2021 года . - ^ а б Ибрагим Динсер и Марк А. Розен. Накопление тепловой энергии: системы и приложения , страница 155
- Courty JM, Kierlik E, Les chaufferettes chimiques, Налейте ла Наука, décembre 2008, стр. 108-110
- «Кристаллизация перенасыщенного ацетата натрия» . Журнал химического образования . 2015-07-19.
- «Как работают грелки из ацетата натрия?» . HowStuffWorks . Апрель 2000 . Проверено 3 сентября 2007 .
Реакции [ править ]
Ацетат натрия можно использовать для образования сложного эфира с алкилгалогенидом, таким как бромэтан :
CH 3 COONa + BrCH 2 CH 3 → CH 3 COOCH 2 CH 3 + NaBr
Ацетат натрия подвергается декарбоксилированию с образованием метана (CH 4 ) в форсированных условиях (пиролиз в присутствии гидроксида натрия):
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3
Оксид кальция — типичный катализатор, используемый для этой реакции. Соли цезия также катализируют эту реакцию. [ необходима цитата
]
Название продукта
Химическое вещество в международной кодификации пищевых добавок числится под индексом Е 262 (в других документах может встретиться написание Е–262).
ГОСТ 54626–2011 закрепил определение Натрия ацетаты (международный синоним Sodium Acetates).
Пищевые натрия ацетаты представлены двумя химическими видами:
- Ацетат натрия:
- Sodium Acetatei;
- натрий уксуснокислый (химическое название);
- E 262i.
- Диацетат натрия:
- Sodium Acetateii;
- гидроацетат натрия;
- натрий уксуснокислый, кислый (химическое название);
- Sodium Hydrogen Acetate (Sodium Diacetate);
- E 262ii.
Немецкие наименования: Natriumacetat, Natrium salz der Essigsaure.
Французские: Acetate de Sodium, Sel de Sodium de l’aside acetique.
Области применения вещества человеком
Существует несколько видов ацетатов натрия: технический и пищевой. Первую разновидность используют в производстве химических грелок и обогревателей, как составную часть смеси “горячий лёд”. В сфере строительства ацетаты натрия дают противоморозный эффект для бетона, используются при возведении монолитных конструкций.
Текстильная промышленность применяет вещество при окрашивании тканей и дублении кожи. Также добавка используется в сфере фотографии и гальванотехники, в производстве красящих продуктов, средств гигиены, в химической отрасли.
По своей структуре технический ацетат натрия – это тригидрат натриевой соли уксусной кислоты, который имеет вид чешуек или кусочков различных форм.
Вообще человеку знакомы два типа добавки Е262:
- ацетат натрия Е262i;
- диацетат натрия Е262ii.
Вещества имеют различные химические формулы, но мало отличаются друг от друга по своим свойствам.
В производстве еды пищевой ацетат натрия нашёл себе применение, в основном в такой пище:
- в хлебобулочных изделиях (для защиты сырья от бактерий “картофельной болезни”);
- в консервированных овощах и фруктах (для улучшения вкуса продукта);
- в картофельных чипсах (для придания им более приятного вкуса и аромата).
В медицинской промышленности добавка применяется в изготовлении мочегонных препаратов и других лекарств.
Как сделать ацетат натрия в домашних условиях
Даже человек, далекий от глубоких познаний в области химии, может получить это вещество самостоятельно. Для этого понадобится всего два элемента: пищевая сода и уксусная кислота. Уравнение химической реакции при соединении этих продуктов имеет такой вид:
- NaHCO3 + CH3COOH = CH3COONa + H2CO3.
Другими словами, получение ацетата в домашних условиях называют «гашением соды». В результате этой химической реакции получается нестойкое соединение, моментально разлагающееся на воду и углекислый газ. Во время выпаривания получившегося раствора образуется кристаллический ацетат натрия. Как правило, для его получения берут соду и кислоту в соотношениях: 84 г гидрокарбоната натрия с 750 г винного уксуса (8%) или с 86 г уксусной эссенции (70%). В последнем случае выпаривание не понадобится. В результате реакции получается около 80 г ацетата натрия.
Негативные свойства вещества
Хотя ацетат натрия и малотоксичен, чрезмерное его употребление все-таки может нанести заметный ущерб здоровью человека. Так, его не рекомендуют людям, страдающим от таких заболеваний: артериальная гипертензия, вегето-сосудистая дистония, дисбактериоз. Следует значительно ограничить потребление продуктов, содержащих Е262 и тем, у кого наблюдаются проблемы с кишечником, мочевыводящими путями, печенью, желчным пузырем. Это обусловлено тем, что ацетат натрия в кишечники нередко превращается в токсичные нитраты, обладающие канцерогенным действием. Именно поэтому медики предупреждают о том, что чрезмерное потребление продуктов, содержащих Е262, может привести к образованию злокачественных опухолей, отравлениям и возникновению аллергических реакций. Ацетат натрия нельзя применять при производстве детских пищевых продуктов, поэтому наличие на упаковке маркировки Е262 является серьезной причиной отказа от их покупки.
Основные производители
Ацетаты натрия на отечественный рынок поставляют: Уральский завод промышленной химии (город Магнитогорск), завод им. Я. М. Свердлова и ООО «Органика» (оба город Дзержинск Нижегородской области).
Большой объем продукции производит китайская компания Fooding, включающая 35 химических предприятий из нескольких регионов страны.
Высоким качеством отличается продукция немецкой компании W. Urlich GmbH, имеющей 70‑летнюю историю развития.
Утверждение, что при попадании в организм пищевая добавка Е 262 превращается в канцерогенные нитриты, не выдерживает критики.
Ацетаты натрия находятся внутри клеток растений и живых организмов. Являются естественными консервантами всех кисломолочных продуктов как прямой результат бактериальной ферментации. Если не употреблять соду ложками, не пить уксус литрами, пищевая добавка E 262 будет полезным и безопасным компонентом продуктов.
Упаковка
Согласно ГОСТ 54626–2011, для упаковки пищевых ацетатов натрия могут применяться:
- продуктовые тканные мешки из полипропилена (используют чаще всего);
- ящики для кондитерских изделий из гофрированного картона;
- бумажные многослойные мешки.
Обязательное требование — наличие дополнительного вкладыша из прочного полиэтилена, предназначенного для упаковки пищевых продуктов.
Разрешено упаковывать пищевой консервант в другую безопасную тару (бочки, канистры, контейнеры).
Кроме стандартной маркировки, должен стоять знак «Беречь от влаги».
Польза и вред
Ацетаты натрия имеют выраженные бактерицидные и дезинфицирующие свойства. Пищевой консервант Е 262 хорошо усваиваются организмом. Ацетат натрия признан абсолютно безопасным (4 класс по ГОСТ 12.1.007–76).
Диацетат натрия отнесен к умеренно опасным продуктам (3 класс). При длительном вдыхании паров или употреблении большого количества внутрь может:
- спровоцировать конъюнктивит;
- негативно действовать на кожу;
- вызывать нетяжелые аллергические реакции;
- раздражать верхние дыхательные пути;
- нарушать обмен веществ.
С осторожностью следует употреблять продукты с кодом Е 260 людям, чувствительным к уксусу.
Детям и беременным женщинам стоит исключить из своего рациона пищевой краситель Е151!
Детские ланч-боксы очень красивые и разноцветные. Если вы часто устраиваете детские праздники в своем заведении, то этот вид посуды для вас просто необходим! Подробнее в этой статье.
Формальдегид не должен использоваться при производстве пищевых продуктов, так как это очень опасный консервант. Подробнее о нем вы можете прочитать здесь.