Физические свойства FeO(II):
- кристаллы черного цвета;
- плотность 5,7 г/см3;
- нерастворим в воде.
Химические свойства FeO(II):
- это основной оксид;
- легко вступает в реакции с кислотами, образуя соли железа: FeO+H2SO4 = FeSO4+H2O; FeO+2HCl = FeCl2+H2O
- легко окисляется кислородом воздуха: 4FeO+O2 = 2Fe2O3
- FeO(II) получают восстановлением FeO(III) при высоких температурах: Fe2O3+H2 = 2Fe+H2O; Fe2O3+CO = 2FeO+CO2↑
Гидроксид железа Fe(OH)2(II)
Физические свойства Fe(OH)2:
- белый порошок;
- на воздухе частично окисляется, приобретая зеленый оттенок;
- не растворяется в воде.
Химические свойства Fe(OH)2:
- Fe(OH)2 проявляет основные свойства;
- в присутствии влаги окисляется, образуя гидроксид железа (III), приобретая при этом бурый цвет: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
- легко реагирует с кислотами: Fe(OH)2+2HCl = FeCl2+2H2O Fe(OH)2+H2SO4 = FeSO4+2H2O
- в концентрированных растворах щелочей образует ферраты (комплексные соли железа) при кипячении: Fe(OH)2+2NaOH = Na2[Fe(OH)4]
- разлагается при нагревании: Fe(OH)2 = FeO+H2O
Получают Fe(OH)2 из солей железа (II) при их взаимодействии с щелочами: FeCl2+2NaOH = Fe(OH)2+2NaCl FeSO4+2NaOH = Fe(OH)2+Na2SO4
Поскольку, Fe+2 легко окисляется до Fe+3, все соединения железа(II) являются восстановителями. Также восстановительными свойствами обладают и соли железа (II).
Качественная реакция на катион железа (II):
- для обнаружения Fe+2 используют красную кровяную соль (гексацианоферрат калия): 3FeSO4+2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓+3K2SO4
- о присутствии катионов железа судят по образовавшемуся осадку темно-синего цвета (турнбулева синь): 3Fe2++2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И.
Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
| Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
Оксид железа Fe2O3(III)
Физические свойства Fe2O3:
- порошок бурого цвета;
- может существовать в трех модификациях: α, β, γ
- нерастворим в воде.
Химические свойства Fe2O3:
- Fe2O3 проявляет амфотерные свойства;
- реагирует с кислотами: Fe2O3+6HCl = 2FeCl3+3H2O Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
- реагирует с твердыми щелочами при высокой температуре: Fe2O3+2NaOH = 2NaFeO2+H2O Fe2O3+2KOH = 2KFeO2+H2O
- реагирует с карбонатами натрия и калия при высокой температуре: Fe2O3+Na2CO3 = 2NaFeO2+CO2
- реагирует с восстановителями: Fe2O3+2Al = 2Fe+Al2O3 3Fe2O3+CO = 2Fe3O4+CO2↑
Fe2O3 получают:
- обжигом пирита: 4FeS2+11O2 = 2Fe2O3+8SO2↑
- разложением гидроксида железа (III): 2Fe(OH)3 = Fe2O3+3H2O
Fe2O3 содержится в буром и красном железняке, являющихся исходным сырьем в производстве чугуна.
Оксиды
Оксид железа (II) FeO
Оксид железа (II) – черное кристаллическое вещество, которое нерастворимо в воде и проявляет свойства основания. Оксид железа (II) взаимодействует с растворами, расплавами и другими соединениями.
- С кислотами
FeO + 2 HCl ⟶ FeCl2 + H2O
- С кислородом воздуха
4 FeO + O2 ⟶ 2 Fe2O3
- С водородом
Fe2O3 + H2 ⟶ 2 Fe + H2O
Оксид получают путем следующей реакции:
Fe2O3 + СО ⟶ 2 FeO + CO2
Гидроксид железа Fe(OH)3(III)
Физические свойства Fe(OH)3:
- вещество рыхлой консистенции красно-коричневого цвета.
Химические свойства Fe(OH)3:
- Fe(OH)3 является слабым основанием;
- Fe(OH)3 проявляет амфотерные свойства с преобладанием оснОвных;
- реагирует с разбавленными кислотами с образованием солей: Fe(OH)3+3HCl = FeCl3+3H2O
- реагирует с концентрированными растворами щелочей при длительном нагревании с образованием устойчивых гидроксокомплексов: Fe(OH)3+3NaOH = Na3[Fe(OH)6]
- при нагревании разлагается с образованием оксида железа (III): 2Fe(OH)3 = Fe2O3+3H2O
- Fe(OH)3 получают из солей железа (III) при их взаимодействии с щелочами: Fe(OH)3+3NaOH = Fe(OH)3↓+3NaCl
Поскольку, под действием восстановителей Fe+3 превращается в Fe+2, все соединения железа со степенью окисления +3 являются окислителями: 2Fe+3Cl3+2KI-1 = 2Fe+2Cl2+2KCl+I20
Качественные реакции на катион железа (III):
- катионы Fe+3 обнаруживаются действием желтой кровяной соли (гексацианоферрат калия) — реакция идет с выпадением берлинской лазури (осадка темно-синего цвета): 4Fe+3Cl3+3K4[Fe(CN)6]-4 = Fe4[Fe(CN)6]3↓+12KCl
- катионы Fe+3 обнаруживаются роданидом аммония (в результате реакции образуется роданид железа красного цвета): Fe+3Cl3+3NH4CNS- ↔ Fe(CNS)3+3NH4Cl
Железа [III] гидроксид полимальтозат (Ferri (III) hydroxydum polymaltosatum)
Дозы и сроки лечения зависят от степени недостатка железа. Суточную дозу можно разделить на несколько приемов или принять однократно.
Внутрь.
Взрослые.
Таблетки следует разжевывать или глотать целиком во время или после еды. Суточную дозу допустимо принимать в один прием. Лечение клинически выраженного дефицита: по 1 таблетке 1-3 раза в день в течение 3-5 месяцев до нормализации концентрации гемоглобина. Прием продолжают в течение нескольких месяцев, чтобы восстановить запасы железа в организме (по таблетке в сутки). беременным — по 1 таблетке 2-3 раза в сутки (до нормализации содержания гемоглобина) с последующим приемом по 1 таблетке в сутки до родов, для лечения латентного дефицита железа и профилактики его недостаточности — по 1 таблетке в сутки.
Капли допустимо смешивать с фруктовыми и овощными соками или искусственными питательными смесями, не опасаясь снижения активности препарата. 1 мл (20 капель) содержит 176,5 мг железа гидроксида полимальтозного комплекса (50 мг элементарного железа), 1 капля — 2,5 мг элементарного железа. Для лечения клинически выраженного дефицита железа взрослым назначают по 40-120 капель в сутки, беременным — по 80-120 капель в сутки. Длительность лечения — не менее 2 месяцев. При клинически выраженном дефиците железа нормализация гемоглобина достигается лишь через 2-3 месяца после начала лечения. Для восстановления его внутренних резервов прием в профилактических дозах продолжают в течение нескольких месяцев. Для лечения латентного дефицита железа взрослым назначают по 20-40 капель в сутки, беременным — по 40 капель в сутки. Профилактика дефицита железа: взрослым — по 4-6 капель в сутки, беременным — по 6 капель в сутки.
1 мл сиропа содержит 10 мг железа. Для лечения клинически выраженного дефицита взрослым и кормящим женщинам назначают по 10-30 мл в сутки, беременным — по 20-30 мл в сутки; для лечения латентного дефицита железа — 5-10 мл в сутки и 10 мл в сутки соответственно. Для профилактики дефицита железа у беременных препарат назначают в дозе 5-10 мл в сутки.
Дети.
Лечение железодефицитной анемии различного генеза и латентного дефицита железа у младенцев и детей младшего возраста: детям первого года жизни — по 6-10 капель в сутки; в возрасте 1-12 лет — по 10-20 капель в сутки.
Лечение клинически выраженного дефицита железа. Внутрь. Недоношенные — по 1-2 капли на 1 кг массы ежедневно в течение 3-5 месяцев, до 1 года — по 10-20 капель в сутки; 1-12 лет — по 20-40 капель в сутки. Продолжительность лечения — не менее 2 месяцев. Нормализации гемоглобина достигают лишь через 2-3 месяца после начала лечения. Для восстановления внутренних резервов железа прием в профилактических дозах продолжают в течение нескольких месяцев.
Профилактика дефицита железа. Внутрь. До 1 года — по 2-4 капли в сутки; 1-12 лет — по 4-6 капель в сутки.
Лечение клинически выраженного дефицита железа. До 1 года — 2,5-5 мл в сутки (25-50 мг железа); 1-12 лет — по 5-10 мл в сутки.
Лечение латентного дефицита железа. 1-12 лет — по 2,5-5 мл в сутки.
Внутримышечно.
Взрослые.
Раствор для инъекций предназначен только для внутримышечного введения. Большое значение имеет техника инъекции. Из-за неправильного введения препарата может возникнуть болезненность и окрашивание кожи в месте инъекции. Вместо общепринятой рекомендована вентроягодичная инъекция (в верхний наружный квадрант большой ягодичной мышцы). Можно использовать только неповрежденные ампулы. При образовании осадка раствор непригоден для применения. После вскрытия ампулы его следует вводить немедленно.
Длина иглы должна быть не менее 5-6 см. Просвет иглы не должен быть слишком широким. Для детей и взрослых с небольшой массой тела иглы должны быть короче и тоньше.
В соответствии с рекомендациями Hochstetter
место инъекции определяют следующим образом: по линии позвоночного столба на уровне, соответствующем пояснично-подвздошному сочленению, фиксируют точку A. Если больной лежит на правом боку, то средний палец левой руки располагают в точке A. Отставляют указательный палец от среднего так, чтобы он находился под линией подвздошного гребня в точке B. Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами, и является местом инъекции.
Инструменты дезинфицируют обычным способом.
Прежде чем ввести иглу, сдвигают кожу примерно на 2 см, чтобы хорошо закрыть канал прокола после извлечения иглы. Это предотвращает проникновение введенного раствора в подкожные ткани и окрашивание кожи. Иглу располагают вертикально по отношению к поверхности кожи, под большим углом к точке подвздошного сочленения, чем к точке бедренного сустава. После инъекции иглу медленно извлекают и пальцем прижимают участок кожи, прилегающий к месту инъекции, примерно в течение 5 минут. После введения препарата больному необходимо подвигаться.
Дети.
Эффективность и безопасность внутримышечного применения не изучены.
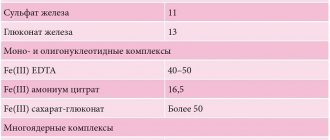
Соли железа
- Соли, в которых железо имеет степень окисления +2 (FeCl2, FeSO4), обладают восстановительными свойствами: сульфат железа FeSO4 применяют в качестве фунгицидов, консерванта древесины, как компонент электролитов;
- хлорид железа FeCl2 применяют для получения хлорида железа (III), в качестве катализатора в органическом синтезе.
- сульфат железа Fe2(SO4)3 применяют для очистки воды, для получения квасцов, как компонент электролитов;
В начало страницы
Положение в таблице Менделеева и строение атома
Железо расположено в 8 группе побочной подгруппе. У этого элемента 26 электронов, распределенных по 4 уровням. Электронная конфигурация: 1s22s22p63s23p63d64s2. Для его атома характерно предзаполнение s-подуровня, поэтому в действительности формула следующая: 1s22s22p63s23p64s23d6. Железо является d-элементом. Благодаря этому, основные степени окисления железа: 0, +2, +3.
Физические свойства
Железо обладает всеми свойствами металлов:
— пластичность (ковкость);
— электропроводность;
— теплопроводность;
— металлический блеск;
— высокая температура плавления (15390С).
Многие свойства находятся в оптимальных границах, поэтому железо часто используют при изготовлении различных изделий из металла. Для изменения определенных характеристик изготавливаются сплавы.
Основные сплавы железа
Металлы отличаются некоторыми параметрами. Например, одни обладают меньшей температурой плавления, другие большей прочностью, третьи – наиболее электропроводны. Иногда, для изменения свойств металла, его сплавляют с неметаллами (чаще всего, углерод). Самый распространенный сплав – сталь. Основу сплава составляет железо и углерод, кроме них могут добавляться различные металлы (легирующие компоненты), меняющие свойства сплава.
Таблица. Сплавы железа и их свойства
В качестве легирующих металлов стали могут использовать:
- Cr – хром
- Mo – молибден
- Ni – никель
- Si – кремний
- Cu – медь
- W – вольфрам
- Al – алюминий
- Mn – марганец
- Ti – титан
- Nb – ниобий
- Co — кобальт
Легирующими компонентами чугуна являются неметаллы: марганец, кремний, сера, фосфор и некоторые металлы (алюминий, хром).
Способы получения
Основным способом получения железа является выделение из минеральных руд. Основным считается доменный процесс. Выделение железа производится в несколько стадий.
Доменная печь
Таблица. Стадии доменного процесса
Мартеновская печь
Для снижения содержания примесей в чугуне, полученный материал отправляют в Мартеновскую печь. Это плавильная установка. Процесс увеличения доли железа происходит в три этапа:
- Плавление. Здесь образуется большое количество FeO.
- Окисление. С+ FeO = Fe+CO. в результате реакции доля углерода снижается.
- Раскисление. Окисление оставшегося FeO алюминием, ферромарганцем или ферросилицием.
Электрическая печь
Установка предназначена для получения легированной стали. Установка разогревается до высоких температур (цифра зависит от итогового сплава) и добавляется окислительный материал (нихром, фехраль и т.д.).
Получение
Гидроксид железа (II) может быть получен в виде осадка в обменных реакциях растворов солей железа (II) со щёлочью, например:
FeSO4 + 2KOH ⟶ Fe(OH)2↓ + K2SO4
Образование гидроксида железа (II) является одной из стадий ржавления железа:
2Fe + 2H2O + O2 ⟶ 2Fe(OH)2 Также гидроксид железа (II) может быть получен электролизом раствора солей щелочных металлов(например хлорида натрия) при перемешивании. Сначала образуется соль железа, которая при реакции с образовавшимся гидроксидом натрия даёт гидроксид железа. Чтобы получить двухвалентный гидроксид нужно вести электролиз при большой плотности тока. Реакция в общем виде: Fe + 2H2O ⟶ Fe(OH)2↓ + H2
Нахождение железа в природе
В природе железо содержится в рудах. Они могут отличаться по содержанию железа и других примесей. К основным железным рудам относятся: магнетит, гематит, пирит.
Магнетит (магнитный железняк)
Химическая формула – FeO·Fe2O3. К основному оксиду могут примешиваться различные металлы и их оксиды. Зоны залежей магнетита проводят к формированию магнитных аномалий – участков Земли, на которых магнитные приборы указывают не на полюса, а на эту залежь. По этой причине использовать компасы и электронные приборы в этих зонах бесполезно.
Магнетит добывается в Челябинской области, на Кольском полуострове, Южном Урале, на Украине (гора Кривой рог).
Кратер добычи железной руды в Курской Магнитной Аномалии. Источник
Эта руда является основной для получения железа, так как его содержание в ней – 72,4%. В форме минерала используется в качестве утяжелителя глинистых растворов при бурении.
Пирит
Химическая формула — FeS2 (серный или железный колчедан). Может содержать примеси Mn, Ni, Co. Это минерал желтого цвета. Из-за внешнего сходства его часто путали с золотом, поэтому этот минерал часто называют золотом дураков. Хотя, самородное золото часто содержится в пирите в виде примесей и даже встраивается в го кристаллическую решетку.
Считается одним из самых распространенных сульфидов. Залежи пирита расположена во всех геотермальноактивных зонах, а также, в донных отложениях Черного моря.
При контакте с воздухом окисляется до лимонита (FeOOH·(Fe2O3·nH2O).
Пирит используется для получения серной кислоты, сероводорода или в строительном деле в качестве добавки в цемент.
Гематит
Химическая формула — Fe2O3. С давних времен минерал использовался для изготовления красок, ритуальных украшений и лекарственных препаратов. В настоящее время является основным источником получения чугуна.
Основные месторождения:
- Украинское (Кривбасс);
- Михайловское (КМА);
- Колатсельгские штольни;
- Байкальское месторождение;
- Альпийское;
- Кутим.
Кроме минералов существует еще метеоритное железо. Это форма металла, попавшего на Землю из космоса. Во время прохождения через плотные слои атмосферы все примеси метеорита сгорают. Такое железо считается самым чистым. Оно практически не подвергается коррозии.
Смешанный оксид Fe3O4
Интересным соединение железа является смешанный оксид. Его особенность в том, что в одной кристаллической решетке есть сразу два иона железа — +2 и +3. Так как они образуют единый комплекс, часто их записывают как один оксид. На самом деле это кристаллогидрат двух оксидов: FeO⋅Fe2O3. Для него характерны следующие реакции:
- Разложение: Fe3O4 → 3Fe + 2O2
- Реакция с разбавленной кислотой: Fe3O4 + 4 H2SO4 → Fe2(SO4)3 + FeSO4 + 4 H2O
- Окисление: 4Fe3O4 + 2O2 →6Fe2O3
- Сплавление: Fe3O4 + 14NaOH → Na4FeO3 + 2Na5FeO4 + 7H2O
- Конпропорционирование: Fe + Fe3O4 → 4FeO
- Восстановление водородом до железа и воды.