| Хлорид калия | |
| Общие | |
| Систематическое наименование | хлорид калия |
| Традиционные названия | хлористый калий |
| Хим. формула | |
| Физические свойства | |
| Молярная масса | 74,555 г/моль |
| Плотность | 1,984 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 776 °C |
| • кипения | 1407 °C |
| Мол. теплоёмк. | 51,30 Дж/(моль·К) |
| Химические свойства | |
| Растворимость | |
| • в воде при 0 °C | 28,1 г/100 мл |
| • в воде при 20 °C | 34,0 г/100 мл |
| • в воде при 100 °C | 56,7 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7447-40-7 |
| PubChem | 4873 |
| Рег. номер EINECS | 231-211-8 |
| SMILES | [Cl-].[K+] |
| InChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 WCUXLLCKKVVCTQ-UHFFFAOYSA-M |
| екс Алиментариус | E508 |
| RTECS | TS8050000 |
| ChEBI | 32588 |
| ChemSpider | 4707 |
| Безопасность | |
| ЛД50 | 2600 мг/кг |
| Токсичность | малотоксичен |
| NFPA 704 | 0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Хлори́д ка́лия
(KCl; калийная соль, сильвин) — химическое соединение, неорганическое соединение состава KCl. Является средней калиевой солью соляной кислоты.
Образует белое кристаллическое вещество без запаха, хорошо растворимое в воде. Относится к структурному типу NaCl. В природе встречается в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
Краткая характеристика хлорида калия:
Хлорид калия – неорганическое вещество белого цвета.
Химическая формула хлорида калия KCl.
Хлорид калия – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и калия, бинарное соединение калия и хлора.
Хорошо растворяется в воде. Практически не растворяется в ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
Негорюч, пожаро- и взрывобезопасен.
Хлорид калия по степени воздействия на организм относится к 3-му классу опасности по ГОСТ 12.1.007 как умеренно опасное вещество. Не образует токсичных соединений в воздушной среде.
Не является коррозионным веществом.
Хлорид калия является пищевой добавкой Е508.
Хлорид калия встречается в природе в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
Применение
- Хлористый калий применяют для производства КОН, KСO3, KСlO4, KNO3 и других соединений калия.
- В сельском хозяйстве хлористый калий – распространенное калийное удобрение.
- В пищевой промышленности хлорид натрия используют как добавку (E508) к поваренной соли («соль с пониженным содержанием натрия»).
- В медицине растворы калия хлорида применяют внутрь или внутривенно при недостатке калия в организме (например, при лечении диуретиками, длительной рвоте), в случае нарушений сердечного ритма и др.
Ионы калия играют очень важную роль в регуляции функций организма. Соли калия быстро выводятся почками. Подобно другим солям калия хлорид оказывает умеренное мочегонное действие.
Физические свойства хлорида калия:
| Наименование параметра: | Значение: |
| Химическая формула | KCl |
| Синонимы и названия иностранном языке | potassium chloride (англ.) калий хлористый (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | белый, бесцветный |
| Вкус | соленый |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 1984 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 1,984 |
| Температура кипения, °C | 1407 |
| Температура плавления, °C | 776 |
| Молярная масса, г/моль | 74,555 |
| Растворимость в воде (20 oС), г/100 г | 34,4 |
Примечания[ | ]
- Владимиров Д. А. и др.
Оптимизация записи голограмм на аддитивно окрашенных кристаллах KCl (недоступная ссылка) // Оптика и спектроскопия. — 2005. — Т. 99, № 1. — С. 147—150. (недоступная ссылка) - В Вашингтоне изменили состав смертельной инъекции (неопр.)
. Lenta.ru (3 марта 2010). Дата обращения: 14 августа 2010. - В. В. Ковзов, И. В. Фомченко, М. А. Макарук, В. А. Юркевич.
Оценка эффективности применения препаратов «Ветгидрон» и «Регидравет» при комплексном лечении поросят и телят с желудочно-кишечными болезнями (other). — 2012. — ISSN 2078-0109.
Получение хлорида калия:
В промышленности хлорид калия получают из природного минерала сильвинита методами галургии и флотации. При этом галургический метод получения хлорида калия основан на различной растворимости KCl и NaCl в воде при повышенных температурах.
Хлорид калия получают в результате следующих химических реакций:
- 1. взаимодействия калия, оксида калия и гидроксида калия с соляной кислотой.
- 2. взаимодействия калия и хлора:
2K + Cl2 → 2KCl.
- 3. взаимодействия гидроксида калия и хлорида алюминия:
AlCl3 + 3KOH → Al(OH)3 + 3KCl.
- 4. взаимодействия йодида калия и хлорида свинца:
AlCl3 + 3KOH → Al(OH)3 + 3KCl.
Хлорид калия: и лекарство, и отрава
Химическое вещество с десятком ипостасей – все это о хлориде калия. Медики открыли для себя его удивительную способность излечивать человеческий организм от многих недугов, работники сельского хозяйства уже не один десяток лет применяют хлорид калия в качестве минерального удобрения, а мастера-свечники отлично знают, как с помощью хлорида калия придать необычный оттенок пламени декоративной свечи.
Хлорид калия: общие характеристики
Второе название хлорида калия – калиевая соль соляной кислоты. Соединение представляет собой вещество с кристаллической структурой белого цвета, не имеющее запаха. В природе хлорид калия встречается в виде минералов:
- Сильвин. Минерал впервые был открыт итальянскими геологами, что нашли его на легендарном вулкане Везувий в далеком 1832-м году)
Карналлит. Этот минерал представляет собой двойную соль – хлорид калия и магния. Был назван в честь первооткрывателя минерала – немца Карналла.
Хлорид калия: методы получения
Самым распространенным способом получения хлорида калия, является реакция соляной кислоты и гидроксида калия.
Также хлорид калия успешно добывается из сильвинита. И делается это двумя основными способами:
- Галургический метод. При низкой температуре готовится насыщенный раствор хлорида калия и хлорида натрия. После – раствор нагревается и полученной смесью обрабатывается сильвинит. В процессе обработки минерала раствор дополнительно обогащается хлоридом калия, а хлорид натрия выпадает в осадок и отделается в с помощью фильтрации.
- Флотационный метод. Этот метод заключается в разделении минералов по принципу их способности удержаться на жидкой грани разделов двух фаз.
Хлорид калия: сферы применения
- Сельское хозяйство. Агрономам хорошо известна способность хлорида калия отлично удобрять почву, обогащая ее таким нужным для нормального роста растений калием.
- Медицина. На прилавках аптек хлорид калия можно найти в форме растворов 4-х и 10-процентных на основе раствора глюкозы. Применяют хлорид калия при заболеваниях: гипокалиемия (недостаток калия в организме человека), сердечная аритмия, интоксикация организма определенными группами препаратов.
- Изготовление свечей. Хотите создать свечу своими руками с пламенем необычного цвета? – Для этих целей отлично подойдет порошок хлорида калия. Этот компонент способен придать пламени свечи благородный, пурпурный цвет. Достаточно лишь добавить 1 чайную ложку вещества в раствор для вымачивания фитиля…
Есть еще, пожалуй, самый странный способ использования хлорида калия. Некоторые американские штаты по сей день используют вещество… как средство для исполнения смертного приговора в тюрьмах. Приговоренному к смерти заключенному вводится смертельная инъекция хлорида калия.
Хлорид калия
и изготовление свечей
Декоративная свеча «Королевский пурпур». Для создания необычной свечной поделки нам понадобятся:
Для начала изготовим раствор для вымачивания фитиля. Для этого разбавим в половине стакана теплой воды 2 ст.л. соли, 4 ст. л. буры и 1 ч. л. хлорида калия. Хорошенько перемешаем раствор до полного растворения всех компонентов. На 30 минут опустим фитиль в готовый раствор. Фитиль просушиваем в сухом помещении в течение нескольких дней.
Теперь можно приступить непосредственно к изготовлению свечи. Плавим воск на водяной бане и добавляем к расплавленной свечной массе красный краситель. Вновь мешаем восковую смесь до полной однородности.
В свечную форму устанавливаем с помощью держателя пропитанный и просушенный фитиль, заливаем форму растопленной свечной массой. По желанию, украшаем свечу декором. Это может быть и картинка в стиле декупаж, и необычное рельефное изображение с помощью техники эмбоссинг, и обычные блестки.
Теперь, когда свеча застыла, можно ее зажечь. Благодаря добавлению в раствор для фитиля хлорида калия, пламя свечи окрасится в красивый пурпурный цвет. В декоративной свече вещество абсолютно безвредно для здоровья человека! Кстати, придать пламени свечи необычный цвет способны и другие вещества: хлорид лития, сульфт магния или сульфат меди.
Хлорид калия: где купить
Вещество продается в аптеках в виде глюкозных растворов. Самый маленький флакон на 10 мл стоит всего 0,5 у.е.
Что касается хлорида калия, как минерального удобрения, то стоит он около 0,5 у.е. за 1 кг. Если же брать хлорид калия, как вещество в чистом виде, то за один кг производители просят около 0,8-1 у.е. Купить вещество можно не выходя из дому, через Интернет.
Сохранить статью:
makecandles.ru
Химические свойства хлорида калия. Химические реакции хлорида калия:
Химические свойства хлорида калия аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида калия и натрия:
KCl + Na → K + NaCl (t = 760-890 °C).
В результате реакции образуются калий и хлорид натрия. В ходе реакции газообразным натрием воздействуют на расплав хлорида калия.
2. реакция взаимодействия хлорида калия и нитрата натрия:
NaNO3 + KCl → NaCl + KNO3.
В результате реакции образуются нитрат калия и хлорид натрия.
3. реакция взаимодействия хлорида калия и нитрита натрия:
NaNO2 + KCl → KNO2 + NaCl.
В результате реакции образуются нитрит калия и хлорид натрия.
4. реакция взаимодействия хлорида калия и нитрата серебра:
AgNO3 + KCl → AgCl + KNO3.
В результате реакции образуются нитрат калия и хлорид серебра. В ходе реакции используется разбавленный раствор хлорида калия.
5. реакция взаимодействия хлорида калия и хлорида цинка:
ZnCl2 + 2KCl → K2[ZnCl4].
В результате реакции образуется тетрахлорцинкат калия.
6. реакция взаимодействия хлорида калия и хлорида алюминия:
KCl + AlCl3 → K[AlCl4].
В результате реакции образуется тетрахлороалюминат калия.
7. реакция взаимодействия хлорида калия и хлорида палладия:
PdCl2 + 2KCl → K2[PdCl4].
В результате реакции образуется тетрахлоропаладат калия. В ходе реакции используется концентрированный раствор хлорида калия.
8. реакция взаимодействия хлорида калия и хлорида платины:
PtCl4 + 2KCl → K2[PtCl6].
В результате реакции образуется гексахлороплатинат калия. В ходе реакции используется концентрированный раствор хлорида калия.
9. реакция взаимодействия хлорида калия, хлорида железа и воды:
FeCl3 + 2KCl + H2O → K2[Fe(H2O)Cl5].
В результате реакции образуется пентахлороакваферрат калия. В ходе реакции используется насыщенные растворы хлорида калия и хлорида железа.
10. реакция взаимодействия хлорида калия с минеральными кислотами:
Хлорид калия взаимодействует с минеральными кислотами.
11. реакция электролиза водного раствора хлорида калия:
KCl + 3H2O ± 6е– → 3H2 + KClO3 (t = 760-890 °C),
2KCl + 2H2O ± 2е– → H2 + Cl2 + 2KOH.
В результате первой реакции образуются водород и хлорат калия, в результате второй – водород, хлор и гидроксид калия.
12. реакция электролиза расплава хлорида калия:
2KCl ± 2е– → 2K + Cl2.
В результате реакции образуются водород и хлор.
Применение в ветеринарии[ | ]
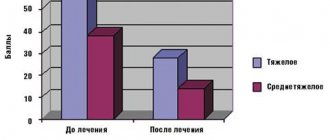
Используется как компонент порошковых препаратов для восстановления водно-электролитного баланса у животных, используется в комплексной терапии при заболеваниях, протекающих с диарейным синдромом (диспепсия, абомазоэнтерит, гастроэнтерит, энтероколит и др.). В 1 г препарата содержится: натрия хлорида – 180 мг; натрия цитрата – 150 мг; калия хлорида – 140 мг; вспомогательные вещества: глицин, L -изолейцин, лактулоза и наполнитель лактоза. Порошок растворяется в воде и выпаивается животным.
Пример упаковки препарата
Препараты данного типа хорошо всасывается, быстро восстанавливает уровень натрия и калия в плазме крови, восполняет дефицит жидкости в организме животных, регулирует кислотно-щелочное равновесие, уменьшает агрегацию форменных элементов и вязкость крови, обладает детоксикационными свойствами. Компоненты препарата являются естественными метаболитами обмена веществ. Ионы натрия и калия восстанавливают функционирование клеточных мембран в кишечнике, миокарде и скелетной мускулатуре. Натрия цитрат препятствует развитию ацидоза. Применяются для восстановления водноэлектролитного баланса при лечении животных с заболеваниями, протекающими с диарейным синдромом, обладает высокой лечебной эффективностью, которая составила при комплексном лечении поросят периода отъема с желудочно-кишечными болезнями — 91,1 % и при комплексном лечении телят молозивно-молочного периода и периода доращивания с болезнями органов пищеварения — 90 %. Препараты способствуют нормализации показателей крови и повышению сохранности поросят и телят.[3]