Йодид натрия
- 7681-82-5 Y
- 13517-06-1 (дигидрат) N
- Интерактивное изображение
- ЧЕБИ: 33167 Y
- ChEMBL1644695 N
- 5048 Y
- 5238
- WB6475000
- F5WR8N145C Y
- DTXSID2041125
- InChI = 1S / HI.Na / h1H; / q; + 1 / p-1 Y
Ключ: FVAUCKIRQBBSSJ-UHFFFAOYSA-M Y
- InChI = 1 / HI.Na / h1H; / q; + 1 / p-1
Ключ: FVAUCKIRQBBSSJ-REWHXWOFAL
- . [I-]
D )
= 0,6462 нм
)
)
o 298 )
⦵ 298 )
˚)
0
1
Йодида натрия
( химическая формула
NaI
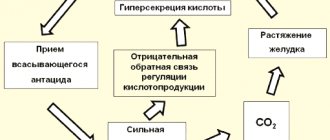
) представляет собой ионное соединение образуется из химической реакции из натрия металла и йода . В стандартных условиях это белое водорастворимое твердое вещество, содержащее смесь катионов натрия (Na + ) и йодид- анионов (I — ) в соотношении 1: 1 в кристаллической решетке . Он используется в основном как пищевая добавка и в органической химии . Его производят в промышленности в виде соли, образующейся при взаимодействии кислых иодидов с гидроксидом натрия .[11] Это хаотропная соль .
Использует [ редактировать ]
Пищевая добавка [ править ]
Йодид натрия, а также йодид калия обычно используются для лечения и предотвращения йодной недостаточности . Йодированная поваренная соль содержит 10 частей на миллион йодида . [11]
Органический синтез [ править ]
Одноатомные цепочки NaI, выращенные внутри двойных углеродных нанотрубок . [12]
Иодид натрия используется для превращения алкилхлоридов в алкилйодиды . Этот метод, реакция Финкельштейна , [13] основан на нерастворимости хлорида натрия в ацетоне, который управляет реакцией: [14]
R – Cl + NaI → R – I + NaCl
Ядерная медицина [ править ]
Некоторые радиоактивные йодидные соли натрия, в том числе Na 125 I и Na 131 I , имеют радиофармацевтическое применение, например, для лечения рака щитовидной железы и гипертиреоза или в качестве индикаторов с радиоактивной меткой при визуализации (см. Изотопы йода> Радио йод I-123, I-124 , I-125 и I-131 в медицине и биологии ).
Сцинтилляторы NaI (Tl), легированные таллием [ править ]
Йодида натрия активируется с таллия , NaI (Tl), когда подвергают ионизирующей радиации испускает фотоны (т.е. мерцают ) и используется в сцинтилляционных детекторов , традиционно в ядерной медицине , геофизике , ядерной физики и измерений параметров окружающей среды. NaI (Tl) — наиболее широко используемый сцинтилляционный материал. Кристаллы обычно соединяются с фотоэлектронным умножителем в герметичной сборке, поскольку йодид натрия гигроскопичен . Точная настройка некоторых параметров (например, радиационной стойкости ,послесвечение , прозрачность ) можно добиться, варьируя условия роста кристаллов . Кристаллы с более высоким уровнем легирования используются в детекторах рентгеновского излучения с высоким спектрометрическим качеством. Для этой цели йодид натрия можно использовать как в виде монокристаллов, так и в виде поликристаллов . Длина волны максимальной эмиссии 415 нм. [15]
Натрия йодид Na131I (Sodium iodide, 131I)
Раствор с определенной радиоактивностью должен вводиться пациентам внутривенно напрямую.
Радиойодтерапия
При лечении тиреотоксикоза при диффузном и многоузловом токсическом зобе лечение осуществляется через 3-4 недели после тиреоидэктомии или отмены L-тироксина за 20 дней до введения препарата. Больные переводятся в специализированные палаты, оборудованные автономной системой вентиляции и канализации, соединенной со специальными очистными сооружениями. Пациентов выводят из «закрытого» режима при снижении мощности гамма- излучения до допустимой нормами радиационной безопасности (3 мкЗв/ч).
При лечении тиреотоксикоза количество вводимого препарата подбирается индивидуально в пределах от 111 до 555 МБк.
Основным условием для проведения радиойодтерапии рака и метастазов щитовидной железы является тиреоидэктомия. Срок проведения лечения — не ранее 4-6 недель после операции. Наиболее оптимальной формой для радиойодтерапии является высокодифференцированный А-клеточный рак щитовидной железы. Проведение радиойодтерапии метастазов В- и С-клеточных форм рака щитовидной железы нецелесообразно.
При лечении метастазов рака щитовидной железы препарат назначают внутрь в количестве 1850 — 3700 МБк 1 раз в 3 месяца. Перед каждым повторным назначением препарата проводят исследования йодпоглотительной активности метастазов. Для этого используют метод сцинтиграфии или радиоизотопного сканирования после введения 37 — 74 МБк препарата. Длительность терапии может достигать 2 лет, а общая доза 131I — 18,5-25,9 МБк.
В настоящее время существует два наиболее распространенных способа расчета вводимой активности йода-131.
Индивидуальный расчет на основании объема щитовидной железы, скорости захвата йода-131 в ходе проведения диагностического сканирования через 24 часа после приема препарата и заданной активности на грамм ткани (диапазон от 0,1 до 0,3 МБк/г) по формуле:
Ав = (Аз х V) / (С х 10), где
Аз — заданная активность, МБк/г;
V — объем щитовидной железы, см3;
С — скорость захвата йода-131 через 24 часа после введения препарата;
10 — коэффициент.
Назначение фиксированной активности йода-131:
190 МБк — маленькие железы;
380 МБк — железы среднего размера;
579 Мбк — крупные железы.
Перед началом лечения необходимо предварительное определение поглощения йода-131 щитовидной железой, что гарантирует правильность лечения, исключает возможности ошибки, связанной с использованием фиксированной активности у больного с крупной, но плохо поглощающей йод-131 железой.
При терапевтическом применении препарата обязательным условием является постоянный контроль за состоянием периферической крови.
Радиойодиагностика
Подготовка пациента. Исследование функционального состояния щитовидной железы должно проводиться не ранее, чем через 4-6 недель после отмены приема препаратов стабильного йода, йодсодержащих и йодированных продуктов питания и поливитаминных препаратов, содержащих йод, йодсодержащих рентгеноконтрастных средств, фтора, брома, тийодтиронина, тироксина, тиреоидина, 6-метилтиоурацила и других аналогичных антитиреоидных препаратов, а также глюкокортикостероидов.
Для исследования функции щитовидной железы по величине накопления йода-131 достаточно ввести 0,037-0,074 МБк препарата, при сканировании щитовидной железы, определении белково-связанного йода и исследовании методом радиометрии всего тела — 0,111-0,185 МБк.
Методы исследования
Функциональное состояние щитовидной железы
может быть оценено по:
-величине накопления йода-131 в железе через 2, 4, 24 часа и в более поздние сроки после применения препарата;
-уровню белково-связанного йода в плазме;
-результатам радиометрии всего тела.
Величина накопления 131I в щитовидной железе
является суммарным показателем состояния неорганической и органической фаз йодного обмена в этом органе. Определение проводят с помощью радиометра, располагая торец датчика на расстоянии 30 см от передней поверхности шеи. Радиометрию стандарта, в качестве которого используют 131I в количестве, равном введенному пациенту, проводят в тех же геометрических условиях.
Процент накопления радионуклида в щитовидной железе (А) рассчитывают по формуле:
А = [B-Nф/ C-Nф] х 100%, где:
В — содержание 131I в железе, имп/мин;
С — содержание 131I в стандарте, имп/мин;
Nф — фон, имп/мин.
У здоровых людей в щитовидной железе через 2 часа накапливается в среднем 14% от введенного количества изотопа, через 4 часа — 19%, через 24 часа — 27%.
С целью определения уровня белково-связанного йода
у больного через 48 часов берут из локтевой вены пробу крови (8 — 10 мл). После центрифугирования 4 — 5 мл плазмы крови переносят в пробирку и отделяют белок трехкратным добавлением 10% раствора трихлоруксусной кислоты в объеме, равном объему исследуемой плазмы крови с последующим центрифугированием при 2000 об/мин в течение 10 мин. Полученный осадок растворяют в 2 М растворе едкого натрия или едкого калия, доводя до исходного объема плазмы крови, и радиометрируют в колодцевом счетчике параллельно с эталоном. В качестве последнего используют раствор 131I, разведенного в соотношении 1:500; объем эталона должен быть равен объему взятой для радиометрии плазмы крови.
Процент белково-связанного йода (А) рассчитывают по формуле:
А = (В — Nф) х 1000 х 100/С х (Д — Nф) х 500 %/л, где:
В — содержание 131I в железе, имп/мин;
С — объем плазмы крови, взятой для анализа, мл;
Д — содержание 131I в эталоне, имп/мин;
Nф — фон, имп/мин.
Нормальный уровень белково-связанного йода — не более 0,3% в л.
Радиометрия всего тела
позволяет оценить периферический этап обмена тиреоидных гормонов и проводится следующим образом: через 2 часа после приема 1,0 МБк препарата, в течение которых пациента просят не опорожнять мочевой пузырь, проводят с помощью специального датчика диаметром 10-20 см первое измерение в геометрии, обеспечивающей необходимую точность; результаты этой первой радиометрии принимают за 100%; в последующем радиометрию повторяют через 24, 72, 120 и 192 часа; регистрацию каждый раз осуществляют как с экранирование области шеи (щитовидной железы) свинцовой пластинкой толщиной 4-5 см, так и без экранирования. По результатам радиометрии рассчитывают содержание 131I в последующие сроки в щитовидной железе и во всем теле, за исключением щитовидной железы, в процентах от введенного количества.
Содержание 131I в норме в организме человека (без учета щитовидной железы) через 1 сутки составляет 10-25%, через 3 суток — 9,7-15%, через 8 суток — 2-12%.
Методика радионуклидной диагностики А-клеточного рака и метастазов щитовидной железы включает сканирование или сцинтиграфию всего тела через 24 и 48 часов после внутривенного введения 111-165 МБк препарата.
Данные о растворимости [ править ]
Йодид натрия обладает высокой растворимостью в некоторых органических растворителях, в отличие от хлорида или даже бромида натрия:
| Растворитель | Растворимость NaI (г NaI / кг растворителя при 25 ° C) [16] |
| H 2 O | 1842 г. |
| Жидкий аммиак | 1620 |
| Жидкий диоксид серы | 150 |
| Метанол | 625–830 |
| Муравьиная кислота | 618 |
| Ацетонитрил | 249 |
| Ацетон | 504 |
| Формамид | 570–850 |
| Ацетамид | 323 (41,5 ° С) |
| Диметилформамид | 37–64 |
| Дихлорметан | 0,09 [17] |
Ссылки [ править ]
- ^ Б с д е е Haynes, стр. 4,86
- Seidell, Атертон (1919). Растворимость неорганических и органических соединений c. 2 . Компания Д. Ван Ностранд . п. 655 .
- Перейти
↑ Haynes, p. 5,171 - Мията, Такео (1969). «Экситонная структура NaI и NaBr». Журнал Физического общества Японии
.
27
(1): 266. Bibcode : 1969JPSJ … 27..266M . DOI : 10,1143 / JPSJ.27.266 . - Guizzetti, G .; Nosenzo, L .; Регуццони, Э. (1977). «Оптические свойства и электронная структура галогенидов щелочных металлов по термоотражению». Physical Review B
.
15
(12): 5921–5926. Bibcode : 1977PhRvB..15.5921G . DOI : 10.1103 / PhysRevB.15.5921 . - Перейти
↑ Haynes, p. 4,130 - Перейти
↑ Haynes, p. 10,250 - Дэйви, Уиллер П. (1923). «Прецизионные измерения кристаллов галогенидов щелочных металлов». Физический обзор
.
21
(2): 143–161. Полномочный код : 1923PhRv … 21..143D . DOI : 10.1103 / PhysRev.21.143 . - Перейти
↑ Haynes, p. 5,36 - «Натрий йодид 383112» . Сигма Олдрич
. - ^ a b Лайдей, Филлис А. (2005). «Йод и соединения йода». Энциклопедия промышленной химии Ульмана
. Вайнхайм: Wiley-VCH. С. 382–390. DOI : 10.1002 / 14356007.a14_381 . - Senga, Ryosuke; Суэнага, Кадзу (2015). «Спектроскопия одноатомных электронных потерь энергии легких элементов» . Nature Communications
.
6
: 7943. Bibcode : 2015NatCo … 6.7943S . DOI : 10.1038 / ncomms8943 . PMC 4532884 . PMID 26228378 . - Финкельштейн, Хэнк (1910). «Darstellung organischer Jodide aus den entsprechenden Bromiden und Chloriden» . Бер.Dtsch.Chem.Ges.
(на немецком).
43
(2): 1528–1532. DOI : 10.1002 / cber.19100430257 . - Стрейтвизер, Эндрю (1956). «Сольволитические реакции вытеснения на насыщенных атомах углерода». Химические обзоры
.
56
(4): 571–752. DOI : 10.1021 / cr50010a001 . - «Сцинтилляционные материалы и сборки» (PDF) . Кристаллы Сен-Гобен . 2021 . Проверено 21 июня 2021 года .
- Берджесс, Джон (1978). Ионы металлов в растворе
. Серия Эллиса Хорвуда по химическим наукам. Нью-Йорк: Эллис Хорвуд. ISBN 9780470262931. - Де Намор, Анджела Ф. Данил; Трабулсси, Рафик; Салазар, Франц Фернандес; Де Акоста, Вильма Диандерас; Де Вискардо, Ибони Фернандес; Португалия, Хайме Муньос (1989). «Передача и распределение свободных энергий 1: 1 электролитов в системе растворителей вода – дихлорметан при 298,15 К». Журнал химического общества, Труды Фарадея 1
.
85
(9): 2705–2712. DOI : 10.1039 / F19898502705 .
Иодид натрия
- Общие сведения.
Формула:
NaJ
Иодид натрия NaI.
Бесцветные прозрачные кристаллы. Хорошо растворяется в воде и спирте. Существует ряд кристаллогидратов (NaJ.2Н2О, NaJ.5Н2О и др.) и полииодиды NaI3 и NaI5. Молярная электропроводность при бесконечном разведении при 25оС равна 126,9 Cм.см2/моль [4].
| -288,06 кДж/моль; | -284,84 кДж/моль; | 98,6 Дж/моль.K [3]. |
Температура кипения: 1300 ºC
Температура плавления: 651° С
Плотность: 3.66
Растворимость в воде, г/100 мл при 20°C: 179,320
- Получение.
Натрий йодистый (йодид натрия) получают взаимодействием I2 или иодо-воздушной смеси с растворами едкого натра с последующим восстановлением образовавшегося NaIO3 сероводородом, перекисью водорода или др., реакцией едкого натра, содой или сульфатом натрия с иодистоводородной кислотой.
- Качественный анализ.
- Аналитические реакции на катион натрия.
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8
c образованием жёлтого кристаллического осадка (фармакопейная реакция — ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl
+ Zn(UO2)3(CH3COO)8 + CH3COOН + 9 H2O
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl
Мешающие ионы: избыток ионов K+, катионы тяжёлых металлов (Hg22+, Hg2+, Sn2+, Sb3+, Bi3+, Fe3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K+, NH4+, Ag+).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6]
с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl
+ K[Sb(OH)6] Na[Sb(OH)6] + KCl
Условия проведения реакции: а) достаточная концентрация Na+; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+ и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6] + HCl KCl + H3SbO4 + 2 H2O
H3SbO4 HSbO3 + H2O
3.2. Аналитические реакции на иодид-ион.
1. С групповым реагентом — раствором AgNO3(ГФ).
Методика:
к 2 каплям раствора иодида, подкисленного азотной кислотой, добавляют 1-2 капли раствора нитрата серебра, образуется жёлтый творожистый осадок, нерастворимый в растворе аммиака и разведённой HNO3.
2. С хлоридом железа(III) или нитритом натрия в кислой среде (экстракционный способ) (ГФ).
2 I—
+ 2 Fe3+ I2 + 2 Fe2+
2 I—
+ 2 NO2- + 4 H+ I2 + 2 NO + 2 H2O
Методика:
К 2-3 каплям раствора, содержащего иодид-ионы, прибавляют 1-2 капли разбавленной серной кислоты, 0,5 см3 хлороформа, 2-3 капли раствора хлорида железа(III) или нитрита натрия, энергично встряхивают. Хлороформный слой окрашивается в розовато-фиолетовый цвет. При добавлении раствора крахмала появляется синяя окраска.
ПРИМЕЧАНИЕ: обнаружению иодид-ионов с хлоридом железа(III) мешают тиоцианат- и ацетат-ионы.
Нитритом натрия можно открыть иодид-ионы капельным методом:
Методика:
на фильтровальную бумагу наносят последовательно по 1 капле растворов крахмала, 2 моль/дм3 СН3СООН, иодида и KNO2. Наблюдают синее пятно или кольцо.
Реакция с нитритом натрия в кислой среде специфична и позволяет обнаружить иодид-ионы в присутствии хлорид-, бромид-, ацетат- ионов..
3. С концентрированной серной кислотой (ГФ).
2 HI
+ H2SO4(конц.) I2 + SO2 + 2 H2O
Методика:
при нагревании 0,1 г вещества с 1 см3 концентрированной H2SO4 выделяются фиолетовые пары иода.
4. С хлорамином Б (хлорной водой) с выделением молекулярного иода.
5. С солями свинца(II) с образованием жёлтого осадка.
2 I
— + Pb2+ PbI2
- Количественный анализ.
3.1. Аргентометрия.
Определение массовой доли йодида натрия в растворе аргентометрическим методом Фаянса (вариант прямого титрования)
Определение основано на осаждении йодид-ионов раствором нитрата серебра в уксуснокислой среде в присутствии адсорбционного индикатора эозина.
1. KI
+ AgNO3AgI+ KNO3
2. {(AgI)n
nI—(n-x) K}x-
xK+
3. [(AgI)n]
4. {(AgI)n
nAg+(n-x) NO3—}x+
хNO3
—
в конечной точке титрования:
5. {(AgI)n
nAg+(n-x) Jnd—}x+
x NO3—
М (KI) = 166,01 г/моль
М (NaI) = 149,89 г/моль
Методика:
Точный объём раствора йодида калия (индивидуальное задание) помещают в колбу для титрования, прибавляют 2-3 капли раствора индикатора эозина, 10 капель разведённой (30%) уксусной кислоты и титруют 0,05 М раствором нитрата серебра до окрашивания осадка в ярко-розовый цвет.
- Применение.
Натрий йодид (Натрий йодистый) применяется • для производства монокристаллов, • в фармацевтической промышленности и медицине • в ветеринарии и сельском хозяйстве • как сцинтиллятор, компонент электролита в химичекских источниках тока и электрохимических преобразователях и др.
- Список литературы.
- Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
- Методическое указание «Инструментальные методы анализа», Пермь, 2004;
- Методическое указание «Качественный химический анализ», Пермь, 2003;
- Методическое указание «Количественный химический анализ», Пермь, 2004;
- Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991;
- «Большая советская энциклопедия»;
- https://ru.wikipedia.org/.