Симпони® (Simponi)
Инфекции
Перед назначением препарата Симпони®, в ходе терапии и в течение 5 месяцев после ее окончания пациенты должны находиться под тщательным наблюдением на предмет развития инфекций. В случае развития тяжелых инфекций или сепсиса терапия должна быть прекращена.
Препарат Симпони® не следует назначать пациентам с клинически выраженной активной инфекцией. Необходимо соблюдать осторожность при применении препарата Симпони® у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе. Пациентам рекомендуется по возможности избегать воздействия потенциальных факторов риска инфекции.
Пациенты, получающие терапию ингибиторами ФНО подвержены большему риску развития инфекционного процесса. Имеются сообщения о развитии бактериальных (включая сепсис и пневмонию), микобактериальных (туберкулеза), инвазивных грибковых и оппортунистических инфекций, в т.ч. с летальным исходом, у пациентов, получавших ингибиторы ФНО, включая препарат Симпони®. В некоторых случаях серьезные инфекции развивались у пациентов, получавших сопутствующую терапию иммунодепрессантами, которая, как и само заболевание, предрасполагает к развитию инфекций. Пациенты с новыми случаями инфекционных заболеваний должны быть тщательно обследованы. Применение препарата Симпони® следует прекратить в случаях тяжелых инфекций или сепсиса и назначить соответствующую антибактериальную или противогрибковую терапию вплоть до контроля инфекционного процесса.
Перед началом лечения препаратом Симпони® у пациентов, проживавших или посещавших регионы, эндемичные по инвазивным микозам, таким как гистоплазмоз, кокцидиомикоз или бластомикоз, необходимо тщательно взвешивать возможную пользу и риск лечения препаратом Симпони®.
Туберкулез
Зарегистрированы случаи развития туберкулеза у пациентов, получающих терапию препаратом Симпони®. В большинстве случаев это были внелегочные или диссеминированные формы туберкулеза.
Перед началом лечения препаратом Симпони® необходимо оценить факторы риска туберкулеза (включая близкий контакт с больными активным туберкулезом) и исключить наличие латентного или активного туберкулеза. Лечение латентного туберкулеза следует провести перед применением препарата Симпони®. В случае активного туберкулеза терапия препаратом Симпони® противопоказана.
У пациентов с наличием латентного туберкулеза или активного туберкулеза в анамнезе, адекватное лечение которых не может быть подтверждено, необходимо провести противотуберкулезную терапию до назначения препарата Симпони®.
Тесты на латентный туберкулез могут оказаться ложноотрицательными, особенно у пациентов с иммунодефицитом или тяжелым заболеванием. Перед назначением препарата Симпони® необходимо рассмотреть возможность лечения латентного туберкулеза при наличии у пациентов соответствующих факторов риска, несмотря на отрицательные результаты теста на латентный туберкулез. Решение о назначении противотуберкулезной терапии у таких пациентов следует принимать только после консультации фтизиатра, сопоставив риск наличия латентного туберкулеза и риск применения противотуберкулезной терапии.
У пациентов, получающих препарат Симпони®, необходимо контролировать признаки и симптомы активного туберкулеза во время и после лечения, в том числе у пациентов, у которых результаты тестов на латентный туберкулез были отрицательными.
Все пациенты должны быть проинформированы о симптомах, подозрительных на туберкулез (длительный кашель, потеря массы тела, субфебрильная лихорадка) и необходимости обращения за медицинской помощью в случае их появления. При развитии туберкулезной инфекции на фоне терапии препаратом Симпони® применение препарата должно быть прекращено и назначена противотуберкулезная терапия
Реактивация вируса гепатита В
Как и при лечении другими иммунодепрессантами, терапия ингибиторами ФНОα сопровождалась реактивацией вируса гепатита В у хронических носителей вируса (при положительном тесте на поверхностный антиген), в том числе с развитием летального исхода. Все пациенты перед началом терапии должны быть обследованы для исключения вирусного гепатита В. Хронические носители вируса гепатита В должны находиться под тщательным наблюдением перед началом лечения, во время лечения и в течение нескольких месяцев после прекращения лечения препаратом Симпони®.
Данные об эффективности сочетанного применения противовирусной терапии и ингибиторов ФНОα у пациентов – хронических вирусоносителей не доступны.
При реактивации вирусной инфекции лечение препаратом Симпони® должно быть прекращено и назначена соответствующая противовирусная терапия.
Злокачественные опухоли
Возможная роль терапии ингибиторами ФНОα в развитии злокачественных опухолей не установлена, однако, основываясь на текущих данных, нельзя исключить риск развития лимфом, лейкозов и иных злокачественных опухолей на фоне анти ФНОα терапии. Необходимо соблюдать осторожность при назначении ингибиторов ФНО пациентам со злокачественными опухолями в анамнезе или при продолжении терапии в случае развития злокачественной опухоли.
Злокачественные опухоли у детей
В ходе постмаркетинговых исследований сообщались случаи образования злокачественных опухолей, некоторые со смертельным исходом, среди детей, подростков и совершеннолетних молодых людей (в возрасте до 22 лет), которые получали ингибиторы ФНО (начало терапии в возрасте ≤18 лет). Приблизительно в половине случаев сообщалось о лимфомах. Другие случаи представлены рядом различных злокачественных опухолей, включающим злокачественные опухоли, которые обычно не отмечаются у детей и подростков. Большинство пациентов получали сопутствующую терапию иммунодепрессантами, такими как метотрексат, азатиоприн или 6-меркаптопурин. Роль ингибиторов ФНО в развитии злокачественных опухолей у детей и подростков остается неясной.
Лимфома
В контролируемых клинических исследованиях при лечении всеми ингибиторами ФНО, включая препарат Симпони®, случаи лимфомы регистрировали чаще у пациентов, получавших лечение ингибиторами ФНО, чем в контрольной группе. В клинических исследованиях препарата Симпони® 2 и 3 фазы частота лимфомы у пациентов, получавших Симпони®, была выше ожидаемой частоты в общей популяции. У пациентов с ревматоидным артритом и другими хроническими воспалительными заболеваниями, особенно у пациентов с высокой активностью болезни и/или пациентов, подвергаемых длительной терапии иммунодепрессантами, риск развития лимфомы выше (в несколько раз), чем в общей популяции, даже без лечения ингибиторами ФНО.
Лейкозы
В ходе постмаркетингового применения ингибиторов ФНО для лечения ревматоидного артрита и других заболеваний сообщалось о случаях острого и хронического лейкозов. Даже в отсутствии терапии ингибиторами ФНО, пациенты с ревматоидным артритом могут быть подвержены повышенному риску (приблизительно в 2 раза) развития лейкозов по сравнению с общей популяцией.
Другие злокачественные опухоли
В контролируемых клинических исследованиях препарата Симпони® 2 и 3 фазы у пациентов с ревматоидным артритом, псориатическим артритом и анкилозирующим спондилитом частота других злокачественных опухолей (за исключением немеланомного рака кожи) была сходной в группе препарата Симпони® и контрольной группе.
В клиническом исследовании, оценивающем применение препарата Симпони® у пациентов с тяжелой персистирующей астмой, злокачественные опухоли у пациентов, получавших препарат Симпони®, встречались чаще, чем в контрольной группе. Значимость данного факта не установлена.
В клиническом исследовании с применением другого ингибитора ФНОα инфликсимаба у пациентов с умеренной и тяжелой ХОБЛ зарегистрирована большая частота опухолей легких, головы и шеи в группе ингибитора ФНО по сравнению с контролем. Поэтому предосторожность должна быть соблюдена при назначении ингибиторов ФНО пациентам с ХОБЛ, а также пациентам с высоким риском, например хроническим курильщикам.
Застойная сердечная недостаточность
При лечении ингибиторами ФНО наблюдались случаи нарастания или развития застойной сердечной недостаточности, в т.ч. при терапии препаратом Симпони®. В клинических исследованиях с применением других ингибиторов ФНО наблюдалось прогрессирование сердечной недостаточности и повышение смертности по причине ХСН. Действие препарата Симпони® не изучалось у пациентов с застойной сердечной недостаточностью. Препарат Симпони® следует применять с осторожностью у пациентов с легкой сердечной недостаточностью (I-II класс по NYHA). Пациенты должны находиться под наблюдением и в случае возникновения новых или ухудшения имеющихся признаков сердечной недостаточности терапия препаратом Симпони® должна быть прекращена.
Неврологические нарушения
Применение ингибиторов ФНО, включая препарат Симпони®, в редких случаях сопровождалось появлением или нарастанием клинических и/или рентгенологических признаков демиелинизирующих заболеваний ЦНС (включая рассеянный склероз) и периферической нервной системы. У пациентов с существующими или недавно появившимися демиелинизирующими заболеваниями необходимо тщательно взвешивать пользу и риск лечения ингибиторами ФНО перед назначением препарата Симпони®. В случае развития таких заболеваний терапия препаратом Симпони® должна быть прекращена.
Хирургическое лечение
Данные по безопасности применения препарата Симпони® у пациентов, получающих хирургическое лечение, в т.ч. артропластику, ограничены. При планировании операций необходимо учитывать длительный T1/2. При выполнении операций пациентам, получающим терапию препаратом Симпони®, необходим тщательный мониторинг инфекций и своевременная их терапия в случае возникновения.
Иммуносупрессия
Существует потенциальная вероятность воздействия ингибиторов ФНО, включая препарат Симпони®, на иммунитет против инфекций и опухолей, связанная блокадой воспаления и модуляцией клеточного ответа, опосредуемых через ФНОα.
Аутоиммунные процессы
Относительный дефицит ФНОα на фоне терапии ингибиторами ФНО может приводить к развитию аутоиммунных процессов. При появлении клинических симптомов волчаночноподобного синдрома и положительных тестах на антитела к двуспиральной ДНК терапия препаратом Симпони® должна быть прекращена.
Сочетанное применение препарата Симпони® и препарата анакинра
Сочетанное применение анакинры и другого ингибитора ФНО, этанерцепта в клинических исследованиях сопровождалось развитием серьезных инфекций и нейтропении и не привело к дополнительному клиническому эффекту. Вследствие характера побочных реакций, наблюдаемых при этой комбинированной терапии, аналогичные виды токсичности могут возникать при комбинированной терапии препаратом анакинра и другими ингибиторами ФНО. В связи с этим сочетанное применение препарата Симпони® и анакинры не рекомендуется.
Сочетанное применение препарата Симпони® и препарата абатацепт
В клинических исследованиях сочетанное применение ингибиторов ФНО и абатацепта было связано с повышенным риском инфекций, включая серьезные инфекции, по сравнению с применением только одних ингибиторов ФНО, без усиления клинического эффекта. Ввиду характера побочных реакций, наблюдаемых при комбинированной терапии ингибиторами ФНО и абатацептом, комбинация Симпони® и абатацепта не рекомендуется.
Смена биологических базисных противовоспалительных препаратов
При переводе с одного биологического препарата на другой следует продолжить наблюдение пациентов на наличие признаков инфекции.
Гематологические реакции
В ходе постмаркетингового исследования имеются сообщения о панцитопении, лейкопении, нейтропении и тромбоцитопении у пациентов, получающих ингибиторы ФНО, включая Симпони®. Необходимо соблюдать осторожность при лечении препаратом Симпони® пациентов с цитопенией или наличием серьезных случаев цитопении в анамнезе.
Пациенты с развитием признаков гематологических нарушений (персистирующая лихорадка, кровоподтеки, кровотечения, бледность) должны быть немедленно обследованы. В случае выраженных гематологических нарушений терапия Симпони® должна быть прекращена.
Аллергические реакции
В постмаркетинговом исследовании препарата Симпони® описаны серьезные системные реакции гиперчувствительности, включая анафилактические. Часть случаев описаны после первого введения препарата. В случаях развития анафилактических реакций или иных серьезных аллергических реакций применение препарата Симпони® должно быть прекращено и назначена соответствующая терапия.
Вакцинация
Пациентам, получающим препарат Симпони®, может проводиться сопутствующая вакцинация, но не живыми вакцинами. Данные об ответе на вакцинацию, риске инфекции или возможности передачи инфекции при применении живых вакцин у пациентов, получающих препарат Симпони®, отсутствуют. У пациентов с псориатическим артритом, получавших препарат Симпони® в одном исследовании 3 фазы, отмечен эффективный В-клеточный иммунный ответ на пневмококковую полисахаридную вакцину. У сопоставимого числа пациентов с псориатическим артритом, получавших и не получавших препарат Симпони®, наблюдалось по крайней мере двукратное увеличение титров антител. Доля пациентов, ответивших на пневмококковую вакцину, в группе препарата Симпони® и контрольной группе пациентов, получавших метотрексат, была ниже, чем у пациентов, не получавших метотрексат. В целом полученные данные свидетельствуют о том, что препарат Симпони® не подавлял гуморальный иммунный ответ на эту вакцину.
Чувствительность к латексу
Защитный колпачок иглы на предварительно заполненном шприце изготовлен из сухого натурального каучука, содержащего латекс, который может вызвать аллергические реакции у пациентов, чувствительных к латексу.
Пациенты пожилого возраста
В исследованиях 3 фазы у пациентов с ревматоидным артритом, псориатическим артритом и анкилозирующим спондилитом частота нежелательных явлений, серьезных нежелательных явлений и серьезных инфекций при лечении препаратом Симпони® не отличалась у пациентов в возрасте 65 лет и старше и пациентов более молодого возраста. Количество пациентов старше 65 лет с язвенным колитом было недостаточно для установления отличий их ответа на терапию по сравнению с ответом пациентов с язвенным колитом в возрасте от 18 до 65 лет. В целом у пожилых пациентов была отмечена более высокая частота инфекций, поэтому при лечении пожилых пациентов следует соблюдать осторожность.
Почечная и печеночная недостаточность
Специальные исследования препарата Симпони® у пациентов с нарушением функции почек и печени не проводились. Необходимо соблюдать осторожность при лечении пациентов с нарушениями функции печени.
Клиническая эффективность при лечении ревматоидного артрита
Эффективность и безопасность препарата Симпони® изучали в трех многоцентровых, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях у более 1500 пациентов в возрасте ≥18 лет со средне-тяжелым или тяжелым активным ревматоидным артритом, диагностированным в соответствии с критериями Американской коллегии ревматологов (ACR) по крайней мере за 3 месяца до скрининга. Препарат Симпони® вводили подкожно в дозах 50 мг или 100 мг (с МТ или без него) каждые 4 недели. Длительность плацебо-контролируемой фазы составляла 24 недели.
В целом клиническая эффективность препарата Симпони® в дозах 50 мг и 100 мг существенно не отличалась.
Во всех исследованиях 3 фазы доля пациентов, адекватно ответивших на лечение через 14 и 24 недели, в группах препарата Симпони® была выше, чем в контрольных группах. Ответ наблюдался через 4 недели после начала лечения препаратом Симпони® (когда в первый раз оценивали результаты) и сохранялся в течение 24 недель.
При лечении препаратом Симпони® по сравнению с плацебо было выявлено клинически и статистически значимое улучшение качества жизни. Отмечено статистически значимое улучшение трудоспособности и снижение утомляемости.
Клиническая эффективность при лечении псориатического артрита
Безопасность и эффективность препарата Симпони® изучали в многоцентровом, рандомизированном, двойном слепом, плацебо-контролируемом исследовании у 405 взрослых пациентов с активным псориатическим артритом, не ответивших на терапию НПВП или базовыми противовоспалительными препаратами. В этом исследовании время с момента постановки диагноза псориатического артрита составляло, по крайней мере, 6 месяцев до включения в исследование, диаметр бляшечного поражения кожи – не менее 2 см. В исследование включали пациентов с различными подтипами псориатического артрита, в т.ч. полиартритом без ревматоидных узелков (43%), асимметричным периферическим артритом (30%), артритом дистальных межфаланговых суставов (15%), спондилитом с периферическим артритом (11%) и мутилирующим артритом (1%). Предыдущая терапия антагонистом ФНО была критерием исключения. Препарат Симпони® вводили п/к в дозах 50 мг или 100 мг каждые 4 недели с метотрексатом или без него. Рандомизированным пациентам назначали плацебо (n=113), препарат Симпони® 50 мг (n=146) и препарат Симпони® 100 мг (n=146). Первичной конечной точкой была доля пациентов, достигших 20% улучшения по критериям АCR (ACR 20) через 14 недель. Результаты лечения сравнивали с плацебо в течение 24 недель.
В целом клиническая эффективность препарата Симпони® в дозах 50 мг и 100 мг существенно не отличалась.
Улучшение по основным параметрам, характеризующим активность заболевания, было отмечено уже при первом обследовании (через 4 недели) после начала лечения и сохранялось в течение 24 недель. Частота ответа через 14 недель была сходной у пациентов с различных подтипами псориатического артрита, в т.ч. полиартритом без ревматоидных узелков, асимметричным периферическим артритом, артритом дистальных межфаланговых суставов и спондилитом с периферическим артритом. Число пациентов с мутилирующим артритом было недостаточным для оценки эффективности. Частота ответа на лечение препаратом Симпони® была сопоставимой у пациентов, получавших и не получавших метотрексат.
При лечении препаратом Симпони® наблюдалось улучшение показателей активности псориатического артрита, в т.ч. числа опухших суставов, числа болезненных суставов, дактилита и энтезита. Кроме того, у пациентов, получавших препарат Симпони®, выявлено значительное улучшение псориаза кожи и ногтей.
Лечение препаратом Симпони® привело к значительному улучшению физической функции, а также качества жизни. Трудоспособность значительно увеличилась, а время пребывания с пациентом лиц, осуществляющих уход или лечение, сократилось.
Клиническая эффективность при лечении анкилозирующего спондилита
Безопасность и эффективность препарата Симпони® изучали в многоцентровом, рандомизированном, плацебо-контролиируемом исследовании у 356 взрослых пациентов с активным анкилозирующим спондилитом. В исследование включали пациентов, у которых сохранялись признаки активности анкилозирующего спондилита, несмотря на лечение НПВП или базисными противовоспалительными препаратами. Они ранее не получали антагонисты ФНО. Из исследования исключали пациентов с полным анкилозом позвоночника. Препарат Симпони® вводили п/к каждые 4 недели. Рандомизированным пациентам назначали плацебо (n=78), препарат Симпони® 50 мг (n=138) и препарат Симпони® 100 мг (n=140). Первичной конечной точкой была доля пациентов, достигших улучшения в виде ASAS 20 через 14 недель. Эффективность сравнивали с плацебо в течение 24 недель.
В целом клиническая эффективность препарата Симпони® в дозах 50 мг и 100 мг существенно не отличалась.
По сравнению с плацебо лечение препаратом Симпони® привело к значительному уменьшению симптомов через 14 и 24 недели. Улучшение основных показателей активности анкилозирующего спондилита отмечалось при первой оценке результатов лечения (4 недели) и сохранялось в течение 24 недель.
Лечение препаратом Симпони® вызывало значительное увеличение физической функции, которую оценивали через 14 и 24 недели. У пациентов, получавших препарат Симпони®, улучшение физической функции сохранялось в течение 24 недель. Качество жизни также значительно улучшилось через 14 и 24 недели. Кроме того, выявлено значительное улучшение сна и трудоспособности.
Клиническая эффективность при лечении язвенного колита
Эффективность препарата Симпони® изучали в двух рандомизированных, плацебо контролируемых, двойных слепых исследованиях у взрослых пациентов.
В исследовании индукции ремиссии (PURSUIT-Induction) оценивали пациентов со среднетяжелым или тяжелым активным язвенным колитом (от 6 до 12 баллов по шкале Мейо, не менее 2 по подшкале эндоскопии), у которых ответ на стандартную терапию был недостаточным или отсутствовал или у которых была зависимость от кортикостероидов. В части исследования по подбору дозы пациенты были рандомизированы в 4 группы: 400 мг препарата Симпони® п/к на неделе 0 и 200 мг на неделе 2 (400/200 мг), 200 мг препарата Симпони® п/к на неделе 0 и 100 мг на неделе 2 (200/100 мг), 100 мг препарата Симпони® п/к на неделе 0 и 50 мг на неделе 2 (100/50 мг), плацебо п/к на неделе 0 и на неделе 2 (плацебо). В части исследования по подтверждению дозы 771 пациентов было рандомизировано в 3 группы: 400 мг препарата Симпони® п/к на неделе 0 и 200 мг на неделе 2, 200 мг препарата Симпони® п/к на неделе 0 и 100 мг на неделе 2, плацебо п/к на неделе 0 и на неделе 2. Допускался одновременный прием постоянных доз аминосалицилатов, кортикостероидов, и/или иммуносупрессантов перорально. В данном исследовании оценивалась эффективность препарата Симпони® в течение 6 недель.
Результаты исследования поддерживающий терапии (PURSUIT-Maintenance) основаны на оценке данных 463 пациентов, у которых был достигнут клинический ответ на предыдущую терапию препаратом Симпони® в стадии индукции. Пациенты были рандомизированы в 3 группы: 50 мг препарата Симпони®, 100 мг препарата Симпони® или плацебо; препарат вводили п/к каждые 4 недели. Допускался одновременный прием постоянных доз аминосалицилатов, кортикостероидов, и/или иммуносупрессантов перорально. В данном исследовании оценивалась эффективность препарата Симпони® в течение 54 недель.
Таблица. Основные результаты исследований PURSUIT-Induction и PURSUIT-Maintenance
| PURSUIT-Induction | ||
| Плацебо n=256 | Симпони® 200/100 мг n=257 | |
| Процент пациентов | ||
| Пациенты с клиническим ответом на 6 неделеа | 30% | 52%b |
| Пациенты с клинической ремиссией на 6 неделе | 6% | 19%b |
| Пациенты с заживлением слизистойd на 6 неделе | 29% | 43%b |
| Изменение исходного результата IBDQ на 6 неделе | 15±31 | 27±34b |
| PURSUIT-Maintenance | ||
| Плацебо n=156 | Симпони®100 мг n=154 | |
| Процент пациентов | ||
| Поддержание ответа (пациенты с клиническим ответом на 54 неделе)e | 31% | 51%b |
| Стойкая ремиссия (пациенты с клинической ремиссией на 30 и 54 неделях)f | 15% | 29%g |
| Стойкой заживление слизистой (пациенты с заживлением слизистой на 30 и 54 неделях) | 27% | 44%b |
n — количество пациентов; а определяется как уменьшение исходного результата по шкале Мейо на ≥30% и на ≥3 баллов, сопровождающееся уменьшением количества баллов по шкале ректального кровотечения на ≥1, или если количество баллов по этой шкале от 0 до 1; b p≤0.001, для группы голимумаба по сравнению с плацебо; c определялся как результат по шкале Мейо ≤2 баллов, при отсутствии результатов по индивидуальным подшкалам >1; d определяется как результат по подшкале эндоскопии от 0 до 1 балла; е активность язвенного колита у пациентов оценивали по частичному результату шкалы Мейо каждые 4 недели (потеря ответа подтверждалась эндоскопией). Следовательно, пациенты, сохранившие ответ, были в стадии продолжительного клинического ответа при каждой оценке в течение 54 недель; f пациент в стадии ремиссии и на неделе 30, и на неделе 54 (без признаков потери ответа в любую точку времени в течение 54 недель) для достижения стойкой ремиссии; g р = 0.003, для группы голимумаба по сравнению с плацебо.
Иммуногенность
Антитела к голимумабу были выявлены у 5% (105/2115) пациентов с ревматоидным артритом, псориатическим артритом и анкилозирующим спондилитом, получавших препарат Симпони® в течение 52 недель в исследованиях 3 фазы. Частота антителообразования была сопоставимой у пациентов с различными ревматическими заболеваниями. У пациентов, получавших сопутствующую терапию метотрексатом, частота антител была ниже, чем у пациентов, которые принимали препарат Симпони® без метотрексата (3% (41/1262) и 8% (64/853) соответственно).
Антитела к голимумабу были выявлены у 3% (26/946) пациентов с язвенным колитом, получавших препарат Симпони® в течение 54 недель в исследованиях 2 и 3 фазы. У 68% (21/31) антитело-положительных пациентов нейтрализующие антитела были обнаружены in vitro.
При лечении с использованием сопутствующей терапии иммуносупрессантами (азатиоприном, 6-меркаптопурином и метотрексатом) число пациентов с антителами к голимумабу (2%; 6/389) было меньше, чем при лечении без сопутствующей терапии (4%; 28/809).
Присутствие антител к голимумабу может увеличивать риск развития реакций в месте инъекции. Низкая частота образования антител к голимумабу не позволяет определенно судить о связи между иммуногенностью и клинической эффективностью или безопасностью.
Поскольку анализ иммуногенности является продукт-специфичным и специфичным для каждого отдельного набора реактивов, сравнение уровня антител к различным продуктам не является корректным.
Использование в педиатрии
Специальные исследования препарата Симпони® у детей не проводились. Препарат противопоказан у детей и подростков до 18 лет, т.к. безопасность и эффективность у этой категории пациентов не изучены.
Влияние на способность управлять транспортными средствами и другими механизмами
Препарат Симпони® может оказывать незначительное влияние на способность управлять автомобилем и работать с механизмами в связи возможным развитием побочных реакций со стороны нервной системы и органа зрения.
Симпони 50мг/0,5мл 0.5мл/№1
Инфекции
Перед назначением препарата Симпони, в ходе терапии и в течение 5 месяцев после ее окончания пациенты должны находиться под тщательным наблюдением на предмет развития инфекций. В случае развития тяжелых инфекций или сепсиса терапия должна быть прекращена.
Препарат Симпони не следует назначать пациентам с клинически выраженной активной инфекцией. Необходимо соблюдать осторожность при применении препарата Симпони у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе. Пациентам рекомендуется по возможности избегать воздействия потенциальных факторов риска инфекции.
Пациенты, получающие терапию ингибиторами ФНО, подвержены большему риску развития инфекционного процесса. Имеются сообщения о развитии бактериальных (включая сепсис и пневмонию), микобактериальных (туберкулеза), инвазивных грибковых и оппортунистических инфекций, в т.ч. с летальным исходом, у пациентов, получавших ингибиторы ФНО, включая препарат Симпони. В некоторых случаях серьезные инфекции развивались у пациентов, получавших сопутствующую терапию иммунодепрессантами, которая, как и само заболевание, предрасполагает к развитию инфекций. Пациенты с новыми случаями инфекционных заболеваний должны быть тщательно обследованы. Применение препарата Симпони следует прекратить в случаях тяжелых инфекций или сепсиса и назначить соответствующую антибактериальную или противогрибковую терапию вплоть до контроля инфекционного процесса.
Перед началом лечения препаратом Симпони у пациентов, проживавших или посещавших регионы, эндемичные по инвазивным микозам, таким как гистоплазмоз, кокцидиомикоз или бластомикоз, необходимо тщательно взвешивать возможную пользу и риск лечения препаратом Симпони.
Туберкулез
Зарегистрированы случаи развития туберкулеза у пациентов, получающих терапию препаратом Симпони. В большинстве случаев это были внелегочные или диссеминированные формы туберкулеза.
Перед началом лечения препаратом Симпони необходимо тщательно обследовать пациента для выявления как активного, так и латентного туберкулезного процесса. Обследование должно включать в себя тщательный сбор анамнеза, в т.ч. необходимо исключить наличие туберкулеза в анамнезе и контакта с больными туберкулезом, а также уточнить, проводится ли в настоящее время или проводилась ранее терапия иммунодепрессантами. Следует провести необходимые скрининг-тесты (рентгенологическое исследование грудной клетки, туберкулиновая проба). При этом следует учитывать, что у тяжелобольных пациентов и у пациентов с иммуносупрессией тесты на латентный туберкулез могут оказаться ложноотрицательными.
В случае диагностирования активного туберкулеза терапию препаратом Симпони начинать нельзя.
При подозрении на латентный туберкулез следует провести консультацию фтизиатра.
Во всех случаях, описанных далее, следует тщательно оценить возможный риск и ожидаемую пользу терапии препаратом Симпони.
У пациентов с наличием латентного туберкулеза необходимо провести противотуберкулезную терапию до назначения препарата Симпони.
У пациентов с несколькими или значительными факторами риска развития туберкулеза, но у которых латентный туберкулез не подтвержден тестом, следует рассмотреть необходимость противотуберкулезной терапии до начала терапии препаратом Симпони.
Следует рассмотреть необходимость применения противотуберкулезной терапии до начала лечения препаратом Симпони у пациентов с активным или латентным туберкулезом в анамнезе, для которых адекватный курс терапии не может быть подтвержден.
Сообщалось о случаях развития активного туберкулеза у пациентов, получавших терапию препаратом Симпони во время и после лечения латентного туберкулеза. У пациентов, получающих препарат Симпони, необходимо контролировать признаки и симптомы активного туберкулеза, в т.ч. у пациентов с отрицательными результатами теста на латентный туберкулез, пациентов, получающих терапию по поводу латентного туберкулеза, и пациентов с указаниями в анамнезе на проведение терапии туберкулеза.
Пациенты должны быть проинформированы о симптомах, подозрительных на туберкулез (длительный кашель, потеря массы тела, субфебрильная лихорадка) и необходимости обращения за медицинской помощью в случае их появления во время или после терапии препаратом Симпони.
Реактивация вируса гепатита В
Как и при лечении другими иммунодепрессантами, терапия ингибиторами ФНОα сопровождалась реактивацией вируса гепатита В у хронических носителей вируса (при положительном тесте на поверхностный антиген), в т.ч. с развитием летального исхода. Все пациенты перед началом терапии должны быть обследованы для исключения вирусного гепатита В. Хронические носители вируса гепатита В должны находиться под тщательным наблюдением перед началом лечения, во время лечения и в течение нескольких месяцев после прекращения лечения препаратом Симпони.
Данные об эффективности сочетанного применения противовирусной терапии и ингибиторов ФНОα у пациентов – хронических вирусоносителей не доступны.
При реактивации вирусной инфекции лечение препаратом Симпони должно быть прекращено и назначена соответствующая противовирусная терапия.
Злокачественные опухоли
Возможная роль терапии ингибиторами ФНОα в развитии злокачественных опухолей не установлена, однако, основываясь на текущих данных, нельзя исключить риск развития лимфом, лейкозов и иных злокачественных опухолей на фоне антиФНОα терапии. Необходимо соблюдать осторожность при назначении ингибиторов ФНО пациентам со злокачественными опухолями в анамнезе или при продолжении терапии в случае развития злокачественной опухоли.
Злокачественные опухоли у детей
В ходе постмаркетинговых исследований сообщалось о случаях образования злокачественных опухолей, некоторые со смертельным исходом, среди детей, подростков и совершеннолетних молодых людей (в возрасте до 22 лет), которые получали ингибиторы ФНО (начало терапии в возрасте ≤18 лет). Приблизительно в половине случаев сообщалось о лимфомах. Другие случаи представлены рядом различных злокачественных опухолей, включающим злокачественные опухоли, которые обычно не отмечаются у детей и подростков. Большинство пациентов получали сопутствующую терапию иммунодепрессантами, такими как метотрексат, азатиоприн или 6-меркаптопурин. Роль ингибиторов ФНО в развитии злокачественных опухолей у детей и подростков остается неясной.
Лимфома и лейкоз
В контролируемых клинических исследованиях при лечении всеми ингибиторами ФНО, включая препарат Симпони, случаи лимфомы регистрировали чаще у пациентов, получавших лечение ингибиторами ФНО, чем в контрольной группе. В клинических исследованиях 2b и 3 фазы частота лимфомы у пациентов, получавших препарат Симпони, была выше ожидаемой частоты в общей популяции. В ходе пострегистрационного применения ингибиторов ФНО сообщалось о случаях развития лейкоза. Т.к. риск развития лимфомы и лейкоза повышен у пациентов с ревматоидным артритом с затянувшимся, высокоактивным воспалительным заболеванием, то оценка риска затруднена.
В пострегистрационном периоде сообщалось о редких случаях развития гептолиенальной Т-клеточной лимфомы при проведении терапии ингибиторами ФНО. Этот редкий вид Т-клеточной лимфомы характеризуется очень агрессивным течением заболевания и обычно заканчивается летальным исходом. Почти все случаи были зарегистрированы у пациентов с болезнью Крона или у пациентов с язвенным колитом. В большинстве случаев сообщалось о развитии заболевания у подростков или молодых взрослых мужчин. Почти все из этих пациентов получали терапию азатиоприном или 6-меркаптопурином совместно с ингибитором ФНО во время или до установления диагноза. Следует тщательно оценить возможный риск одновременного применения азатиоприна или 6-меркаптопурина и препарата Симпони. Нельзя исключить риск развития гепатолиенальной лимфомы у пациентов, получающих лечение ингибиторами ФНО.
У пациентов с ревматоидным артритом и другими хроническими воспалительными заболеваниями, особенно у пациентов с высокой активностью болезни и/или пациентов, подвергаемых длительной терапии иммунодепрессантами, риск развития лимфомы выше (в несколько раз), чем в общей популяции, даже без лечения ингибиторами ФНО.
Нелимфоцитарные злокачественные опухоли
В контролируемых клинических исследованиях препарата Симпони 2b и 3 фазы у пациентов с ревматоидным артритом, псориатическим артритом, анкилозирующим спондилитом и язвенным колитом частота других злокачественных опухолей (за исключением немеланомного рака кожи) была сходной в группе препарата Симпони и контрольной группе.
В клиническо
Симпони, 50 мг/0.5 мл, раствор для подкожного введения, 0,5 мл, 1 шт.
Живые вакцины и лекарственные препараты, содержащие инфекционные агенты
Пациентам, принимающим препарат Симпони®, может проводиться сопутствующая вакцинация, но не живыми вакцинами (см. раздел «Взаимодействие с другими лекарственными препаратами»). Данные об ответе на вакцинацию или возможности вторичной передачи инфекции при применении живых вакцин у пациентов, получающих терапию ингибиторами ФНО, недостаточны. Применение живых вакцин может привести к клиническому проявлению инфекций, включая диссеминированную инфекцию. Использование препаратов, содержащих инфекционные агенты, такие как живые аттенуированные бактерии (например, инстилляции мочевого пузыря БЦЖ для лечения рака), может привести к клиническому проявлению инфекций, включая диссеминированную инфекцию. Не рекомендуется одновременное применение лекарственных препаратов, содержащих инфекционные агенты, и препарата Симпони®.
Аллергические реакции
Чувствительность к латексу
Защитный колпачок иглы одноразового шприца и одноразовой шприц-ручки изготовлен из сухого натурального каучука, содержащего латекс, который может вызвать аллергические реакции у пациентов, чувствительных к латексу.
Особые группы пациентов
Дети
Вакцинация
По возможности, рекомендуется завершить плановую вакцинацию в соответствии с календарем прививок до начала терапии препаратом Симпони® у пациентов детского возраста.
Пожилые пациенты
В исследованиях 3 фазы у пациентов с РА, ПсА, АС и ЯК частота нежелательных явлений, серьезных нежелательных явлений и серьезных инфекций при лечении препаратом Симпони® не отличалась у пациентов в возрасте 65 лет и старше и пациентов более молодого возраста. Однако при лечении пожилых пациентов следует соблюдать осторожность и уделять особое внимание возникновению инфекций. Пациенты в возрасте 45 лет и старше не принимали участия в исследовании нерентгенографического аксиального спондилоартрита.
Почечная и печеночная недостаточность
Специальные исследования препарата Симпони® у пациентов с нарушениями функции почек и печени не проводились. Необходимо соблюдать осторожность при лечении пациентов с нарушениями функции печени.
Возможность медицинских ошибок
Лекарственный препарат Симпони® зарегистрирован в двух дозировках: 50мг/0,5мл и 100мг/1,0мл в виде раствора для подкожного введения. Очень важно использовать верную дозировку в соответствии с разделом «Способ применения и дозы». Следует соблюдать осторожность при применении, чтобы избежать применения недостаточной дозы или передозировки.
Клиническая эффективность при лечении ревматоидного артрита
Эффективность и безопасность препарата Симпони® изучали в трех многоцентровых, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях у более чем 1500 пациентов в возрасте ≥18 лет со среднетяжелым или тяжелым активным РА. диагностированным в соответствии с критериями Американской коллегии ревматологов (ACR) по крайней мере за 3 месяца до скрининга: у взрослых пациентов, у которых ответ на терапию БПВП, включая МТ, оказался неадекватным; у взрослых пациентов, не получавших ранее МТ и ингибиторы ФНО: у пациентов, которые ранее получали один или несколько ингибиторов ФНО. Препарат Симпони® вводили подкожно в дозах 50 мг или 100 мг (с МТ или без него) каждые 4 недели. Длительность плацебо-контролируемой фазы составляла 24 недели.
В целом клиническая эффективность препарата Симпони® в дозах 50 мг и 100 мг существенно не отличалась.
Во всех исследованиях 3 фазы доля пациентов, адекватно ответивших на лечение через 14 и 24 недели, в группах препарата Симпони® была выше, чем в контрольных группах. Ответ по критериям ACR наблюдался через 4 недели после начала лечения препаратом Симпони® (когда в первый раз оценивали результаты) и сохранялся в течение последующих 24 и 104 недель.
При лечении препаратом Симпони® по сравнению с плацебо было выявлено клинически и статистически значимое улучшение физической функции и качества жизни. Отмечено статистически значимое улучшение трудоспособности и снижение утомляемости.
В исследовании с участием взрослых пациентов, не получавших ранее МТ, для оценки влияния Симпони® на рентгенологическое прогрессирование использовалась шкала vdH-S, в которой учитывается число и выраженность эрозий суставов и сужений суставных щелей кистей и стоп. Число пациентов без новых эрозий или с изменениями исходного показателя шкалы vdH-S ≤0 было достоверно выше у пациентов в группе Симпони®, чем в контрольных группах (р = 0,003). Влияние на рентгенологичеекое прогрессирование, достигнутое на 52 неделе, сохранялось вплоть до 104 недели.
У пациентов, которые остались в исследовании и продолжали терапию препаратом Симпони®, влияние на рентгенологические показатели сохранялось со 104 до 256 недели.
Клиническая эффективность при лечении псориатического артрита
Безопасность и эффективность препарата Симпони® изучали в многоцентровом, рандомизированном, двойном слепом, плацебо-контролируемом исследовании у 405 взрослых пациентов с активным ПсА. не ответивших на терапию нестероидными противовоспалительными препаратами или БПВП. В этом исследовании время с момента постановки диагноза ПсА составляло по крайней мере 6 месяцев до включения в исследование, диаметр бляшечного поражения кожи — не менее 2 см. В исследование включали пациентов с различными подтипами ПсА. в том числе полиартритом без ревматоидных узелков (43%), асимметричным периферическим артритом (30%), артритом дистальных межфаланговых суставов (15%), спондилитом с периферическим артритом (11%) и мутилирующим артритом (1%). Предыдущая терапия антагонистом ФНО была критерием исключения. Препарат Симпони®» вводили подкожно в дозах 50 мг или 100 мг каждые 4 недели с МТ или без него. Рандомизированным пациентам назначали плацебо (n = 113), препарат Симпони® 50мг (n = 146) и препарат Симпони® 100мг (n = 146). Первичной конечной точкой была доля пациентов, достигших 20% улучшения по критериям ACR (ACR 20) через 14 недель. Результаты лечения сравнивали с плацебо в течение 24 недель.
В целом клиническая эффективность препарата Симпони® в дозах 50 мг и 100 мг существенно не отличалась.
Улучшение по основным параметрам, характеризующим активность заболевания, было отмечено уже при первом обследовании (через 4 недели) после начала лечения и сохранялось в течение 24 недель. Частота ответа через 14 недель была сходной у пациентов с различными подтипами ПсА. в том числе полиартритом без ревматоидных узелков. асимметричным периферическим артритом, артритом дистальных межфаланговых суставов и спондилитом е периферическим артритом. Число пациентов с мутилирующим артритом было недостаточным для оценки эффективности. Частота ответа на лечение препаратом Симпони® была сопоставимой у пациентов, получавших и не получавших МТ.
При лечении препаратом Симпони® наблюдалось улучшение показателей активности псориатического артрита, в том числе числа опухших суставов, числа болезненных суставов, дактилита и энтезита. Кроме того, у пациентов, получавших препарат Симпони®, выявлено значительное улучшение псориаза кожи и ногтей.
Лечение препаратом Симпони® привело к значительному улучшению физической функции, а также качества жизни. Трудоспособность значительно увеличилась, а время пребывания с пациентом лиц, осуществляющих уход или лечение, сократилось.
У пациентов, которые остались в исследовании и продолжали терапию препаратом Симпони®, влияние на клинические показатели сохранялось со 104 до 256 недели.
Клиническая эффективность при лечении аксиального спондилоартрита
Клиническая эффективность при лечении анкилозирующего спондилита
Безопасность и эффективность препарата Симпони® изучали в многоцентровом, рандомизированном, плацебо-контролируемом исследовании у 356 взрослых пациентов с активным АС. В исследование включали пациентов, у которых сохранялись признаки активности АС, несмотря на лечение нестероидными противовоспалительными препаратами или БПВП и которые ранее не получали антагонисты ФНО. Из исследования исключали пациентов с полным анкилозом позвоночника. Препарат Симпони® вводили подкожно каждые 4 недели. Рандомизированным пациентам назначали плацебо (n = 78), препарат Симпони® 50 мг (n = 138) и препарат Симпони® 100 мг (n = 140). Первичной конечной точкой была доля пациентов, достигших улучшения в виде ASAS 20 через 14 недель. Эффективность сравнивали с плацебо в течение 24 недель.
В целом клиническая эффективность препарата Симпони® в дозах 50 мг и 100 мг существенно не отличалась.
По сравнению с плацебо лечение препаратом Симпони® привело к значительному уменьшению симптомов через 14 и 24 недели. Улучшение основных показателей активности АС отмечалось при первой оценке результатов лечения (4 недели) и сохранялось в течение 24 недель.
Лечение препаратом Симпони® способствовало значительному улучшению физической функции, которую оценивали через 14 и 24 недели. У пациентов, получавших препарат Симпони®, улучшение физической функции сохранялось в течение 24 недель. Качество жизни также значительно улучшилось уже через 14 недель. Кроме того, выявлено значительное улучшение сна и трудоспособности.
У пациентов, которые остались в исследовании и продолжали терапию препаратом Симпони® д влияние на клинические показатели сохранялось с 24 до 256 недели.
Клиническая эффективность при лечении нерентгенографического аксиального сиондилоартрита.
Безопасность и эффективность препарата Симпони® изучали в многоцентровом, рандомизированном. двойном слепом. плацебо-контролируемом исследовании (GO-AHEAD) у 197 взрослых пациентов с тяжелой активной формой нерентгенографического аксиального спондилоартрита (пациенты. отвечающие критериям ASAS классификации аксиального спондилоартрита, но не отвечающие критериям модифицированной Нью-Йоркской классификации АС). В исследование включали пациентов, у которых сохранялись признаки активности заболевания (индекс активности заболевания АС (BASDAI) ≥4 и критерии согласно визуальной аналоговой шкале (VAS) по общей боли в спине ≥4. каждый по шкале от 0 до 10 см), несмотря на лечение НПВП, и которые ранее не получали терапию другими биологическими препаратами, включая терапию антагонистами ФНО. Пациентам рандомизированно назначали плацебо или препарат Симпони® 50 мг, подкожно каждые 4 недели. С 16-й недели начиналась открытая фаза исследования, в которой все пациенты получали терапию препаратом Симпони®’ 50 мг подкожно каждые 4 недели до 48-й недели с оценкой эффективности в течение 52 недель и безопасности в течение 60 недель. Примерно 93% пациентов, получавших препарат Симпони® в начале открытой фазы исследования (16 неделя), продолжили получать лечение до конца исследования (52 неделя).
Анализ был сделан по двум показателям для всех пациентов (АТ, N=197) и пациентов с объективными признаками воспаления (OSI, N=158, такими как повышение концентрации СРБ и/или с подтверждением сакроилеита по данным МРТ в начале исследования). В данном исследовании оценивалась эффективность препарата Симпони® в течение 16 недель по сравнению с плацебо. Первичной конечной точкой была доля пациентов, достигших улучшения в виде ASAS 20 на 16-й неделе. Основные результаты представлены в таблице 2 и описаны ниже.
Таблица 2. Основные результаты исследования GO-AHEAD на 16-й неделе.
| Улучшения в признаках и симптомах | ||||
| Все пациенты (АТ) | Пациенты с объективными признаками воспаления (OSI) | |||
| Плацебо | Симпони® 50 мг | Плацебо | Симпони® 50 мг | |
| па | 100 | 97 | 80 | 78 |
| Пациенты, ответившие на лечение, % | ||||
| ASAS 20 | 40% | 71%** | 38% | 77%** |
| ASAS 40 | 23% | 57%** | 23% | 60%** |
| ASAS 5/6 | 23% | 54%** | 23% | 63%** |
| ASAS частичная ремиссия | 18% | 33%* | 19% | 35%* |
| ASDAS-Cb <1,3 | 13% | 33%* | 16% | 35%* |
| BASDAI 50 | 30% | 58%** | 29% | 59%** |
| Ингибирование воспаления в крестцово-подвздошных суставах, определяется с помощью МРТ | ||||
| Плацебо | Симпони® 50 мг | Плацебо | Симпони® 50 мг | |
| nс | 87 | 74 | 69 | 61 |
| Среднее изменение в крестцово-подвздошных суставах, определенное с помощью МРТ по шкале SPARCCd | -0,9 | -5,3** | -1,2 | -6,4** |
an — количество рандомизированных и получавших назначенную терапию пациентов;
b концентрация СРБ шкалы активности заболевания АС (ASDAS-C), (АТ-плацебо, N=90; АГ-Симпони® 50 мг, N=88; OSI-плацебо, N=71; OSI-Симпони® 50 мг, N=71);
сn — количество пациентов, для которых есть исходные и полученные на 16-й неделе данные МРТ;
d SPARCC (исследовательский консорциум Канады по спондилоартриту);
** р<0,0001 для Сим пони1 в сравнении с плацебо;
* р<0,05 для Сим пони’ в сравнении с плацебо.
Статистически значимое улучшение в симптомах и признаках тяжелого активного нерентгенографического аксиального спондилоартрита было показано у пациентов, получавших терапию препаратом Симпони® 50 мг в сравнении с пациентами, получавшими плацебо на 16-й неделе (см. таблицу 2). Улучшение по основным параметрам, характеризующим активность заболевания, было отмечено уже при первом обследовании (через 4 недели) после начала лечения препаратом Симпони®.
Статистически значимое уменьшение воспаления в крестцово-подвздошных суставах, определяемое с помощью МРТ по шкале SPARCC, наблюдалось у пациентов, получавших терапию препаратом Симпони® 50 мг в сравнении с пациентами, получавшими плацебо на 16-й неделе (см. таблицу 2). Боль, оцениваемая как общая боль в спине и ночная боль по шкале VAS, и активность заболевания, определяемая по шкале ASDAS-C, также показали статистически значимое улучшение на 16-й неделе в сравнении с исходными значениями у пациентов, получавших терапию препаратом Симпони® 50 мг, в сравнении с пациентами, получавшими плацебо на 16-й неделе (р<0,0001).
Было выявлено статистически значимое улучшение в подвижности позвоночника, определенное по метрологическому индексу заболевания АС (BASMI) и статистически значимое улучшение физической функции, определённое по функциональному индексу АС (BASFI) у пациентов, получавших терапию препаратом Симпони® 50 мг, в сравнении с пациентами, получавшими плацебо (р<0,0001). У пациентов, получавших терапию препаратом Симпони®, наблюдалось значительно большее улучшение качества жизни при оценке по опросникам ASQoL и EQ-5D, физических и психических составляющих по опроснику SF-36, а также значительное улучшение продуктивности при оценке по опроснику WPAI, по сравнению с пациентами, получавшими плацебо.
У пациентов с объективными признаками воспаления (OSI) также демонстрировались статистически значимые результаты для всех конечных точек, описанных ранее. Улучшения, наблюдаемые на 16-й неделе среди пациентов, получающих терапию препаратом Симпони® 50 мг, сохранялись у пациентов, оставшихся в исследовании до 52 недели.
Клиническая эффективность при лечении язвенного колита
Эффективность препарата Симпони® изучали в двух рандомизированных, плацебо контролируемых, двойных слепых исследованиях у взрослых пациентов.
В исследовании индукции ремиссии (PURSUIT-Induction) оценивали пациентов со среднетяжелым или тяжелым активным ЯК (от 6 до 12 баллов по шкале Мейо, не менее 2 по подшкале эндоскопии), у которых ответ на стандартную терапию был недостаточным или отсутствовал или у которых была зависимость от кортикостероидов. В части исследования по подтверждению дозы 761 пациент был рандомизирован в 3 группы: 400 мг препарата Симпони® подкожно на неделе 0 и 200 мг на неделе 2, 200 мг препарата Симпони® подкожно на неделе 0 и 100 мг на неделе 2, плацебо подкожно на неделе 0 и на неделе 2. Допускался одновременный прием постоянных доз аминосалицилатов. кортикостероидов и/или иммуносупрессантов перорально. В данном исследовании оценивалась эффективность препарата Симпони® в течение 6 недель.
Результаты исследования поддерживающей терапии (PURSUIT-Maintenance) основаны на оценке данных 456 пациентов, у которых был достигнут клинический ответ на предыдущую терапию препаратом Симпони® в стадию индукции. Пациенты были рандомизированы в 3 группы: 50 мг препарата Симпони®, 100 мг препарата Симпони® или плацебо; препарат вводили подкожно каждые 4 недели. Допускался одновременный прием постоянных доз аминосалицилагов. кортикостероидов и/или иммуносупрессантов перорально. В данном исследовании оценивалась эффективность препарата Симпони® в течение 54 недель. Пациенты, которые завершили лечение в исследовании поддерживающей терапии в течение 54 недель, продолжили лечение в продленной фазе клинического исследования с оценкой эффективности на 216 неделе.
Таблица 3. Основные результаты исследований PURSUIT-Induction и PURSUIT-Maintenance.
| PURSUIT-Induction | |||
| Плацебо N=251 | Симпони® 200/100 мг, N=253 | ||
| Процент пациентов | |||
| Пациенты с клиническим ответом на 6-ой неделеa | 30% | 51%** | |
| Пациенты с клинической ремиссией на 6-ой неделеb | 6% | 18%** | |
| Пациенты с заживлением слизистой на 6-ой неделеc | 29% | 42%* | |
| PURSUIT-Maintenance | |||
| Плацебоd N=154 | Симпони® 50 мг N=151 | Симпони® 100 мг N=151 | |
| Процент пациентов | |||
| Поддержание ответа (пациенты с клиническим ответом на 54-ой неделе)e | 31% | 47%* | 50%** |
| Стойкая ремиссия (пациенты с клинической ремиссией на 30-ой и 54-ой неделях)f | 16% | 23%g | 28%* |
где:
N количество пациентов;
** р ≤0,001;
* р ≤0,01;
aопределяется как уменьшение исходного результата по шкале Мейо на ≥30% и на ≥3 баллов, сопровождающееся уменьшением количества баллов по шкале ректального кровотечения на ≥1 или если количество баллов по этой шкале от 0 до 1;
b определялся как результат по шкале Мейо ≤2 баллов при отсутствии результатов по индивидуальным под шкалам >1;
c определяется как результат по подшкале эндоскопии от 0 до 1 балла;
d только стадия индукции;
e активность язвенного колита у пациентов оценивали по частичному результату шкалы Мейо каждые 4 недели (потеря ответа подтверждалась эндоскопией). Следовательно, пациенты, сохранившие ответ, были в стадии продолжительного клинического ответа при каждой оценке в течение 54 недель;
f пациент должен быть в стадии ремиссии и на неделе 30, и на неделе 54 (без признаков потери ответа в любой точке времени в течение 54 недель) для достижения стойкой ремиссии;
g среди пациентов массой менее 80 кг большее количество пациентов, получавших поддерживающую терапию голимумабом по 50 мг, продемонстрировали стойкую клиническую ремиссию по сравнению с пациентами, получавшими плацебо.
Количество пациентов, у которых было стойкое заживление слизистой (пациенты с заживлением слизистой на 30-ой и 54-ой неделях) было больше в группе препарата Симпони® (42% в группе 50 мг (номинальное значение р<0.05) и 42% в группе 100 мг (номинальное значение р<0.005)) по сравнению с группой плацебо (27%).
Среди 54% пациентов (247/456), получавших сопутствующую терапию кортикостероидами на момент начала поддерживающей терапии, количество пациентов с клиническим ответом без применения кортикостероидов на неделе 54 было больше в группах, получавших препарат Симпони® в дозе 50 мг (38%, 30/78) и в дозе 100 мг (30%, 25/82), по сравнению с группой плацебо (21%, 18/87). Количество пациентов, которые прекратили прием кортикостероидов к неделе 54, было больше в группах препарата Симпони® в дозе 50 мг (41%, 32/78) и в дозе 100 мг (33%, 27/82) по сравнению с группой плацебо (22%, 19/87). Среди пациентов, набранных в продленную фазу клинического исследования, доля пациентов, которым не требовалась терапия кортикостероидами, в основном сохранялась на протяжении 216 недель.
К 6-ой неделе применение препарата Симпони® значительно улучшало качество жизни пациентов, что подтверждено улучшением показателей, специфичных для заболевания (IBDQ), по сравнению с исходным уровнем. У пациентов, получавших поддерживающую терапию препаратом Симпони®, улучшение качества жизни, измеренное согласно IBDQ, поддерживалось в течение 54 недель.
Примерно 63% пациентов, которые получали терапию препаратом Симпони® в начале продленной фазы клинического исследования (неделя 56), продолжили получать терапию до конца исследования (последняя доза голимумаба на 212 неделе).
Иммуногенность
Антитела к голимумабу были выявлены методом иммуноферментного анализа (ИФА) у 5% (105/2062) пациентов с РА, ПсА и АС, получавших препарат Симпони® в течение 52 недель в исследованиях 3 фазы. Частота антителообразования была сопоставимой у пациентов с различными ревматическими заболеваниями. У пациентов, получавших сопутствующую терапию МТ, частота образования антител была ниже, чем у пациентов, которые принимали препарат Симпони® без МТ (3% [41/1235] и 8% [64/827] соответственно).
Антитела к голимумабу были выявлены методом ИФА у 4% (4/93) пациентов с нерентгенографическим аксиальным спондилоартритом, получавших препарат Симпони® в течение 16 недель.
Антитела к голимумабу были выявлены методом ИФА у 3% (26/946) пациентов с ЯК, получавших препарат Симпони® в течение 54 недель в исследованиях 2 и 3 фазы. У 68% (21/31) антитело-положительных пациентов нейтрализующие антитела были обнаружены in vitro. При лечении с использованием сопутствующей терапии иммуносупрессантами (азатиоприном, 6-меркаптопурином и метотрексатом) число пациентов с антителами к голимумабу (1%; 4/308) было меньше, чем при лечении без сопутствующей терапии (3%; 22/638).
Для выявления антител к голимумабу в исследовании пЮИА использовался метод ИФА с определением общих антител, включая связанных с препаратом. В связи с большей чувствительностью и меньшей погрешностью метода ожидалась большая частота выявления антител к голимумабу по сравнению с использованием предыдущего метода ИФА. В рамках исследования 3 фазы пЮИА вплоть до 48 недели методом ИФА с определением общих антител, включая связанных с препаратом, антитела к голимумабу были выявлены у 40% (69/172) детей, получавших голимумаб; у большинства из них зарегистрирован титр антител ниже уровня 1:1000. Влияние на сывороточную концентрацию голимумаба отмечалось при титре >1:100, влияние на эффективность отмечалось только при достижении титра >1:1000; было зарегистрировано небольшое число детей с титром >1:1000 (N = 8). Среди детей с наличием антител к голимумабу нейтрализующие антитела были выявлены у 39% (25/65). Поскольку чаще всего регистрировались случаи с низким титром антител, повышение частоты выявления антител методом ИФА с определением общих антител, включая связанных с препаратом, не оказывает видимого влияния на концентрацию препарата, эффективность и безопасность. Таким образом, новой информации по профилю безопасности не выявлено. Присутствие антител к голимумабу может увеличивать риск развития реакций в месте инъекции. Низкая частота образования антител к голимумабу не позволяет определенно судить о связи между иммуногенностью и клинической эффективностью или безопасностью.
Поскольку анализ иммуногенности является продукт-специфичным и специфичным для каждого отдельного набора реактивов, сравнение концентрации антител к различным продуктам не является корректным.
Клиническая эффективность при лечении полиартикулярного ювенильного идиопатического артрита
Эффективность и безопасность препарата Симпони® изучалась в рамках рандомизированного, двойного слепого, плацебо контролируемого исследования с рандомизированной отменой (GO KIDS). в которое были включены 173 пациента (возраст от 2 до 17 лет) с активным пЮИА, с наличием, как минимум, 5 суставов с активным воспалением и неадекватным ответом на терапию МТ. В исследование были включены дети с полиаргикулярным ЮИА (полиартрит с положительным либо отрицательным ревматоидным фактором, распространенный олигоаргрит. ювенильный псориатический артрит или системный ЮИА без системной симптоматики на момент обследования). Медиана количества суставов с активным воспалением на исходном уровне составила 12; медиана концентрации СРБ составила 0,17 мг/дл.
Часть 1 клинического исследования представлена 16-недельной открытой фазой, в рамках которой пациенты получали препарат Симпони® в дозе 30 мг/м2 (максимум 50 мг) подкожно каждые 4 недели вместе с МТ. 154 пациента, у которых на неделе 16 был достигнут терапевтический ответ ACR Ped 30 были включены в Часть 2 клинического исследования, представленную рандомизированной фазой отмены, где пациенты получали препарат Симпони® 30 мг/м2 (максимум 50 мг) + МТ, либо плацебо + МТ каждые 4 недели. После обострения заболевания пациенты получали препарат Симпони® 30 мг/м2 (максимум 50 мг) + МТ. На неделе 48 пациенты были включены в долгосрочную продленную фазу клинического исследования.
Терапевтический ответ ACR Ped 30, 50, 70 и 90 отмечался уже на неделе 4 данного клинического исследования.
На неделе 16 терапевтический ответ ACR Ped 30 был достигнут у 87% пациентов, у 79%, 66%, 36% пациентов отмечался терапевтический ответ ACR Ped 50, ACR Ped 70 и ACR Ped 90 соответственно. На неделе 16 у 34% пациентов было установлено неактивное заболевание, определявшееся по наличию всех признаков, указанных далее: отсутствие суставов с активными проявлениями артрита, отсутствие лихорадки, сыпи, серозита, спленомегалии. гепатомегалии и генерализованной лимфоаденопатии, связанных с ЮИА, отсутствие активного увеига, нормальные показатели скорости оседания эритроцитов (<20мм/час) и концентрации СРБ (<1,0 мг/дл), оценка активности заболевания врачом <5 мм по шкале VAS; продолжительность периода утренней скованности <15 минут.
На неделе 16 по всем уровням ACR Ped была достигнута клинически значимая положительная динамика относительно исходного уровня (Таблица 4).
Таблица 4. Положительная динамика компонентов ACR Ped на неделе 16а.
| Медиана процентного значения положительной динамики | ||
| Симпони® 30 мг/м2 nb = 173 | ||
| Общая оценка заболевания врачом (VASc 0–10 см) | 88% | |
| Общая оценка общего благополучия пациентом, либо его родителями (VAS 0–10 см) | 67% | |
| Число суставов с активным воспалением | 92% | |
| Число суставов с ограниченной амплитудой движений | 80% | |
| Физическая функция по опроснику CHAQd | 50% | |
| СОЭ (мм/час)е | 33% | |
a исходный уровень = неделя 0;
b “n” — число включенных пациентов;
c VAS — Визуальная Аналоговая Шкала;
d CHAQ (Child Health Assessment Questionnaire) — Опросник по оценке состояния здоровья детей;
e СОЭ (мм/час) — скорость оседания эритроцитов (миллиметры в час).
Первичная конечная точка — процент пациентов с наличием терапевтического ответа ACR Ped 30 на неделе 16, у которых не наблюдалось внезапного обострения заболевания за период с недели 16 по неделю 48, не была достигнута. У большинства пациентов в период с недели 16 по неделю 48 внезапного обострения заболевания не отмечалось (59% в группе препарата Симпони® + МТ, 53% в группе плацебо + МТ; р = 0,41).
Анализ первичной конечной точки в подгруппах, разделенных по исходной концентрации СРБ (≥1 мг/дл по сравнению с <1 мг/дл), показал большую частоту внезапного обострения заболевания в группе плацебо + МТ по сравнению с группой голимумаб + МТ среди пациентов с концентрацией СРБ на исходном уровне ≥1 мг/дл (87% по сравнению с 40%; р=0,0068).
На неделе 48 отмечался терапевтический ответ ACR Ped 30 у 53% и 55% пациентов из групп препарат Симпони® + МТ и плацебо + МТ соответственно; состояние неактивного заболевания достигнуто у 40% и 28% пациентов из групп препарат Симпони® + МТ и плацебо + МТ соответственно.
Влияние на способность управлять транспортными средствами и другими механизмами
Препарат Симпони® может оказывать незначительное влияние на способность управлять автомобилем и работать с механизмами. После введения препарата Симпони® может развиться головокружение. В этом случае не следует управлять автомобилем и работать с механизмами.
Голимумаб (Golimumabum)
Инфекционные и паразитарные заболевания:
инфекции верхних дыхательных путей (ринит, назофарингит, фарингит, ларингит), бактериальные инфекции (флегмона), вирусные инфекции (грипп и герпес), бронхит, синусит, поверхностные грибковые инфекции, септический шок, сепсис, туберкулез, инфекции нижних дыхательных путей (пневмония), оппортунистические инфекции (инвазивные грибковые инфекции (гистоплазмоз, кокцидиоидомикоз, пневмоцистоз), бактериальные, атипичные микобактериальные и протозойные), абсцесс, бактериальный артрит, реактивация гепатита B, пиелонефрит, инфекционный бурсит.
Доброкачественные, злокачественные опухоли и неуточненные новообразования:
рак кожи, плоскоклеточный рак и миелоцитарный невус, лимфома, лейкоз.
Со стороны системы кроветворения:
анемия, лейкопения, тромбоцитопения, панцитопения, апластическая анемия.
Со стороны иммунной системы:
аллергические реакции (бронхоспазм, гиперчувствительность, крапивница), положительная реакция на аутоантитела, анафилактические реакции, системный васкулит, саркоидоз.
Со стороны эндокринной системы:
нарушения щитовидной железы (гипотиреоидит, гипертиреоидит и зоб).
Со стороны обмена веществ:
повышение глюкозы в крови и повышение липидов.
Со стороны нервной системы:
головокружение, парестезия, головная боль, депрессия, бессонница, демиелинизирующие заболевания (центральная и периферическая формы), нарушения равновесия, расстройства личности.
Со стороны органов зрения:
нарушение зрения (помутнение), конъюнктивиты, аллергические реакции (покраснение, раздражение).
Со стороны сердечно-сосудистой системы:
артериальная гипертензия, застойная сердечная недостаточность (впервые выявленная или ухудшение имеющейся), аритмия, стенокардия, тромбоз (включая тромбоз глубоких вен и артерий), болезнь Рейно, гиперемия.
Со стороны дыхательной системы:
бронхиальная астма и сопутствующие симптомы (одышка, гиперактивность бронхов), интерстициальная болезнь легких.
Со стороны пищеварительной системы:
запор, диспепсия, боль в области ЖКТ, тошнота, воспалительные заболевания ЖКТ (гастрит, колит), рефлюкс, стоматит, повышение активности печеночных трансаминаз, холелитиаз, нарушения функции печени.
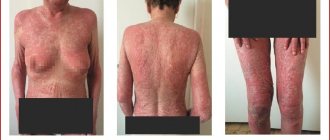
Со стороны кожи и подкожных тканей:
зуд, сыпь, псориаз (выявленный впервые или ухудшение имеющегося заболевания, ладонно-подошвенный, пустулезный), крапивница, системный васкулит, алопеция, дерматит.
Со стороны костно-мышечной системы и соединительной ткани:
волчаноподобный синдром, переломы костей.
Со стороны мочевыделительной системы:
заболевания мочевого пузыря, почек.
Со стороны половых органов и молочных желез:
заболевания молочных желез, нарушения менструации.
Общие нарушения:
гипертермия, астения, дискомфорт в области груди.
Местные реакции:
эритема, крапивница, уплотнение, боль, кровоподтек, зуд, раздражение, парестезия в месте инъекции, медленное заживления в месте инъекции.