В настоящее время в структуре хирургических вмешательств при первичных и метастатических опухолях печени первое место занимают обширные резекции печени, характеризующиеся высокой травматичностью, нередко массивной интраоперационной кровопотерей [1]. За последние годы непосредственные результаты обширных резекций печени, по данным современной литературы, заметно улучшились. Так, в начале 90-х годов летальность после резекций печени, выполненных по поводу онкологических заболеваний, составляла от 20 до 33%. На сегодняшний день этот показатель не превышает 2—6% и определяется в основном массивной интраоперационной кровопотерей и пострезекционной печеночной недостаточностью [8]. В последние годы отмечается тенденция к снижению объема кровопотери при подобных оперативных вмешательствах. Ряд исследователей указывают, что на фоне благоприятной тенденции средний объем кровопотери при резекциях печени по-прежнему превышает 2000 мл, что не может удовлетворять на современном этапе развития медицины [3].
Массивная кровопотеря приводит к гиповолемии, анемии, снижению перфузии органов и тканей, что обусловливает нарушение доставки кислорода, формирование кислородной задолженности и к возникновению синдрома полиорганной недостаточности [4]. Кроме того, потеря тромбоцитов и плазменных факторов свертывания приводит к гипокоагуляции и коагулопатии потребления, что на фоне травмы, наличия обширной раневой поверхности и кислородного дефицита тканей способно реализоваться в синдром диссеминированного внутрисосудистого свертывания (ДВС) [5].
В настоящее время кровесберегающие технологии делят на технические и фармакологические. К техническим кровесберегающим технологиям относят использование аппаратов реинфузии излившейся аутокрови (Cell Saver), современных хирургических скальпелей (гармонический) и коагуляторов (аргонно-плазменный). К фармакологическим технологиям относят заготовку аутокрови, нормоволемическую гемодилюцию, применение ингибиторов фибринолиза, активаторов тромбоцитарного звена гемостаза, поддержание относительной гиповолемии [6]. Важной особенностью операций на печени часто является абсолютная невозможность лигирования кровоточащего сосуда. Именно поэтому так важно поддерживать относительную гиповолемию и стремиться к быстрому формированию сгустка в поврежденном сосуде [6].
В этой связи представляет интерес возможность оказывать влияние на мышечный тонус стенок мелких сосудов. В нашем институте проведена оценка возможности периоперационного использования терлипрессина (Ремистип, «ФЕРРИНГ-Лечива a.o.», Чешская Республика), действующее вещество которого представляет собой синтетический аналог гормона задней доли гипофиза вазопрессина. В организме человека терлипрессин подвергается биотрансформации и превращается в активные метаболиты, оказывающие выраженный вазоконстрикторный и гемостатический эффекты. При этом, в отличие от вазопрессина, терлипрессин не оказывает клинически значимое антидиуретическое действие. Активные метаболиты терлипрессина вызывают спазм артериол и венул преимущественно в паренхиме внутренних органов, сокращение гладких мышц стенки пищевода, повышение тонуса и перистальтики кишечника. Терлипрессин оказывает длительное действие, максимальная концентрация препарата в крови достигается через 60—120 мин после введения, устойчивый гемостатический эффект сохраняется на протяжении 4—6 ч [7]. Показано, что при выполнении экстирпации матки с резекцией большого сальника по поводу рака яичников использование терлипрессина позволяет снизить объем общей кровопотери на 40%. Терлипрессин не оказывает влияния на показатели свертывания крови, что актуально для онкологических больных с начальными признаками синдрома гиперкоагуляции [2].
Цель исследования — анализ интраоперационного применения терлипрессина с целью снижения уровня кровопотери и оценка влияния препарата на результаты хирургического лечения онкологических больных при расширенных резекциях печени наряду с традиционными кровосберегающими технологиями.
Фармакологические свойства препарата Глипрессин
Фармакодинамика. Терлипрессин — синтетический аналог гормона задней доли гипофиза — вазопрессина. Терлипрессин снижает давление в системе воротной вены и портальный кровоток, вызывает спазм мышц пищевода с дальнейшим сужением варикозно-расширенных вен пищевода. Биологически активный лизин-вазопрессин медленно высвобождается из неактивного прогормона терлипрессина. Метаболическая элиминация лизин-вазопрессина происходит параллельно с высвобождением, поэтому его концентрация в плазме крови от минимальной до субтоксической сохраняется на протяжении 4–6 ч. Терлипрессин повышает тонус гладких мышц в сосудах и органах ЖКТ. Повышение ОПСС приводит к снижению трофики нервных волокон, иннервирующих внутренние органы. Снижение артериальной перфузии приводит к снижению давления в системе воротной вены. Одновременное сокращение мышечных оболочек разных отделов кишечника проявляется усилением перистальтики. Сокращающиеся мышцы стенки пищевода пережимают варикозные узлы. Антидиуретическое действие терлипрессина составляет всего 3% от активности нативного вазопрессина, поэтому оно не является клинически значимым. При нормоволемии почечный кровоток существенным образом не изменяется, но повышается при гиповолемии. Терлипрессин оказывает медленное гемодинамическое действие на протяжении 2–4 ч. Незначительно повышается систолическое и диастолическое АД. При ренальной гипертензии и генерализованном атеросклерозе отмечалось выраженное повышение АД. Даже при применении препарата в высоких дозах терлипрессин не оказывает кардиотоксического действия. Под влиянием терлипрессина значительно снижается кровоток в эндометрии и миометрии. Ввиду сосудосуживающего эффекта терлипрессина снижается кровоток в коже, что проявляется бледностью кожных покровов. Гемодинамический эффект и действие на гладкие мышцы являются основными фармакологическими эффектами терлипрессина. Централизация кровообращения при гиповолемии рассматривается как компенсаторная защитная реакция при кровотечении из варикозно-расширенных вен пищевода. Фармакокинетика. Терлипрессин фармакологически малоактивен. Активный метаболит терлипрессина — лизин-вазопрессин характеризуется медленным высвобождением вследствие разрушения последнего. Глициновый остаток при расщеплении триглицилнонапептида легко выводится в свободном виде. Средний T1/2 терлипрессина — 24±2 мин. После в/в болюсного введения терлипрессин выводится согласно закономерностям кинетики второго порядка. Период полужизни в фазу распределения (продолжительность — до 40 мин) составляет 12 мин. При отщеплении свободного глицинового остатка гормон лизин-вазопрессин высвобождается медленно и достигает пиковой концентрации через 120 мин. В моче определяется всего 1% терлипресcина, так как препарат полностью метаболизируется при участии эндо- и экзопептидаз печени и почек.
Эффективность и безопасность применения терлипрессина при кесаревом сечении у беременных с высоким риском кровотечения: многоцентровое всенаправленное когортное исследование Terli-Bleed. Часть I
Ю.С.Распопин (Краевой клинический центр охраны материнства и детства, Красноярск, Российская Федерация, Красноярский государственный медицинский университет им. проф. В.Ф.Войно-Ясенецкого, Красноярск, Российская Федерация), Е.М.Шифман (Московский областной научно-исследовательский клинический институт им. М.Ф.Владимирского, Москва, Российская Федерация), А.А.Белинина (Алтайский краевой клинический перинатальный центр, Барнаул, Российская Федерация), А.В.Ростовцев (Городская клиническая больница скорой медицинской помощи №8, Воронеж, Российская Федерация), Н.В.Артымук (Кемеровский государственный медицинский университет, Кемерово, Российская Федерация), А.С.Оленев (Городская клиническая больница №24, Москва, Российская Федерация), В.Б.Цхай (Красноярский государственный медицинский университет им. проф. В.Ф.Войно-Ясенецкого, Красноярск, Российская Федерация, Федеральное медико-биологическое агентство России, Красноярск, Российская Федерация), Ю.С.Александрович (Санкт-Петербургский государственный педиатрический медицинский университет, Санкт Петербург, Российская Федерация), И.В.Молчанова (Алтайский краевой клинический перинатальный центр, Барнаул, Российская Федерация), О.Н.Новикова (Кемеровский государственный медицинский университет, Кемерово, Российская Федерация)
Профилактика послеродовых кровотечений является одной из важных задач современного акушерства, анестезиологии и интенсивной терапии.
Цель
. Оценить эффективность и безопасность применения терлипрессина в качестве средства профилактики раз вития послеродовых кровотечений во время операции кесарева сечения у беременных высокой группы риска.
Пациенты и методы.
С февраля по декабрь 2021 г. проведено многоцентровое всенаправленное когортное исследование, в котором участвовало 5 медицинских центров. В исследование были включены 454 беременные женщины, родоразрешенные операцией кесарева сечение, которые были поделены на две группы: I группа (n = 351) – контрольная, II группа (n = 103) – исследуемая, с применением терлипрессина, вводимого в толщу миометрия. Оценка профилактического эффекта препарата проводилась по нескольким основным направлениям: объем кровопотери, необходимость проведения дополнительных методов хирургического гемостаза, безопасность интраоперационного применения.
Результаты.
Выявлены значительные различия при оценке значимых факторов риска развития послеродового кровотечения, сопутствующей патологии и коморбидного состояния между группами. Исследуемая группа оказалась более угрожаемой по развитию послеродовых кровотечений. В контрольной группе чаще применялись дополнительные меры хирургического гемостаза, в том числе гистерэктомии (2,6% против 1,9%) и релапаротомии (1,9% против 1%). Медиана объема кровопотери оказалась статистически ниже в исследуемой группе (700 мл против 800 мл). Тем не менее следует отметить существенный разброс данных по объему кровопотери: так, в контрольной группе максимальная кровопотеря составила 10000 мл, а в исследуемой – 4500 мл. Не отмечено серьезных осложнений в обеих группах.
Заключение.
Исследование показало, что применение терлипрессина может снизить объем кровопотери у женщин с высокими факторами риска развития послеродовой кровопотери, а также сократить количество гистерэктомий и релапаротомий. Необходимо продолжить проспективную часть исследования с увеличением рандомизированной выборки пациентов.
Ключевые слова
: акушерское кровотечение, кесарево сечение, терлипрессин
Акушерские кровотечения являются одной из основных причин материнской смертности в нашей стране и во всем мире [1, 2]. Для решения этой проблемы постоянно разрабатываются и совершенствуются хирургические методы гемостаза при операции кесарева сечения (КС), позволяющие снизить объем кровопотери. На это же направлены исследования новых факторов риска, эффективности про филактического применения транексамовой кислоты и раз личных утеротоников [3, 4]. Продолжаются исследования по выбору безопасных и эффективных профилактических доз окситоцина и карбетоцина не только в плане коррекции гемодинамических нарушений, но и снижения объема интра операционной кровопотери [5, 6]. Несмотря на все достижения и порой кажущиеся успехи, массивные послеродовые кровотечения продолжают и сегодня оставаться глобальным вызовом современному акушерству, анестезиологии и интенсивной терапии. Поэтому не теряет своей актуальности дальнейший поиск средств профилактики и лечения атонических кровотечений во время операции КС.
Цель исследования.
Оценить эффективность и безопасность применения терлипрессина в качестве средства профилактики развития послеродовых кровотечений во время операции кесарева сечения у беременных высокой группы риска.
Пациенты и методы
Дизайн исследования был разработан и утвержден научным комитетом Ассоциации акушерских анестезиологов реаниматологов. С февраля по декабрь 2021 г. проведено многоцентровое всенаправленное когортное исследование TerliBleed, в котором приняли участие 5 медицинских центров: Красноярский краевой клинический центр охраны материнства и детства; Алтайский краевой клинический пери натальный ; Кузбасская областная детская клиническая больница; Воронежская городская клиническая больница скорой медицинской помощи №8; Перинатальный центр при городской клинической больнице №24 Департамента здравоохранения города Москвы. Сбор и регистрация клинических данных проводились проспективно и ретроспективно. Были получены согласия этических комитетов непосредственно в каждой клинике, где проводилось исследование. Использование терлипрессина не противоречило его инструкции по медицинскому применению, согласно которой показаниями к применению препарата являются: кровотечения во время хирургических вмешательств на органах брюшной полости и малого таза, маточных кровотечениях, в том числе в родах и при прерывании беременности [7]. Нашими воронежскими коллегами также был получен патент RU 2 709 819 C1 «Способ уменьшения кровопотери при оперативном родоразрешении у родильниц высоких групп риска», с использованием терлипрессина в мышечную ткань матки [8]. В исследовании приняли участие 454 беременные женщины с высокими факторами риска по развитию кровотечения, такими как [9]:
1) нарушение сократительной способности матки (атония, паритет родов более 4);
2) многоплодная беременность, многоводие, крупный плод;
3) миома матки с узлом/узлами больших размеров (>5 см);
4) аномальная плацентация (МКБ О43, О44) – предлежание, врастание, плотное прикрепление плаценты.
Все женщины были родоразрешены путем операции КС. Операции были выполнены в условиях как регионарной, так и общей анестезии. Оценка объема кровопотери проводи лась гравиметрическим методом, путем прямого сбора крови в градуированные емкости, совместно с взвешиванием пропитанных кровью салфеток и операционного белья. Контроль измеряемых параметров проводился трижды: за 24 ч до операции, сразу после операции и на следующий день через 24 ч после КС.
Критерии включения: беременные женщины с высокими факторами риска по развитию массивных и тяжелых после родовых кровотечений, которым выполнена операция КС в плановом или в экстренном порядке, в возрасте от 18 до 49 лет, паритет и срок гестации – без ограничений, отсутствие непереносимости терлипрессина.
Критерии исключения: наличие онкологических заболеваний, туберкулеза, тяжелой соматической патологии в стадии декомпенсации, ментальных и психических расстройств, затрудняющих продуктивный контакт, хронического алкоголизма и наркомании по шкале ASA 4, 5, 6й степени, наличие противопоказаний к применению препарата терлипрессин.
Женщины были поделены на 2 группы: контрольная группа (группа I), включившая 351 пациентку, получавших стандартную профилактику кровотечений соответственно клиническим рекомендациям [9], и исследуемая группа (группа II), состоявшая из 103 пациенток, получивших, кроме стандарт ной профилактики, дополнительно препарат терлипрессин (Реместип®, Ferring Company, Берлин, Германия) после извлечения плода и пересечения пуповины. Терлипрессин вводился в место разреза на матке – в толщу миометрия, в дозе до 0,4 мг, разведенной до 10 мл 0,9%м раствором хлорида натрия [8].
Для оценки профилактического эффекта препарата терлипрессин были определены множественные первичные конечные точки, которые позволяют оценить препарат по нескольким важнейшим направлениям: объем послеродовой кровопотери; необходимость проведения дополни тельных методов хирургического гемостаза; необходимость проведения гистерэктомии; необходимость введения утеротоников второй линии; необходимость проведения релапаротомии.
Вторичные конечные точки определялись с целью всесторонне оценить безопасность местного применения препарата терлипрессин в указанной популяции беременных жен щин при операции КС. В связи с этим оценка безопасности применения препарата также была разделена на несколько значимых направлений: острая дыхательная недостаточ ность (в том числе показания к искусственной вентиляции легких (ИВЛ)); острое повреждение почек; неврологические осложнения; осложнения со стороны печени; полиорганная недостаточность; побочные эффекты.
Методы статистики, использованные для анализа данных, включали: методы описательной статистики (расчет сред них, стандартных отклонений для числовых показателей, абсолютных и относительных частот для бинарных и категориальных переменных); Ткритерий Стьюдента для проверки гипотезы о различии средних двух независимых выборок; критерий c2 и точный критерий Фишера для проверки различия частот и распределений частот бинарных и категориальных показателей. Уровень значимости для принятия статистической гипотезы о достоверности различия принят равным 0,05 (р < 0,05) при мощности критерия 0,80. Подготовка данных к анализу и статистическая обработка проводилась с помощью программных пакетов Microsoft® EXCEL® 2010 Proofing Tools и STATISTICA 12, а также стандартных библиотек программной среды R.
Результаты исследования и их обсуждение
Проводя сравнительную оценку антропометрических данных, не было получено статистически значимого различия между группами I и II по возрасту, росту, весу и индексу массы тела (ИМТ). Однако различие средних значений срока гестации было статистически значимо (р = 0,007): в контрольной группе средний срок гестации составил 36 нед., тогда как в исследуемой группе был на неделю больше (табл. 1). По нашему мнению, это различие не имеет практического значения.
Высокий паритет является одним из значимых факторов риска развития послеродовых кровотечений. Влияние этого фактора риска значительно усиливается c неуклонным ростом частоты операции КС [10].
Группы I и II были сопоставимы по частоте предшествующих операций КС (р = 0,118) (табл. 2). Однако наличие кровопотери в предшествующих родах в исследуемой группе более чем в 2 раза выше по сравнению с контрольной группой: 8,7% против 3,7%, если вычислять частоты ко всем пациенткам группы (р = 0,038). Если же исключить из рас четов пациенток, у которых не было предшествующих родов, то соотношение частот между группами будет 12,9% (9/70) и 5,2% (13/262). Таким образом, частота патологиче ских кровопотери во время предыдущих родов в исследуемой группе почти в 2,5 раза выше, чем контрольной группе, различие статистически значимо (р = 0,023). Эти результаты нашего анализа говорят о том, что большинство участников исследования использовали введение терлипрессина у пациенток с более высокой степенью риска по развитию массивного послеродового кровотечения.
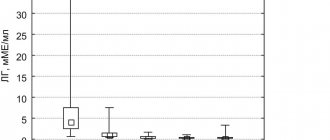
Анализ частоты встречаемости наличия врожденных дефектов гемостаза показал близко подошедшую к порогу статистической значимости рассчитанную вероятность р. В исследуемой группе частота выше, чем в контрольной группе, почти в 5 раз (2,9% против 0,6%, р = 0,054). Частота данной патологии в целом очень низкая в популяции, и для более определенного решения о достоверности различия необходима выборка значительно большего объема. Однако следует отметить эту тенденцию уже на данной выборке (рис. 1).
Частота различной экстрагенитальной патологии в группе II более чем в 2,5 раза превосходила таковую в контрольной группе (45,63% против 17,4% соответственно, р = 0,0001).
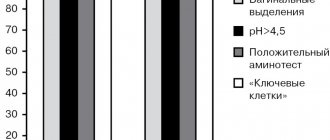
По результатам анализа частоты встречаемости акушерских факторов риска развития кровотечения статистически значимыми являлись такие показатели, как многоплодная беременность, крупный плод, врастание плаценты, миома матки >5 см. В контрольной группе чаще встречались такие патологии, как многоплодная беременность (33,9% против 21,4%) и крупной плод (20,5% против 10,7%). С другой стороны, в исследуемой группе в 2 раза чаще встречалась более грозная патология, такая как врастание плаценты (15,5% против 7,4%), которая с большей вероятностью увеличивает риск развития массивных кровотечений, угрожающих жизни [10, 11].
Результаты сравнения частоты встречаемости акушерских факторов риска между группами представлены на рис. 2.
На основании полученных результатов мы предполагаем, что в исследуемой группе пациентки имели более высокий риск развития послеродового кровотечения. В данном случае это трудно подвергнуть сомнению, так как частота факторов риска, особенно таких серьезных, как placenta accreta, наличие врожденных дефектов системы гемостаза и патологическая кровопотеря во время предыдущих родов являются значимыми факторами риска [10, 12]. Возможно, что данный факт из анамнеза, а также наличие экстрагенитальной патологии и высоких факторов риска повлияли на решение наших коллег при отборе пациенток, которые вошли в исследуемую группу. В результате это привело к тому, что в большинстве центров в группу пациенток, получивших терлипрессин, подбирались пациенты с заведомо более зна чимыми факторами риска. Мы отдаем себе отчет в том, что это является одним из ограничений нашего исследования. Но на данном этапе нам не представлялось возможным по этическим соображениям сделать дизайн исследования более строгим или же прибегнуть к различным вариантам «ослепления». Кроме того, во всех случаях решение о применении с целью профилактики терлипрессина принималось анестезиолого-мреаниматологом совместно с оперирующем акушеромгинекологом на основании коллегиальной, комплексной оценки риска развития кровотечения.
Терлипрессин является эффективным препаратом при лечении и профилактики кровотечений желудочнокишечного тракта, во время операций на печени и органах малого таза [13–15]. Что касается акушерства, то на сегодняшний день терлипрессин практически не изучен, есть лишь единичные работы, посвященные этому вопросу [16]. На наш взгляд, представляет несомненный интерес вазопрессорный эффект препарата [15], который может воздействовать на сосуды матки, сужая их, и тем самым способствовать раз витию первичного гемостаза. Терлипрессин (Nтриглицил8 лизин вазопрессин) является синтетическим аналогом вазопрессина, гормоназаднейдолигипофиза. Фармакологическое действие терлипрессина связано с его активными метабо литами, в том числе лизинвазопрессином, который преимущественно воздействует на рецепторы V1, находящиеся в гладкой мускулатуре сосудов разного калибра [15, 17]. Такого типа рецепторы были обнаружены и на тромбоцитах: воздействуя на них, вазопрессин и его аналоги способны увеличивать их агрегационную способность [18]. Также имеются работы, показывающие сходство строения молекул терлипрессина и окситоцина и перекрестное воздействие этих препаратов на одноименные рецепторы, за счет чего может дополнительно усиливаться тонус гладкой мускулатуры матки [19].
Оценивая изучаемые параметры при операции КС в данном исследовании, следует отметить, что их частота не имела статистически значимых различий между группами I и II (табл. 3). Однако обращает на себя внимание более частое выполнение различных дополнительных мер хирургического гемостаза в контрольной группе. Так, перевязка маточных артерий в группе I проводилась в 10,5% случаев, в группе II – в 7,8%, наложение компрессионных швов на матку – в 13,1 и 7,8% соответственно, применение баллонной тампонады матки – в 2,3% и 0% соответственно. Наиболее значимый фактор, указывающий на массивную и неуправляемую кровопотерю, такой как выполнение гистерэктомии, чаще отмечался в контрольной группе – 9 (2,6%) случаев, чем в иссле дуемой группе – 2 (1,9%), хотя и не достиг статистической значимости. Проведение релапаротомий, при неэффективности первичного гемостаза, также чаще наблюдалось в контрольной группе (5 случаев, 1,4%), чем в группе II (1 случай, 1%) (табл. 3).
При этом у одной пациентки могло применяться несколько дополнительных методов хирургического гемостаза во время операции КС. Их сравнение и частота между группами представлены на рис. 3.
Анализируя частоту встречаемости различных методов гемостаза во время операции КС, можно заметить, что почти у 2/3 пациенток в исследуемой группе не применялись никакие дополнительные меры по устранению кровотечения, тогда как в контрольной группе таких пациенток было чуть более половины. Также по одному дополнительному методу гемостаза, примененного в контрольной группе, про водилось у трети пациенток, тогда как в исследуемой группе доля таких пациенток меньше. По два и более метода хирургического гемостаза во время КС проведено у 8,8% пациенток в исследуемой группе, а в контрольной группе несколько больше – у 10,9%. Эти различия складываются в картину, позволяющую предположить, что в исследуемой группе проблем при операции КС было несколько меньше, чем в контрольной группе. Необходимо дальнейшее изучение этого вопроса, чтобы уточнить, так ли это и какие факторы, кроме применения терлипрессина, могли повлиять на такое рас пределение частот.
Самым важным показателем эффективности профилактики послеродовых кровотечений, конечно же, являются различия в объеме кровопотери между исследуемыми группами. При оценке данных показателей не достигнуто статистически значимого различия (табл. 4).
Различие частоты патологических и массивных кровопотерь (>1000 мл) между группами I и II на данной выборке не достигло статистической значимости.
Из-за сильно скошенного влево распределения и больших выбросов объема кровопотери средние значения не улавливают различия между группами I и II (табл. 5), однако медианы в общей выборке различаются и критерий Манна– Уитни указывает на статистически значимое различие распределения объема кровопотери между группами (р = 0,002). Распределение объема кровопотери в нашем исследовании наглядно видно на диаграмме (рис. 4). Можно отметить существенный разброс данных и максимальные показатели в контрольной группе. Так, в контрольной группе максимальная кровопотеря составила 10000 мл, а в исследуемой в два раза меньше – 4500 мл.
Анализируя данные показатели, сложно сделать однозначные выводы об эффективности терлипрессина в группах сравнения в части профилактики патологической кровопотери. Тем не менее, оценивая медиану и интерквартильный интервал объема кровопотери, можно отметить более низкие показатели кровопотери в исследуемой группе с применением терлипрессина. Можно предположить, что, если выделить одинаковые факторы риска, основную патологию, данные показатели могут меняться.
Второй, не менее важной, целью исследования была все сторонняя оценка безопасности применения препарата терлипрессина в акушерской практике.
Местное применение терлипрессина выбрано с целью уменьшения системного воздействия препарата на организм, тем самым минимизации его неблагоприятного воздействия. Учитывая то, что терлипрессин является мощным вазопрессором, при внутривенном введении он вызывает системное сокращения гладкой мускулатуры сосудов и вну тренних органов, что приводит к повышению общего периферического сосудистого сопротивления [8]. Клинически это может проявиться подъемом артериального давления, тахи или брадикардией, головной болью. Также описаны клинические случаи с развитием некроза кожи на фоне примене ния терлипрессина [20]. Все эти побочные эффекты были описаны в литературе при внутривенном введении препарата. В инструкции по применению препарата допускается его местное применение, пара и/или интрацервикально в дозе 4 мл (0,4 мг) с разведением до 10 мл 0,9%м раствором натрия хлорида [7].
Практически все отмеченные осложнения в исследовании имеют низкую частоту встречаемости в популяции, поэтому на данной выборке с объемом в несколько сотен пациенток большинство осложнений не проявилось совсем, а те немногие, что были зарегистрированы, встречались в единичных случаях, что не позволило адекватно провести сравнительный анализ частот осложнений между группами (табл. 6).
В контрольной группе у 7 пациенток отмечено повышение активности печеночных ферментов и у 3 – снижение диуреза <0,5 мл\кг\ч, тогда как в исследуемой группе этих осложнений не зарегистрировано, однако различие было статистически незначимо. Остальные осложнения либо отсутствовали в обеих группах, либо имели сопоставимую относительную частоту.
Хочется отметить отсутствие тяжелых осложнений в виде летальных исходов и тяжелых органных повреждений в обеих группах. Также в группе с терлипрессином не отмечено каких-либо осложнений, связанных с местным применением препарата в толщу миометрия. Полученные нами результаты совпадают с данными ряда работ, посвященных применению терлипрессина в акушерстве и гинекологии [16, 21, 22].
Заключение
Проводя сравнительный статистический анализ частоты факторов риска, акушерского анамнеза и коморбидности сравниваемых групп, мы обнаружили, что в исследуемой группе с применением терлипрессина пациентки оказались более тяжелыми и угрожаемыми по развитию патологических и массивных кровотечений. Предположительно это связано с принципом отбора пациенток, так как в некоторых центрах терлипрессин применялся у пациенток с наивысшей угрозой кровотечения как дополнительный метод профилактики, а в некоторых случаях и для лечения кровотечения у пациенток высокой группы риска, после чего пациенток включали в исследование. Поэтому мы считаем, что необходимо продолжить проведение дополнительных проспективных исследований с более строгим подбором пациенток и достаточным объемом выборки и рандомизированным распределением пациенток на группы. Возможно, что для этого будет полезно исследование с формированием выборки методом подбора пар соответствия.
Вместе с тем необходимо отметить, что, несмотря на вышесказанное, использование терлипрессина позволило статистически значимо снизить объем кровопотери и частоту дополнительных методов хирургического гемостаза, таких как перевязка маточных артерий, компрессионные швы на матку, баллонная тампонада матки. Особенно важным является то, что использование терлипрессина позволило снизить число гистерэктомий как последнего метода хирургической остановки кровотечения и количество релапаротомий.
Результаты нашего исследования показали, что при местном применении терлипрессина не отмечалось системных либо побочных эффектов и отрицательных проявлений действия препарата.
Информация о финансировании Финансирование данной работы не проводилось. Financial support
No financial support has been provided for this work.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests
The authors declare that there is no conflict of interest.
Информированное согласие
При проведении исследования было получено информированное согласие пациентов.
Informed consent
In carrying out the study, written informed consent was obtained from all patients
Литература
1. Hawkins SS, Ghiani M, Harper S, Baum CF, Kaufman JS. Impact of State-Level Changes on Maternal Mortality: A Population-Based, Quasi-Experimental Study. Am J Prev Med. 2021 Feb;58(2):165-174. DOI: 10.1016/j.amepre.2019.09.012
2. Коноплянников АГ, Михалёва ЛМ, Оленев АС, Кудрявцева ЯЮ, Сонголова ЕН, Грачева НА, и др. Анализ структуры материнской смертности. Вопросы гине- кологии, акушерства и перинатологии. 2020;19(3):133-138. DOI: 10.20953/ 1726-1678-2020-3-133-138
3. Franchini M, Mengoli C, Cruciani M, Bergamini V, Presti F, Marano G, et al. Safety and efficacy of tranexamic acid for prevention of obstetric haemorrhage: an updated systematic review and meta-analysis. Blood Transfus. 2021 Jul; 16(4):329-337. DOI: 10.2450/2018.0026-18
4. Onwochei DN, Owolabi A, Singh PM, Monks DT. Carbetocin compared with oxytocin in non-elective Cesarean delivery: a systematic review, meta-analysis, and trial sequential analysis of randomized-controlled trials. Can J Anaesth. 2020 Nov;67(11):1524-1534 DOI: 10.1007/s12630-020-01779-1 (In English).
5. Дегтярёв ЕН, Шифман ЕМ, Тихова ГП, Куликов АВ. Влияние дозы окситоцина на изменение сегмента ST, артериальную гипотонию и величину кровопоте- ри у рожениц разных возрастных групп во время операции кесарева сечения. Вестник интенсивной терапии им. А.И.Салтанова. 2018;3:77-87. DOI: 10.21320/ 1818-474X-2018-3-77-86
6. Дегтярёв ЕН, Шифман ЕМ, Тихова ГП, Куликов АВ, Жуковец ИВ. Влияние дозы окситоцина на объем интраоперационной кровопотери во время операции кесарева сечения. Вопросы гинекологии, акушерства и перинатологии. 2018;17(6):51-56. DOI: 10.20953/1726-1678-2018-6-51-56
7. Инструкция по медицинскому применению препарата Терлипрессин, компа- ния Ферринг-Лечива А.С. Адрес: https://grls.rosminzdrav.ru/Grls_View_v2. aspx?routingGuid=b101de51-90de-409b-9f78-09f6aa529149&t=
8. Патент на внутриматочное введение Реместипа. Адрес: https://new.fips.ru/ registers-doc-view/fips_servlet?DB=RUPAT&DocNumber=0002709819&TypeFile=html
9. Шифман ЕМ, Куликов АВ, Роненсон АМ, Абазова ИС, Адамян ЛВ, Андреева МД, и др. Профилактика, алгоритм ведения, анестезия и интенсив- ная терапия при послеродовых кровотечениях. Клинические рекомендации. Вестник интенсивной терапии им. А.И.Салтанова. 2019;3:9-33. DOI: 10.21320/ 1818-474X-2019-3-9-33
10. Kong CW, To WWK. Risk factors for severe postpartum haemorrhage during caesarean section for placenta praevia. J Obstet Gynaecol. 2021 May;40(4): 479-484. DOI: 10.1080/01443615.2019.1631769
11. Давыдов АИ, Стрижаков АН, Новрузова НХ. Осложнения оперативной гистероскопии: профилактика и лечение. Вопросы гинекологии, акушерства и перинатологии. 2016;15(6):52-60. DOI: 10.20953/1726-1678-2016-6-52-60
12. Davey MA, Flood M, Pollock W, Cullinane F, McDonald S. Risk factors for severe postpartum haemorrhage: A population-based retrospective cohort study. Aust N Z J Obstet Gynaecol. 2020 Aug;60(4):522-532. DOI: 10.1111/ajo.13099
13. Zhou X, Tripathi D, Song T, Shao L, Han B, Zhu J, et al. Terlipressin for the treatment of acute variceal bleeding: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore). 2021 Nov;97(48):e13437. DOI: 10.1097/MD.0000000000013437
14. Abbas MS, Mohamed KS, Ibraheim OA, Taha AM, Ibraheem TM, Fadel BA, et al. Effects of terlipressin infusion on blood loss and transfusion needs during liver resection: A randomised trial. Acta Anaesthesiol Scand. 2021 Jan;63(1):34-39. DOI: 10.1111/aas.13226
15. Morelli A, Ertmer C, Rehberg S, Lange M, Orecchioni A, Cecchini V, et al. Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP)
16. Александрович ЮС, Ростовцев АВ, Кононова ЕС, Пшениснов КВ, Акименко ТИ. Эффективность низких доз терлипрессина для профилактики интраоперационной кровопотери в акушерстве. Вестник анестезиологии и реаниматологии. 2020;17(4):78-84. DOI: 10.21292/2078-5658-2020-17-4-78-84
17. Manning M, Stoev S, Chini B, Durroux T, Mouillac B, Guillon G. Peptide and non- peptide agonists and antagonists for the vasopressin and oxytocin V1a, V1b, V2 and OT receptors: research tools and potential therapeutic agents. Prog Brain Res. 2008;170:473-512. DOI: 10.1016/S0079-6123(08)00437-8
18. Inaba K, Umeda Y, Yamane Y, Urakami M, Inada M. Characterization of human platelet vasopressin receptor and the relation between vasopressin-induced platelet aggregation and vasopressin binding to platelets. Clin Endocrinol (Oxf). 1988 Oct;29(4):377-86. DOI: 10.1111/j.1365-2265.1988.tb02886.x
19. Manning M, Misicka A, Olma A, Bankowski K, Stoev S, Chini B, et al. Oxytocin and vasopressin agonists and antagonists as research tools and potential therapeutics. J Neuroendocrinol. 2012 Apr;24(4):609-28. DOI: 10.1111/j.1365-2826.2012. 02303.x
20. Busta Nistal MR, Mora Cuadrado N, Fernández Salazar L. Ischemic skin necrosis secondary to the use of terlipressin. Rev Esp Enferm Dig. 2021 Dec 3. DOI: 10.17235/reed.2020.7467/2020
21. Брюннлер Т, Мандрака Ф, Ланггартнер Ю. Терлипрессин: клиническое применение, рациональное дозирование, сравнение эффективности различных режимов введения. Здоров’я України. 2010;2(13):3.
22. Rundqvist E, Allen D, Larsson G. Comparison between lysine vasopressin and a long-acting analogue (N alpha-triglycyl-lysine vasopressin) used as local hemostatic agents for conization. Acta Obstet Gynecol Scand. 1988;67(4):301-5
Информация о соавторах:
Шифман Ефим Муневич, доктор медицинских наук, профессор, заведующий кафедрой анестезиологии и реаниматологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского; президент Ассоциации акушерских анестезиологов-реаниматологов; заслуженный врач Республики Карелия; эксперт по анестезиологии и реаниматологии Федеральной службы по надзору в сфере здравоохранения Адрес: 129110, Москва, ул. Щепкина, 61/2 Телефон: (495) 6816000 Email ORCID: 0000000261138498
Белинина Антонина Анатольевна, кандидат медицинских наук, заместитель главного врача Алтайского краевого клинического перинатального центра Адрес: 656047, Барнаул, ул. Фомина, 154 Телефон: (385) 2569381 Email ORCID: 000000021038366
Ростовцев Андрей Викторович, заведующий отделением анестезиологии реанимации Воронежской городской клинической больницы скорой медицинской помощи №8; главный внештатный анестезиолог-реаниматолог по профилю «Акушерство и гинекология» Воронежской области Адрес: 394008, Воронеж, ул. Ростовская, 90 Телефон: (920) 2116116 Email ORCID: 000000030375752X
Артымук Наталья Владимировна, доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии им. проф. Г.А. Ушаковой Кемеровского государственного медицинского университета Адрес: 650056, Кемерово, ул. Ворошилова, 22а Телефон: (960) 9233355 Email ORCID: 0000000170146492
Оленев Антон Сергеевич, кандидат медицинских наук, заместитель главного врача по медицинской части, заведующий филиалом Перинатальный , доцент кафедры акушерства и гинекологии с курсом перинатологии Медицинского института РУДН, главный внештатный специалист по акушерству и гинекологии Департамента здравоохранения г. Москвы Адрес: 127287, Москва, 4й Вятский пер., 39 Телефон: (495) 6134509 Email ORCID: 0000000196326731
Александрович Юрий Станиславович, доктор медицинских наук, заведующий кафедрой анестезиологии, реаниматологии и неотложной педиатрии факультета послевузовского и дополнительного профессионального образования Санкт-Петербургского государственного педиатрического медицинского университета Адрес: 194100, Санкт-Петербург, ул. Литовская, 2А Телефон: (921) 5898126 Email ORCID 0000000221314813
Цхай Виталий Борисович, доктор медицинских наук, заведующий кафедрой перинатологии акушерства и гинекологии лечебного факультета Красноярского государственного медицинского университета им. проф. В.Ф.ВойноЯсенецкого; руководитель по акушерству и гинекологии Центра здоровья супружеской пары Федерального медико-биологического агентства России Адрес: 660022, Красноярск, ул. П.Железняка, 1 Телефон: (391) 2653584 Email ORCID: 000000032283884
Новикова Оксана Николаевна, доктор медицинских наук, доцент, профессор кафедры акушерства и гинекологии им. проф. Г.А. Ушаковой Кемеровского государственного медицинского университета Адрес: 650059, Кемерово, ул. Ворошилова, 22А Телефон: (384) 2533016 Email ORCID 0000000155701988
Тактика ведения пациенток с обширным акушерским кровотечением до перипартальной гистерэктомии и исходы в девяти Европейских странах
Целью
этого исследования было сравнить стратегии ведения в случае акушерского кровотечения, ведущего к гистерэктомии в 9 европейских странах участников INOSS и описать исходы для матерей и новорожденных после перипартальной гистерэктомии.
Материал и методы.
Мы объединили данные девяти общенациональных или мультирегиональных акушерских исследований, проведенных в Бельгии, Дании, Финляндии, Франции, Италии, Нидерландах, Словакии, Швеции и Великобритании в период с 2004 по 2021 гг. Гистерэктомии выполнены в сроки от 22 гестационных недель до 48 ч послеродового периода. Учитывали частоту материнской смертности, осложнения после гистерэктомии и неблагоприятные неонатальные исходы (мертворождение или неонатальная смертность).
Результаты.
В исследование были включены 1302 женщины. Применение утеротоников было самым низким в Словакии (48/73, 66%) и самым высоким в Дании (25/27, 93%), использование внутриматочного баллона было самым низким в Словакии (1/72,1%) и самым высоким в Дании (11/27, 41%), а интервенционная радиология варьировала от 0/27 в Дании и Словакии до 11/59 (79%) в Бельгии. У женщин с приращением плаценты применение утеротоников было самым низким в Финляндии (5/16, 31%) и самым высоким в Великобритании (84/103, 82%), использование внутриматочного баллона варьировалось от 0/14 в Бельгии и Словакии до 29/103 (28%) в Великобритании. Интервенционная радиология была самой низкой в Дании (0/16) и самой высокой в Финляндии (9/15, 60%). Материнская смертность составила 14/1226 (1%), наиболее частыми осложнениями были гематологические (95/1202, 8%) и респиратор ные (81/1101, 7%). Осложнения у новорожденных наблюдались в 79 (6%).
Заключение.
Методы лечения акушерских кровотечений у женщин, которым в конечном итоге была сделана перипартальная гистерэктомия, сильно различались в этих девяти европейских странах. Эта потенциально спасающая жизнь операция сопряжена со значительными неблагоприятными исходами для матери и новорожденного.
Kallianidis AF, Maraschini A, Danis J et al. INOSS (the International Network of Obstetric Survey Systems).
Management of major obstetric hemorrhage prior to peripartum hysterectomy and outcomes across nine European countries.
Acta Obstet Gynecol Scand. 2021 Mar 14. doi: 10.1111/aogs.14113. Department of Obstetrics and Gynecology, Leiden University Medical Center, Leiden, the Netherlands
Применение препарата Глипрессин
Растворить порошок при помощи введения во флакон прилагаемого растворителя. Вначале вводят в/в медленно 1–2 мг Глипрессина (1–2 флакона). Поддерживающая доза — 1 мг (1 флакон) каждые 4–6 ч. Суточная доза Глипрессина, как правило, составляет 120–150 мкг/кг массы тела; для взрослых с массой тела 70 кг — 8–9 мг/сут, вводимые с 4-часовыми интервалами. Дальнейшее разведение препарата можно осуществлять путем добавления 0,9% р-ра натрия хлорида до 10 мл. Глипрессин применяют лишь при постоянном кардиомониторировании (АД, ЧСС, водный баланс) в условиях блока интенсивной терапии. Препарат можно применять на догоспитальном этапе в качестве первой неотложной помощи при подозрении на кровотечение. При применении препарата необходимо постоянное наблюдение на предмет возникновения признаков гиповолемии. При необходимости терапия препаратом может длиться 2–3 дня.
Побочные эффекты препарата Глипрессин
бледность кожных покровов, умеренное или значительное (при АГ (артериальная гипертензия)) повышение АД, аритмия, брадикардия, а также развитие острой коронарной недостаточности. В отдельных случаях отмечали головную боль, локальный некроз. Терлипрессин может усиливать перистальтику ЖКТ ввиду стимулирующего действия на гладкие мышцы, что проявляется болью в животе, тошнотой, диареей. В отдельных случаях бронхоспазм может стать причиной одышки. Сокращение мышц матки может вызвать нарушение кровообращения в эндометрии и миометрии. Возможны единичные случаи гипонатриемии и гипокалиемии, особенно при изначально нарушенном водном балансе.
Особые указания по применению препарата Глипрессин
С осторожностью, при наличии мониторинга, применяют Глипрессин при следующих состояниях и заболеваниях: БА, АГ (артериальная гипертензия), поражение сердца и сосудов (генерализованный атеросклероз, заболевания сердца, коронарная недостаточность, аритмия), почечная недостаточность. Период беременности и кормления грудью. Применение Глипрессина противопоказано ввиду возможной мальформации органов плода, спонтанного аборта. На период применения препарата прекращают кормление грудью. Дети. Нет опыта применения Глипрессина у детей, поэтому не следует применять препарат в педиатрической практике. Не влияет на скорость реакции при управлении транспортными средствами или работе с механизмами.
Взаимодействия препарата Реместип
Вазоконстрикторный эффект и стимулирующее влияние на тонус миометрия усиливаются при сочетанном применении с окситоцином и метилэргометрином. Реместип потенцирует действие неселективных блокаторов β-адренорецепторов в отношении снижения давления в системе воротной вены. Сочетанное применение с препаратами, снижающими ЧСС, может быть причиной тяжелой брадикардии. Препарат не следует смешивать в одном шприце с другими лекарственными средствами. Применять только рекомендуемые растворители.