Несмотря на очевидный прогресс в культурной и социальной сферах человека, паразитарные заболевания кожи по-прежнему являются актуальной проблемой дерматологии. Наиболее часто врачу приходится сталкиваться с заболеваниями, вызываемыми клещами. Паразиты для хозяина являются чужеродными организмами, выделяющими различные вещества, в ответ на которые развиваются соответствующие реакции: клеточные (пролиферация и гипертрофия), тканевые (воспаление — сосудистая реакция, экссудация, отек, инфильтрация), а также системные гуморальные (иммунные) изменения. Паразитарные болезни кожи подразделяются на поверхностные (локализация на поверхности и внутри эпидермиса) и глубокие (дерма, подкожно-жировая клетчатка). Наиболее распространенными паразитарными заболеваниями кожи являются чесотка и демодекоз.
Демодекоз — часто встречающаяся патология у человека и животных, вызванная клещами рода Demodex.
В общей структуре заболеваний кожи демодекоз составляет 2,9 %, а в структуре акнеформных дерматозов — 10,5 %. В настоящее время из 65 видов и нескольких подвидов демодекса у людей обнаруживаются только два:
Demodex folliсulorum и Demodex brevis.
Каждый вид и подвид демодекса строго специфичен для своего хозяина. Клещ железница
(Demodex folliсulorum)
встречается наиболее часто, обнаруживается только у человека в волосяных фолликулах, сальных железах, вне хозяина его размножение прекращается [7]. Клещ жизнеспособен и вне хозяина при постоянной влажности и комнатной температуре в темноте до 9 сут. Оптимальная температура для развития клеща — 30–40 °С, при температуре 14 °С клещи находятся в состоянии оцепенения, а при 52 °С быстро погибают. В воде насекомые могут жить до 25 дней, при сухом воздухе погибают через 1,5 дня. Самая благоприятная питательная среда для демодекса — растительное масло, жир, вазелин. Клещи имеют размеры 0,3–0,4 мм. В полости волосяного фолликула самки откладывают яйца, из которых через 60 ч вылупляется личинка, которая неподвижна и постоянно питается. Через 40 ч личинка превращается в нимфу 1, которая также малоподвижна и остается в фолликуле. Спустя 72 ч происходит превращение в нимфу 2, подвижную, перемещающуюся по кожным покровам, и через 60 ч — превращение во взрослую особь. Взрослая особь вновь попадает в фолликул и после откладывания яиц погибает. Жизненный цикл клеща составляет около 15 сут. [4].
Если в организме хозяина имеются какие-либо патологические процессы — нейроэндокринные, желудочно-кишечные, психические, иммунные, а также при наличии очагов хронической инфекции происходит сенсибилизация организма к клещу. В этой ситуации демодекс представляет собой химический, механический раздражитель, способствующий развитию и поддержанию патологического процесса. Кроме этого, нарушается симбиоз с коринебактериями и условно-патогенной флорой, что также является пусковым фактором для развития заболевания. Возможно также бессимптомное носительство клеща при отсутствии патологии кожи. Наибольшая активность демодекса на коже человека наблюдается в весенне-осенний период, что связано с повышенной инсоляцией, изменением температуры окружающей среды, иммунными и эндокринными изменениями. Наиболее часто клещ обнаруживается в области носогубной складки, щек, носа, подбородка, достаточно редко — в области шеи и очень редко — в области спины и груди.
Клинические проявления демодекоза разнообразны. Существуют кожные и глазные проявления заболевания. Необходимо различать непосредственно демодекоз и заболевания, течение которых усугубляет наличие клещей. Наиболее распространенные заболевания представлены в табл. 1.
Для выбора терапии имеют значение клиническая картина заболевания, наличие форм клещей, их количество. Необходимо также учитывать имеющуюся у пациента сопутствующую патологию. Для воздействия непосредственно на клещей демодекс применяются акарицидные средства,
к которым относятся производные нитроимидазольной группы. До последнего времени наиболее эффективным средством из этой группы считался метронидазол, применяемый от 4 до 6 нед. [3, 8, 9]. О механизме действия препарата нет единого мнения. До сих пор не ясно, какое из его фармакодинамических свойств играет ведущую роль в достижении клинического эффекта при лечении демодекоза. Установлено, что метронидазол усиливает защитные и регенераторные функции слизистой оболочки желудка и кишечника [1, 2] и оказывает выраженное противоотечное действие [14]. Препарат дает бактериостатический эффект в отношении грамотрицательных анаэробных палочек [16], а также антипаразитарный — в отношении
Demodex folliculorum
[1]. В экспериментальных и клинических исследованиях показано супрессивное действие препарата на некоторые показатели клеточного иммунитета, отмечено также подавление хемотаксиса лейкоцитов [13, 15].
В целом препарат переносится хорошо, однако в процессе терапии возможны побочные явления: головная боль, тошнота, рвота, сухость во рту, крапивница, кожный зуд, лейкопения, кандидоз. Кроме того, в последние годы значительно чаще стали констатировать случаи неудач в лечении демодекоза метронидазолом. Не исключено, что неудачи терапии могут быть связаны с возникновением устойчивости бактериально-паразитарной флоры к метронидазолу, применяемому более 40 лет.
В последнее время появились сообщения об эффективном лечении розовых угрей и демодекоза относительно новым производным нитроимидазола — орнидазолом: a-(chlorome-thyl)-2-methyl-5-nitroimidazole-1-ethanol [12]. Отмечено не только противопаразитарное действие препарата, но и бактериостатическое, повышающее активность нейтрофилов, стимулирующее адренергические структуры, усиление репаративных процессов [2].
Цель работы:
определение эффективности применения орнидазола в комплексном лечении демодекоза.
Фармакологические свойства препарата Орнидазол
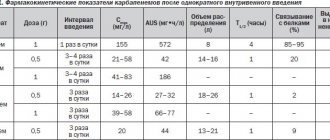
Орнидазол — производное имидазола, активен в отношении Trichomonas vaginalis, Entamoeba histolytica, Giardia lamblia (Giardia intestinalis), а также некоторых анаэробных бактерий, таких как Bacteroides и Clostridium spp., Fusobacterium spp., и анаэробных кокков. После перорального приема 90% орнидазола быстро всасывается. Максимальная концентрация в плазме крови достигается в течение 3 ч. Связывание орнидазола с белками плазмы крови составляет около 13%. В зависимости от режима дозирования оптимальная концентрация активного вещества в плазме крови колеблется от 6 до 36 мкг/л. Очень хорошо проникает в СМЖ, другие биологические жидкости и в ткани организма. Период полувыведения составляет около 13 ч. После однократного приема орнидазола 85% дозы выводится в течение первых 5 дней. Выведение происходит главным образом с мочой (63%) и калом (22%). Около 4% принятой дозы выделяется почками в неизмененном виде.
Применение препарата Орнидазол
Внутрь, после еды. При трихомониазе назначают по 500 мг 2 раза в сутки (утром и вечером) в течение 5 дней. Чтобы устранить возможность повторного заражения, половой партнер должен пройти такой же курс лечения. Суточная доза для детей составляет 25 мг/кг в 1 прием. При амебиазе возможны следующие схемы лечения: 3-дневный курс лечения больных с амебной дизентерией и 5–10-дневный курс лечения при всех формах амебиаза.
Длительность лечения, дни | Суточная доза | |
Взрослые и дети с массой тела более 35 кг | Дети с массой тела до 35 кг | |
| 3 | 1,5 г однократно вечером. При массе тела более 60 кг — 2 г равными дозами в 2 приема (утром и вечером) | 40 мг/кг однократно |
| 5–10 | 1 г равными дозами в 2 приема (утром и вечером) | 25 мг/кг однократно |
При лямблиозе взрослым и детям с массой тела более 35 кг назначают 1,5 г однократно вечером. Детям с массой тела менее 35 кг — 40 мг/кг однократно. Продолжительность лечения составляет 1–2 дня. Для профилактики инфекций, вызванных анаэробными бактериями, — по 1 г за 1–2 ч до операции; после операции — по 500 мг 2 раза в сутки в течение 3–5 дней. В/в вводят взрослым и детям старше 12 лет в разовой дозе 0,5–1 г с интервалом 8–12 ч. Суточная доза не должна превышать 4 г. Курс лечения в среднем составляет 5–10 дней.
Результаты
Основными субъективными проявлениями бактериального вагиноза у обследованных женщин являлись патологические выделения сливкообразного гомогенного характера из половых путей, которые наблюдали у 30 (100,0%) пациенток 1-й группы и у 29 (96,7%) пациенток 2-й группы. Также пациентки 1-й и 2-й групп предъявляли жалобы на неприятный «рыбный» запах выделений из половых путей — 28 (93,3%) и 27 (90,0%) соответственно, дискомфорт в области половых органов — 16 (53,3%) и 14 (46,7%) пациенток соответственно и болезненность при половых контактах — 10 (33,3%) и 11 (36,7%) пациенток соответственно.
У всех обследованных пациенток при микроскопическом исследовании вагинального содержимого были выявлены «ключевые клетки». Положительный результат аминотеста определялся у 29 (96,7%) пациенток 1-й группы и у 30 (100%) — 2-й группы. Также у большинства пациенток было выявлено повышенное значение рН вагинального содержимого — более 4,5. Обе группы являлись сопоставимыми по клиническим признакам бактериального вагиноза (рис. 1).
Рис. 1. Результаты клинического обследования пациенток до назначения терапии (р>0,05).
Средний показатель выраженности патологических выделений по оценке пациенток 1-й группы составил 2,4, по оценке пациенток 2-й группы — 2,2; неприятного запаха выделений из половых путей — 1,7 и 1,7; дискомфорта в области половых органов — 1,2 и 0,8; болезненности при половых контактах – 0,6 и 0,6 соответственно. По результатам объективного обследования средний показатель выраженности патологических выделений у пациенток 1-й группы составил 2,3, у пациенток 2-й группы — 2,2.
При анализе качественного состава вагинальной микрофлоры были получены следующие результаты: A.
vaginae
был идентифицирован у 12 (40,0%) пациенток 1-й группы и 16 (53,3%) 2-й группы,
G.vaginalis
— у 28 (93,3%) и 29 (96,7%) пациенток соответственно. Также выявлялись и другие микроорганизмы, ассоциированные с бактериальным вагинозом, —
Mobiluncus,Leptotrix
(рис. 2).
Рис. 2. Результаты лабораторных исследований пациенток до назначения терапии.
По данным бактериологического исследования, у большинства обследованных пациенток (у 83,3% больных 1-й группы и 80,0% — 2-й группы) представители семейства Lactobacillaceae
не определялись, у 3 (10%) и у 3 (10%) пациенток обследуемых групп соответственно количество лактобацилл находилось на уровне 102—103 КОЕ/мл, а у 2 (6,7%) и 3 (10%) пациенток соответственно — на уровне 104—105 КОЕ/мл (рис. 3).
Рис. 3. Результаты оценки лактобациллярной составляющей вагинальной микрофлоры до назначения терапии у пациенток обследованных групп.
После установления соответствия клинических и лабораторных данных у обследованных больных критериям включения в исследование всем пациенткам была назначена терапия по схемам, приведенным в разделе «Материал и методы».
Через 14 дней после окончания терапии была проведена оценка субъективных и объективных клинических показателей, а также выполнены лабораторные исследования.
Согласно результатам опроса пациенток, было установлено, что 1 (3,3%) пациентка 1-й группы и 5 (16,6%) пациенток 2-й группы предъявляли жалобы на выделения из половых путей. Также 1 (3,3%) пациентка 1-й группы и 4 (13,3%) пациентки 2-й группы жаловалсь на неприятный «рыбный» запах патологических выделений. Дискомфорт в области половых органов беспокоил 4 (13,3%) пациенток 2-й группы, болезненность при половых контактах отмечала 1 (3,3%) пациентка 2-й группы.
При оценке характера вагинальных выделений были получены следующие данные: у 1 (3,3%) пациентки 1-й группы и 4 (13,3%) 2-й группы вагинальные выделения имели сливкообразный характер и неприятный «рыбный» запах, характерный для бактериального вагиноза; у 1 (3,3%) пациентки 2-й группы вагинальные выделения были творожистыми и сопровождались гиперемией и отечностью слизистой оболочки влагалища. Положительный результат аминотеста определялся у 4 (13,3%) пациенток 2-й группы, значение рН вагинального содержимого более 4,5 — у 1 (3,3%) пациентки 1-й группы и 3 (13,3%) 2-й группы. При микроскопическом исследовании вагинального содержимого у 1 (3,3%) пациентки 1-й группы и 4 (13,3%) 2-й группы были выявлены «ключевые» клетки, что также подтверждало диагноз бактериального вагиноза у обследованных женщин (рис. 4).
Рис. 4. Результаты клинического обследования пациенток после проведенной терапии (p<0,05).
Показатель выраженности патологических выделений по оценке пациентки 1-й группы составил 2,0, по оценке пациенток 2-й группы — 2,2; неприятного запаха выделений из половых путей — 1,0 и 1,6 соответственно; дискомфорта в области половых органов — 0 и 1,6 соответственно; болезненности при половых контактах — 0 и 1,0 соответственно. По результатам объективного обследования показатель выраженности патологических выделений у пациентки 1-й группы составил 2,0, у пациенток 2-й группы — 2,2.
При качественной оценке вагинальной микрофлоры было установлено, что A.
vaginae
и
Mobiluncus
были идентифицированы в вагинальном содержимом только у пациенток 2-й группы у 3 (10,0%) и 2 (6,7%) обследованных соответственно.
G.vaginalis
выявлялись у 1 (3,3%) пациентки 1-й группы и 2 (6,7%) пациенток 2-й группы (рис. 5).
Рис. 5. Результаты бактериоскопического исследования вагинального содержимого у пациенток обследованных групп после проведенной терапии (p<0,05).
При оценке лактобациллярной составляющей вагинальной микрофлоры после проведенной терапии было установлено, что нормализация показателей (количество лактобацилл на уровне 105—107 КОЕ/мл) была достигнута у 21 (70,0%) пациентки 1-й группы и у 14 (46,7%) пациенток 2-й группы. Обращало на себя внимание, что у 10 (33,3%) пациенток 2-й группы представители семейства Lactobacillaceae
не определялись, в 1-й группе этот показатель был равен 10% (рис. 6).
Рис. 6. Результаты оценки лактобациллярной составляющей вагинальной микрофлоры у пациенток обследованных групп после проведенной терапии (p<0,05).
Достоверной разницы в удобстве применения препаратов установлено не было. Однако при анализе нежелательных лекарственных явлений было выявлено, что у 6 (20,0%) пациенток 2-й группы на фоне терапии метронидазолом отмечались побочные явления со стороны желудочно-кишечного тракта (тошнота, металлический привкус во рту, боли в эпигастральной области, диарея). У 1 (3,3%) пациентки 1-й группы на фоне лечения был зарегистрирован дискомфорт в эпигастральной области, самопроизвольно разрешившийся после завершения терапии.
При мониторинге показателей жизненных функций клинически значимых отклонений не было выявлено ни у одной из обследованных пациенток.
Особые указания по применению препарата Орнидазол
Следует соблюдать осторожность при применении орнидазола у пациентов с заболеваниями ЦНС, например с эпилепсией, поражениями головного мозга, рассеянным склерозом. В случае превышения рекомендуемых доз повышается риск развития побочных эффектов у детей, больных с поражением печени, злоупотребляющих алкоголем, беременных и кормящих грудью. Исследования на животных не выявили какого-либо тератогенного или токсического действия орнидазола на плод. Контролированные клинические исследования у беременных не проводили; однако назначать орнидазол в ранние сроки беременности или в период кормления грудью можно только по абсолютным показаниям.
Обсуждение
Согласно полученным данным, клинические признаки бактериального вагиноза после проведенного лечения достоверно чаще регистрировались у пациенток 2-й группы по сравнению с таковыми у пациенток 1-й группы: у 4 (13,3%) и у 1 (3,3%) пациентки соответственно. У 1 (3,3%) пациентки 2-й группы, кроме того, были выявлены клинические признаки кандидозного вульвовагинита.
Нормализация показателей лактобациллярной микрофлоры была установлена у 83,3% пациенток 1-й группы, что достоверно превышало эти показатели у пациенток 2-й группы (56,7%). При этом отсутствие представителей семейства Lactobacillus
при лабораторных исследованиях наблюдалось у 10 (33,3%) пациенток, проводивших лечение Трихополом (метронидазол), и только у 3 (10,0%) пациенток, проводивших лечение Тибералом (орнидазол). Однако полученные результаты могут быть следствием выборки пациентов и диктуют необходимость проведения дальнейших исследований по изучению влияния препаратов на лактобациллярную микрофлору влагалища.
На фоне проведенной терапии удалось достичь снижения интенсивности среднего показателя выраженности патологических выделений (по оценке пациенток) на 16,7% у больных 1-й группы при отсутствии динамики у больных 2-й группы, неприятного «рыбного» запаха выделений из половых путей — на 41,2 и 5,9% соответственно, дискомфорта в области половых путей — на 100% у больных 1-й группы при повышении показателя на 62,5% у больных 2-й группы, выраженности болезненности при половых контактах — на 100% у больных 1-й группы при повышении показателя на 40% у больных 2-й группы, выраженности патологических выделений по оценке врача — на 13,0% у больных 1-й группы при отсутствии динамики у больных 2-й группы (рис. 7 и 8).
Рис. 7. Динамика уровня выраженности симптомов заболевания у пациенток 1-й группы до лечения и после него.
Рис. 8. Динамика уровня выраженности симптомов заболевания у пациенток 2-й группы до лечения и после него.
При оценке общей эффективности терапии пациенткой были получены следующие результаты: о «выраженном улучшении» свидетельствовали 29 (96,7%) пациенток 1-й группы и 20 (66,7%) пациенток 2-й группы, о «незначительном улучшении» — 1 (3,3%) и 5 (16,7%) пациенток соответственно, о «состоянии без перемен» — 3 (10,0%) пациентки 2-й группы, об «ухудшении» — 2 (6,7%) пациентки 2-й группы.
При оценке общей эффективности терапии врачом клиническое выздоровление было зарегистрировано у 29 (96,7%) пациенток 1-й группы и 20 (66,7%) пациенток 2-й группы, значительное улучшение — у 2 (6,7%) пациенток 2-й группы, улучшение — у 3 (10%) пациенток 2-й группы, состояние без изменений — у 1 (3,3%) пациентки 1-й группы и 2 (6,7%) пациенток 2-й группы, ухудшение — у 3 (10,0%) пациенток 2-й группы.