Введение
У части больных COVID-19 (Сoronavirus disease 2019) заболевание сопровождается избыточным воспалительным ответом с выбросом большого количества провоспалительных цитокинов, что прямо коррелирует с выраженностью повреждения легких, развитием полиорганной недостаточности и неблагоприятным исходом [1–3]. Выявлены факторы неблагоприятного прогноза, связанные с феноменом «цитокиновой бури», содержанием С-реактивного белка и интерлейкин-6 (ИЛ-6) [4–6]. В связи с этим стали активно применяться лекарственные средства супрессивной иммуномодуляции с прицельным блокированием цитокинов [7–9], в частности моноклональные антитела к ИЛ-6 и его рецепторам [10–14]. Опубликованные результаты клинических исследований RCT-TCZ-COVID, CORIMUNO, STOP-COVID [15–17] сходятся в том, что наиболее часто исследуемый представитель этой группы — тоцилизумаб — не имеет достоверной эффективности при легком и среднетяжелом течении COVID-19, но требуются дальнейшие исследования для оценки эффективности при тяжелом течении заболевания. Полученные результаты исследований не позволяют однозначно судить об эффективности и безопасности препаратов данной фармакологической группы, но появляется все больше данных о пользе у отдельных категорий больных [18–22]. Результаты исследований одного препарата нередко экстраполируются на всех представителей данного класса. Не обнаружено работ со сравнительным изучением эффективности и безопасности различных препаратов группы моноклональных антител к ИЛ-6 и его рецепторам у пациентов с COVID-19. Нами было проведено ретроспективное наблюдательное исследование по сравнению эффективности и безопасности трех препаратов моноклональных антител — тоцилизумаба, левилимаба и олокизумаба — при однократном введении у госпитализированных пациентов с тяжелым течением COVID-19.
Цель исследования — сравнение эффективности и безопасности применения препаратов моноклональных антител к ИЛ-6 у пациентов с COVID-19 тяжелого течения.
Энбрел (Этанерцепт) 50мг/мл 1мл №2 — Инструкция
Лекарственная форма
Раствор для подкожного введения 50 мг/мл, в упаковке 2 шприца по 1 мл.
Состав
Раствор для п/к введения бесцветный или светло-желтого цвета, прозрачный или слегка опалесцирующий; допускается наличие мелких от прозрачного до белого цвета аморфных белковых включений.
| 1 мл | |
| этанерцепт | 50 мг |
Вспомогательные вещества: аргинина гидрохлорид, натрия хлорид, сахароза, натрия гидрофосфата дигидрат, натрия дигидрофосфата дигидрат, вода д/и.
Клинико-фармакологическая группа
Препарат с противовоспалительным действием. Ингибитор фактора некроза опухоли альфа (ФНО-α).
Фармако-терапевтическая группа
Иммунодепрессивное средство.
Фармакологическое действие
Иммунодепрессант, ингибитор ФНОα. Представляет собой гибридную димерную белковую молекулу состоящую из ФНО рецептора с молекулярной массой 75 kD, соединенную с Fc фрагментом (CH2 и CH3 области) человеческого IgG1. Продуцируется с применением технологии рекомбинантной ДНК на клетках яичников китайского хомячка.
Этанерцепт является конкурентным ингибитором связывания ФНО с его рецепторами на поверхности клетки, и, таким образом, ингибирует биологическую активность ФНО. ФНО и лимфотоксин относятся к провосиангтельным цитокинам, которые связываются с двумя четко различимыми ФНО-рецепторами на поверхности клетки: 55-килодальтон (р55) и 75-килодальтон (р75). Оба ФНО-рецептора присутствуют в организме в мембраносвязанной и свободной формах. Растворимые ФНО-рецепторы регулируют биологическую активность ФНО.
Димерная структура ФНО-рецептора в молекуле этанерцепта обеспечивает его более высокую аффинность к ФНОα, что в свою очередь определяет более выраженное конкурентное ингибирование активности ФНОα, по сравнению с мономерным растворимым ФНО-рецептором, присутствующим в биологических жидкостях. Этанерцепт способен также модулировать биологические ответы, контролируемые другими биологическими активными веществами (цитокины, адгезивные молекулы или протеиназы), которые индуцируются или регулируются под влиянием ФНО.
Не вызывает комплемент-опосредованного цитолиза мышиных Т-клеток, экспрессированных ФНО на поверхности клеток. ФНО является эндогенным цитокином, который участвует в нормальном воспалительном и иммунном ответах. ФНО является доминантным цитокином в процессе воспаления при ревматоидном артрите. Повышение уровня ФНО также обнаруживается в синовиальной жидкости и псориатических бляшках у пациентов с псориатическим артритом, в сыворотке и синовиальной ткани у пациентов с анкилозирующим спондилитом. При псориазе инфильтрация воспалительными клетками, включая Т-клетки, приводит к повышению уровня ФНО в псориатических очагах, по сравнению с интактной кожей.
Фармакокинетика
После п/к введения этанерцепт абсорбируется медленно. Cmax достигается через 48 ч после введения в однократной дозе. Абсолютная биодоступность — 76%. Фармакокинетическая кривая имеет биэкспоненциальный характер. Среднее значение Vd составляет 7.6 л, в равновесном состоянии Vd составляет 10.4 л. Медленно выводится из организма. T1/2 — около 70 ч. У пациентов с ревматоидным артритом клиренс составляет 0.066 л/ч. Фармакокинетика этанерцепта у пациентов с ревматоидным артритом, псориазом и анкилозирующим спондилитом имеет сходный характер.
Показания препарата Энбрел
Лечение умеренного или тяжелого активного ревматоидного артрита (в комбинации с метотрексатом или в качестве монотерапии).
Лечение умеренного и тяжелого активного ювенильного идиопатического полиартрита у детей и подростков в возрасте 2-17 лет (при недостаточной эффективности или непереносимости метотрексата).
Лечение активного и прогрессирующего псориатического артрита у взрослых (при неэффективности БПВП).
Для уменьшения симптомов у пациентов с активным анкилозирующим спондилитом (при неэффективности стандартной терапии).
Лечение умеренно выраженного или тяжелого псориаза у взрослых (при наличии противопоказаний или непереносимости другой системной терапии, включающей циклоспорин, метотрексат или PUVA-терапию).
Лечение детей в возрасте 6 лет и старше с хроническим тяжелым псориазом (при непереносимости или недостаточной эффективности другой системной терапии или фототерапии).
Режим дозирования
Вводят п/к. Разовая доза для взрослых составляет 50 мг, для детей в возрасте от 2 до 17 лет — 800 мкг/кг (но не более 50 мг/нед.). Кратность введения и длительность применения зависят от показаний и переносимости лечения.
Побочное действие
Инфекции: инфекции верхних дыхательных путей, цистит, инфекции кожи, пневмоня, флегмона, септический артрит, сепсис, туберкулез, оппортунистические инфекции (включая инвазивные грибковые, протозойные, бактериальные и атипичиные микобактериальные инфекции, инфекции мягких тканей и послеоперационных ран; у детей — ветряная оспа с симптомами асептического менингита, аппендицит, гастроэнтерит, асептический шок, вызванный стрептококками группы А.
Иммунологические реакции: образование аутоиммунных антител, аутоиммунный гепатит, кожные проявления подострой красной волчанки, дискоидная красная волчанка, волчаночноподобный синдром, синдром активации макрофагов, антинейтрофильный цитоплазматический серопозитивный васкулит.
Аллергические реакции: крапивница, анафилактические реакции, включая ангионевротический отек и бронхоспазм.
Со стороны нервной системы: головная боль, головокружение, ишемия мозга, депрессия, судороги, явления демиелинизации в ЦНС, сходные с наблюдающимися при рассеянном склерозе или состоянием локальной демиелинизации, такие как неврит зрительного нерва и поперечный миелит; у детей — депрессия/расстройства личности.
Со стороны системы кроветворения: тромбоцитопения, анемия, лейкопения, нейтропения, панцитопения, апластическая анемия.
Со стороны пищеварительной системы: боли в животе, диспепсия, рвота, холецистит, панкреатит, кровотечение из ЖКТ, аппендицит, аутоиммунный гепатит; у детей эзофагит, гастрит.
Со стороны костно-мышечной системы: бурсит, миозит.
Дерматологические реакции: зуд, сыпь, ухудшение течения псориаза, кожные формы васкулита (включая лейкоцитокластический васкулит), синдром Стивенса-Джонсона, токсический эпидермальный некролиз многоформная эритема; у детей — язвенные поражения кожи.
Со стороны сердечно-сосудистой системы: сердечная недостаточность, инфаркт миокарда, ишемия миокарда, артериальная гипертензия, артериальная гипотензия, тромбоз глубоких вен, тромбофлебит, ухудшение течения застойной сердечной недостаточности.
Со стороны мочевыделительной системы: мембранозная гломерулонефропатия, камни в почках.
Общие реакции: лихорадка, астения, периферические отеки, лимфоаденопатия; у детей — сахарный диабет 1 типа.
Местные реакции: боль, отек, покраснение.
Малигнизация: описаны случаи развития лимфомы, рака толстой кишки, молочной железы, легких, предстательной железы, внекожный солидный рак, рак кожи (не относящийся к меланоме), меланома, карцинома из клеток Меркеля.
Противопоказания к применению
Сепсис или состояния с повышенным риском его развития; тяжелые активные инфекции, включая хронические или локализованные инфекции; беременность, период лактации (грудного вскармливания); повышенная чувствительность к этанерцепту.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применение у детей
У детей младше 4 лет эффективность и безопасность этанерцепта не изучены. У детей и подростков в возрасте до 18 лет не изучены эффективность и безопасность этанерцепта для лечения псориаза.
Особые указания
Следует тщательно взвесить ожидаемую пользу терапии и имеющийся риск при необходимости применения этанерцепта у следующих категорий пациентов: с хроническими или рецидивирующими инфекциями; подвергавшихся воздействию туберкулезной инфекции; проживающих или временно находившихся в зонах эндемичных по туберкулезу, микозу; при гистоплазмозе, кокцидиоидомикозе или бластомикозе; при заболеваниях и состояниях, предрасполагающих к развитию инфекций, например, прогрессирующий или устойчивый к терапии сахарный диабет, обширное хирургическое вмешательство; при алкогольном гепатите среднетяжелого и тяжелого течения, гепатите С; при застойной сердечной недостаточности; состояниях иммунодефицита; нарушениях гематологических показателей, при рассеянном склерозе, неврите зрительного нерва, поперечном миелите.
Перед началом, во время и после окончания лечения этанерцептом следует провести обследование пациента для оценки риска возникновения и наличия инфекций, в т.ч. оппортунистических. Этанерцепт следует отменить при развитии тяжелых инфекций (в т.ч. туберкулеза, микобактериальной инфекции) или сепсиса.
При развитии гематологических нарушений во время лечения этанерцепт следует отменить.
У пациентов с хронической сердечной недостаточностью, т.к. во время лечения возможно ухудшение течения данного заболевания.
У пациентов, являющихся носителями вируса гепатита B, возможна реактивация инфекции во время лечения этанерцептом; в таких случаях его следует немедленно отменить.
При применении этанерцепта у пациентов с сахарным диабетом может потребоваться коррекция дозы гипогликемических препаратов.
Частота развития различного типа злокачественных опухолей внекожной локализации была значительно выше у пациентов с гранулематозом Вегенера, получавших этанерцепт, чем в контрольной группе. Поэтому этанерцепт не рекомендуется применять у пациентов с гранулематозом Вегенера.
Не следует применять этанерцепт у пациентов с псориазом одновременно с иммунодепрессантами или фототерапией, т.к. возможно усиление иммунодепрессивного действия.
На фоне лечения этанерцептом не следует проводить вакцинацию живыми вакцинами.
Лекарственное взаимодействие
Этанерцепт можно применять в комбинации с метотрексатом для лечения ревматоидного артрита. В клинических исследованиях при изучении безопасности и эффективности показано, что метотрексат не влияет на фармакокинетику этанерцепта. Влияние этанерцепта на фармакокинетику метотрексата у человека не изучено. Безопасность и эффективность комбинации с метотрексатом для лечения псориаза не изучена. Этанерцепт следует с осторожностью применять в комбинации с метотрексатом для лечения псориаза.
При одновременном применении этанерцепта и анакинры повышается частота развития тяжелых инфекций, при этом терапевтический эффект не усиливается (данная комбинация нецелесообразна).
Одновременное применение с абатацептом сопровождалось повышением частоты серьезных побочных реакций. Клинических преимуществ данной комбинации не отмечено, поэтому совместное применение не рекомендуется.
При одновременном применении с сульфасалазином наблюдается более выраженное уменьшение количества лейкоцитов, по сравнению с применением каждого из данных активных веществ в отдельности.
Этанерцепт не оказывает существенного влияния на биодоступность дигоксина. Однако в присутствии дигоксина наблюдалось уменьшение биодоступности этанерцепта, которое характеризовалось значительной индивидуальной вариабельностью.
Условия хранения
Хранить в оригинальной упаковке в недоступном для детей месте в холодильнике при температуре от 2 до 8 ° С.
Не замораживать.
Срок годности
3 года.
Категория отпуска
По рецепту.
Материалы и методы
Одноцентровое ретроспективное обсервационное когортное исследование проведено в Городской клинической больнице № 40 Департамента здравоохранения города Москвы. В исследование включали пациентов с тяжелым течением новой коронавирусной инфекции COVID-19 (Сoronavirus disease 2019), госпитализированных в период с 01.12.2020 по 01.01.2021 в палатные отделения и получивших лечение одним из препаратов моноклональных антител: тоцилизумаб («Актемра»), левилимаб («Илсира») или олокизумаб («Артлегиа»). Пациенты были разделены на три группы в зависимости от получаемого препарата. Всем пациентам препараты вводились однократно в дозе 162 мг для тоцилизумаба подкожно или 400 мг для внутривенного введения, 324 мг п/к для левилимаба и олокизумаба. Для исходной оценки были использованы повышение С-реактивного белка выше рефересных значений [23, 24], а также эмпирическая визуальная шкала КТ (компьютерная томография). В качестве конечных точек были выбраны добавление в диагноз сепсиса (увеличение qSOFA более 3, SOFA [Sepsis-related Organ Failure] на 2 и более балла после введения исследуемых препаратов, прокальцитонин в плазме > 2,0 нг/мл) [45] и летальный исход. Статистическая обработка данных проводилась с помощью программы BioStat LE 7.3.0, StatTech v. 1.2.0 (ООО «Статтех», Россия). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью точного критерия Фишера, проверка нормальности распределения количественных признаков осуществлялась с использованием критерия Шапиро—Уилка. Данные для количественных показателей представлены в виде среднего значения и стандартного отклонения (при нормальном распределении), медианы и межквартильного интервала (при отклонении распределения от нормального). Данные для качественных переменных представлены в виде абсолютных значений и доли в процентах. Медианы количественных показателей сравнивали с помощью U-критерия Манна—Уитни (при сравнении двух групп). Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Расчет отношения шансов (ОШ) проводился с помощью метода логистической регрессии. Критическое значение уровня значимости принималось равным 5 %. У всех пациентов имелось информированное согласие на применение препаратов моноклональных антител и на использование персональных данных в научных целях.
Исследование одобрено локальным этическим комитетом ГБУЗ ГКБ № 40 ДЗМ.
Результаты исследования
Включенные в анализ пациенты всех трех групп были сопоставимы по возрасту и полу. Статистически значимых различий по среднему времени введения препарата от начала заболевания, объему поражения паренхимы легких, по данным КТ, содержанию С-реактивного белка до и через 24 ч после введения препаратов не выявлено (табл. 1).
Таблица 1. Основные характеристики пациентов в сравниваемых группах
Table 1. The main characteristics of patients in the compared group
| Показатель | Тоцилизумаб п/к | Тоцилизумаб в/в | Левилимаб | Олокизумаб | р |
| Количество больных | 114 | 86 | 100 | 100 | нет различий |
| Средний возраст, лет* | 64,5 ± 13,4 | 64,7 ± 13,5 | 65,5 ± 13,5 | 67,0 ± 12,3 | 0,39 |
| Мужчины/женщины | 71/43 | 35/51 | 42/58 | 49/51 | 0,39 |
| Время введения от момента госпитализации, сутки** | 2 (1) | 8 (4) | 2 (2) | 2 (2) | 0,14 |
| Степень поражения легких по эмпирической визуальной шкале (КТ) | 2 (1) | 2 (1) | 2 (1) | 2 (1) | нет различий |
| СРБ до введения, мг/л** | 100 (77) | 110 (79) | 106 (79) | 115 (92) | 0,41 |
| СРБ через 24 ч после введения, мг/л** | 67 (87) | 70 (92) | 63 (82) | 69 (69) | 0,99 |
* Результат представлен в виде: среднее значение ± стандартное отклонение.
** Результат представлен в виде медианы межквартильного интервала.
При анализе показателя «Летальный исход» в зависимости от введенного препарата (тоцилизумаб, олокизумаб, левилимаб) нам не удалось выявить значимых различий (p = 0,259, точный критерий Фишера для многопольных таблиц) (табл. 2). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью точного критерия Фишера. Апостериорные сравнения выполнялись с помощью критерия χ2 Пирсона с поправкой Холма.
Таблица 2. Анализ показателя «Летальный исход» в зависимости от введенного препарата
Table 2. Analysis of the “Lethal outcome” indicator depending on the injected drug
| Препарат | Результат | p | |
| Выписанные | Летальный исход | ||
| Тоцилизумаб | 186 (93)* | 14 (7) | 0,26 |
| Олокизумаб | 95 (95) | 5 (5) | |
| Левилимаб | 89 (89) | 11 (11) | |
* В скобках приведена доля в процентах.
При оценке исхода «Сепсис» в зависимости от введенного препарата нам не удалось установить статистически значимых различий (p = 0,587, точный критерий Фишера для многопольных таблиц) (табл. 3). В качестве количественной меры эффекта при сравнении относительных показателей нами использовался показатель ОШ с 95%-м доверительным интервалом (95% ДИ).
Таблица 3. Анализ показателя «Сепсис» в зависимости от введенного препарата
Table 3. Analysis of the “Sepsis” indicator depending on the of injected drug
| Препарат | Результат | p | |
| Нет сепсиса | Сепсис | ||
| Тоцилизумаб | 192 (96) | 8 (4) | 0,59 |
| Олокизумаб | 97 (97) | 3 (3) | |
| Левилимаб | 94 (94) | 6 (6) | |
Был проведен анализ показателя «Сепсис» в зависимости подкожного или внутривенного введения тоцилизумаба (табл. 4). При оценке показателя «Сепсис» в зависимости от пути введения тоцилизумаба не удалось выявить статистически значимых различий (p = 0,293, точный критерий Фишера). Шансы сепсиса в группе подкожного введения тоцилизумаба были ниже в 2,28 раза по сравнению с группой внутривенного введения тоцилизумаба, различия шансов не были статистически значимыми (ОШ = 0,44; 95% ДИ 0,1–1,88). При оценке показателя «Летальный исход» в зависимости от пути введения, не удалось выявить статистически значимых различий (p = 0,279, точный критерий Фишера). Шансы скончавшихся в группе подкожного введения были ниже в 1,85 раза по сравнению с группой внутривенного введения, различия шансов не были статистически значимыми (ОШ = 0,54; 95% ДИ 0,18–1,62) (табл. 5).
Таблица 4. Анализ показателя «Сепсис» в зависимости от пути введения тоцилизумаба
Table 4. Analysis of the “Sepsis” indicator depending way of injected drug tocilizumab
| Путь введения | Результат | p | |
| Нет сепсиса | Сепсис | ||
| в/в | 81 (94,19) | 5 (5,81) | 0,29 |
| п/к | 111 (97,37) | 3 (2,63) | |
Таблица 5. Анализ показателя «Летальный исход» в зависимости от пути введения тоцилизумаба
Table 5. Analysis of the indicator “Lethal outcome” depending on way of injection tocilizumab
| Путь введения | Летальный исход | p | |
| Выписанные | Скончавшиеся | ||
| в/в | 78 (90,7) | 8 (9,3) | 0,28 |
| п/к | 108 (94,74) | 6 (5,26) | |
Обсуждение
Проведен анализ эффективности и безопасности трех препаратов моноклональных антител к ИЛ-6 и его рецепторам (тоцилизумаба, левилимаба и олокизумаба) при однократном введении у госпитализированных пациентов со среднетяжелым и тяжелым течением COVID-19 в одноцентровом наблюдательном ретроспективном когортном исследовании [25].
Все три препарата входят во временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» Минздрава РФ [44], однако в общемировой практике только тоцилизумаб для внутривенного ведения вошел в национальные рекомендации по лечению COVID-19 (Китай, Италия, Испания, Греция, Швейцария, Ирландия, Польша, Турция, Израиль, Япония, Египет, Иран и ряд других стран) [44–46].
Что касается применения тоцилизумаба для подкожного введения, то данный препарат неплохо зарекомендовал себя при лечении ревматоидного артрита [26], хотя для лечения осложнений противоопухолевой терапии модифицированными Т-клетками с химерным антигенным рецептором к CD19 (СAR-T) зарегистрирована только внутривенная лекарственная форма препарата [27]. При прямом сравнении внутривенного и подкожного введения тоцилизумаба, проведенном Kaminski et al., был сделан вывод о предпочтительности внутривенного пути [28]. Ряд исследователей изучали возможность приготовления раствора тоцилизумаба для внутривенного введения из препарата для подкожного введения [29]. В то же время некоторые авторы полагают, что применение тоцилизумаба в виде подкожного введения является эффективным методом лечения пациентов с COVID-19 [30–33]. Кроме того, было показано, что при подкожном применении тоцилизумаба отмечается улучшение показателей коагуляции независимо от типа тромбопрофилактики [34]. В отношении левилимаба и олокизумаба ситуация более сложная, т. к. работ, посвященных изучению эффективности и безопасности при COVID-19 крайне мало [35, 36].
В настоящей работе при применении всех трех препаратов наблюдалось статистически значимое снижение содержания С-реактивного белка через 24 ч после введения, при этом достоверных статистических различий между группами выявлено не было. Так, в исследовании, проведенном Potere et al., летальность в группе из 40 пациентов, получавших терапию тоцилизумабом в виде однократного подкожного введения, составила 5 % [37]. В исследовании Malekzadeh et al. к концу периода наблюдения летальность в группе тоцилизумаба для подкожного введения составила 7 % [38]. Близкие результаты были получены в исследованиях, проведенных Guaraldi et al. и De Rossi et al. [39, 40]. Наибольший показатель летальности — 10,3 % был зарегистрирован в исследовании, проведенном Sciascia et al. [41]. Что касается олокизумаба, то пока в единственной опубликованной работе летальный исход наблюдался у 3,5 % пациентов [35]. Данных о летальности при применении левилимаба в открытых источниках не опубликовано. Таким образом, полученные в настоящей работе результаты соответствуют данным ранее проведенных исследований о летальности при применении препаратов моноклональных антител тел к ИЛ-6 и его рецепторам для подкожного введения у пациентов со среднетяжелым и тяжелым течением новой коронавирусной инфекции (COVID-19). Существенным недостатком настоящего исследования является отсутствие контрольной группы — как результата обязательного следования валидным клиническим рекомендациям Минздрава РФ и приказу Департамента здравоохранения г. Москвы [44]. К недостаткам также можно отнести наличие только внутригоспитальной оценки пациентов и отсутствие на данный момент отдаленных результатов применения препаратов и исходов заболевания. В то же время учитывая расчетные показатели летальности, полученные на основании исходных характеристик, в 16–19 %, можно предположить, что применение данных препаратов является эффективным. Выявленные недостоверные различия в конечных точках исследования между препаратами требуют дальнейшего изучения [42, 43].
Энбрел® (Enbrel® )
Подкожно.
Лечение препаратом Энбрел® должно назначаться и контролироваться врачом, имеющим опыт в диагностике и лечении ревматоидного артрита, ювенильного идиопатического полиартрита, псориатического артрита, анкилозирующего спондилита или псориаза. Энбрел® в виде готового раствора 25 мг (одноразовый шприц, содержащий 0,5 мл препарата) и 50 мг (одноразовый шприц, содержащий 1,0 мл препарата) или 50 мг (шприц-ручка, содержащая 1 мл препарата) используется для пациентов, имеющих массу тела более 62,5 кг. У пациентов с массой тела менее 62,5 кг следует использовать лиофилизат для приготовления раствора.
Перед введением препарата необходимо внимательно изучить инструкцию по его применению, которая находится в конце данного раздела.
Взрослые
Ревматоидный артрит
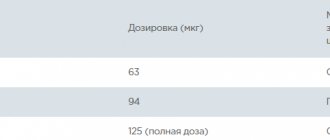
Рекомендуемая доза составляет 25 мг препарата Энбрел® дважды в неделю с интервалом 3-4 дня. Альтернативная доза — 50 мг один раз в неделю, которая может быть введена путем однократной подкожной инъекции 50 мг или двух инъекцией по 25 мг препарата, сделанных практически одновременно.
Псориатический артрит
Рекомендуемая доза — 25 мг препарата Энбрел® дважды в неделю с интервалом 3-4 дня. Альтернативная доза — 50 мг один раз в неделю, которая может быть введена путем однократной подкожной инъекции 50 мг или двух инъекцией по 25 мг препарата, сделанных практически одновременно.
Анкилозирующий спондилит
Рекомендуемая доза — 25 мг препарата Энбрел® дважды в неделю с интервалом 3-4 дня. Альтернативная доза — 50 мг один раз в неделю, которая может быть введена путем однократной подкожной инъекции 50 мг или двух инъекцией по 25 мг препарата, сделанных практически одновременно.
Дорентгенологическая стадия аксиальной формы спондилоартрита
Рекомендуемая доза — 25 мг препарата Энбрел® дважды в неделю с интервалом 3-4 дня. Альтернативная доза — 50 мг один раз в неделю, которая может быть введена путем однократной подкожной инъекции 50 мг или двух инъекций по 25 мг препарата, сделанных практически одновременно.
Псориаз
Рекомендуемая доза — 25 мг препарата Энбрел® дважды в неделю с интервалом 3-4 дня. Возможно введение 50 мг препарата один раз в неделю путем однократной подкожной инъекции или двух инъекцией по 25 мг препарата, сделанных практически одновременно. В качестве альтернативы можно применять Энбрел® по 50 мг дважды в неделю на протяжении не более 12 недель. При необходимости продолжения лечения Энбрел® следует вводить в дозе 25 мг дважды в неделю или 50 мг один раз в неделю. Терапию следует проводить до достижения ремиссии и, как правило, не более 24 недель. Введение препарата следует прекратить, если после 12 недель лечения не наблюдается положительной динамики симптомов. В некоторых случаях продолжительность лечения может составить более 24 недель.
У взрослых пациентов в зависимости от оценки врача и индивидуальных особенностей пациента терапию можно проводить непрерывно или с перерывами.
При необходимости повторного назначения препарата Энбрел® следует соблюдать длительность лечения, указанную выше. Рекомендуется назначать дозу 25 мг дважды в неделю или 50 мг один раз в неделю.
Длительность терапии у некоторых больных может превышать 24 недели.
Пожилые пациенты (65 лет и старше)
Нет необходимости корректировать дозу или способ применения.
Дети (в возрасте старше 12 лет и имеющие массу тела 62,5 кг и более)
У детей в возрасте младше 12 лет и с массой тела менее 62,5 кг (см. раздел «Противопоказания») следует применять Энбрел® в лекарственной форме лиофилизат для приготовления раствора для подкожного введения, который позволяет ввести дозу менее 25 мг.
Дети в возрасте старше 12 лет и с массой тела более 62,5 кг могут применять Энбрел® в лекарственной форме раствор для подкожного введения в виде шприцев или шприц-ручек для одноразового использования.
Ювенальный идиопатический полиартрит
(дети в возрасте старше 12 лет и с массой тела более 62,5 кг (для препарата Энбрел® в лекарственной форме «раствор для подкожного введения»))
У данной группы пациентов препарат Энбрел® в лекарственной форме «раствор для подкожного введения» применяют как у взрослых: разовая доза 25 мг. Препарат вводится дважды в неделю с интервалом 3-4 дня. Лечение препаратом следует прекратить, если после 4 месяцев терапии не наблюдается положительной динамики симптомов.
Возможно введение дозы 50 мг один раз в неделю.
Распространенный олигоартрит
(дети в возрасте старше 12 лет и с массой тела более 62,5 кг (для препарата Энбрел® в лекарственной форме «раствор для подкожного введения»))
У данной группы пациентов препарат Энбрел® в лекарственной форме «раствор для подкожного введения» применяют как у взрослых: разовая доза 25 мг. Препарат вводится дважды в неделю с интервалом 3-4 дня. Лечение препаратом следует прекратить, если после 4 месяцев терапии не наблюдается положительной динамики симптомов.
Возможно введение 50 мг один раз в неделю.
Псориатический артрит
(подростки старше 12 лет и с массой тела более 62,5 кг (для препарата Энбрел® в лекарственной форме «раствор для подкожного введения»))
У данной группы пациентов препарат Энбрел® в лекарственной форме «раствор для подкожного введения» применяют как у взрослых: разовая доза 25 мг. Препарат вводится дважды в неделю с интервалом 3-4 дня. Лечение препаратом следует прекратить, если после 4 месяцев терапии не наблюдается положительной динамики симптомов.
Возможно введение 50 мг один раз в неделю.
Артрит, ассоциированный с энтезитами
(подростки старше 12 лет и с массой тела более 62,5 кг (для препарата Энбрел® в лекарственной форме «раствор для подкожного введения»))
У данной группы пациентов препарат Энбрел® в лекарственной форме «раствор для подкожного введения» применяют как у взрослых: разовая доза 25 мг. Препарат вводится дважды в неделю с интервалом 3-4 дня. Лечение препаратом следует прекратить, если после 4 месяцев терапии не наблюдается положительной динамики симптомов.
Возможно введение 50 мг один раз в неделю.
Псориаз
(дети в возрасте старше 12 лет и с массой тела более 62,5 кг (для препарата Энбрел® в лекарственной форме «раствор для подкожного введения»))
Разовая доза препарата составляет 50 мг. Препарат вводится один раз в неделю, длительность терапии составляет не более 24 недель. Введение препарата следует прекратить, если после 12 недель лечения не наблюдается ответа на проводимую терапию. При необходимости повторного назначения препарата Энбрсл® следует соблюдать длительность лечения, указанную выше. Разовая доза препарата составляет 50 мг один раз в неделю.
В случае пропуска дозы в положенное время, необходимо внести препарат сразу же, как только об этом вспомнили, но при условии, что следующая инъекция должна быть не ранее, чем через день. В противном случае необходимо пропустить забытую инъекцию и сделать вовремя очередную инъекцию.
Нарушение функции печени и почек:
нет необходимости корректировать дозу.
Ниже представлены инструкции по подготовке и введению раствора для подкожного введения препарата Энбрел® в шприцах и в шприц-ручках.
Выбор места инъекции
— Рекомендуются три места для введения препарата Энбрел®: (1) передняя поверхность средней трети бедра; (2) живот, кроме области размером 5 см вокруг пупка; (3) наружная поверхность плеча (см. рис. 1). Если вы делаете инъекцию себе, не следует использовать наружную поверхность плеча.
— Каждую инъекцию следует выполнять в новое место. Место каждой новой инъекции должно быть на расстоянии не менее 3 см от места предыдущих инъекций. НЕ ВВОДИТЕ препарат в участки, в которых есть болезненность, покраснение кожи, кровоподтек или уплотнение. Не вводите в участки со шрамами или растяжками. (Может оказаться полезным записывать места предыдущих инъекций).
— Если ребенок болеет псориазом, старайтесь не вводить препарат непосредственно в участки, приподнятые над поверхностью кожи, утолщенные, покрасневшие или в очаги с шелушением («псориатические бляшки»).
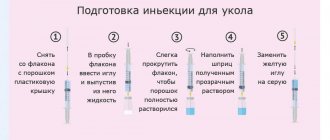
1) ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ И ВВЕДЕНИЮ РАСТВОРА ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ ПРЕПАРАТА Энбрел® В ШПРИЦЕ
Пациенты или их родители / опекуны, которые будут проводить инъекции, должны быть проинформированы о том, как правильно проводить инъекцию. В случае, если в дальнейшем инъекции будут проводиться самим пациентом или его родителями / опекуном, то первое введение необходимо осуществить под контролем квалифицированного медицинского персонала.
Подготовка к инъекции
Этот препарат нельзя смешивать в одном шприце или флаконе с любыми другими препаратами!
— Извлеките картонную коробку с предварительно заполненными шприцами с препаратом Энбрел® из холодильника и поместите ее на чистую хорошо освещенную и ровную поверхность. Возьмите один предварительно заполненный шприц. Не встряхивайте шприц. Поместите картонную коробку с оставшимися шприцами обратно в холодильник.
— Оставьте шприц с раствором Энбрел® на 15-30 минут, чтобы он нагрелся до комнатной температуры. НЕ СНИМАЙТЕ колпачок с иглы шприца, пока он не достигнет комнатной температуры. Не подогревайте Энбрел® каким-либо другим способом (например, в микроволновой печи или в горячей воде).
— Вымойте руки с мылом в теплой воде.
— Убедитесь, что раствор в шприце прозрачный или слегка опалесцирующий, бесцветный или светло-желтый, может содержать небольшие полупрозрачные или белые частицы белковой природы. В противном случае не вводите раствор. Используйте другой шприц, предварительно заполненный препаратом Энбрел®.
— Вам также понадобятся: спиртовая салфетка, она входит в набор, и ватный шарик или марлевая салфетка.
Подготовка участка кожи и введение раствора Энбрел®
— Круговыми движениями протрите участок кожи, в который будете вводить Энбрел®, чистой спиртовой салфеткой. НЕ КАСАЙТЕСЬ этой области до выполнения инъекции.
— Снимите колпачок с иглы, с силой потянув его со шприца (см. рис. 2). Соблюдайте осторожность, не сгибая и не перекручивая колпачок во время удаления, чтобы не повредить иглу.
— При удалении колпачка на конце иглы может появиться капля жидкости; это допустимо.
— Не касайтесь иглы и избегайте ее соприкосновения с любой другой поверхностью. Не касайтесь поршня и не надавливайте на него. Это может привести к вытеканию жидкости из шприца.
— Когда очищенный участок кожи полностью высохнет, одной рукой соберите кожу в складку и удерживайте ее. Второй рукой держите шприц, как карандаш.
— Быстрым коротким движением направьте иглу в кожу под углом от 45° до 90° (см. рис. 3). Со временем вы найдете угол, наиболее удобный при введении. Старайтесь не вводить иглу в кожу слишком медленно или с чрезмерным усилием.
— После того, как игла полностью войдет в кожу, выпустите складку кожи, которую вы держали. Свободной рукой придерживайте основание шприца, чтобы стабилизировать его положение. Затем надавите на поршень, чтобы ввести весь раствор с медленной постоянной скоростью (см. рис. 4).
— Когда шприц станет пустым, извлеките иглу из кожи; старайтесь держать ее под тем же углом, под которым ее вводили.
— Надавите ватным шариком или марлевой салфеткой на место инъекции в течение 10 секунд. Может возникнуть небольшая кровоточивость. НЕ ПРОТИРАЙТЕ место инъекции. Можно наложить повязку.
Утилизация отходов
— Предварительно заполненный шприц предназначен только для одноразового применения. НИКОГДА не используйте шприц и иглу повторно, НИКОГДА не одевайте колпачок на иглу повторно. Утилизируйте иглу и шприц в соответствии с указаниями Вашего врача или медсестры.
Если у Вас сеть вопросы, пожалуйста, обратитесь к врачу или медсестре, которые работают с препаратом Энбрел®.
2) ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ и ВВЕДЕНИЮ РАСТВОРА ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ ПРЕПАРАТА ЭНБРЕЛ® В ШПРИЦ-РУЧКЕ
— Нe пытайтесь выполнить инъекцию самостоятельно, если вы не поняли, как следует надлежащим образом использовать шприц-ручку. При наличии у вас вопросов, касающихся инъекции, пожалуйста, задайте их врачу или медицинской сестре.
Этап 1. Подготовка к введению препарата Энбрел®
— Выберите чистую, хорошо освещенную, плоскую рабочую поверхность.
Соберите следующие предметы, которые необходимы для выполнения инъекции, и поместите их па рабочую поверхность (см. рис. 5):
а. Одну предварительно наполненную шприц-ручку и одну спиртовую салфетку (извлеките их из картонной пачки со шприц-ручками, которую вы храните в холодильнике). Не встряхивайте при этом шприц-ручку.
б. Один ватный шарик или марлевую салфетку.
— Оцените состояние раствора в шприц-ручке через прозрачное смотровое окошко. Допустимо вводить только прозрачный или слегка опалесцирующий, бесцветный или бледно-желтый раствор, не содержащий видимых частиц. В противном случае следует использовать другую шприц-ручку, а затем обратиться за помощью к фармацевту.
— Не снимая белого колпачка иглы, подождите приблизительно 15-30 минут, чтобы раствор препарата Энбрел® в шприц-ручке согрелся до комнатной температуры. Это позволит повысить комфортность инъекции. Не согревайте шприц-ручку другим способом. Всегда кладите шприц-ручку в места, недоступные дли детей.
— Пока раствор в шприц-ручке согревается до комнатной температуры, прочтите сведения о мероприятиях Этапа 2 (приведенные ниже), и выберите место введения.
Этап 2. Введение препарата Энбрел®
— После согревания раствора до комнатной температуры в течение приблизительно 15-30 минут, вымойте руки мылом и водой.
— Круговыми движениями протрите участок кожи, в который будете вводить Энбрел®, чистой спиртовой салфеткой и дайте высохнуть. НЕ КАСАЙТЕСЬ этой области до выполнения инъекции.
— Достаньте шприц-ручку, снимите с нее белый колпачок, потянув его прямо на себя (см. рис. 7). Во избежание повреждения иглы, закрытой колпачком, не наклоняйте колпачок, снимая его, и не пытайтесь надеть его снова после снятия. После удаления колпачка иглы вы увидите фиолетовый защитный экран, слегка выступающий за край шприц-ручки. Сама игла будет оставаться внутри шприц-ручки до момента се активации.
— Осторожно соберите кожу в складку между большим и указательным пальцами свободной руки — это позволит упростить введение препарата и сделать его более комфортным. Старайтесь не дотрагиваться до очищенной поверхности кожи.
— Не оказывая давления на зеленую кнопку активации, расположенную в верхней части шприц-ручки, установите ее под прямым углом (90°) к месту введении и плотно прижмите ее открытый конец к коже таким образом, чтобы защитный экран полностью ушел внутрь шприц-ручки. При этом будет определяться легкое вдавление кожи (см. рис. 8). Необходимо помнить, что зеленая кнопка активации будет оставаться блокированной, что не позволит активировать шприц-ручку до тех пор, пока фиолетовый защитный экран не окажется полностью внутри шприц-ручки.
— Плотно прижмите шприц-ручку к коже и убедитесь, что фиолетовый защитный экран полностью вошел внутрь нее. Для выполнения инъекции нажмите и сразу отпустите зеленую кнопку, расположенную в верхней части шприц-ручки (см. рис. 9). После отпускания кнопки вы услышите щелчок. Продолжайте удерживать шприц-ручку плотно прижатой к коже либо до второго щелчка, либо в течение 10 секунд после первого щелчка (учитывается наиболее раннее из событий).
Примечание
: после первого щелчка уберите палец с кнопки активации, поскольку в противном случае вы не услышите второго щелчка после завершения инъекции. Для полного введения препарата Энбрел® не требуется удерживать кнопку в нажатом состоянии.
— После второго щелчка (или через 10 секунд) инъекция завершается (см. рис. 10), и вы сможете ослабить давление на кожу (см. рис. 11), по мере чего фиолетовый защитный экран автоматически выдвинется и закроет иглу.
При этом цвет смотрового окошка шприц-ручки изменится на фиолетовый, что является подтверждением правильности введения дозы препарата. Если этого не произойдет, следует обратиться за помощью к врачу, медицинской сестре или фармацевту, поскольку в такой ситуации не может быть гарантировано введение полной дозы препарата Энбрел®. Не пытайтесь использовать данную шприц-ручку повторно, также не начинайте использовать новую шприц-ручку, не посоветовавшись с медицинской сестрой или фармацевтом.
— При появлении капель крови в месте введения прижмите ватный шарик или марлевую салфетку к месту инъекции и удерживайте их в течение 10 секунд. Не трите место инъекции.
Этап 3. Утилизации использованной шприц-ручки
— Шприц-ручка предназначена только для однократного использования, поэтому ее повторное применение не допускается. Утилизация использованных шприц-ручек должна производиться в соответствии с инструкциями врача, медицинской сестры или фармацевта.
При наличии у вас вопросов, пожалуйста, задайте их врачу, медицинской сестре иди фармацевту, имеющим опыт работы с препаратом Энбрел®.
Выводы
Применение у пациентов с тяжелым течением COVID-19 разных препаратов моноклональных антител против ИЛ-6 не обнаружило достоверных различий в летальных исходах между тоцилизумабом, левилимабом и олокизумабом. Выявленные различия между препаратами в частоте развития сепсиса и летального исхода требуют дальнейших рандомизированных контролируемых исследований.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Бобкова С.С., Жуков А.А., Проценко Д.Н., Самойленко В.В., Тюрин И.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
ORCID авторов
Бобкова С.С
Жуков А.А
Проценко Д.Н
Самойленко В.В
Тюрин И.Н
Литература
- Moore J.B., June C.H. Cytokine release syndrome in severe COVID-19. Science. 2020; 368(6490): 473–474. DOI:1126/science.abb8925
- Song P., Li W., Xie J., et al. Cytokine storm induced by SARS-CoV-2. Clin Chim Acta. 2020; 509: 280–287. DOI: 10.1016/j.cca.2020.06.017
- Zhao Z., Wei Y., Tao C. An enlightening role for cytokine storm in coronavirus infection. Clin Immunol. 2021; 222: DOI: 10.1016/j.clim.2020.108615
- Lavillegrand J.R., Garnier M., Spaeth A. et al. Elevated plasma IL-6 and CRP levels are associated with adverse clinical outcomes and death in critically ill SARS-CoV-2 patients: inflammatory response of SARS-CoV-2 patients. Ann Intensive Care. 2021; 11(1): 9. DOI: 10.1186/s13613-020-00798-x
- Potempa L.A., Rajab I.M., Hart P.C., et al. Insights into the Use of C-Reactive Protein as a Diagnostic Index of Disease Severity in COVID-19 Infections, Am J Trop Med Hyg. 2020; 103(2): 561–563. DOI: 10.4269/ajtmh.20-0473
- Yonas E., Alwi I., Pranata R., et al. Elevated interleukin levels are associated with higher severity and mortality in COVID 19. A systematic review, meta-analysis, and meta-regression. Diabetes Metab Syndr. Nov-Dec 2020; 14(6): 2219–2230. DOI: 10.1016/j.dsx.2020.11.011
- Conti P., Ronconi G., Caraffa A., et al. Induction of proinflammatory cytokines (IL-1 and IL-6) and lung inflammation by COVID-19: antiinflammatory strategies. J Biol Regul Homeost Agents. 2020; 4(2): 327–331. DOI: 10.23812/CONTI-E
- Moradian N., Gouravani M., Salehi M.A., et al. Cytokine release syndrome: inhibition of pro-inflammatory cytokines as a solution for reducing COVID-19 mortality. Eur. Cytokine Netw. 2020; 31(3): 81–93. DOI: 10.1684/ecn.2020.0451
- Pum A., Ennemoser M., Adage T., Kungl A.J. Cytokines and Chemokines in SARS-CoV-2 Infections—Therapeutic Strategies Targeting Cytokine Storm. Biomolecules. 2021; 11(1): DOI: 10.3390/biom11010091
- Chen J., Zhang L., Hou H., et al. Interleukin 6 signaling blockade treatment for cytokine release syndrome in COVID 19 (Review). Exp Ther Med. 2021; 21(1): 24. DOI: 10.3892/etm.2020.9456
- Crisafulli S., Isgrò V., La Corte L., et al. Potential Role of Anti interleukin (IL) 6 Drugs in the Treatment of COVID 19: Rationale, Clinical Evidence and Risks. BioDrugs. 2020; 34(4): 415–422. DOI: 10.1007/s40259-020-00430-1
- Hashizume M. Outlook of IL-6 signaling blockade for COVID-19 pneumonia. Inflamm Regen. 2020; 40: DOI: 10.1186/s41232-020-00134-7
- Nasonov E., Samsonov M. The role of Interleukin 6 inhibitors in therapy of severe COVID-19. Biomed Pharmacother. 2020; 131: DOI: 10.1016/j.biopha.2020.110698
- Zhou Z., Price C. Overview on the use of IL-6 agents in the treatment of patients with cytokine release syndrome (CRS) and pneumonitis related to COVID-19 disease. Expert Opin Investig Drugs. 2020; 29(12): 1407–1412.DOI: 10.1080/13543784.2020.1840549
- Salvarani C., Dolci G., Massari M., et al. Effect of tocilizumab vs standard care on clinical worsening in patients hospitalized with COVID-19 pneumonia: A Randomized Clinical Trial. JAMA Intern Med. 2021; 181(1): 24–31. DOI: 10.1001/jamainternmed.2020.6615
- CORIMUNO-19 Collaborative group. Effect of anakinra versus usual care in adults in hospital with COVID-19 and mild-to-moderate pneumonia (CORIMUNO-ANA-1): a randomised controlled trial. Lancet Respir Med. 2021; 9(3): 295–304. DOI: 10.1016/S2213-2600(20)30556-7
- Stone J.H, Frigault M.J., Serling-Boyd N.J., et al. Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. N Engl J Med. 2020; 383(24): 2333–2344. DOI: 10.1056/NEJMoa2028836
- Nugroho C.W., Suryantoro S.D., Yuliasih Y., et al. Optimal use of tocilizumab for severe and critical COVID-19: a systematic review and meta-analysis F1000 Research 2021, 10:73 Proc Natl Acad Sci U S A. 2020; 117(20): 10970–10975. DOI: 10.1073/pnas.2005615117
- Kow C.S., Hasan S.S. The effect of tocilizumab on mortality in hospitalized patients with COVID-19: a meta-analysis of randomized controlled trials. Eur J Clin Pharmacol. 2021; 1–6. DOI: 10.1007/s00228-021-03087-z
- Berardicurti O., Ruscitti P., Ursini F., et al. Mortality in tocilizumab-treated patients with COVID-19: a systematic review and meta-analysis. Clin Exp Rheumatol. 2020; 38(6): 1247–1254.
- Kim M.S., An M.H., Kim W.J. et al. Comparative efficacy and safety of pharmacological interventions for the treatment of COVID-19: A systematic review and network metaanalysis. PLoS Med. 2020; 17(12): e1003501. DOI: 10.1371/journal.pmed.1003501
- The REMAP-CAP Investigators, Gordon A.C., Mouncey P.R., et al. Interleukin-6 Receptor Antagonists in Critically Ill Patients with Covid-19 — Preliminary report. MedRxiv. 2021. DOI: 10.1101/2021.01.07.21249390
- Knight S.R., Ho A., Pius R., et al. Risk stratification of patients admitted to hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: development and validation of the 4C Mortality Score. BMJ. 2020; 370: m3339. DOI: 10.1136/bmj.m3339
- Catoire P., Tellier E., de la Rivière C., et al. Assessment of the SpO2/FiO2 ratio as a tool for hypoxemia screening in the emergency department. Am J Emerg Med. 2021; 44: 116–120. DOI: 10.1016/j.ajem.2021.01.092
- Wang X., Kattan M.W. Cohort Studies: Design, Analysis, and Reporting. Chest, 2020; 158(1S): S72– DOI: 10.1016/j.chest.2020.03.014
- Burmester G.R., Rubbert-Roth A., Cantagrel A., et al. A randomised, double-blind, parallel-group study of the safety and efficacy of subcutaneous tocilizumab versus intravenous tocilizumab in combination with traditional disease-modifying antirheumatic drugs in patients with moderate to severe rheumatoid arthritis (SUMMACTA study). Ann Rheum Dis. 2014; 73(1): 69–74. DOI: 10.1136/annrheumdis-2013-203523
- Le R.Q., Li L., Yuan W., et al. FDA approval summary: tocilizumab for treatment of chimeric antigen receptor T cell-induced severe or life-threatening cytokine release syndrome. Oncologist. 2018; 23(8): 943–947. DOI: 10.1634/theoncologist.2018-0028. Epub 2021 Apr 5.
- Kaminski M., Sunny S., Balabayova K., et al. Tocilizumab therapy for COVID-19: A comparison of subcutaneous and intravenous therapies. Int J Infect Dis. 2020; 101: 59–64. DOI: 10.1016/j.ijid.2020.09.1447
- Navas N., Hermosilla J., Torrente-López A., et al. Use of subcutaneous tocilizumab to prepare intravenous solutions for COVID-19 emergency shortage: Comparative analytical study of physicochemical quality attributes. J Pharm Anal. 2020; 10(6): 532–545. DOI: 10.1016/j.jpha.2020.06.003
- Potere N., Di Nisio M., Rizzo G., et al. Low-dose subcutaneous tocilizumab to prevent disease progression in patients with moderate COVID-19 pneumonia and hyperinflammation. International Journal of Infectious Diseases. Int J Infect Dis. 2020; 100: 421–424. DOI: 10.1016/j.ijid.2020.07.078
- Mazzitelli M., Arrighi E., Serapide F., et al. Use of subcutaneous tocilizumab in patients with COVID‐19 pneumonia. J Med Virol. 2021; 93(1): 32–34. DOI: 10.1002/jmv.26016
- Greco G., Ripamonti D., Binda F., et al. Potential Role of Subcutaneous Tocilizumab Injections in Patients With COVID-19 associated Pneumonia. J Med Virol. 2021; 93(2): 686–688. DOI: 10.1002/jmv.26494
- Mastroianni A., Greco S., Apuzzo G., et al. Subcutaneous tocilizumab treatment in patients with severe COVID-19 related cytokine release syndrome: An observational cohort study. EClinicalMedicine. 2020; 24: 100410. DOI: 10.1016/j.eclinm.2020.100410
- Di Nisio M., Potere N., Candeloro M., et al. Interleukin-6 receptor blockade with subcutaneous tocilizumab improves coagulation activity in patients with COVID-19. Eur J Intern Med. 2021; 83: 34–38. DOI: 10.1016/j.ejim.2020.10.020
- Ганюкова Н.Г., Ликстанов М.И., Косинова М.В. идр. Эффективность таргетной терапии ингибитором ИЛ-6 (олокизумаб) в купировании гипервоспаления при среднетяжелой пневмонии, обусловленной вирусом Sars-Cov-2. Фундаментальная и клиническая медицина. 2020; 5(4): 8–13.
- ЦветовВ.М., Матвеев А.В., Сычев Д.А. Целесообразность рутинного применения препарата олокизумаб при COVID-19. Качественная клиническая практика. 2020; S4: 68–70.
- Potere N., Di Nisio M., Cibelli D., et al. Interleukin-6 receptor blockade with subcutaneous tocilizumab in severe COVID-19 pneumonia and hyperinflammation: a case–control study. Ann Rheum Dis. 2021; 80(2): 1–2. DOI: 10.1136/annrheumdis-2020-218243
- Malekzadeh R., Abedini A., Mohsenpour B., et al. Subcutaneous tocilizumab in adults with severe and critical COVID-19: A prospective open-label uncontrolled multicenter trial. Int Immunopharmacol. 2020; 89(Pt B): 107102. DOI: 10.1016/j.intimp.2020.107102
- Guaraldi G., Meschiari M., Cozzi-Lepri A., et al. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol. 2020; 2(8): e474–e484. DOI: 10.1016/S2665-9913(20)30173-9
- De Rossi N., Scarpazza C., Filippini C., et al. Montichiari COVID-19 Study Group. Early use of low dose tocilizumab in patients with COVID-19: A retrospective cohort study with a complete follow-up. EClinicalMedicine. 2020; 25: DOI:10.1016/j.eclinm.2020.100459
- Sciascia S., Aprà F., Baffa A., et al. Pilot prospective open, single-arm multicentre study on off-label use of tocilizumab in severe patients with COVID-19. Clin Exp Rheumatol. 2020; 38(3): 529–532.
- Takeuchi T., Smolen J.S., Choy E.H., et al. Considering new lessons about the use of IL-6 inhibitors in arthritis. Considerations in Medicine. 2018; 2: 7–11. DOI: 10.1136/conmed-2018-000002
- Smolen J.S., Aletaha D., Choy E.H., et al. Targeting IL-6: A review of data. Considerations in Medicine. 2018; 2: 12–18. DOI: 10.1136/conmed-2018-000003
- Минздрав России. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» версия 10 (08.02.2021) [Электронный ресурс]. Режим доступа: https://staticminzdrav.gov.ru/system/attachments/attaches/000/054/588/original/%D0%92%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5_%D0%9C%D0%A0_COVID-19_%28v.10%29-08.02.2021_%281%29.pdf. Ссылка активна на 03.03.2021. . Access mode of the Ministry of Health of Russia Temporary guidelines “Prevention, diagnosis and treatment of new coronavirus infection (COVID-19)” version 10 (02/08/2021) . Available from: https://static0.minzdrav.gov.ru/system/attachments/attaches/000/054/588/original/%D0%92%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5_%D0%9C%D0%A0_COVID-19_%28v.10%29-08.02.2021_%281%29.pdf (accessed 03.03.2021). (In Russ)]
- Руднов В.А., Кулабухов В.В. СЕПСИС-3: Обновленные ключевые положения, потенциальные проблемы и дальнейшие практические шаги. Вестник анестезиологии и реаниматологии. 2016; 13(4): 4–11.
Этанерцепт в лечении ювенильного артрита: от опыта клинических исследований до клинической практики
Одной из наиболее значимых для патогенеза ЮА мишеней является фактор некроза опухоли–альфа (ФНО–α) [1,3,5–11]. ФНО–α – цитокин, выполняющий очень важные функции в формировании системного воспалительного процесса. Первично он регулирует рост, выживаемость и функции клеток иммунной системы [3,7–9]. Биологические функции ФНО–α включают индукцию провоспалительных цитокинов, таких как интерлейкин–1 (ИЛ–1) и интерлейкин–6 (ИЛ–6), увеличение подвижности лейкоцитов и их миграции из кровеносного русла в ткани путем повышения проницаемости эндотелиального слоя кровеносных сосудов микроциркуляторного русла и усиления экспрессии молекул клеточной адгезии. ФНО–α способен индуцировать гибель клеток путем апоптоза, запускать каскад воспалительных реакций, ингибировать канцерогенез и репликацию вирусов. ФНО–α играет очень важную роль в генезе деструктивных процессов при ревматических заболеваниях, в которые вовлечены остеокласты, синовиальные фибробласты и хондроциты, и с его гиперпродукцией связаны такие клинические проявления, как боль, отек, формирование костных эрозий и сужение суставной щели. Из системных клинических эффектов при ревматоидном воспалении наиболее ярко действие ФНО–α проявляется в феномене потери массы тела, что давало основание называть этот цитокин «кахектином». Ингибиция действия ФНО–α позволяет рассчитывать на устранение указанных патологических процессов и обеспечить предупреждение необратимых структурных изменений суставов. Среди ингибиторов ФНО, зарегистрированных в РФ к настоящему времени (2010 г.), имеется 3 ГИБП – этанерцепт, инфликсимаб, адалимумаб. Их сравнительная характеристика представлена в таблице 1. Среди всех биологических агентов, используемых в ревматологии, наиболее обширный в мире опыт применения у детей с ювенильным артритом накоплен в отношении этанерцепта. Этанерцепт (Энбрел®) по своей структуре представляет собой белок, состоящий из двух рецепторов ФНО (рФНО2/75) с добавлением Fc–фрагмента человеческого IgG1. Таким образом, он состоит из человеческих компонентов, но в целом представляет собой искусственную молекулу, не существующую в природе. Этанерцепт связывается с молекулой ФНО, блокируя тем самым ее взаимодействие с рецепторами на клеточной поверхности. В отличие от антител к ФНОα (инфликсимаб, адалимумаб), этанерцепт не вызывает лизиса клеток, вовлеченных в процесс воспаления, и способен нейтрализовать только свободный ФНО, не оказывая влияния на ФНО, представленный в связанной с рецептором форме. Хотя клиническое значение подобных различий полностью не установлено, оно может объяснять ряд отличий в действии этих агентов, как в плане развития терапевтического эффекта, так и формирования побочных реакций. Этанерцепт, воспроизводя ингибирующий эффект природно существующих растворимых рецепторов к ФНО отличается от них более продолжительным периодом выведения и, следовательно, обладает более выраженным и длительно сохраняющимся эффектом, чем естественные растворимые рецепторы ФНО. Свое действие этанерцепт начинает реализовать вскоре после инъекции, однако клинически явный эффект обнаруживается примерно через 2–3 недели или даже ранее [12,13]. Впрочем, у больных ЮА, по–видимому, из–за сложного взаимодействия компонентов цитокиновой сети в патогенезе заболевания возможны и индивидуальные особенности ответа на терапию этанерцептом со значительной отсрочкой в достижении эффекта, что не исключает возможности дальнейшего успешного лечения. Так, например, в недавно опубликованном мультицентровом педиатрическом исследовании, выполненном в Нидерландах [14], из 179 пациентов с ювенильным идиопатическим артритом (ЮИА) у 34 детей (20%) в первые 3 месяца приема этанерцепта клинически значимого ответа не было получено. Несмотря на видимую неэффективность терапии, в данном исследовании лечение было продолжено и обнаружено, что в половине из рефрактерных наблюдений достигнуто потенцирование эффекта в более поздние сроки. Из представленных авторами данных можно отметить, что на достижение эффекта влияет клинический вариант ЮИА, впрочем, как и на эффективность в целом. Ниже всего процент «ответчиков» на терапию ингибиторами ФНО наблюдается среди пациентов с системным вариантом ЮА. В обсуждаемом Нидерландском исследовании [14] 30% уровня улучшения клинически важных показателей активности ЮИА в первые 3 месяца лечения достигли только 62% больных системным вариантом ЮИА в отличие от 85–90% пациентов с другими клиническими вариантами ЮИА. Пролонгация терапии этанерцептом более 3–х месяцев ненамного улучшило показатели эффективности при системном варианте, увеличив процент «ответчиков» с 62 до 67%. При серопозитивном полиартикулярном ЮИА продолжение терапии этанерцептом более 3 месяцев также не способствовало увеличению доли «ответчиков» на терапию, хотя этот показатель в данной когорте изначально был существенно выше, чем при системном ЮИА (85% против 62%). Напротив, при клинических вариантах ЮИА, относящихся к группе ювенильных спондилоартропатий (псориатический артрит, артрит с энтезитом), эффективность терапии этанерцептом констатирована у 100% пациентов, причем в пределах первых 3 месяцев лечения – у 90% больных ювенильным псориатическим артритом и у 83% больных, относящихся к категории «артрит с энтезитом». Таким образом, у 10% и 17% этих пациентов соответственно достигнутый эффект был отсрочен более, чем на 3 месяца. Приведенное исследование может служить наглядной иллюстрацией того, что результаты рандомизированных клинических исследований (РКИ), выполненных на предрегистрационной стадии изучения фармакологического препарата, не дают исчерпывающей информации о вызываемых им эффектах в силу «рафинированной» популяционной выборки пациентов. РКИ этанерцепта положило начало большой серии РКИ, выполненных за последние 10–12 лет Международной педиатрической ревматологической организацией по клиническим исследованиям (PRINTO – the Pediatric Rheumatology International Trials Organisation) и Педиатрической ревматологической объединенной исследовательской группы (PRCSG – Pediatric Rheumatology Collaborative Study Group). Тщательно проработанная методология выполнения исследования по изучению эффективности и безопасности этанерцепта послужила прототипом для проведения РКИ других ГИБП в педиатрической ревматологии [1,2,4,6,10,11]. Особенности «педиатрического» дизайна РКИ (особенно применительно к ГИБП) заключаются в том, что первой фазой исследования является не плацебо–контролируемая фаза, как это принято при ревматоидном артрите взрослых, а применение изучаемого препарата в открытом режиме, обычно в течение 3 месяцев (рис. 1). Если достигается 30%–е улучшение стандартных показателей активности заболевания, так называемых «ACRpedi»–критериев, то пациент вступает во вторую фазу РКИ и рандомизируется в одну из групп (группу исследуемого лекарственного средства «study medication» или группу плацебо). Этические принципы проведения клинических исследований в педиатрии предусматривают строгое соблюдение интересов ребенка, поэтому в случае обострения заболевания в плацебо–контролируемой фазе РКИ пациент преждевременно выбывает из этой фазы и в случае согласия пациента и родителей включается в 3–й этап исследования – продолжительную открытую фазу, длительность которой может составлять несколько лет. Такой вид дизайна РКИ называют «дизайн с выбыванием», а данная методика, кроме доказательств эффективности исследуемого препарата, дает дополнительную информацию о том, как долго сохраняется эффект применяемого ГИБП после его отмены, что имеет важное значение для клинической практики. Для оценки результатов клинических исследований в педиатрической ревматологии (при ЮА), кроме особого дизайна, используется и специфический инструмент оценки эффективности терапии [10,11] в виде критериев ACR pedi 30,50,70 («педиатрические» критерии Американской коллегии ревматологов 30, 50 и 70% ответа на терапию), включающие 6 показателей: 1) число «активных» суставов (из 75 суставов); 2) число суставов с ограничением функции (из 75 суставов); 3) СОЭ и/или СРБ; 4) общая оценка активности болезни, по мнению врача (ВАШ); 5) оценка общего самочувствия (активности болезни), по мнению пациента или его родителей (ВАШ); 6) оценка функциональной способности с помощью Опросника Childhood Health Assesment Quesionnare – CHAQ. Динамика перечисленных показателей в процессе лечения дает основание судить о степени эффективности: 30%–е улучшение показателей позволяет считать эффект умеренно положительным, 50% – хорошим; 70% – очень хорошим. После получения первых результатов РКИ этанерцепта с учетом отличного клинического эффекта, критерии ACRpedi были дополнены понятием 90 и 100%–й эффективности (ACRpedi90 и ACRpedi100) [1,15–18]. Этанерцепт явился первым ГИБП в педиатрической ревматологии, эффект которого был изучен в ходе многоцентрового РКИ [11,15–18], и закономерно, что этанерцепт стал первым ГИБП, зарегистрированным для лечения полиартикулярного варианта ювенильного ревматоидного артрита (ЮРА)/ЮИА в США (май 1999) и странах Европейского Союза (февраль 2000). РКИ этанерцепта, первые результаты которого были опубликованы в 2000 г. [12], было продолжено в открытом режиме приема этанерцепта вплоть до настоящего времени. Опубликованные в 2008 г. результаты охватывают 8–летний период непрерывного применения этанерцепта у детей с полиартикулярным вариантом течения ЮРА. В это исследование изначально было включено 69 пациентов, у 74% из которых к окончанию 3 месяцев применения этанерцепта в открытом режиме было достигнуто 30%–е улучшение по критериям ACR pedi. В плацебо–контролируемой фазе исследования было показано, что процент больных, достигших 30%–го улучшения, увеличился до 80% у пациентов, рандомизированных в группу этанерцепта по сравнению со снижением этого показателя до 35% в группе плацебо. В период плацебо–контролируемой фазы у 21 (81%) из 26 пациентов, получавших плацебо, отмечено обострение заболевания, тогда как среди получавших этанерцепт обострение наблюдалось у 7 (28%) из 25 пациентов (р<0,03). Пролонгация терапии этанерцептом в рамках дальнейшего открытого исследования вплоть до 8 лет непрерывного приема показала неизменное нарастание эффекта, как это представлено на диаграмме (рис. 2). Так, среди пациентов, закончивших 8–летний период непрерывного применения этанерцепта (таковых осталось 11), было отмечено достижение всеми 100% больных критериев 30, 50 и 70%–го улучшения, а у 18% – 100% улучшения [18]. Результаты, полученные по данным РКИ, могут существенно отличаться от условий реальной клинической практики. Сложная процедура организации РКИ в педиатрии обусловливает ограниченное число РКИ педиатрической ревматологии: как правило, только одно международное многоцентровое исследование для каждого ГИБП с включением относительно небольшого числа пациентов (для этанерцепта – 69; инфликсимаба – 122; адалимумаба – 171; абатацепта – 190 пациентов). Это обстоятельство резко контрастирует с опытом аналогичных РКИ при ревматоидном артрите (РА) взрослых, которые включают несколько тысяч пациентов и несколько отдельных РКИ различного дизайна. Предполагалось, что данные, полученные на популяции взрослых пациентов, могут составить доказательную базу эффективности и безопасности ГИБП и для пациентов детского возраста. По–видимому, именно поэтому все РКИ ингибиторов ФНО при ЮА включали пациентов с полиартикулярным вариантом ЮРА/ЮИА, который из всех клинических вариантов ЮА обнаруживает максимальное сходство с РА взрослых. С иммунологической точки зрения полиартикулярный ЮА не может являться эквивалентом РА, как минимум, вследствие того обстоятельства, что полиартикулярный ЮА в подавляющем большинстве случаев серонегативен по ревматоидному фактору. В реальной клинической практике максимальные трудности для курации представляют пациенты с клиническими вариантами ЮА, не имеющими эквивалентов во взрослом возрасте: системный вариант; ЮА, ассоциированный с увеитом; высокоактивным HLA–B27–ассоциированным олиго/полиартритом без вовлечения аксиального скелета. Условия РКИ предусматривают строгое соблюдение протокола с жесткими критериями включения/исключения, направленными на формирование гомогенных групп, с однотипной базисной терапией (преимущественно только метотрексат), ограничениями по включению в исследование пациентов с опытом предшествующей терапии ГИБП, ограничениями по дозе получаемых пациентом глюкокортикоидов (не более 0,2 мг/кг или 10 мг в сутки по преднизолону), существенными ограничениями по коморбидной патологии. Например, как правило, не допускается включение в РКИ пациентов с положительной реакцией Манту, пациентов, имеющих в анамнезе указания на инфекцию мочевыводящих путей, синуситы, грибковое поражение слизистых оболочек и т.д. На практике среди пациентов с рефрактерными вариантами ЮА, нуждающихся в применении ГИБП, подавляющее большинство составляют пациенты, получающие различные базисные препараты и их комбинации, в т.ч. лефлуномид, прием которого является безусловным критерием исключения для рекрутирования пациента в РКИ. Как следствие активной иммуносупрессивной терапии, у пациентов с рефрактерными вариантами ЮА высока частота коморбидных инфекций, по крайней мере, в анамнезе. Рефрактерность к терапии обусловливает невозможность снижения ниже «физиологической» дозы глюкокортикоидов, и «гормонозависимость» чаще всего выступает в качестве ведущей причины для интенсификации терапии за счет назначения ГИБП. Значительные трудности для педиатрической практики в ситуациях, требующих назначения ГИБП, представляет интерпретация данных реакции Манту и отсутствие взаимопонимания по этому вопросу детских ревматологов и детских фтизиатров. Общепринятая в педиатрии процедура разграничения понятий «тубинфицированность» и «поствакцинальная аллергия» не всегда пригодна для пациентов с ЮА, получающих многолетнюю иммуносупрессивную терапию. С другой стороны, риск активации латентного туберкулеза и его неконтролируемого течения на фоне терапии ГИБП, особенно ингибиторами ФНО, исключительно высок, поскольку ФНО является обязательным структурным компонентом туберкулезной гранулемы. Применение ингибиторов ФНО, особенно моноклональных антител (инфликсимаб, адалимумаб), которые не только инактивируют ФНО, но и подавляют его продукцию (табл. 1), создает условия для активации туберкулезной инфекции и ее диссеминации. Этим обстоятельством объясняется, что в каждом долгосрочном наблюдении больших групп пациентов, получающих ингибиторы ФНО, зарегистрировано несколько единичных случаев развития туберкулеза. За 8 лет опыта применения инфликсимаба и адалимумаба в детской клинике НИИР РАМН у 92 пациентов детского возраста с ЮА наблюдался всего один случай развития диссеминарованного туберкулеза – через 4 месяца после начала терапии инфликсимабом у 17–летней девочки с отрицательными туберкулиновыми пробами до начала применения ГИБП (рис. 3). Вследствие специфического механизма действия, отличного от действия моноклональных антител, применение этанерцепта более безопасно в отношении риска развития туберкулеза по сравнению с инфликсимабом и адалимумабом, что подтверждается многочисленными данными регистров пациентов [19]. Уникальный для педиатрической ревматологии обширный опыт применения ГИБП накоплен за 10 лет применения этанерцепта. Этот опыт обобщен и опубликован в данных национальных регистров Германии [20,21], США [22], Нидерландов [23], а также в многочисленных данных серии открытых исследований этанерцепта при различных вариантах ЮА, отраженных в обзорах [10,11,15]. Согласно постмаркетинговым данным к февралю 2009 г., около 13 850 детей были пролечены этанерцептом, что составило приблизительно 44 600 пациенто–лет. Солидный опыт применения этанерцепта в мировой клинической практике позволил сформулировать показания к назначению этанерцепта и условия мониторирования его безопасности. Показанием к назначению этанерцепта служит полиартикулярный вариант заболевания тяжелого или средней тяжести течения в случае неэффективности, как минимум, 3–месячного курса базисной терапии 1–2 препаратами (в т.ч. обязательно метотрексат) в адекватной терапевтической дозе и/или при невозможности применения метотрексата из–за развития побочных реакций. Следует отметить, что комбинация этанерцепта с метотрексатом представляется более предпочтительной по сравнению с монотерапией этанерцептом в отношении долгосрочной эффективности. Этанерцепт используется дважды в неделю в дозе 0,4 мг/кг массы тела (доза вводится дважды в неделю с интервалом 72–96 часов; максимальная доза 25 мг). В США зарегистрированные показания для лечения ЮА допускают возможность однократного в неделю применения этанерцепта в дозе 0,8 мг/кг/нед; при этом максимально допустимая доза препарата 50 мг/нед, а максимальная доза одномоментно вводимого препарата в одно место инъекции составляет 25 мг. Однократный в неделю способ введения препарата был апробирован и показал сопоставимые результаты по сравнению с 2–кратным в неделю введением [21,24]. Мониторирование безопасности препарата подразумевает, помимо рутинных гематологических и биохимических показателей, тщательное обследование на наличие туберкулезной инфекции, вирусных гепатитов, очагов активной инфекции до начала терапии этанерцептом и, как минимум, каждые полгода в процессе лечения либо по клиническим показаниям. При назначении этанерцепта в условиях реальной клинической практики следует иметь в виду относительные ограничения и необходимость более взвешенного и осторожного подхода к применению этанерцепта при системном ЮА [25–28], а также у пациентов с увеитом или риском развития ревматоидного поражения глаз [29–36]. Сенсацией в педиатрической ревматологии стало сообщение в июне 2008 г. Федерального агентства, регулирующего оборот лекарственных средств в США (FDA) о 30 случаях злокачественных опухолей у детей, подростков и молодых людей с ревматическими заболеваниями, которые лечились ингибиторами ФНО [37]. В последующем в августе 2009 г. FDA дополнила сообщение 18 дополнительными наблюдениями [38]. Таким образом, FDA были получены 48 сообщений о злокачественных опухолях в педиатрии более чем за 8–летний период (2001–2008) [39]. Анализ этих публикаций позволяет сделать вывод о том, что преимущественно онкологические заболевания развивались у пациентов с воспалительными заболеваниями кишечника (25 случаев), получавших ингибиторы ФНО: как правило, инфликсимаб в сочетании с такими иммуносупрессивными препаратами, как азатиоприн, 6–меркаптопурин или глюкокортикоиды, реже – в сочетании с метотрексатом. Только 6 из 48 пациентов получали ингибиторы ФНО в качестве монотерапии. Наиболее примечательно, что в 10 из 48 случаев развилась редкая и очень злокачественная гепатолиенальная Т–клеточная лимфома (HSTCL) [40], причем все 10 пациентов с HSTCL страдали воспалительным заболеванием кишечника и лечились анти–ФНО моноклональными антителами, 9 из 10 – инфликсимабом, 1–адалимумабом. Несмотря на то, что зарегистрированные наблюдения онкологических заболеваний на фоне лечения ингибиторами ФНО у детей превышают популяционные значения, к настоящему времени пока не сформулировано обоснованного заключения о прямой связи применения ГИБП с развитием опухолевых заболеваний. В этой связи в клинической практике перед назначением ингибиторов ФНО следует учитывать наличие таких факторов риска, как семейные случаи онкологических заболеваний, заболевания с повышенным риском развития опухолей (болезнь Крона или синдром Дауна) или предшествующее лечение цитотоксическими препаратами, такими как циклофосфамид, азатиоприн, 6–меркаптопурин. Из всего вышесказанного можно заключить, что появление в арсенале педиатра–ревматолога препарата этанерцепт существенно увеличивает терапевтические возможности в лечении рефрактерных вариантов ЮА при приемлемом профиле безопасности и позволяет надеяться на успешность лечения и прогноза этого заболевания в будущем.
Литература 1. Cassidy JT, Petty RE., Laxer R.M., Lindsley C.B. Textbook of pediatric rheumatology. 6th ed. Philadelphia: Saunders Elsevier; 2010; 794 p. 2. Szer I.S., Kimura Y., Malleson P.N., Southwood T.R. Arthritis in children and adolescents: Juvenile idiopathic arthritis. Oxford university press. 456 p. 3. Алексеева Е.И., Литвицкий П.Ф. Ювенильный ревматоидный артрит: этиология, патогенез, клиника, алгоритмы диагностики и лечения. Рук. Для врачей, преподавателей, научных сотрудников. /Под общ. Ред. А.А.Баранова. – М.: ВЕДИ, 2007; 308 с. 4. Carrasco R., Smith J.A., Lovell D. Biologic agents for the treatment of juvenile rheumatoid arthritis: current status. Paediatr Drugs 2004;6:137–146. 5. Wilkinson N., Jackson G., Gardner–Medwin J. Biologic therapies for juvenile arthritis. Arch Dis Child 2003; 88: 186–191 6. Klein A., Hornef G. Treatment strategies for juvenile idiopathic arthritis. Expert Opin Pharmacother. 2009; 10 (18); 3049–3060. 7. Beutler BA. The role of tumor necrosis factor in health and disease. J Rheumatol Suppl 1999; 57:16–21. 8. McDevitt H, Munson S, Ettinger R, Wu A. Multiple roles for tumor necrosis factor–alpha and lymphotoxin alpha/beta in immunity and autoimmunity. Arthritis Res 2002; 4 Suppl 3:S141–S152. 9. Sfikakis PP, Kollias G. Tumor necrosis factor biology in experimental and clinical arthritis. Curr Opin Rheumatol 2003; 15(4):380–6. 10. Hayward K., Wallace C. Recent developments in anti–rheumatic drugs in pediatrics: treatment of juvenile idiopathic arthritis. Arthr.Res. & Ther. 2009, 11:216 (doi:10.1186/ar2619). 11. Breda L., Del Torto M., De Sanctis S., Chiarelli F. Biologics in children’s autoimmune disorders: efficacy and safety. Eur J Pediatr. DOI 10.1007/s00431–010–1238–z 12. Lovell D.J., Giannini E.H., Reiff A., et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis. N. Engl. J. Med., 2000, 16, 342(11), 763–769. 13. Kietz D.A., Pepmueller P.H., Moore T.L. Clinical response to etanercept in polyarticular course juvenile rheumatoid arthritis. J Rheumatol 2001;28: 360–362. 14. Otten M., Prince F., Twilt M. et al. Delaed clinical response in patients with juvenile idiopathic arthritis treated with etanercept. J.Rheumatol. 2010; 37: 665–667. 15. Pain C., McCann L. Challenges in the management of juvenile idiopathic arthritis with etanercept. Biologics: Targets & Therapy 2009:3 127–139. 16. Lovell D.J., Giannini E.H., Reiff A., Jones O.Y., Schneider R., Olson J.C., et al. Long–term efficacy and safety of etanercept in children with polyarticular–course juvenile rheumatoid arthritis: interim results from an ongoing multicenter, open–label, extended–treatment trial. Arthritis Rheum 2003; 48: 218–226. 17. Lovell D.J., Reiff A., Jones O.Y., Schneider R., et al. Long–term safety and efficacy of etanercept in children with polyarticular–course juvenile rheumatoid arthritis. Arthritis Rheum 2006; 54: 1987–1994. 18. Lovell D.J., Reiff A., Ilowite N.T., Wallace C.A. et al. Safety and efficacy of up to eight years of continuous Etanercept therapy in patients with Juvenile rheumatoid arthritis. Arthritis Rheum 2008; 58; 5: 1496–1504. 19. Raychaudhuri S.P., Nguen C.T., Raychaudhuri S.K., Gershwin M.E. Incidence and nature of infectious disease in patients treated with anti–TNF agents. Autoimmuniti reviews 2009; 67–81; www elsevier.com. 20. Horneff G, Schmeling H, Biedermann T, Foeldvari I, Ganser G, Girschick HJ et al. The German etanercept registry for treatment of juvenile idiopathic arthritis. Ann Rheum Dis 2004; 63(12):1638–44. 21. Horneff G, De Bock F, Foeldvari I, Girschick HJ, Michels H, Moebius D et al. Safety and efficacy of combination of etanercept and methotrexate compared to treatment with etanercept only in patients with juvenile idiopathic arthritis (JIA): preliminary data from the German JIA Registry. Ann Rheum Dis 2009; 68(4):519–25. 22. Giannini EH, Ilowite NT, Lovell DJ, Wallace CA, Rabinovich CE, Reiff A et al. Long–term safety and effectiveness of etanercept in children with selected categories of juvenile idiopathic arthritis. Arthritis Rheum 2009; 60(9):2794–804. 23. Prince F.H.M., Twilt M., ten Cate R., Van Rossum M.A.J., et al. Long–term follow–up on effectiveness and safety of etanercept in JIA: the Dutch national register. Ann Rheum Dis published online 15 Apr 2008 doi:10.1136/ard.2007.087411 24. Horneff G., Ebert A., Fitter S.,et al. Safety and efficacy of once weekly etanercept 0.8 mg/kg in a multicentre 12 week trial in active polyarticular course juvenile idiopathic arthritis. Rheumatology 2009;48:916–919 25. Quartier P, Taupin P, Bourdeaut F, Lemelle I, Pillet P, Bost M et al. Efficacy of etanercept for the treatment of juvenile idiopathic arthritis according to the onset type. Arthritis Rheum 2003; 48(4):1093–101. 26. Eberhard BA, Ilowite NT. Response of systemic onset juvenile rheumatoid arthritis to etanercept: is the glass half full or half empty? J Rheumatol 2005; 32(5):763–765. 27. Kimura Y, Pinho P, Walco G, Higgins G, Hummell D, Szer I et al. Etanercept treatment in patients with refractory systemic onset juvenile rheumatoid arthritis. J Rheumatol 2005; 32(5):935–42. 28. Russo RA, Katsicas MM, Zelazko M. Etanercept in systemic juvenile idiopathic arthritis. Clin Exp Rheumatol 2002; 20(5):723–6. Reiff A, Takei S, Sadeghi S, Stout A, Shaham B, Bernstein B et al. Etanercept therapy in children with treatment–resistant uveitis. Arthritis Rheum 2001; 44(6):1411–5. 29. Reddy AR, Backhouse OC. Does etanercept induce uveitis? Br J Ophthalmol 2003; 87(7):925. 30. Schmeling H, Horneff G. Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatology (Oxford) 2005; 44(8):1008–11. 31. Smith JA, Thompson DJ, Whitcup SM, Suhler E, Clarke G, Smith S et al. A randomized, placebo–controlled, double–masked clinical trial of etanercept for the treatment of uveitis associated with juvenile idiopathic arthritis. Arthritis Rheum 2005; 53(1):18–23. 32. Galor A, Perez VL, Hammel JP, Lowder CY. Differential effectiveness of etanercept and infliximab in the treatment of ocular inflammation. Ophthalmology 2006; 113(12):2317–23. 33. Foeldvari I, Nielsen S, Kummerle–Deschner J, Espada G, Horneff G, Bica B et al. Tumor necrosis factor–alpha blocker in treatment of juvenile idiopathic arthritis–associated uveitis refractory to second–line agents: results of a multinational survey. J Rheumatol 2007; 34(5):1146–50. 34. Lim LL, Fraunfelder FW, Rosenbaum JT. Do tumor necrosis factor inhibitors cause uveitis? A registry–based study. Arthritis Rheum 2007; 56(10):3248–52. 35. Tynjala P, Lindahl P, Honkanen V, Lahdenne P, Kotaniemi K. Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis 2007; 66(4):548–50. 36. 3Lim LL. Uveitis following the use of tumor necrosis factor alpha inhibitors: Reply on comments. Arthritis Rheum 2008; 58:1556–7. 37. U.S.Food and Drug Administration. Information for Healthcare Professionals: Tumor Necrosis Factor (TNF) Blockers (marketed as Remicade, Enbrel, Humira, Cimzia, and Simponi). https://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm174474.htm 2009. 38. U.S.Food and Drug Administration. Early Communication About an Ongoing Safety Review of Tumor Necrosis Factor (TNF) Blockers (marketed as Remicade, Enbrel, Humira, and Cimzia). CDER Homepage. https://www.fda.gov/cder/drug/early_comm/TNF_blockers.htm 2008. 39. U.S.Food and Drug Administration. Follow–up to the June 4, 2008 Early Communication about the Ongoing Safety Review of Tumor Necrosis Factor (TNF) Blockers (marketed as Remicade, Enbrel, Humira, Cimzia, and Simponi). https://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm174449.htm 2009. 40. Diak P., Siegel J., Grenade L. Malignancy in children and TNF blockers: forty eight cases reported to the Food and Drug administration. Arthr. Rheum 2010; 61;8; 2517–2524.