Автор:
Амеличева Алена Александровна медицинский редактор
Быстрый переход Лечение аутоиммунной гемолитической анемии
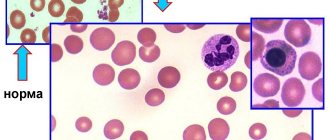
Аутоиммунная гемолитическая анемия (АИГА) — группа редких приобретенных гематологических болезней и синдромов, характеризующихся гемолизом (разрушением) эритроцитов, вследствие образования аутоантител к антигенам этих компонентов крови.
АИГА может возникнуть в любом возрасте, чаще ей подвержены женщины (60%). Патология развивается постепенно или внезапно.
Выделяют два основных типа АИГА: тепловую (аутоантитела наиболее активны/атакуют эритроциты при температуре 37-40 °C) и холодовую — с холодовыми гемолизинами (аутоантитела наиболее активны при температуре менее 30 °C, эритроциты разрушаются даже при локальном воздействии холода, например, когда человек пьет холодную воду или моет руки в холодной воде).
Распространенность АИГА составляет 1 случай на 70-80 тысяч человек в год.
Причины
Причины возникновения заболевания изучены недостаточно. На сегодняшний день известно, что примерно 50% случаев т-АИГА являются идиопатическими (развиваются спонтанно). Тогда как х-АИГА ассоциированы с другими заболеваниями или возникают с ними одновременно: аутоиммунными, онкологическими, инфекционными (системная красная волчанка, лимфолейкоз, неходжкинская лимфома, вирус Эпштейна — Барр, цитомегаловирус, микоплазменная пневмония, гепатит, ВИЧ). Играть роль в развитии АИГА может и прием определенных лекарств, например, препаратов пенициллинового ряда (лекарственно индуцированная АИГА).
3.Симптомы и диагностика
Аутоиммунный лизис эритроцитов может внезапно начаться и так же внезапно, без какого-либо вмешательства, закончиться. В других случаях заболевание развивается исподволь и длительное время протекает бессимптомно.
Встречается и неуклонно прогрессирующее течение, – например, с повышенной чувствительностью пациента к холоду.
Наиболее типичными симптомами аутоиммунной гемолитической анемии выступают «беспричинная» (на самом деле вызванная тканевой гипоксией) утомляемость, слабость, сердцебиение, одышка, дискомфортное ощущение тяжести в левом подреберье (имеет место спленомегалия, преимущественное уничтожение эритроцитов происходит именно в селезенке).
Иногда отмечаются боли в сердце и/или пояснице, тошнота и частая рвота. При более выраженной патологии наблюдается желтушность. Некоторые патогенетически разные типы заболевания приводят к «синдрому черной мочи», в клинике других формируется ангиоспастическое реагирование на холод и развивается вторичный синдром Рейно, холодовая крапивница или, при наиболее тяжелых нарушениях тканевой трофики в конечностях, – акрогангрена.
Подозрение на гемолитическую анемию возникает, как правило, при наличии соответствующей клиники и жалоб, а также характерного анамнеза (факторы риска см. выше). Однако окончательный диагноз устанавливается и подтверждается тщательным, чаще всего многократным лабораторным исследованием крови (прямая и непрямая пробы Кумбса, общеклинический, биохимический анализ и т.д.).
О нашей клинике м. Чистые пруды Страница Мединтерком!
Симптомы
У некоторых людей заболевание может протекать бессимптомно, особенно если АИГА развивается постепенно (разрушение эритроцитов не настолько масштабно). В основном же симптомы АИГА схожи с клиническими проявлениями других типов анемии (слабость, повышенная утомляемость, бледность кожных покровов).
Симптомы при более тяжелом течении заболевания (быстром разрушении эритроцитов) включают желтушность кожных покровов и видимых слизистых оболочек, слабость, повышенную утомляемость с тахикардией и одышкой при физической нагрузке, ощущение дискомфорта в животе, чувство переполнения, холодные конечности и периферический цианоз (при холодовой АИГА). При физикальном осмотре выявляется спленомегалия (патологическое увеличение размеров селезенки) различной степени.
Если АИГА развивается на фоне другой патологии, преобладать могут симптомы основного заболевания, например: увеличение и болезненность лимфатических узлов, лихорадка, сильные боли в спине и ногах, головные боли, рвота, диарея, изменение цвета мочи на темно-коричневый.
1.Общие сведения
Анемия (малокровие, досл. греч. «обескровленность») – синдром, сопутствующий множеству заболеваний и патологических состояний. Анемией называют снижение концентрации гемоглобина в крови, что чаще всего связано с дефицитом его носителей, красных кровяных телец – эритроцитов. Вступая, благодаря высокому содержанию железа в химическом составе, в соединение с легочным кислородом и затем распространяя его в связанном виде с током крови, гемоглобин обеспечивает оксигенацию всех тканей и органов. Соответственно, снижение удельного числа эритроцитов и/или недостаток гемоглобина в них, – что и составляет суть анемии, – приводит к нарушениям клеточного дыхания и развитию полиморфной клинической картины. Многообразие симптоматики определяется, в основном, конкретной этиопатогенетической основой анемии как синдрома: это может быть авитаминоз, несбалансированное питание, заболевания кроветворной системы (в частности, костного мозга), массивные одномоментные кровопотери или хронические кровотечения, инфекции, паразитозы и т.д.
Гемолитическая анемия встречается существенно реже прочих анемий (железодефицитная, гемопоэтическая и др.) и, в свою очередь, представляет собой большую группу врожденных и приобретенных заболеваний, общая суть которых состоит в аномально быстром разрушении эритроцитов, – «гемолитическая» означает «вызванная растворением, распадом крови». В разнородной группе таких малокровий наиболее распространены аутоиммунные гемолитические анемии, включающие, опять же, несколько вариантов.
В отношении аутоиммунной гемолитической анемии прояснены пока далеко не все вопросы, и это заболевание изучается сегодня настолько интенсивно, насколько позволяет его относительная редкость. Установлено, в частности, что манифестация может произойти в любом возрасте, что среди заболевающих преобладают лица женского пола, что типы течения и варианты исхода широко варьируют. Большинство исследователей в настоящее время склоняются к гипотезе о полиэтиологическом (многопричинном) характере заболевания.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Лечение аутоиммунной гемолитической анемии
Первой линией терапии тепловой аутоиммунной гемолитической анемии являются глюкокортикостероиды. Высокодозная монотерапия преднизолоном может назначаться в течение 3-6 недель с постепенным снижением дозы или отменой в дальнейшем. Однако из-за сильно выраженных побочных эффектов такого лечения все чаще используют краткосрочную пульс-терапию метилпреднизолоном или дексаметазоном. Примерно треть пациентов достигают ремиссии, остальным же необходима поддерживающая терапия ГКС.
При неэффективности стероидной терапии рассматривается возможность проведения спленэктомии (хирургическое удаление селезенки), биологической терапии (ритуксимаб) или иммуносупрессивной терапии (циклоспорин, азатиоприн и др.).
Прогноз зависит от первопричины заболевания, своевременно начатого и правильно подобранного лечения. Благоприятный прогноз (достижение ремиссии, длительная ремиссия) полностью связан с положительным терапевтическим ответом у пациента и отсутствием осложнений.
Пациентам с холодовой аутоиммунной гемолитической анемией рекомендуется избегать триггеров (холода, в том числе инфузий холодных растворов), а также пройти лечение основного заболевания (например, лимфомы), если с ним связано развитие х-АИГА. Терапия первой линии при х-АИГА — ритуксимаб. ГКС не является терапией выбора из-за низкого терапевтического ответа у пациентов. Также неэффективна и спленэктомия. В тяжелых случаях рекомендован плазмоферез.
Особенности и преимущества лечения аутоиммунной гемолитической анемии в клинике Рассвет
Аутоиммунная гемолитическая анемия достаточно редкое заболевание крови, по мере его изучения критерии диагностики и лечения дорабатываются и обновляются.
Гематологи клиники Рассвет придерживаются стандартизированных диагностических критериев и терапевтических подходов, разработанных Международной консенсусной группой по АИГА. Мы осознаем важность точного диагностического поиска у таких пациентов, поскольку течение заболевания и эффективное лечение зависят от типа задействованных антител. Для диагностики первичной АИГА мы используем моноспецифический прямой антиглобулиновый тест, обязательно выясняем причины манифестации вторичной АИГА, т. е. выявляем основное заболевание, с которым связано развитие гемолитической анемии.
При лечении т-АИГА мы используем глюкокортикостероиды. Ритуксимаб назначаем только на раннем этапе тяжелого течения заболевания, а также при отсутствии быстрого терапевтического ответа на стероиды. Ритуксимаб в сочетании с антинеопластическим препаратом назначаем пациентам с х-АИГА в случаях, если их состояние требует лечения по клиническим признакам.
Гематология Рассвета представлена врачами высокой квалификации, имеющими большой опыт в выявлении и лечении сложнодиагностируемых и редких болезней. В своей работе наши специалисты используют международные протоколы лечения, применяют только безопасные, доказанные и эффективные методы.
Анемии, патология гемостаза, онкогематология
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Приобретенные гемолитические анемии, при которых повышенное разрушение эритроцитов является результатом разрушающего воздействия аутоантител, направленных против неизмененных антигенов мембраны собственных эритроцитов больного, называются аутоиммунными.
Предполагается, что, как и при других аутоиммунных заболеваниях, причины выработки антиэритроцитарных аутоантител лежат в нарушении функции иммунной системы организма, в частности–в нарушении способности Т-клетки-супрессора держать под контролем аутоиммунные или «запретные» клоны В-лимфоцитов, способные вырабатывать антитела против антигенов собственного организма.
Частота АИГА составляет 1:80000 населения, чаще болеют женщины.
Течение и прогноз АИГА во многом определяется типом аутоантиэритроцитарных антител, циркулирующих в крови больного.
Аутоиммунные антитела имеют структуру чаще IgG, реже – IgM и IgA. Они могут обнаруживать наибольшую активность при высокой температуре тела (тепловые антитела), или при низкой температуре (холодовые антитела), или фиксироваться на эритроцитах при низкой температуре, а оказывать повреждающее действие при температуре тела (двухфазные антитела Донат-Ландштейнера).
По механизму повреждающего действия антиэритроцитарные антитела разделяются на:
— агглютинины, вызывающие склеивание (агглютинацию) эритроцитов;
— гемолизины, обуславливающие разрушение (лизис) эритроцитов при участии системы активированного комплемента;
— опсонины, способствующие фагоцитозу эритроцитов.
В зависимости от серологических особенностей выделяют два основных типа агглютининов: полные и неполные.
Полные агглютинины вызывают склеивание эритроцитов в любой среде: водно-солевой или коллоидной. Большинство полных агглютининов относится к IgM. Благодаря большой величине молекулы аутоантитела типа IgM способны преодолевать отрицательное электростатическое взаимодействие между эритроцитами, поэтому даже в солевой среде сыворотка, содержащая полные IgM агглютинины, вызывает склеивание эритроцитов, если на их поверхности присутствуют антигены, против которых эти IgM-аутоантитела направлены.
Неполные антитела чаще имеют структуру IgG или IgA и неспособны вызывать агглютинацию эритроцитов в водно-солевой среде. Склеивание эритроцитов неполными антителами может происходить только в коллоидной среде, в тех случаях, когда им удается изменить электростатические силы, вызывающие отталкивание эритроцитов. У больных с аутоиммунной гемолитической анемией, вызванной неполными агглютининами, антитела фиксируются на поверхности эритроцитов к соответствующему антигену (чаще – системы резус), вызывая их сенсибилизацию, но не процесс внутрисосудистого склеивания (агглютинации).
Гемолизины встречаются реже, чем агглютинины. В зависимости от температурного оптимума различают тепловые, холодовые и двухфазные гемолизины. Большинство гемолизинов относится к IgG-типу, реже – к IgМ и IgА. Фиксируясь на поверхности эритроцитов, обладающих соответственным антигеном, против которого направлены антитела, гемолизины вызывают деструкцию эритроцитов, главным образом, через активацию системы комплемента, компоненты которого обладают протеолитическим действием.
Опсонинами называют антитела, способствующие фагоцитозу эритроцитов моноцитами и макрофагами. Опсонины обычно обнаруживаются одновременно с холодовыми гемолизинами. Выявляются опсонины по эритрофагоцитозу, наступающему после инкубации исследуемой крови с сывороткой больного.
АИГА подразделяются на отдельные варианты в зависимости от серологических особенностей или типа аутоантител, которые вызывают их развитие. Кроме того, в каждом серологическом варианте выделяются идиопатические и симптоматические формы, которые возникают у больных, уже имеющих другие заболевания.
Классификация АИГА
I. АИГА с неполными тепловыми агглютининами:
— идиопатические;
— симптоматические у больных с лимфопролиферативными заболеваниями (хронический лимфолейкоз, лимфомы), СКВ, РА, узелковый периартериит, опухоли яичников, заболевания щитовидной железы.
II. АИГА с тепловыми гемолизинами:
— идиопатические;
— симптоматические у больных с миелофиброзом и хроническим лимфолейкозом.
III. АИГА с полными холодовыми агглютининами:
— идиопатические;
— симптоматические у больных после перенесенной вирусной пневмонии, инфекционного мононуклеоза, у больных с лимфопролиферативными заболеваниями, макроглобулинемей Вальденстрема, моноклональной гаммапатией и у больных с хроническим гепатитом.
IV. АИГА с двухфазными холодовыми гемолизинами типа Донат-Ландштейнера:
— идиопатические;
— симптоматические у больных с далеко зашедшими формами сифилиса, при вирусных инфекциях (цитомегаловирус).
АИГА с неполными тепловыми агглютининами
АИГА с неполными тепловыми агглютининами является наиболее распространенной формой (80 – 85%) этого типа гемолитических анемий. АИГА с неполными тепловыми агглютининами (НТА) встречается о всех возрастных группах, но чаще у людей среднего возраста, с частотой 1:80000 населения. Среди больных отмечается некоторое преобладание женщин (55-60%). С равной частотой встречаются идиопатические и симптоматические формы.
Клиника
АИГА с НТА, как правило, начинается постепенно и характеризуется медленно прогрессирующей бледностью, желтушностью кожи и слизистых, иногда – субфебрильной температурой. В связи с постепенной адаптацией больного к медленному снижению уровня гемоглобина, общее состояние больного страдает незначительно. Реже встречается острое и подострое начало болезни с уменьшением гематокрита на 5% и более каждые 24 часа, при этом быстро нарастает желтуха, появляется резка общая слабость, цианоз, одышка, тахикардия и другие признаки сердечно-сосудистой недостаточности. В дальнейшем заболевание, как правило, приобретает хроническое течение, при котором эпизоды усиления гемолиза сменяются состоянием клинико-гематологической компенсации. Рецидивы гемолиза могут провоцироваться инфекциями, хирургическими вмешательствами и беременностью.
Незначительное увеличение печени отмечается у 1/2 – 1/3 больных, а умеренное увеличение селезенки – у более, чем 1/2 больных.
Механизм гемолиза при АИГА с НТА имеет внутриклеточный характер, т.е. разрушение эритроцитов осуществляется макрофагами, обладающими рецепторами к Ig. Поскольку аутоантитела имеют свою структуру Ig, то макрофаги фагоцитируют те эритроциты, на поверхности которых фиксированы антитела, чаще типа IgG. Фагоцитозу могут подвергаться эритроциты целиком (эритрофагоцитоз) или их фрагменты. В последнем случае эритроциты уменьшаются в размерах и принимают вид микроцитов.
Наиболее интенсивно внутриклеточный гемолиз протекает в селезенке, где в синусах происходит физиологическое замедление кровотока и, следовательно, удлиняется продолжительность контакта сенсибилизированных эритроцитов и макрофагов, выстилающих стенки синусов.
Аналогичный тип внутриклеточного гемолиза при АИГА с НТА имеет место и в печени, костном мозге и других органах, богатых макрофагами.
Лабораторные данные
Анемия при АИГА с НТА носит нормохромный и слегка макроцитарный характер (за счет увеличенного содержания ретикулоцитов, больших по своим размерам, чем нормоциты). При просмотре мазка крови отмечается заметная полихромазия и анизоцитоз, присутствие микросфероцитов и нормобластов (особенно у больных с активным гемолизом). Феномен аутоагглютинации наблюдается редко. Содержание ретикулоцитов повышено. Продолжительность жизни эритроцитов укорочена.
Осмотическая резистентность за счет изменения свойств мембраны фиксированными аутоантителами обычно снижена, этим же объясняется сфероцитоз эритроцитов.
Число лейкоцитов чаще всего слегка увеличено во время гемолитических кризов. Количество тромбоцитов нормальное или несколько снижено. При наличии, помимо антиэритроцитарных, также и тромбоцитарных антител (синдром Фишер-Ивенса) развивается сопутствующая глубокая тромбоцитопения, тяжелая вызвать тяжелые геморрагические осложнения.
В костном мозге обнаруживается выраженная гиперплазия красного ростка кроветворения, иногда с мегалобластными чертами, вследствие относительной недостаточности фолатов, потребление которых активно пролиферирующими нормобластами значительно повышается.
В плазме определяется гипербилирубинемия за счет неконъюгированной (непрямой) фракции; в кале повышается количество стеркобилина, а в моче – уробилина.
Диагноз и дифференциальный диагноз
Диагноз АИГА с НТА устанавливается на основании обнаружения клинических и лабораторных признаков приобретенного внутриклеточного гемолиза и положительных результатов прямой антиглобулиновой пробы Кумбса.
Проба Кумбса выявляет фиксированные на эритроцитах антитела с помощью антиглобулиновой антисыворотки, полученной путем иммунизации животных глобулиновой фракцией плазмы человека. Антиглобулиновая антисыворотка животных содержит антитела (типа полных агглютининов), направленные против глобулинов человека (рис. 11). Поскольку аутоантитела при АИГА с НТА, фиксированные на поверхности эритроцитов по своей структуре – глобулины, под действием антиглобулиновой сыворотки в солевой среде происходит агглютинация сенсибилизированных эритроцитов, что подтверждает наличие на их поверхности аутоантител и диагноза АИГА с НТА.
Отрицательная прямая проба Кумбса, однако, не исключает наличие АИГА с НТА, а может свидетельствовать и небольшой плотности аутоантител на поверхности эритроцита (менее 200 молекул). В этих случаях для подтверждения диагноза используются более чувствительные тесты: трипсин- или папаин-Кумбс тест и агрегат-геммаглютинизационная проба, разрешающая способность которых более, чем в 100 раз превышает таковую у стандартной прямой пробе Кумбса.
Дифференцировать АИГА с НТА иногда приходится с лекарственными иммунными гемолитическими анемиями (ЛИГА), при которых также может быть положительной прямая проба Кумбса. В основе ЛИГА лежит изменение антигенной структуры мембраны эритроцита под действием лекарственного препарата – гаптена, результатом чего является появление на эритроците нового антигена и, как следствие, выработка к нему антител. Среди препаратов, которые могут вызвать иммунный гемолиз, следует упомянуть α-метилдопа, цефалоспорины, рифампицин, анальгин, хинидин, парацетамол и др. Поэтому у всех больных с положительной прямой пробой Кумбса, собирая анамнез, необходимо исключить длительный прием лекарственных препаратов, отмена которых обычно ведет к прекращению гемолиза и делает пробу Кумбса отрицательной.
Лечение
Основным методом лечения АИГА с НТА является назначение кортикостероидов (преднизолона или его аналогов). В среднем используется 1 мг преднизолона на кг веса больного (60-80 мг/сутки). В такой дозе преднизолон назначается до нормализации уровня гемоглобина, исчезновения желтухи и других лабораторных признаков гемолиза, что иногда сопровождается отрицательным результатом прямой пробы Кумбса. Затем дозу преднизолона постепенно снижают по 0,5-1 таб. в 2-3 дня до полной отмены. Лечение преднизолоном приводит к нормализации концентрации гемоглобина у 75% больных, хотя прямая проба Кумбса при этом может оставаться положительной.
При неэффективности кортикостероидов, что становится ясным в течение 2-х недель наблюдения за больным, или при рецидиве гемолиза после его отмены показана спленэктомия, которая может привести к полному выздоровлению больного или позволит увеличить интервалы между курсами терапии кортикостероидами.Для лечения больных, резистентных к преднизолону и при отсутствии эффекта от спленэктомии, используются цитостатики, иммуносупрессанты: имуран или 6-меркаптопурин в дозе 100-150 мг в сутки, циклофосфан в дозе 200 мг/сутки, хлорбутин 5-10 мг/сутки, циклоспорин 5 мг/кг/сутки и др. В большинстве случаев иммуносупрессивная терапия приводит к улучшению гематологических показателей, однако, стойкая ремиссия наблюдается нечасто.
В течение последних лет в лечении резистентных форм АИГА используются моноклональные антитела к CD20 – Ритуксимаб (Мабтера) внутривенно 375 мг/м2 1 раз в неделю в течение 4х недель частота ремиссий достигает 55-80%, поддерживающей терапии обычно не требуется. В тяжелых случаях может использоваться плазмаферез.
Положительный эффект иногда оказывает внутривенное введение больших доз иммуноглобулинов, нейтрализующих аутоантитела и их воздействие на эритроциты. К сожалению, отмена в/в введения иммуноглобулинов сопровождается рецидивом заболевания.
В случаях глубокой анемии с симптомами гипоксии переливать кровь больным с АИГА с НТА можно только специально подобранную эритроцитарную массу. С этой целью на станциях переливания крови или банках крови эритроциты доноров (обычно от 15-20 человек) инкубируются (каждый образец отдельно) в плазме больного при 370С. После этого с каждым образцом донорских эритроцитов производится прямая проба Кумбса. В случае агглютинации донорских эритроцитов антиглобулиновой антисывороткой использовать их для переливания нельзя, т.к. на мембране донорских эритроцитов содержатся те же антигены, против которых направлены антитела в плазме больного. Можно переливать только те донорские эритроциты, которые после инкубации в плазме больного дали отрицательную прямую пробу Кумбса.
Течение и прогноз
Для АИГА с НТА характерно волнообразное течение с чередованиями клинического благополучия и рецидивов болезни. Продолжительность заболевания колеблется от нескольких месяцев до многих лет. У ¼ больных наступает полное выздоровление со стойким переходом положительной пробы Кумбса в отрицательную.
В целом прогноз при АИГА с НТА следует считать серьезным, особенно при вторичных формах, осложняющих хронический лимфолейкоз и СКВ.
АИГА с полными тепловыми гемолизинами (ТГ)
АИГА, обусловленная исключительно гемолизинами, встречается довольно редко. Чаще тепловые гемолизины обнаруживаются у больных АИГА с НТА, что значительно ухудшает прогноз при этом заболевании.
Клиника
АИГА с ТГ может протекать как остро, так и хронически. Иктеричность кожи и слизистых выражены незначительно. Во время гемолиза возможны боли в брюшной полости и повышение температуры тела. В период гемолитического криза могут развиваться тромбозы различной локализации.
Печень и селезенка обычно не увеличены. Поскольку разрушение эритроцитов под действием тепловых гемолизинов происходит при активном участии активированного комплемента внутри сосудов, клинические проявления включают появление черной мочи из-за содержанияв ней окисленного гемоглобина или гемоглобинурию. При хроническим внутрисосудистом гемолизе у больного АИГА с ТГ в моче также присутствует гемосидерин.
Лабораторные данные
Нормохромная нормоцитарная анемия, ретикулоцитоз. В плазме повышается уровень свободного гемоглобина и снижение концентрации гаптоглобина. В моче – гемоглобинурия и гемосидеринурия. Участие комплемента в процессах гемолиза при АИГА с ТГ приводит к снижению активности комплемента, причем компоненты комплемента С3, С4, С9 могут быть обнаружены в фиксированном состоянии на поверхности эритроцитов с помощью антикомплементарной антисыворотки.
Диагностика
Проба Кумбса у больных с гемолизиновой АИГА обычно отрицательная. Диагностируется это заболевание по тесту на аутогемолиз: кровь больного, взятая с цитратом, помещается в термостат при 370С. Через 30 – 40 минут происходит покраснение плазмы вследствие разрушения эритроцитов присутствующими в плазме тепловыми аутогемолизинами.
Лечение
В терапии АИГА с ТГ пробуют использовать кортикостероиды и иммунодепрессанты. Иногда отмечается развитие длительной ремиссии, однако, полное выздоровление наблюдается редко.
Прогноз
Прогноз гемолизиновой АИГА зависти от частоты и интенсивности эпизодов гемолиза.
Аутоиммунные гемолитические анемии с полными холодовыми агглютининами
АИГА с полными холодовыми агглютининами (ПХА), или холодовая агглютининовая болезнь (ХАБ), встречается, главным образом, у пожилых людей. Чаще встречаются симптоматические формы ХАБ у больных хроническим лимфолейкозом, макроглобулинемией Вальденстрема, злокачественных лимфомах и при моноклоновой гаммапатии. У молодых людей ХАБ может появиться после инфекционного мононуклеоза, микоплазменной пневмонии. ХАБ составляет около 10 – 20% всех случаев АИГА. Несколько чаще ХАБ болеют женщины.
Клиника
ХАБ свойственно хроническое течение. Заболевание начинается постепенно: характерной особенностью болезни является плохая переносимость холода, под воздействием которого у больных появляется «акроцианоз» в виде посинения и побледнения кожи пальцев, ушей и кончика носа. Изменение цвета кожи может сопровождаться нарушением чувствительности и появлением болей. Эти симптомы, характерные для синдрома Рейно, обычно обратимы: исчезают, как только больной попадает в теплое помещение. Однако, при длительном пребывании на холоде возможно развитие гангрены в местах охлаждения тела. Активность гемолиза при ХАБ, как правило, невелика, поэтому может быть лишь легкая иктеричность кожи и слизистых, печень и селезенка обычно не увеличены. Разрушение агглютинировавших эритроцитов осуществляется макрофагами, т.е. гемолиз носит внутриклеточный характер.
Лабораторные данные
Анемия обычно носит нормохромный и нормоцитарный характер, а уровень гемоглобина резко снижается до 80 г/л. При просмотре мазков крови обращает на себя внимание выраженная спонтанная аутоагглютинация эритроцитов, что затрудняет их подсчет.
Диагноз и дифференциальный диагноз
Диагноз ХАБ основывается на способности сыворотки больного в условиях холода вызывать агглютинацию донорских эритроцитов группы 0. Титр антител, т.е. степень разведения, при котором сохраняется способность сыворотки больного агглютинировать эритроциты, колеблется от 1:1000 до 1:1000000. Титр агглютининов и температурный оптимум их действия во многом определяет клинику заболевания. Холодовые агглютинины относятся к IgM и обычно направлены против антигенов мембраны эритроцитов типа I\i.
Дифференцировать ХАБ нередко приходится с заболеваниями, сопровождающимися нарушением микроциркуляции на холоде: криоглобулинемией и синдромом Рейно сосудистого генеза, нередко осложняющими ревматические заболевания (ревматоидный артрит).
Лечение
Спленэктомия и кортикостероиды при ХАБ обычно неэффективны. Положительные результаты дает использование иммуносупрессантов (хлорбутин, циклофосфан). Хотя необходимость в гемотрансфузиях при ХАБ возникает относительно редко, следует помнить, что больным с этим заболеванием можно переливать только отмытые в физиологическом растворе эритроциты, не содержащие на своей поверхности комплемент.
В большинстве случаев хороший эффект дают такие простые мероприятия, как избегание контакта с холодом, согревание больного и постельный режим.
Течение и прогноз
Течение ХАБ относительно доброкачественное с периодами ухудшения зимой и почти полным исчезновением симптомов летом. Полного выздоровления от ХАБ практически не бывает, вместе случаи летального исхода встречаются крайне редко.
При симптоматических формах ХАБ прогноз в основном определяется основным заболеванием.
Аутоиммунные гемолитические анемии с двухфазными холодовыми гемолизинами или пароксизмальная холодовая гемоглобинурия (ПХГ)
ПХГ является одним из наиболее редко встречающихся видов АИГА. ПХГ характеризуется эпизодами (пароксизмами) внутрисосудистого гемолиза, гемоглобинурией, которые провоцируются охлаждением.
ПХГ вызывается антителами IgG типа, обычно направленными против Р-антигена эритроцитов и которые фиксируются на них при низкой температуре. Гемолиз же происходит при участии комплемента при температуре тела.
Донат и Ландштейнер еще в начале XX века выявили причинную связь между запущенным сифилисом, особенно его врожденной формой, и ПХГ. В настоящее время установлено, что роль сифилиса в развитии ПХГ невелика, однако, это заболевание может осложнять течение некоторых острых вирусных инфекций (корь, краснуха, инфекционный мононуклеоз и др.) или возникать без установленной причины (идиопатическая форма).
Клиника
ПХГ встречается во всех возрастных группах, но чаще у детей. С одинаковой частотой поражаются оба пола. Наиболее характерной особенностью ПХГ является появление мочи черного цвета после местного или общего переохлаждения, особенно в течение достаточно длительного времени.
Заболевание начинается остро: через несколько минут или часов после переохлаждения появляются мышечные боли, боли в брюшной полости, общая слабость, рвота и потрясающий озноб с повышением температуры тела до фебрильных цифр. Во время этого приступа или вскоре после него выделяется черная моча. В дальнейшем появляется желтушность кожных покровов и склер. При стертых формах, которые наблюдаются у ½ больных, все эти симптомы выражены значительно слабее.
Лабораторные данные
Анемия развивается только в период гемолитического криза. Выраженность анемии и ретикулоцитоз зависят от интенсивности и частоты пароксизмов гемолиза.
В крови повышается концентрация свободного гемоглобина (во время криза). В моче – гемоглобинурия, отсюда – ее черное окрашивание.
Диагностика
Присутствие двухфазныхаутоантител типа Донат-Ландштейнера можно установить по гемолизу при 37о предварительно охлажденной крови, что проявляется покраснением плазмы (проба Донат-Ландштейнера). Установлено, что двухфазные гемолизины, в отличие от холодовых агглютининов, редко присутствуют в крови в высоком титре.
Проба Кумбса, если она проведена при низкой температуре, будет положительной, а в стандартных условиях результаты этой пробы отрицательные.
Лечение
При симптоматических формах ПХГ, как правило, наблюдается спонтанное выздоровление по мере излечения от основного заболевания. В терапии идиопатических форм важнейшую роль играют профилактические меры, направленные на предотвращение переохлаждения.
Кортикостероиды и спленэктомия при ПХГ неэффективны.
Аутоиммунная анемия: профилактика и лечение
Аутоиммунная анемия – это заболевание, которое красноречиво говорит о серьезных неполадках в работе иммунной системы. Устранять такие неполадки призваны иммуномодуляторы, однако такой препарат при анемии должен отвечать ряду критериев. Во-первых, высокая эффективность, во-вторых, безопасность, в-третьих, отсутствие реакции с другими лекарственными препаратами.
Современная наука готова представить иммуномодулятор, отвечающий всем этим требованиям. Многолетние исследования клеток иммунной системы позволили открыть удивительную и уникальную молекулу. Она называется фактором переноса или трансфер фактором. Ее специфика заключается в том, что она служит своеобразным микрочипом, на котором собрана информация о работе иммунной системы. Такие молекулы присущи всем позвоночным, и для всех являются идентичными. Благодаря этой универсальности стало возможным выделение трансфер факторов из яичных желтков и коровьего молозива. Выбор именно последнего продукта не случаен, ведь в нем содержится максимальная концентрация информационных клеток. Также молозиво – это всем известный «эликсир здоровья», поскольку оно является источником огромного количества антител, которые мать передает своему младенцу. Трансфер фактор – это иммуномодулятор природного происхождения, который состоит из концентрата информационных молекул. Каким образом он действует? Принцип работы препарата прост, как и все гениальное. Попадая в организм, трансфер фактор сканирует цепочку ДНК на предмет повреждений и неисправностей. Далее высвобождается информация о правильной и эффективной работе иммунной системы. То есть трансфер факторы как опытный тренер, выявляют слабые места ученика и дают информацию о том, как именно нужно действовать в той или иной ситуации. Этот процесс происходит исключительно на информационном уровне, а потому не влияет на работу систем организма. Также отсутствует взаимодействие с какими-либо лекарственными препаратами, а это означает полную безопасность Трансфер фактора.
Суммируя все вышесказанное, можно сказать, что прием Трансфер фактора позволит иммунной системе научиться работать максимально эффективно; различать ситуации, когда нужно усилить иммунный ответ, а когда, наоборот, ослабить; выделять для защиты организма ресурсы, наиболее подходящие для той или иной ситуации. Это говорит о том, что Трансфер фактор, как нельзя лучше, подходит для лечения аутоиммунных анемий, поскольку сможет исправить ошибки в ДНК и отрегулировать иммунную систему должным образом.
Причины возникновения аутоиммунной анемии
Аутоиммунная анемия, как и любые другие аутоиммунные заболевания – это результат сбоя в работе иммунной системы. В свою очередь причиной для этого сбоя может послужить мутация генов, повреждение цепочки ДНК вследствие влияния различных вредоносных факторов. А поскольку ДНК несет в себе всю информацию, необходимую для работы организма, то аутоиммунная анемия может также передаваться по наследству. По этим причинам успешное лечение и профилактика аутоиммунной анемии заключаются, прежде всего, в оптимизации работы иммунной системы.