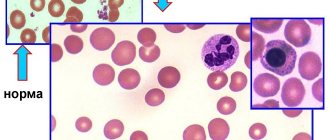
Одним из самых распространенных заболеваний в педиатрии является анемия.
У детей до 3-х летнего возраста анемия встречается в 40% случаях, в период полового созревания в 30%.
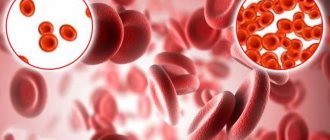
Анемия — патологическое состояние, характеризующееся уменьшением содержания гемоглобина и почти во всех случаях количества эритроцитов в крови.
Очень часто возникновение анемии связано с интенсивным ростом детского организма, повышенным процессом образования, развития и созревания клеток крови у детей.
Процесс кроветворения новорожденного ребенка значительно отличается от процесса кроветворения взрослого человека. Лишь на 4 – 5-м месяце жизни начинается костномозговой период кроветворения, который и становится определяющим всю жизнь. В этот период и до 6-го месяца, происходит физиологическое снижение количества гемоглобина и эритроцитов в крови ребенка. Для нормального развития системы кроветворения требуется большое количество железа, витаминов, микроэлементов и белка. Именно поэтому, очень большое значение уделяется питанию ребенка, а также заболеваемости в данный период. Токсическое воздействие, которое оказывают, казалось бы, самые простые и легко поддающиеся лечению заболевания, очень часто вызывают развитие анемии у ребенка.
Самыми уязвимыми являются дети 6 – 12-го месяца жизни, что связано с истощением резервов железа, накопленных в период внутриутробного развития.
Длительная анемия у детей сопровождается гипоксией, могут развиваться глубокие изменения органов и тканей. У таких детей наблюдается отставание от своих сверстников в физическом и умственном развитии, они чаще страдают респираторными заболеваниями с риском присоединения интеркуррентных заболеваний (случайно присоединяющаяся болезнь, осложняющая течение основного заболевания), они более склонны к развитию хронических заболеваний и различных осложнений.
Причины развития анемии.
Для того чтобы процесс образования крови у ребенка протекал нормально, в период внутриутробного развития его организму необходимо получить от матери и накопить достаточное количество железа. На 28—32 неделях внутриутробного развития происходит самая интенсивная передача железа от матери и его накопление в организме ребенка.
Нарушение нормального протекания беременности в этот важный период, приводит к тому, что происходит нарушение обмена железом между матерью и ребенком и как следствие, его недостаточному накоплению в организме.
Анемия матери, преждевременные роды являются причинами того, что анемия выявляется у всех детей с рождения или примерно с 3-го месяца жизни. Многоплодная беременность так же приводит к развитию анемии.
После рождения, причинами анемии могут служить повреждения эритроцитов из-за гемолитической болезни новорожденных, нарушения образования гемоглобина.
Наиболее часто, анемии вызваны алиментарными причинами. У детей первого года жизни анемия развивается чаще всего из-за однообразного молочного вскармливания, при скудном содержании железа в грудном молоке; раннем переводе ребенка на искусственное или смешанное вскармливание; использовании для кормления неадаптированных смесей, коровьего или козьего молока; не своевременном введении в рацион ребенка прикормов.
В повышенном поступлении железа в организм особенно нуждаются недоношенные дети и дети, рожденные с повышенной массой тела.
Поэтому несоответствие между поступлением железа в организм и его расходом, у детей первого года жизни, также может послужить причиной анемии.
Анемии могут возникать вследствие кровопотерь, например при частых носовых кровотечениях. У детей с нейродермитом, пищевыми аллергиями, экссудативным диатезом, происходит повышенная потеря железа с эпителием кожи, поэтому дети, страдающие такими заболеваниями, входят в группу риска по развитию железодефицитной анемии.
Кроме непосредственной потери железа, к развитию анемии приводят нарушения его всасывания и обмена. Это может встречается например: при рахите или лактазной недостаточности.
Большое значение имеет дефицит витаминов группы B и микроэлементов, именно поэтому так важно полноценное и сбалансированное питание.
Любое инфекционное или хроническое соматическое заболевание, может стать причиной анемии.
Алгоритм диагностики и лечения железодефицитных состояний у детей
Актуальность
Железодефицитные состояния (ЖДС) — самые распространенные дефицитные состояния в человеческой популяции, которые наиболее часто встречаются у детей и женщин репродуктивного возраста [1–7]. Так, установлено, что явный или скрытый дефицит железа имеет место практически у половины детей дошкольного возраста и беременных женщин [8]. При этом отмечено, что распространенность ЖДС неодинакова в различных странах и зависит от социальных и экономических условий [1]. Особо следует подчеркнуть, что вопросы своевременной диагностики и адекватного лечения ЖДС имеют наибольшую остроту в детской практике. При этом актуальность проблемы ЖДС в педиатрии обусловлена не только широким распространением, но и существенным неблагоприятным влиянием дефицита железа на состояние здоровья детей. Доказано, что ЖДС является причиной нарушения функций многих органов и систем организма. Это обусловлено тем, что железо входит в состав многих белков (гемоглобин, миоглобин, цитохромы, железосеропротеиды, оксидазы, гидроксилазы, супероксиддисмутазы и др.), обеспечивающих системный и клеточный аэробный метаболизм и окислительно-восстановительный гомеостаз организма в целом. Так, цитохромы и железосеропротеиды необходимы для транспорта электронов, а гемоглобин — для транспорта кислорода. В свою очередь, такие железосодержащие белки, как оксидазы, гидроксилазы и супероксиддисмутазы, обеспечивают адекватный уровень окислительно-восстановительных реакций в организме [9, 10]. Установлено, что недостаточное содержание в организме железа неблагоприятно сказывается на метаболических процессах, что приводит к нарушению функционирования различных органов и систем. При этом доказано, что прогрессирующее ЖДС сопровождается анемией, нарушением роста и развития детей, в частности психомоторного развития, изменением поведения, снижением интеллекта, дисфункциями иммунитета и другими патологическими проявлениями [1–9, 11–13].
Причины развития ЖДС
Основными причинами ЖДС являются недостаточное поступление железа в организм, плохое его всасывание в кишечнике и повышенные потери. При этом следует отметить, что для определенных этапов роста и развития детского организма имеются характерные факторы риска ЖДС. Так, в антенатальном периоде к дефициту железа в организме плода и новорожденного приводят: нарушение маточно-плацентарного кровообращения, фетоплацентарные и фетоматеринские кровотечения, фетофетальная трансфузия при многоплодной беременности, внутриутробная мелена, недоношенность, а также дефицит железа у матери (длительный латентный). Факторами риска развития ЖДС в интранатальный период являются: преждевременная перевязка пуповины, фетоплацентарная трансфузия, геморрагический синдром различного генеза (кровотечения из-за травматичных акушерских пособий или аномалий развития плаценты и сосудов пуповины) [1, 6]. В постнатальном периоде ведущая роль в развитии ЖДС у детей принадлежит алиментарному фактору. Так, на первом году жизни неадекватное вскармливание ребенка (использование неадаптированных молочных заменителей грудного молока, позднее введение мясных продуктов, недостаточное содержание железа в рационе детей с ускоренными темпами роста — недоношенные, макросоматики, лимфатики) приводит к ЖДС. В последующие периоды детства алиментарный фактор также может играть ведущую роль в развитии ЖДС (нарушение пищевого поведения, веганство, вегетарианство). Особое внимание необходимо обратить на то, что фактором риска ЖДС может стать несбалансированное питание с недостаточным содержанием мясных продуктов в рационе детей, профессионально занимающихся спортом [1, 6]. Нарушение всасывания железа из кишечника может быть обусловлено различными заболеваниями ЖКТ (наследственные и приобретенные синдромы мальабсорбции, хронические воспалительные заболевания кишечника, паразитарные инвазии). Среди основных причин ЖДС, связанных с повышенными потерями железа из организма, следует отметить длительный легкий геморраж из ЖКТ при гастроинтестинальных проявлениях пищевой аллергии (у детей раннего возраста — наиболее часто на белки коровьего молока), а также кровотечения различной локализации и этиологии. При этом группой особо высокого риска по развитию ЖДС являются девушки в период становления менструальной функции [1, 6].
Клиническая картина ЖДС
Развитие ЖДС имеет стадийный характер. При этом сначала происходит опустошение тканевых запасов железа, в то время как в органах кроветворения его уровень остается в пределах нормативных значений. В результате уменьшения содержания железа в тканях снижается активность железосодержащих ферментов, что проявляется симптомами сидеропении. Клинически при этом можно отметить сухость кожи; ломкость, слоистость, поперечную исчерченность и ложкообразную форму ногтей; глоссит, гингивит, стоматит, дисфагию, диспепсические нарушения. Следует подчеркнуть, что на ранних стадиях ЖДС значимых нарушений эритропоэза нет, что и определяет отсутствие анемического синдрома в этот период. Состояние, при котором недостаток железа в тканях и органах организма не сопровождается анемией, принято называть латентным железодефицитом
. В случае дальнейшего нарастания дефицита железа в организме уменьшается его содержание и в органах кроветворения. Это приводит к снижению синтеза гемоглобина и развитию анемии. На данном этапе к клиническим проявлениям сидеропении добавляется симптоматика анемического синдрома (вялость, слабость, быстрая утомляемость, снижение физической активности, тахикардия, приглушенность сердечных тонов и т. д.). Стадию ЖДС, при которой уменьшение содержания железа в организме сопровождается нарушением эритропоэза с развитием гипохромной микроцитарной анемии, терминологически определяют как
железодефицитную анемию
(ЖДА) [1–7].
Диагностика ЖДС
Принимая во внимание низкую специфичность клинических проявлений сидеропении и анемического синдрома, критериями диагностики латентного железодефицита (ЛЖДС) и ЖДА являются характерные лабораторные признаки. При этом показано, что для верификации ЖДС могут быть использованы рутинные лабораторные методы исследования, которые доступны для широкой практики (клинический анализ крови, определение в сыворотке крови железа, ферритина и общей железосвязывающей способности с последующим вычислением коэффициента насыщения трансферрина железом). Особо следует отметить, что поскольку ферритин относится к протеинам воспаления, то его определение должно проводиться одновременнно с С-реактивным белком (СРБ) [1–7, 14, 15]. При этом следует подчеркнуть, что для корректной трактовки клинического анализа крови необходимо оценить все показатели, представленные в гемограмме. Нельзя ограничиваться только анализом уровня гемоглобина, лейкоцитов и СОЭ. Должны быть обязательно интерпретированы такие показатели, как количество эритроцитов и ретикулоцитов, эритроцитарные индексы, «лейкоцитарная формула», абсолютные значения нейтрофилов, лимфоцитов, моноцитов, эозинофилов, тромбоцитов, а также тромбоцитарные индексы [14–16]. Лабораторным критерием анемии является снижение концентрации гемоглобина ниже возрастной нормы. При этом установлено, что нижней границей нормы гемоглобина для детей в возрасте от 1 мес. до 5 лет является уровень 110 г/л, для детей 6–12 лет — 115 г/л, для детей старше 12 лет и подростков — 120 г/л. Следует отметить, что уже на первом этапе расшифровки клинического анализа крови можно не только выявить анемию, но и определить ее тяжесть. Критерием тяжести анемии является степень снижения концентрации гемоглобина (Нb). Так, у детей старше одного месяца жизни используются следующие подходы: снижение Нb до 90 г/л — признак легкой анемии, уровень Нb в пределах 70–90 г/л — маркер среднетяжелой анемии, снижение Нb ниже 70 г/л — критерий тяжелой анемии [6]. Выявление лабораторных признаков анемии определяет необходимость обязательной одновременной оценки значений и других показателей гемограммы. Если при этом анемия сочетается с другими изменениями в клиническом анализе крови (лейкопения, агранулоцитоз, тромбоцитопения), к курации пациента необходимо привлекать гематолога. В тех же случаях, когда в клиническом анализе имеют место только маркеры анемии, врач-педиатр может продолжить поиск причин заболевания самостоятельно. Для этого следующим диагностическим шагом является оценка эритроцитарных индексов, представленных в анализе крови (рис. 1). При этом в первую очередь обращают внимание на показатели, характеризующие степень насыщения эритроцитов гемоглобином. К ним относятся цветовой показатель (ЦП) и среднее содержания гемоглобина в эритроците — MCH (Mean Corpuscular Hemoglobin). В зависимости от степени насыщения эритроцитов гемоглобином различают анемии нормохромную (адекватное содержание Нb в эритроцитах), гипохромную (недостаточное содержание Нb в эритроцитах) и гиперхромную (избыточное содержание Нb в эритроцитах). При снижении гемоглобина ниже возрастной нормы и обнаружении признаков гипохромии эритроцитов (ЦП<0,85, MCH<26 пг) делают вывод о наличии гипохромной анемии. Одновременный анализ значений среднего объема эритроцитов — MCV (Mean Сorpusculare Volume) позволяет дополнительно охарактеризовать выявленную анемию как микроцитарную, нормоцитарную или макроцитарную. В тех случаях, когда имеются признаки гипохромной микроцитарной анемии, необходимо проводить дифференциальный диагноз между ЖДА, сидеробластозом и талассемией. Для этого на следующем этапе расшифровки показателей гемограммы оценивают уровень ретикулоцитов (см. рис. 1). Если количество ретикулоцитов при этом соответствует нормативным значениям (1–2%), это значит, что анемия имеет норморегенераторный характер. В этом случае все характеристики анемии — гипохромия (ЦП<0,85, MCH<26 пг) и микроцитоз (MCV<80 фл) эритроцитов, норморегенарация (ретикулоциты 1–2%) — позволяют сделать вывод о наличии у пациента ЖДА (см. рис. 1). При этом особо следует подчеркнуть, что гипохромный микроцитарный норморегенераторный характер анемии типичен для ЖДА алиментарного генеза, а также для тех вариантов ЖДА, которые обусловлены нарушением всасывания железа в кишечнике (синдром мальабсорбции, воспалительные заболевания кишечника, гельминтозы).
В тех же случаях, когда гипохромная микроцитарная анемия сопровождается повышением уровня ретикулоцитов (>2%), констатируют гиперрегенераторный характер анемии. При этом следует помнить, что указанные характеристики анемии могут быть как при ЖДА, развившейся в результате кровопотери (постгеморрагическая ЖДА), так и при талассемии. Напомним, что талассемии — это группа наследственных заболеваний, обусловленных нарушением синтеза альфа- или бета-цепей гемоглобина, при которых уровень железа в организме не только не снижается, но в ряде случаев даже повышен. Установлено, что талассемия имеет четкую этническую связь. Так, бета-талассемия чаще всего встречается у выходцев из Средиземноморья, Среднего Востока и Индии, а альфа-талассемия — у выходцев из Африки и Юго-Восточной Азии. Учитывая это, при выявлении гипохромной микроцитарной анемии у ребенка с указанной этнической принадлежностью, помимо поиска типичных клинических (легкая иктеричность, гепатоспленомегалия) и лабораторных (мишеневидность эритроцитов) проявлений талассемии, необходимо детализировать семейный анамнез, обращая особое внимание на состояние здоро-вья ближайших родственников (хроническая анемия, гепатоспленомегалия, холелитиаз с молодого возраста и др.) [17–20]. Таким образом, при выявлении гипохромной микроцитарной гиперрегенераторной анемии необходимо проводить дифференциальный диагноз между ЖДА постгеморрагического генеза и талассемией (см. рис. 1). Поскольку при талассемии, в отличие от ЖДА, содержание железа в организме не снижается, то для уточнения генеза заболевания в этом случае необходимо исследовать ферростатус ребенка. Для этого в сыворотке крови определяют уровень железа (СЖ), ферритина (ФС), общей железосвязывающей способности (ОЖСС), а также вычисляют коэффициент насыщения трансферрина железом (КНТЖ). Одновременно с ФС целесообразно исследовать СРБ, т. к. ферритин относится к белкам воспаления и его значение может иметь ложноположительный уровень при воспалительном процессе в организме. Если при обследовании ребенка с гипохромной микроцитарной гиперрегенераторной анемией обнаруживается нормальный или повышенный уровень ЖС, ФС (при нормальных значениях СРБ) и КНТЖ, то необходимо в первую очередь предположить наличие талассемии. Для этого пациента направляют на консультацию к гематологу, который проводит исследование осмотической резистентности эритроцитов, электрофорез гемоглобина, а при необходимости рекомендует генетическое обследование. Если гипохромная микроцитарная гиперрегенераторная анемия сопровождается снижением СЖ (<14 мкмоль/л), ФС (<12 мкг/л), КНТЖ (<17%) и одновременным повышением ОЖСС (>63 мкмоль/л), то имеет место ЖДА постгеморрагического генеза (см. рис. 1).
Диагностика латентных ЖДС
Лабораторные критерии снижения содержания железа в организме (СЖ<14 мкмоль/л, ФС<12 мкг/л, КНТЖ<17%, ОЖСС>63 мкмоль/л) используются не только для диагностики ЖДА, но и для верификации ЛЖДС (табл. 1). Следует напомнить, что ЛЖДС — это начальная стадия дефицита, при которой истощаются тканевые запасы железа в организме, но еще отсутствуют глубокие нарушения эритропоэза, что и объясняет отсутствие анемического синдрома. В результате этого лабораторные изменения при ЛЖДС характеризуются только особенностями ферростатуса, типичными для железодефицита, и не сопровождаются признаками анемии. Поскольку клинические признаки ЛЖДС неспецифичны, а анемический синдром на ранних стадиях железодефицита в организме отсутствует, то в подавляющем большинстве случаев ЛЖДС не диагностируется. В связи с этим истинная частота распространенности ЛЖДС в детской популяции (в т. ч. в России) остается неуточненной. В то же время результаты проведенных пилотных исследований свидетельствуют о том, что в целевых группах и/или в определенных регионах нашей страны частота ЛЖДС может достигать 40% [5–7, 20–24]. В связи с этим актуальность проведения скрининга для своевременного выявления ЛЖДС не вызывает сомнений. Однако понятно, что в условиях рутинной педиатрической практики скрининг ЖДС, основанный на определении в венозной крови ферростатуса, в подавляющем большинстве случаев не может быть реализован. В связи с этим в настоящее время активно изучаются альтернативные способы ранней диагностики ЛЖДС, основанные на исследовании новых показателей клинического анализа крови [6, 16, 23, 24].
Появление в практическом здравоохранении гематологических анализаторов последнего поколения позволяет при исследовании клинического анализа крови дополнительно определить степень насыщения ретикулоцитов гемоглобином (показатель Ret-Hb) и разницу между содержанием гемоглобина в зрелых эритроцитах и в ретикулоцитах (показатель Delta-Hb) [25]. При этом установлено, что с помощью корректной оценки указанных показателей можно выявить начальные нарушения синтеза гемоглобина при ЛЖДС. Так, если у детей из групп риска по развитию железодефицита отсутствует анемия (концентрация Hb в пределах нормы), а эритроциты характеризуются нормохромией (MCH=26–32 пг) и нормоцитозом (MCV=80–95 фл), то особое внимание необходимо уделить оценке таких показателей, как Ret-Hb и Delta-Hb. При этом выявление снижения среднего содержания гемоглобина в ретикулоцитах (Ret-Hb <26 пг) и увеличения различий в насыщении гемоглобином эритроцитов и ретикулоцитов (Delta-Hb >2 пг) позволяет сделать вывод о том, что у ребенка имеет место значимое ЛЖДС с начальными признаками нарушений эритропоэза. Данное заключение основано на том, что ретикулоциты несут «самую свежую» информацию о состоянии эритропоэза, т. к. они обнаруживаются в кровотоке только в течение первых суток после выхода из костного мозга, средняя же продолжительность жизни эритроцитов составляет 120 дней. Таким образом, выявление низких значений насыщения ретикулоцитов гемоглобином (Ret-Hb <26 пг) и увеличение уровня Delta-Hb, при одновременном отсутствии анемии, гипохромии и микроцитоза эритроцитов, является маркером ЛЖДС (рис. 2). В диагностически сложных случаях для верификации ЖДС могут быть использованы такие лабораторные показатели, как цинк-протопорфирин и растворимые трансферриновые рецепторы, характеризующиеся высокой чувствительностью и специфичностью, однако их определение малодоступно для широкой практики [26, 27].
Терапия ЖДС
В основе терапии ЖДС, как латентных, так и манифестных, лежит рациональное применение препаратов железа. В подавляющем большинстве случаев для лечения ЖДС используют пероральные формы препаратов железа. Следует отметить, что в современном лекарственном арсенале врача-педиатра имеются различные по составу (солевые, гидроксид полимальтозные комплексы) и форме выпуска (таблетки, капсулы, сиропы, капли) препараты железа. Расчет индивидуальных доз препаратов при этом, независимо от формы выпуска, должен проводиться с учетом содержания элементарного железа в лекарственном средстве. Так, если используются препараты железа в виде гидроксид полимальтозного комплекса, то суточная доза элементарного железа должна составлять 5 мг/кг в сутки. В тех случаях, когда применяют солевые препараты железа, рекомендуются следующие суточные дозы элементарного железа: детям в возрасте до 3-х лет — 3 мг/кг в сутки; детям старше 3-х лет — 45–60 мг/сут; подросткам — до 120 мг/сут. При этом у детей начиная с 6 лет и у подростков для лечения ЛЖДС и ЖДА может с успехом применяться обновленная формула хорошо известного препарата Тардиферон
[28]. Тардиферон является пролонгированным препаратом, в котором железо представлено в виде сульфата двухвалентного железа [28]. Следует отметить, что результаты исследований фармакокинетических особенностей обновленной формулы препарата Тардиферон [29, 30] свидетельствуют о пролонгированном высвобождении железа в желудочно-кишечном тракте. При этом было показано, что продолжительное высвобождение железа из препарата способствует его оптимальной абсорбции и хорошей переносимости [29, 30]. Подтверждение хорошей переносимости препарата Тардиферон, а также его высокой клиническо-экономической эффективности получено и в серии отечественных исследований [31, 32]. В 1 таблетке препарата Тардиферон содержится 80 мг элементарного железа, что позволяет рекомендовать следующий режим дозирования: детям 6–10 лет — 1 таблетка в сутки; детям старше 10 лет и подросткам — 1–2 таблетки в сутки [28]. Препарат Тардиферон принимают перед едой (не разжевывая), запивая водой, или во время приема пищи. Следует помнить, что препарат Тардиферон не рекомендуется применять одновременно с антацидами и тетрациклинами. Кроме этого, необходимо учитывать, что всасывание в кишечнике железа уменьшается при одновременном использовании продуктов, содержащих полифенолы (бобы, орехи, чай, кофе), фитаты (зерновые, бобовые, овощи, орехи) и большое количество пищевых волокон. При правильно установленном диагнозе ЖДА, адекватном выборе препаратов железа и корректно подобранной дозе в клиническом анализе крови на 10–14-й день терапии отмечается увеличение ретикулоцитов, а к концу 3–4-й недели лечения — прирост гемоглобина на 10 г/л. Нормализация уровня гемоглобина достигается через 4–8 нед. от начала терапии. В тех случаях, когда на фоне адекватно проводимой терапии в декретируемые сроки в клиническом анализе крови отсутствуют ожидаемые позитивные сдвиги, следует усомниться в правильности диагноза. Учитывая, что гипохромия эритроцитов характерна не только для ЖДА, но и для сидеробластоза и талассемии, необходимо отменить препараты железа и вернуться к диагностическому поиску причин анемии. Считаем необходимым обратить внимание еще на один очень важный аспект — строгое соблюдение рекомендованной продолжительности применения препаратов железа при лечении ЖДС. К сожалению, на практике эти рекомендации не всегда строго соблюдаются. Нормализация уровня гемоглобина, которая, как правило, отмечается в течение 1–2 мес. от начала лечения, не должна быть поводом для отмены препаратов железа. Это обусловлено тем, что купирование анемии свидетельствует только о нормализации эритропоэза, в то время как дефицит железа в тканевых депо все еще сохраняется. Иными словами, купирование ЖДА — это устранение только верхушки айсберга, тогда как его основная часть (ЛЖДС) скрыта под водой. В связи с этим необходимо четко придерживаться следующего правила: продолжительность лечения препаратами железа определяется выраженностью ЖДС и степенью тяжести анемии. Так, при легкой степени ЖДА курс лечения препаратами железа составляет 3 мес., при среднетяжелой — 4,5 мес., при тяжелой степени — до 6 мес. [6].
Заключение
В заключение целесообразно еще раз отметить, что ранняя диагностика ЖДС, их своевременная и адекватная коррекция с помощью препаратов железа позволят существенно снизить риск нарушений функционирования различных органов и систем растущего организма, что не только позитивно скажется на состоянии здоровья ребенка, но и улучшит качество его жизни в целом.
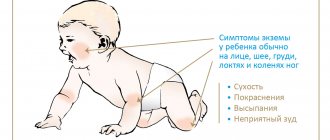
Симптомы анемии у детей
Видимые изменения при анемии у детей наблюдаются со стороны кожи: она становится бледной, сухой, шелушащейся; ногти могут деформироваться, становиться ломкими; волосы теряют здоровый блеск.
При тяжелых формах анемии, и ее длительном течении, у детей появляются трещины на ладонях рук и подошвах ног, в уголках рта. Дети с анемией ослаблены, часто болеют ОРВИ, бронхолегочными заболеваниями, подвержены острым кишечным инфекциям.
Недостаток кислорода, возникающий при анемиях, отражается и на нервной системе. Ребенок становится плаксивым, вялым, быстро утомляется, может испытывать головокружения, снижается тонус мышц.
Реагирует и пищеварительная система. У детей после кормления наблюдаются частые срыгивания и рвота, метеоризм, возможны диарея или запоры, увеличение селезенки и печени, снижается аппетит.
Профилактика анемии
Профилактика начинается с полноценного питания беременной, отведения достаточного времени для прогулок и сна. Детям первого года жизни необходимо после 6-месячного возраста добавлять к грудному молоку прикорм, у более старших нужно организовать разнообразное сбалансирование питание. Важно, чтобы в теплое время года малыш как можно больше находился на воздухе, принимал солнечные ванны. Коллектив врачей клиники «СМ-Доктор» поможет вашему малышу справиться с анемией, разработает индивидуальные меры профилактики. Обращайтесь к профессионалам, чтобы создать идеальные условия для роста и развития ребенка!
Диагностика анемии.
Основу диагностики анемии составляют лабораторные исследования, а именно клинический анализ крови.
Норма гемоглобина крови у детей до 6 лет составляет 125–135 г/л;
об анемии у ребенка говорят в том случае, если этот показатель опускается ниже 110 г/л (у детей до 5 лет) и ниже 120 г/л (у детей старше 5 лет).
В общем анализе крови при анемии у детей выявляется снижение гемоглобина (менее 120-110 г/л), снижение эритроцитов (<3,8х1012/л).
Биохимическое исследование крови включает определение таких показателей как:
- сывороточное железо;
- насыщения трансферрина железом;
концентрации:
- ферритина;
- билирубина;
- витаминов.
Лечение анемии
Методы коррекции анемии зависят от возраста. При естественном вскармливании необходимо вовремя вводить овощной, фруктовый и мясной прикорм, много времени проводить на свежем воздухе, в том числе на солнце. Помещение нужно хорошо проветривать, содержать в чистоте, соблюдать санитарные правила ухода за ребенком.
Детям старшего возраста достаточно упорядочить питание и режим дня для улучшения анализа крови. В питании используют говяжью печень, бобовые, морепродукты, свежие овощи и фрукты, зелень. При необходимости переносят сроки вакцинации, используют массаж и ультрафиолетовое облучение.
Медикаменты назначает врач. Показаны препараты железа и витамины. Минимальная длительность медикаментозного лечения 1 месяц.
Причины В12-дефицитной анемии
Нехватка витамина В12 может быть связана со следующими причинами или их комбинацией:
- нарушение всасывания витамина в кишечнике: гастрит, сопряженный с инфицированием Хеликобактер Пилори, болезнь Крона, перенесенные операции на кишечнике, полипоз слизистой желудка, рак, кишечные свищи и пр.;
- врожденные нарушения обменных процессов;
- хроническая интоксикация оксидом азота, используемого в качестве седации в анестезиологии.
- незначительные нарушения всасывания, например, снижение доступности В12 в пище при хроническом панкреатите, умеренном атрофическом гастрите, приеме метформина, лекарств для снижения выработки соляной кислоты и пр.;
- скудный рацион, вегетарианство;
- хронический алкоголизм.
Одной из форм В12- дефицитной анемии является болезнь Аддисона-Бирмера. При ней появляются аутоантитела к клеткам слизистой оболочки желудка.
Стоит отметить, что В12- и фолиеводефицитные анемии тесно связаны. Фолиевая кислота (витамин В9) также принимает участие в процессах образования эритроцитов. Даже полноценное поступление этих компонентов в продуктах питания не гарантирует отсутствия анемии в тех случаях, когда наблюдается их повышенный расход или имеет место нарушение утилизации в костном мозге. Это может быть связано с паразитозом, дисбактериозом кишечника, беременностью, болезнями печени и крови.
Патогенез (что происходит?) во время железодефицитной анемии у ребенка:
Железо выходит из организма с мочой, калом, потом, а также через ногти, волосы и кожу. Потери не зависят от пола. У детей выходит во внешнюю среду около 0,1–0,3 мг за 24 часа. У подростков потеря составляет максимум 0,5–1,0 мг. Ребенку нужно получать в день 0,5–1,2 мг железа. Повышенная потребность – у грудничков и дошкольников. Чтобы ребенок нормально развивался, в сутки в рационе должно быть 1,5 мг железа у новорожденных, а у детей от 1 до 3 лет – минимум 10 мг.
Дефицит железа провоцирует склонность к инфекционным заболеваниям ЖКТ и органов дыхания малыша. Без железа перестают нормально функционировать структуры головного мозга. При нехватке железа происходят сбои в нервно-психическом развитии малыша. У детей, которым в грудном возрасте поставили диагноз железодефицитной анемии, в возрасте 3-4 лет находят нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения из-за нарушения миелинизации и, как следствие этого, нарушение проводимости нервов.
Диагностика
Диагностика железодефицитной анемии у грудного ребёнка и детей постарше в многопрофильной клинике ЦЭЛТ проводится с участием разных специалистов:
- педиатра;
- гематолога;
- детского гастроэнтеролога.
Ребёнка осматривают, проводят сбор анамнеза, проводят лабораторное обследование, что позволяет установить диагноз анемии, определить её степень. С целью дополнительного обследования возможно привлечение ультразвукового метода диагностики (органов брюшной полости, органов малого таза).
Особенности диагностики
Лечение В12-дефицитной анемии назначается после комплексного обследования. Врач направит на следующие лабораторные гематологические и иные исследования:
- общий анализ крови;
- биохимические и иммунологические исследования: определение уровня В12 в плазме, оценка уровня гомоцистеина в сыворотке или плазме крови, определение антител к париетальным клеткам желудка и др.;
- аспирационная или трепанобиопсия костного мозга.
Также может потребоваться гастроскопия для выявления атрофического гастрита.
Диагноз устанавливает врач на основании жалоб, проявлений болезни, параметров лабораторных исследований. Важно выяснить причину синдрома, в особенности обнаружить болезнь Аддисона-Бирмера.
Кроме того, специалисту необходимо отличить эту разновидность анемии от других болезней, сопровождающихся нарушениями процессов кроветворения. Так, при подозрении на цирроз печени, нарушения, связанные с длительным приемом некоторых препаратов (сульфаниламиды, противосудорожные средства), сидеробластную анемию потребуется дифференциальная диагностика.