Валентин Власов, Вера Морозова, Игорь Бабкин, Нина Тикунова «Наука из первых рук» №4(70), 2016
Об авторах
| Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Государственной премии РФ (1999). Автор и соавтор более 300 научных работ и 20 патентов. |
| Вера Витальевна Морозова — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор более 30 научных работ и 6 патентов. |
| Игорь Викторович Бабкин — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 58 научных работ и 2 патентов. |
| Нина Викторовна Тикунова — доктор биологических наук, заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 120 научных работ и 21 патента. |
В середине прошлого века биологическая наука сделала революционный шаг вперед, установив молекулярные основы функционирования живых систем. Огромную роль в успешных исследованиях, которые привели к определению химической природы наследственных молекул, расшифровке генетического кода и созданию технологий манипуляций генами, сыграли бактериофаги, открытые еще в начале прошлого столетия. На сегодняшний день эти бактериальные вирусы освоили много полезных для человека «профессий»: их используют не только как безопасные антибактериальные препараты, но и как дезинфектанты и даже в качестве основы для создания электронных наноустройств.
Когда в 1930-х гг. группа ученых занялась проблемами функционирования живых систем, то в поиске простейших моделей они обратили внимание на бактериофаги
— вирусы бактерий. Ведь среди биологических объектов нет ничего проще, чем бактериофаги, к тому же их можно легко и быстро выращивать и анализировать, а вирусные генетические программы невелики.
Фаг — это минимального размера природная структура, содержащая плотно упакованную генетическую программу (ДНК или РНК), в которой нет ничего лишнего. Эта программа заключена в белковую оболочку, снабженную минимальным набором устройств для ее доставки внутрь бактериальной клетки. Бактериофаги не могут размножаться сами по себе, и в этом смысле их нельзя считать полноценными живыми объектами. Их гены начинают работать только в бактерии, используя имеющиеся в бактериальной клетке биосинтетические системы и запасы молекул, необходимых для синтеза. Однако генетические программы этих вирусов принципиально не отличаются от программ более сложных организмов, поэтому эксперименты с бактериофагами позволили установить основополагающие принципы устройства и работы генома.
В дальнейшем эти знания и разработанные в ходе исследований методы стали фундаментом для развития биологической и медицинской науки, а также широкого спектра биотехнологических приложений.
Бактериофаги — наши друзья, когда речь идет о бактериях, патогенных для человека. Однако есть и другие, дружественные нам бактерии, которые используются в современных биотехнологических производствах, а также в традиционных производствах пищевой промышленности, таких как сыроварение и т. п. В этих случаях фаги могут приносить большой вред, поскольку в больших популяциях микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения фагов, что приводит к лизису производственных бактериальных культур. При производстве сыра проблема не столь серьезна, так как при этом обычно применяют закваски, состоящие из многих культур, часть которых выдержит фаговую атаку и продолжит процесс молочнокислого брожения. Серьезные неприятности возникают, если весь процесс основан на применении одного конкретного бактериального штамма, как, например, при производстве антибиотиков или терапевтических белков.
Борцы с патогенами
Первые попытки использовать бактериофаги для лечения инфекционных заболеваний были предприняты практически сразу после их открытия, однако недостаток знаний и несовершенные биотехнологии того времени не позволили достичь полного успеха. Тем не менее дальнейшая клиническая практика показала принципиальную возможность успешного применения бактериофагов при инфекционных заболеваниях желудочно-кишечного тракта, мочеполовой системы, при острых гнойно-септических состояниях больных, для лечения хирургических инфекций и т. д.
По сравнению с антибиотиками бактериофаги имеют ряд преимуществ: они не вызывают побочных эффектов, к тому же строго специфичны для определенных видов бактерий, поэтому при их использовании не нарушается нормальный микробиом человека. Однако такая высокая избирательность создает и проблемы: чтобы успешно лечить пациента, нужно точно знать инфекционный агент и подбирать бактериофаг индивидуально.
Фаги можно использовать и профилактически. Так, Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г. Н. Габричевского разработал профилактический продукт «ФУДФАГ» на основе коктейля из бактериофагов, снижающий риск заражения острыми кишечными инфекциями. Клинические исследования показали, что недельный прием препарата позволяет избавиться от гемолизирующей кишечной палочки и других патогенных и условно-патогенных бактерий, вызывающих дисбактериоз кишечника.
Бактериофагами лечат инфекционные болезни не только людей, но и домашних и сельскохозяйственных животных: мастит у коров, колибактериоз и эшерихиоз у телят и свиней, сальмонеллез у кур… Особенно удобно применять фаговые препараты в случае аквакультуры — для лечения промышленно выращиваемых рыб и креветок, так как в воде они долго сохраняются. Бактериофаги помогают защитить и растения, хотя применение фаговых технологий в этом случае затруднено из-за воздействия природных факторов, таких как солнечный свет и дождь, губительных для вирусов.
Фаги могут сыграть большую роль в поддержании микробиологической безопасности продуктов питания, так как применение антибиотиков и химических агентов в пищевой отрасли не решает эту проблему, одновременно снижая уровень экологической чистоты продукции. О серьезности самой проблемы говорят статистические данные: например, в США и России ежегодно регистрируется до 40 тыс. заболевших сальмонеллезом, из которых 1% умирает. Распространение этой инфекции в значительной степени связано с выращиванием, переработкой и потреблением различных видов птицы, и попытки применить для борьбы с ней бактериофаги дали многообещающие результаты.
Так, американская компания Intralytix
производит фаговые препараты для борьбы с листериозом, сальмонеллезом и бактериальным загрязнением кишечной палочкой. Они разрешены к применению как добавки, предотвращающие размножение бактерий на продуктах питания — их распыляют на продукты из мяса и домашней птицы, а также на овощи и фрукты. Эксперименты показали, что коктейль из бактериофагов может быть успешно применен и при транспортировке и реализации живой прудовой рыбы для снижения бактериального загрязнения не только воды, но и самой рыбы.
Очевидным применением бактериофагов является дезинфекция
, то есть уничтожение бактерий в тех местах, где их не должно быть: в больницах, на пищевых производствах и т. п. Для этой цели британская компания
Fixed-Phage
разработала метод фиксации фаговых препаратов на поверхностях, обеспечивающий сохранение биологической активности фагов до трех лет.
Бактериофаги — «дрозофилы» молекулярной биологии
Эксперимент американских исследователей А. Херши и М. Чейза с использованием бактериофагов, меченных изотопами серы и фосфора, доказали роль ДНК как основного носителя генетической информации
В 1946 г. на 11-м симпозиуме в знаменитой американской лаборатории в Колд Спринг Харборе, была провозглашена теория «один ген — один фермент». Бактериолог А. Херши и «бывший» физик, молекулярный биолог М. Дельбрюк доложили об обмене генетическими признаками между различными фагами при одновременном заражении ими клеток кишечной палочки. Это открытие, сделанное в то время, когда физический носитель гена еще не был известен, свидетельствовало, что явление «рекомбинации» — перемешивания генетических признаков, свойственно не только высшим организмам, но и вирусам. Обнаружение этого феномена в дальнейшем дало возможность детально исследовать молекулярные механизмы репликации. Позднее эксперименты с бактериофагами позволили установить принципы устройства и работы генетических программ.В 1952 г. А. Херши и М. Чейз экспериментально доказали, что наследственная информация бактериофага Т2 закодирована не в белках, как считали многие ученые, а в молекулах ДНК (Hershey & Chase, 1952). Исследователи проследили за процессом воспроизводства в двух группах бактериофагов, одна из которых несла меченные радиоактивной меткой белки, а другая — молекулы ДНК. После инфицирования бактерий такими фагами оказалось, что в зараженную клетку передается только вирусная ДНК, что и послужило доказательством ее роли в хранении и передаче наследственной информации.
В качестве объектов для своих исследований М. Дельбрюк и его сотрудники использовали мутантные бактериофаги так называемой Т-серии, поражающие кишечную палочкуВ том же году американские генетики Д. Ледерберг и Н. Циндлер в эксперименте с участием двух штаммов сальмонелл и бактериофага Р22 установили, что бактериофаг способен в процессе размножения включать в себя фрагменты ДНК бактерии-хозяина и передавать их другим бактериям при заражении (Zinder & Lederberg, 1952). Это явление переноса генов от бактерии-донора к реципиенту было названо «трансдукцией». Результаты эксперимента стали очередным подтверждением роли ДНК в передаче наследственной информации.
В 1969 г. А. Херши, М. Дельбрюк и их коллега С. Луриа стали Нобелевскими лауреатами «за открытия, касающиеся механизма репликации и генетической структуры вирусов».
В 1972 г. Р. Берд с коллегами при изучении процесса репликации (копировании клеточной информации) ДНК кишечной палочки использовали бактериофаги в качестве зондов, способных встраиваться в геном бактериальной клетки, и обнаружили, что процесс репликации идет в двух направлениях вдоль хромосомы (Стент, 1974).
Преимущества бактериофагов
| Бактериофаги – антибактериальные агенты и природные антисептики | Безопасны и не токсичны, не имеют побочных эффектов, применяются у новорождённых детей, беременных и кормящих женщин |
| Действие бактериофагов не затрагивает полезную микрофлору организма, в отличие от антибиотиков | Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность |
| Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри | Бактериофаги выводятся из организма естественным путем |
Семь дней творения
Современные методы синтетической биологии позволяют не только вносить различные модификации в фаговые геномы, но и создавать полностью искусственные активные фаги. Технологически это несложно, нужно только синтезировать фаговый геном и ввести его в бактериальную клетку, а там он уже сам запустит все процессы, необходимые для синтеза белков и сборки новых фаговых частиц. В современных лабораториях на эту работу уйдет всего несколько дней.
Генетические модификации применяют, чтобы изменить специфичность фагов и повысить эффективность их терапевтического действия. Для этого наиболее агрессивные фаги снабжают узнающими структурами, связывающими их с целевыми бактериями. Также в вирусные геномы дополнительно встраивают гены, кодирующие токсические для бактерий белки, нарушающие метаболизм, — такие фаги более смертоносны для бактерий.
Бактерии имеют несколько механизмов защиты от антибиотиков и бактериофагов, один из которых — разрушение вирусных геномов ферментами рестрикции
, действующими на определенные нуклеотидные последовательности. Для увеличения терапевтической активности фагов можно за счет вырожденности генетического кода так «переформатировать» последовательности их генов, чтобы минимизировать число нуклеотидных последовательностей, «чувствительных» к ферментам, одновременно сохранив их кодирующие свойства.
Универсальный способ защиты бактерий от всех внешних воздействий — так называемые биофильмы
, пленки из ДНК, полисахаридов и белков, которые бактерии создают совместными усилиями и куда не проникают ни антибиотики, ни терапевтические белки. Такие биопленки — головная боль врачей, так как они способствуют разрушению зубной эмали, образуются на поверхности имплантов, катетеров, искусственных суставов, а также в дыхательных путях, на поверхности кожи и т. п. Для борьбы с биофильмами были сконструированы особые бактериофаги, содержащие ген, кодирующий специальный литический фермент, разрушающий бактериальные полимеры.
Ферменты «от бактериофага»
Большое число ферментов, сегодня широко использующихся в молекулярной биологии и генетической инженерии, были открыты в результате исследований бактериофагов.
Традиционная схема клонирования (встраивания чужеродной ДНК) с использованием в качестве «вектора» плазмиды (внехромосомного генетического элемента, присущего многим штаммам бактерий) начинается с разрезания плазмидной ДНК и вырезания нужного участка хромосомной ДНК с помощью фермента рестриктазы. Затем фрагмент клонируемой ДНК встраивается в плазмиду, которая вводится в бактерию, благодаря чему она становится способной производить чужеродный белок, закодированный во встроенном фрагменте
Одним из таких примеров являются ферменты рестриктазы — группа бактериальных нуклеаз, расщепляющих ДНК. Еще в начале 1950-х гг. было обнаружено, что бактериофаги, выделенные из клеток одного штамма бактерий, зачастую плохо размножаются в близкородственном штамме. Обнаружение этого феномена означало, что у бактерий есть система подавления размножения вирусов (Luria & Human, 1952). В результате была открыта ферментативная система рестрикции-модификации, с помощью которой бактерии разрушали попавшую в клетку чужеродную ДНК. Выделение рестриктаз (эндонуклеаз рестрикции) дало в руки молекулярных биологов бесценный инструмент, позволивший манипулировать ДНК: встраивать одни последовательности в другие или вырезать необходимые фрагменты цепи, что в итоге привело к разработке технологии создания рекомбинантной ДНК.
Еще один широко используемый в молекулярной биологии фермент — ДНК-лигаза бактериофага Т4, которая «сшивает» «липкие» и «тупые» концы двуцепочечных молекул ДНК и РНК. А недавно появились генно-модифицированные варианты этого фермента с большей активностью.
От бактериофагов ведут свое происхождение и большинство используемых в лабораторной практике РНК-лигаз, которые «сшивают» одноцепочечные молекулы РНК и ДНК. В природе они в основном служат для починки сломанных молекул РНК. Исследователи наиболее часто используют РНК-лигазу бактериофага Т4, с помощью которой можно «пришить» одноцепочечные полинуклеотиды к РНК-молекулам, чтобы пометить их. Такой прием применяется для анализа структуры РНК, поиска мест связывания РНК с белками, олигонуклеотидного синтеза и т. д. Недавно среди рутинно используемых ферментов появились термостабильные РНК-лигазы, выделенные из бактериофагов rm378 и TS2126 (Nordberg Karlsson, et al., 2010; Hjorleifsdottir, 2014).
Из бактериофагов получены и некоторые из еще одной группы чрезвычайно важных ферментов — полимераз. Например, очень «точная» ДНК-полимераза бактериофага Т7, которая нашла применение в различных областях молекулярной биологии, таких как сайт-направленный мутагенез, но в основном ее используют для определения первичной структуры ДНК.
Химически модифицированная ДНК-полимераза фага Т7 была предложена как идеальный инструмент для секвенирования ДНК еще в 1987 г. (Tabor & Richardson, 1987). Модификация этой полимеразы увеличила эффективность ее работы в несколько раз: скорость полимеризации ДНК при этом достигает более 300 нуклеотидов в секунду, поэтому ее можно использовать для амплификации больших фрагментов ДНК. Этот фермент стал предшественником секвеназы — генно-инженерного фермента, оптимизированного для секвенирования ДНК в реакции Сэнгера. Секвеназа отличается высокой эффективностью и способностью включать в последовательность ДНК нуклеотидные аналоги, используемые для улучшения результатов секвенирования.
Происхождение от бактериофагов ведут и используемые в молекулярной биологии основные РНК-полимеразы (ДНК-зависимые РНК-полимеразы) — ферменты, которые катализируют процесс транскрипции (считывание РНК-копий с матрицы ДНК). К ним относятся SP6-, T7- и Т3-РНК-полимеразы, названные в честь соответствующих бактериофагов SP6, Т7 и Т3. Все эти ферменты используются для синтеза «в пробирке» антисмысловых РНК-транскриптов, меченых РНК-зондов и т. д.
Первым полностью секвенированным ДНК-геномом стал геном фага φ174 длиной свыше 5 тыс. нуклеотидов (Sanger et al., 1977). Эту расшифровку осуществила группа английского биохимика Ф. Сэнгера, создателя известного одноименного метода секвенирования ДНК.
Полинуклеотидкиназы катализируют перенос фосфатной группы от молекулы АТФ к 5′-концу молекулы нуклеиновой кислоты, обмен 5′-фосфатных групп или фосфорилирование 3′-концов мононуклеотидов. В лабораторной практике наибольшее распространение получила полинуклеотидкиназа бактериофага Т4. Она обычно используется в экспериментах для мечения ДНК радиоактивным изотопом фосфора. Полинуклеотидкиназа также используется для поиска сайтов рестрикции, ДНК и РНК дактилоскопии, синтеза субстратов для ДНК или РНК-лигаз.
В молекулярно-биологических экспериментах также находят широкое применение такие ферменты бактериофагов, как полинуклеотидкиназа фага Т4, обычно используемая для мечения ДНК радиоактивным изотопом фосфора, ДНК и РНК дактилоскопии и др., а также ферменты, расщепляющие ДНК, которые используются для получения одноцепочечных ДНК-матриц для секвенирования и анализа нуклеотидного полиморфизма.
Методами синтетической биологии удалось разработать и бактериофаги, вооруженные самым изощренным оружием, которое бактерии используют против самих фагов. Речь идет о бактериальных системах CRISPR-Cas, представляющих собой комплекс фермента нуклеазы, расщепляющей ДНК, и РНК-последовательности, направляющей действие этого фермента на определенный фрагмент вирусного генома. В качестве «указателя» служит кусочек фаговой ДНК, который бактерия сохраняет «на память» в специальном гене. При обнаружении внутри бактерии аналогичного фрагмента этот белково-нуклеотидный комплекс разрушает его.
Разобравшись с механизмом работы систем CRISPR-Cas, исследователи попробовали снабдить подобным «оружием» и самих фагов, для чего в их геном ввели комплекс генов, кодирующий нуклеазу и адресующие последовательности РНК, комплементарные специфическим участкам генома бактерий. «Мишенью» могут выступать гены, ответственные за множественную лекарственную устойчивость. Эксперименты увенчались полным успехом — такие фаги с большой эффективностью поражали бактерии, на которые были «настроены».
Из чего состоит бактериофаг
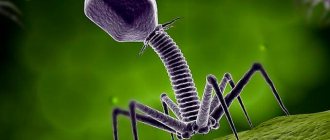
Типичный фаг состоит из «головы» с плотно упакованной генетической программой, состоящей из нуклеиновых кислот (ДНК или РНК), и «хвоста», с помощью которого «впрыскивает» свои гены в клетку бактерии. Зараженная бактерия начинает с помощью собственных внутриклеточных систем и ресурсов синтезировать белки и нуклеиновые кислоты, необходимые для сборки новых вирусных частиц. Зрелые фаги выходят на поиски новой добычи, а «родительская» бактериальная клетка погибает.
Благодаря последним исследованиям стало понятно, что бактериофаги играют важную для поддержания глобального «микробного баланса» роль в биосфере: каждые двое суток они уничтожают половину мировой популяции бактерий и тем самым препятствуют этим быстро размножающимся организмам покрыть толстым слоем земную поверхность.
Бактериофаги появляются везде, где живут бактерии: на суше и в океанах, в почве и в воде, в растениях и животных. Даже в желудочно-кишечном тракте человека содержится около 1012 бактериофагов – на порядок больше, чем звезд в нашей Галактике! И хотя размер фаговых частиц не превышает 0,0001 мм, биомасса фагов на планете достигает фантастической цифры – 1 млрд тонн. Поэтому эти невидимые глазом, но вездесущие создания называют иногда «темной материей» биосферы.
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc
. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.
Знакомьтесь – фекотрансплантация
После лечения антибиотиками в кишечнике иногда происходит быстрое размножение агрессивной бактерии рода клостридий – Clostridium difficile
, вызывающей тяжелейшую диарею, не поддающуюся медикаментозному лечению. Проблема настолько серьезна, что еще недавно от этой болезни в США погибали ежегодно тысячи больных. Лечить эту диарею научились совсем недавно, и очень простым способом – вводя в кишечник больного фекальную микрофлору, взятую от здорового донора. Выздоровление часто наступает практически мгновенно, буквально на следующий день. Очевидно, при такой «пересадке» фекалий больной получает полный набор «правильных» микроорганизмов, уничтоженных антибиотиками, плюс бактериофаги, регулирующие численность патогенных штаммов. Первоначально распространение метода в США сдерживалось FDA, которое пыталось использовать в его отношении принципы регулирования, принятые для обычных лекарств. Однако протесты терапевтов и больных наряду с очевидной безопасностью процедуры сыграли свою роль, и ее разрешили проводить, используя обычные меры предосторожности – выбор здоровых доноров и проведение процедуры специалистами в лечебных учреждениях. Этот метод лечения в последние несколько лет получил в США широкое распространение, давая хорошие результаты. Вероятно, только предубеждением врачей можно объяснить тот странный факт, что лечение фекотрансплантацией сегодня практикуется не во всех европейских странах, а в России его можно получить только в Центре новых медицинских технологий в новосибирском Академгородке
С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa
, а в рамках проекта
Phagoburn
семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (
Intralytix
,
Enbiotix
,
AmpliPhi
). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
«Счетчики» бактерий
Бактериофаги служат не только разносторонним терапевтическим и «дезинфицирующим» средством, но и удобным и точным аналитическим инструментом микробиолога. К примеру, благодаря своей высокой специфичности они являются природными аналитическими реагентами для выявления бактерий определенного вида и штамма.
В простейшем варианте такого исследования в чашку Петри с питательной средой, засеянную бактериальной культурой, добавляют по капле различные диагностические бактериофаги. Если бактерия окажется чувствительной к фагу, то на этом месте бактериального «газона» образуется «бляшка» — прозрачный участок с убитыми и лизированными бактериальными клетками.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Сейчас для выявления и количественного определения разных штаммов микроорганизмов применяют специальные референсные виды
фагов. Очень быстрые, работающие практически в режиме реального времени аналитические системы могут быть созданы на основе генетически модифицированных бактериофагов, которые при попадании в бактериальную клетку запускают в ней синтез репортерных флуоресцирующих (или способных к люминесценции) белков, таких как
люцифераза
. При добавлении к подобной среде необходимых субстратов в ней будет появляться люминесцентный сигнал, величина которого соответствует содержанию бактерий в образце. Такие «меченные светом» фаги были разработаны для детекции опасных патогенов — возбудителей чумы, сибирской язвы, туберкулеза, а также инфекций растений.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Фаготерапия: сквозь тернии
Открытие вирусов, убивающих бактерии, дало начало новому способу контроля за численностью бактерий. Самое очевидное приложение – фаготерапия, применение бактериофагов для лечения бактериальных инфекций человека. Ее преимуществом является крайняя специфичность фагов, поражающих только «избранные» болезнетворные агенты.
В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США.
В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
Так у Элиавы родилась мечта создать в Тбилиси мировой центр исследования бактериофагов. Эта идея заинтересовала И. В. Сталина, и в 1930 г. было построено и оснащено здание будущего Института бактериофагов, микробиологии и вирусологии, который сейчас носит имя его основателя. Однако далее события развивались по сценарию, характерному для СССР тех лет: в 1937 г. Элиава вместе с женой был арестован и расстрелян как «враг народа», а д’Эрель вернулся в Париж. Однако сам институт не погиб и продолжал успешно функционировать.
С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы. Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal).
Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг. там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
Кстати сказать, в прекращении работ с бактериофагами за рубежом, помимо успеха антибиотиков, большую роль сыграл и политический аспект. Ведь фаговая терапия развивалась в СССР, и западным ученым было политически «неправильным» работать по тематике, связанной с именем Сталина. К тому же это были времена лысенковщины, когда западная наука воспринимала со скептицизмом все, что делалось советскими биологами.
Фаговый дисплей
В наши дни бактериофаги широко применяются также в качестве простых систем для наработки белков с заданными свойствами. Речь идет о разработанной в 1980-х гг. крайне эффективной молекулярно-селекционной методике — фаговом дисплее
. Этот термин был предложен американцем Дж. Смитом, который доказал, что на основе бактериофагов кишечной палочки можно создать жизнеспособный модифицированный вирус, несущий на своей поверхности чужеродный белок. Для этого в фаговый геном внедряется соответствующий ген, который сливается с геном, кодирующим один из поверхностных вирусных белков. Такие модифицированные бактериофаги можно выделить из смеси с фагами дикого типа благодаря способности «чужого» белка связываться со специфичными антителами (Smith, 1985).
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 106–1014 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки
. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
Принципиальная схема процедуры биопеннинга — отбора высокоспецифичных рекомбинантных антител к конкретной мишени-антигену из комбинаторной библиотеки фагового дисплея на основе нитчатых бактериофагов. По: (Тикунова, Морозова, 2009)
С помощью фагового дисплея сегодня производят белки, которые могут избирательно связываться с терапевтическими мишенями, например, экспонированные на поверхности фага М13, способные узнавать и взаимодействовать с опухолевыми клетками. Роль этих белков в фаговой частице заключается в «упаковке» нуклеиновой кислоты, поэтому они хорошо подходят для создания препаратов генотерапии, только в этом случае они формируют частицу уже с терапевтической нуклеиновой кислотой.
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Если же концевой поверхностный белок бактериофага «адресовать» на раковые клетки, а к другому поверхностному белку присоединить репортерные группы (например, флуоресцирующие или магнитные), то получится средство для обнаружения опухолей. А если к частице присоединить еще и цитотоксический препарат (а современная биоорганическая химия позволяет легко это сделать), то получится лекарство, направленно действующее на раковые клетки.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
ВОЗ предупреждает, что мир вскоре вступит в «постантибиотиковую» эру, когда лечить обычные бактериальные инфекции будет нечем. И на этом фоне фаготерапия выглядит весьма перспективным направлением, развитие которого может привести к созданию эффективных персонализированных методов лечения заболеваний. Для этого есть как необходимые знания о фагах и механизмах их взаимодействия с бактериальными клетками, так и технологии работы с вирусными агентами.
Для фаговой терапии сегодня используют только вирулентные лизирующие фаги, в основном «хвостатые» фаги порядка Caudovirales, а также нитчатые фаги семейств Leviviridae (с одноцепочечным РНК-геномом) и Inoviridae (с одноцепочечным кольцевым ДНК-геномом).
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Тест: Вирусы — неклеточные формы жизни
Лимит времени: 0
Навигация (только номера заданий)
0 из 10 заданий окончено
Вопросы:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Информация
Инструкция: «Вам предлагаются задания с одним и несколькими правильными ответами из пяти и более предложенных».
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Тест загружается…
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
Результаты
Правильных ответов: 0 из 10
Ваше время:
Время вышло
Вы набрали 0 из 0 баллов (0)
| Средний результат |
| Ваш результат |
Рубрики
- Нет рубрики 0%
максимум из 15 баллов
| Место | Имя | Записано | Баллы | Результат |
| Таблица загружается | ||||
| Нет данных | ||||
Ваш результат был записан в таблицу лидеров Загрузка
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- С ответом
- С отметкой о просмотре
- Задание 1 из 10
1.
Неклеточные формы жизни
Правильно
Неправильно
- Задание 2 из 10
2.
Впервые открыл вирусы
Правильно
Неправильно
- Задание 3 из 10
3.
Вирус поражающий бактерии
Правильно
Неправильно
- Задание 4 из 10
4.
Д.И.Ивановский открыл вирус
Правильно
Неправильно
- Задание 5 из 10
5.
Наружная оболочка вируса
Правильно
Неправильно
- Задание 6 из 10
6.
Бактериофаг открыл
Правильно
Неправильно
- Задание 7 из 10
7.
Впервые предложил вакцину от оспы
Правильно
Неправильно
- Задание 8 из 10
8.
В зависимости от строения вирусы подразделяются на
Правильно
Неправильно
- Задание 9 из 10
9.
Вирусные заболевания
Правильно
Неправильно
- Задание 10 из 10