Галантамин (Galantaminum)
Галантамин вводится внутривенно, внутримышечно, подкожно, чрескожно (методом ионофореза), внутрь в таблетках. Дозу подбирают индивидуально, с учетом возраста больного, характера заболевания, эффективности и переносимости препарата. В начале лечения назначают минимальную эффективную дозу, постепенно увеличивая ее.
Внутрь, максимальная суточная доза для взрослых составляет 10-40 мг в 2-4 приема. При myasthenia gravis
суточная доза разделяется на 3 приема. При лечении деменции альцгеймеровского типа рекомендуемая начальная доза составляет 8 мг в сутки — по 4 мг 2 раза в сутки, через 4 недели переходят на поддерживающую дозу — 16 мг (по 8 мг 2 раза в сутки), которую принимают не менее 4 недель. Вопрос о повышении поддерживающей дозы до максимальной (24 мг в сутки) необходимо решать после оценки клинической ситуации (достигнутого эффекта и переносимости). При переходе с препарата в форме таблеток, принимаемых 2 раза в сутки, на лекарственную форму в виде капсул пролонгированного действия, принимаемых 1 раз в сутки, общая суточная доза должна остаться неизменной.
Подкожно, взрослым: по 2,5-10 мг 1-2 раза в сутки, максимальные разовая и суточная дозы 10 мг и 20 мг соответственно. Подкожно, детям: 1-2 раза в сутки, в возрасте 1-2 лет — по 0,25-1,0 мг в сутки, 3-5 лет — 0,5-5,0 мг в сутки, 6-8 лет — 0,75-7,5 мг в сутки, 9-11 лет — 1,0-10,0 мг в сутки, 12-15 лет — 1,25-12,5 мг в сутки, 15-16 лет — 12,5-20,0 мг в сутки. Большую дозу делят на 2 введения в день.
Длительность лечения зависит от особенности и тяжести заболевания, чаще всего — 40-60 дней, курс лечения можно проводить 2-3 раза с промежуточными периодами в 1-2 месяца.
Внутривенно, в качестве антагониста антидеполяризующих миорелаксантов: взрослым — по 10-20 мг в сутки, детям с 1 года — 1-2 мг, 3-5 лет — 1,5-3 мг, 6-8 лет — 2-5 мг, 9-11 лет — 3-8 мг, 12-15 лет — 5-10 мг.
Внутримышечно, при рентгенологических исследованиях применяется у взрослых в дозе 1-5 мг. При заболеваниях периферической нервной системы и для лечения ночного недержания мочи применяется у детей в виде ионофореза в дозе 1-2 мл 0,25 % раствора.
Применение у пожилых пациентов
Использование у пожилых систематически не изучалось. В связи с большим числом противопоказаний, наиболее применимых для людей пожилого возраста (например, хроническая сердечная недостаточность или длительный приём бета-блокаторов), необходимо тщательное обследование и последующий активный мониторинг состояния таких больных.
Применение у детей
Применение возможно согласно режиму дозирования. Противопоказан детям в возрасте до 1 года (для раствора), до 9 лет (для таблеток).
Галантамин Канон (капсулы) 8мг, 16мг, 24мг
Фармакодинамика
Галантамин (третичный алкалоид) — селективный, конкурентный и обратимый ингибитор ацетилхолинэстеразы. Кроме этого, галантамин усиливает действие ацетилхолина на никотиновые рецепторы, вероятно, за счет связывания с аллостерическим участком рецептора. Благодаря повышению активности холинергической системы, может улучшаться когнитивная функция у пациентов с деменцией альцгеймеровского типа.
Фармакокинетика
Галантамин — это основное соединение с одной константой диссоциации (pKa 8.2). Обладает слабой липофильностью с коэффициентом распределения (LogP) между н-октанолом и буферным раствором (рН 12) равным 1,09. Растворимость в воде (рН 6) составляет 31 мг/мл. Галантамин имеет 3 хиральных центра. S, R, S-конфигурация является естественной (природной). Галантамин частично метаболизируется с помощью различных цитохромов, в основном, изоферментов CYP2D6 и CYP3A4. Некоторые из метаболитов, образующихся в процессе деградации галантамина, активны в условиях in vitro, но не имеют существенного значения в условиях in vivo.
Всасывание
Абсолютная биодоступность галантамина при приеме внутрь высокая — 88,5 ± 5,4%. Показатели площади под кривой «концентрация-время» (AUC24ч) и минимальной концентрации (Сmin) в плазме крови аналогичны таковым при приеме галантамина немедленного высвобождения два раза в сутки. Максимальная концентрация (Cmax) в плазме крови достигается через 4,4 ч. Cmax галантамина пролонгированного действия на 24 % ниже, чем после приема галантамина немедленного высвобождения. Прием пищи не оказывает существенного влияния на AUC, при этом, вызывает увеличение Cmax примерно на 12% и удлинение времени достижения Cmax (TCmax) — примерно на 30 минут. Однако эти изменения не имеют клинического значения.
Распределение
Средний объем распределения (Vd) составляет 175 л. Степень связывания с белками плазмы крови низкая и составляет (18%).
Метаболизм
Исследования in vitro показали, что основными изоферментами системы цитохрома Р450, участвующими в биотрансформации галантамина, являются — CYP2D6 и CYP3A4. Изофермент CYP2D6 участвует в образовании О-десметилгалантамина, а изофермент CYP3A4 — N-оксид-галантамина. Экскреция радиоактивной дозы почками и через кишечник не отличается у пациентов с «медленным» и «быстрым» метаболизмом (низкой и высокой активностью изофермента CYP2D6 соответственно). В плазме крови пациентов с «быстрым» и «медленным» метаболизмом основную часть радиоактивных веществ составляют неизмененный галантамин и его глюкуронид. После однократного приема галантамина ни один из активных метаболитов галантамина (норгалантамин, О-десметилгалантамин и O-десметилноргалантамин) не определялись в неконъюгированной форме в плазме крови пациентов с «быстрым» и «медленным» метаболизмом. Норгалантамин был обнаружен в плазме крови пациентов после длительного приема препарата, при этом его концентрация составляла не более 10% от концентрации галантамина. Исследования в условиях in vitro свидетельствуют об очень низкой способности основных изоферментов системы цитохрома Р450 человека ингибировать галантамин.
Выведение
Выведение галантамина носит биэкспоненциальный характер. Конечный период полувыведения (Т/1/2) у здоровых добровольцев составляет 8-10 ч. По результатам изучения галантамина немедленного высвобождения в популяционных исследованиях клиренс при приеме галантамина внутрь в целевой популяции, как правило, составляет около 200 мл/мин с межиндивидуальной вариабельностью 30%. Через 7 дней после однократного приема внутрь 4 мг 3Н-галантамина 90-97% радиоактивной дозы выводится почками в виде неизмененного галантамина и 2,2-6,3% — через кишечник. После внутривенного введения и приема внутрь 18-22% дозы экскретировалось в виде неизмененного галантамина через почки в течение 24 ч. Почечный клиренс составил 65 мл/мин (20-25% общего плазменного клиренса). Фармакокинетика линейна в диапазоне доз от 8 мг до 24 мг при приеме 1 раз в сутки у пациентов пожилого возраста и молодых пациентов.
Фармакокинетика особых групп пациентов
Результаты клинических исследований показали, что у пациентов с болезнью Альцгеймера концентрация галантамина в плазме крови на 30-40% выше, чем у молодых здоровых лиц. Основываясь на анализе данных популяционной фармакокинетики, клиренс у женщин на 20% ниже по сравнению с мужчинами. Клиренс галантамина у пациентов с «медленным» метаболизмом изофермента CYP2D6 на 25% ниже по сравнению с пациентами с «быстрым» метаболизмом, при этом, бимодальность в популяции не наблюдается. Таким образом, метаболический статус пациента не считается клинически значимым в общей численности населения. Нарушение функции печени: у пациентов с легким нарушением функции печени (5-6 баллов по шкале Чайлд-Пью) фармакокинетические параметры галантамина были сходны с таковыми у здоровых людей. У пациентов с умеренным нарушением функции печени (7-9 баллов по шкале Чайлд-Пью) AUC и Т1/2 галантамина были повышены примерно на 30%. Нарушение функции почек: у пациентов с болезнью Альцгеймера и нарушением функции почек (клиренс креатинина (КК) ≥ 9 мл/мин) коррекции дозы не требуется.
Фармакокинетическо-фармакодинамическая взаимосвязь
В крупных исследованиях III фазы с режимом дозирования галантамина 12 мг и 16 мг два раза в день не наблюдалось видимой корреляции между средними концентрациями в плазме крови и показателями эффективности (изменения по шкале оценки когнитивных функций при болезни Альцгеймера (ADAS-cog/11) и шкале оценки состояния пациента на основании впечатлений врача и ухаживающих за пациентами лиц (CIBIC-plus) на 6-ом месяце терапии). Концентрации в плазме крови у пациентов с обмороками были в том же диапазоне, что и у других пациентов, принимающих ту же дозу. Возникновение тошноты коррелирует с более высоким пиком концентрации в плазме крови.
Опыт клинического применения Реминила (галантамина)
Проблема старения населения затрагивает врачей всех специальностей и особенно психиатров. Причиной тому нарастающая частота слабоумия у пожилых людей. Соответственно нарастает и социально-экономическое бремя общества по лечению и уходу за этой категорией больных. По данным эпидемиологического исследования психического здоровья пожилого населения Москвы, болезнью Альцгеймера (БА) страдает 4,5% жителей в возрасте 60 лет и старше (1).
Таблица 1. Средние суммарные показатели шкал MMSE, ADAS-Cog, IADL, BEHAVE AD перед началом терапии
Рисунок 1. Динамика среднего суммарного показателя MMSE при мягкой, умеренной деменции и по группе в целом
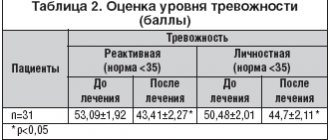
Таблица 2. Динамика среднего показателя разницы сумм баллов шкал ADAS-Cog, IADL, BEHAVE-AD
Рисунок 2. Динамика состояния больных по данным шкалы CGL
Рисунок 3. Динамика среднего суммарного показателя по шкале MMSE при БА и СоД
Рисунок 4. Динамика среднего суммарного показателя MMSE при СмД
Как известно, деменция обусловлена главным образом первичными нейро-дегенеративными процессами, сосудистой патологией или смешанным сосудисто-дегенеративным процессом. По данным литературы, перенесенный инсульт увеличивает риск возникновения сосудистой деменции (СоД) в 4-12 раз (9). На наш взгляд, современное состояние психофармакотерапии позволяет не оставлять без внимания и снижение когнитивной и психосоциальной деятельности, сопряженных с обычным процессом старения.
Общим механизмом для двух основных разновидностей деменций – болезни Альцгеймера (БА) и сосудистой деменции (СоД) – является холинергическая нейротрансмиттерная недостаточность, причастность которой к развитию слабоумия как при БА, так и СоД ныне общепризнанна, а ее компенсация холиномиметическими средствами стала одним из основных подходов к терапии этого заболевания. Доказано, что увеличение концентрации центрального ацетилхолина сопровождается усилением процессов и числа синаптических контактов (4).
Галантамин (Реминил) – селективный конкурентный обратимый ингибитор ацетилхолинэстеразы, способный усиливать эффекты ацетилхолина посредством модулирования никотиновых ацетилхолинергических рецепторов (нАХР). Потенцирование никотиновых рецепторов позволяет усилить никотиновый ответ поврежденных дегенеративным процессом, но продолжающих функционировать холинергических нейронов. Кроме того, Реминил моделирует выделение глютамата, допамина и GABA (ГАМК), ослабляя, таким образом, психологические и поведенческие симптомы деменции. В результате повышения чувствительности нАХР (за счет модулирующего действия галантамина (Реминила) на нАХР) доказана эффективность препарата не только при БА, но и смешанной деменции(СмД) и сосудистой деменции (СоД).
Целью
настоящего исследования являлось изучение эффективности и переносимости Реминила в клинической практике. Нами было предпринято открытое неконтролируемое исследование эффективности и безопасности Реминила при лечении БА, СоД и СмД.
В задачу исследования входило сравнение результатов терапии в зависимости от типа слабоумия, его нозологической принадлежности и степени тяжести.
Методика исследования
разработана совместно с исследователями Научного центра психического здоровья (руководитель – проф. В.А. Концевой). Согласно протоколу исследования отбирались пациенты с мягкой или умеренно выраженной деменцией (по Clinical Dementia Rating) (11), БА (согласно критериям NINCDS/ADRDA), СоД (по критериям NINСDS-AIREN) и «смешанной» деменцией (СмД) (по критериям NINCDS/ADRDA). В исследование включались больные с оценкой показателя шкалы MMSE в диапазоне от 12 до 24 баллов на момент скринингового визита. При диагностике учитывались данные клинико-лабораторного исследования, включая КТ или МРТ головы.
Критерии исключения:
из исследования исключались пациенты с деменциями иного генеза – опухолью головного мозга, болезнью Паркинсона, лобно-височной деменцией и иной патологией мозга, а также с так называемыми метаболическими деменциями и псевдодеменцией. Также не включались больные с тяжелой и/или декомпенсированной соматической патологией. Исключалось одновременное назначение препаратов, оказывающих воздействие на когнитивные функции: ингибиторов ацетилхолинэстеразы, антагонистов NMDA-рецепторов, пептидных препаратов, антиоксидантов, ноотропов, нейролептиков и антидепрессантов с выраженным антихолинергическим действием, а также изменяющих абсорбцию препарата или снижающих частоту сердечных сокращений.
В соответствии с протоколом исследования предусматривалась 3-месячная терапия больных Реминилом в дозе препарата 8 мг/сут. (в 2 приема) в 1-й месяц терапии и 16 мг/сут. (в 2 приема) на протяжении последующих 2 месяцев.
Эффективность терапии анализировали с помощью следующих клинических и психометрических шкал: MMSE, шкалы оценки когнитивных функций ADAS-Cog и навыков повседневной активности (IADL), нарушения поведения при БА (BEHAVE-AD) и общего клинического впечатления (CGL). Кроме того, в специальной таблице фиксировали нежелательные эффекты терапии. Оценка по шкале MMSE производилась четырехкратно: при «нулевом» визите и далее через каждый месяц; по остальным шкалам – троекратно: при «нулевом» визите, через 1 и 2 месяца.
В исследовании участвовали 14 больных (7 мужчин и 7 женщин). У 4 из них диагностирована БА с поздним началом, у 6 имела место СоД и у 4 – СмД. У 11 пациентов имела место мягкая и у 3 – умеренно выраженная деменция. Средний возраст начала болезни (появления слабоумия) был равен 65,3 ± 6,4 г. Средний возраст больных к началу терапии был 71,7 ± 7,8 г. Продолжительность деменции составляла от 2 до 10 лет, в среднем – 5,8 ± 3,9 г. Более чем половина больных (n = 8; 57%) страдали теми или иными соматическими заболеваниями, преимущественно артериальной гипертонией, ИБС, кардиосклерозом, сосудистой энцефалопатией.
Все больные завершили трехмесячный курс лечения. При статистической обработке данных использовались программы SPSS 12.
Оценка динамики данных шкалы MMSE проводилась на основании вычисления суммарного ее показателя; анализ результатов шкал ADAS Cog, IADL и BEHAVE-AD опирался на данные разницы их суммарных показателей между начальной и последующей оценками (таблица 1). При этом рассчитывались средние показатели упомянутых шкал путем попарного сравнения их исходной величины с каждой из последующих методом Вилкоксона. Данные шкалы CGL подвергались частотному (в процентах) анализу.
Исходные данные демонстрируют достоверное соответствие между степенью тяжести слабоумия и его оценкой по данным шкал MMSE и ADAS-Cog, характеризующих различные параметры когнитивных функций больных, а также шкалы IADL, выявляющей степень адаптации их в быту. Подобная тенденция, не достигающая, однако, степени статистической достоверности, наблюдалась и по данным шкалы BEHAVE-AD, фиксирующей весьма разнородные симптомы, из числа которых наиболее часто у обследованных нами больных отмечались нерезко выраженные (в пределах 1-2 баллов) нарушения сна (98%), тревога и фобии (78,5%), субдепрессии (64%), отдельные бредовые симптомы (14,2%).
Результаты исследования
Рисунок 1 демонстрирует статистически достоверную позитивную динамику когнитивного функционирования больных, по данным шкалы MMSE, как по группе в целом, так и при мягкой и умеренной деменции уже к исходу первого месяца терапии. Обращает на себя внимание стабилизация данного показателя после двух месяцев терапии у больных с умеренной деменцией, тогда как у больных с мягкой деменцией статистически достоверное возрастание этого показателя имело место на протяжении всего периода наблюдения.
Сведения о динамике среднего показателя разницы суммарных показателей шкал ADAS-Сog, IADL и BEHAVE-AD приведены в таблице 2.
По данным шкалы ADAS-Cog, как при мягкой и умеренной тяжести деменции, так и по группе в целом статистически достоверное улучшение когнитивных функций больных отмечено уже после 2 месяцев терапии. Показатели этого улучшения возрастали примерно еще на половину к исходу 3 месяца терапии. Подобную динамику претерпевали и соответствующие показатели шкалы BEHAVE-AD, что свидетельствовало о редукции сопутствующих слабоумию продуктивных психопатологических симптомов и поведенческих расстройств. Показатели шкалы IADL у больных с мягкой деменцией демонстрировали достоверное улучшение функциональных возможностей пациентов ко 2 месяцу терапии, с небольшим последующим улучшением к концу 3 месяца. Тогда как у больных с умеренной деменцией такой тенденции не отмечалось, возможно, из-за малого числа больных.
По данным шкалы CGL (рисунок 2), различной степени положительная динамика состояния больных по группе в целом как после 1, так и после 3 мес. терапии отмечена у 80% больных. При всех вариантах слабоумия преобладало минимальное улучшение, при этом отсутствовали случаи ухудшения состояния. Выраженное улучшение наблюдалось только у трети пациентов с мягкой деменцией уже ко 2 месяцу терапии. По завершении терапии улучшение состояния в целом констатировано в 2 раза чаще при мягкой, чем при умеренно выраженной деменции.
В зависимости от диагностической принадлежности деменции удалось сравнить результаты терапии только при мягкой деменции, так как практически все случаи СоД соответствовали мягкой деменции. Отобранные для сравнения лица с БА (n = 3) и СоД (n = 4) отличались по возрасту начала слабоумия (74,3 ± 9,8 и 66,5 ± 6,3лет соответственно), а также по возрасту больных к началу терапии (79,2 ± 11,5 и 70,75 ± 9,5 лет соответственно).
По данным шкалы MMSE (рисунок 3), при примерно одинаковом показателе оценка к началу терапии в группах БА и СоД после 3 месяцев терапии, улучшение когнитивных функций при СоД оказалось более выраженным (примерно на 2,5 балла), чем при БА. Аналогичная тенденция отмечена и по данным шкал ADAS-Cog и IADL. Средний суммарный показатель шкалы BEHAVE-AD улучшался более заметно при СоД. Однако малое число наблюдений делает некорректной статистическую обработку данных по вышеуказанным шкалам. После 1 месяца терапии при БА отмечались случаи с минимальным улучшением, а при СоД доминировали случаи с умеренным улучшением. При СоД уже на этом раннем этапе лечения примерно у 21% больных наблюдалось выраженное и у 9% – умеренное улучшение.
У включенных в исследование 4 больных со СмД тяжесть слабоумия была легкой. Средний возраст начала развития деменции составлял 64,0 ± 4,9 года, средний возраст больных к началу лечения – 67,75 ± 7,7 года.
Рисунок 4 демонстрирует позитивную динамику когнитивных функций больных СмД по данным шкалы MMSE улучшение составило почти 5 баллов по сравнению с исходной оценкой. Явное улучшение больных СмД наблюдалось и по показателям других шкал, но особенно заметно оно было к моменту завершения терапии.
Нежелательные явления
Умеренно выраженные нежелательные явления наблюдались у 2 больных (14,2%). В одном случае отмечалась тошнота, во втором – головная боль, трудности засыпания при увеличении дозы препарата на втором месяце лечения. Снижение суточной дозы препарата (с 16 до 8 мг) привело к исчезновению нежелательных явлений и улучшению состояния пациентов к окончанию терапии, несмотря на применение дозы 8 мг/сут.
Обсуждение результатов
Таким образом, клиническое исследование Реминила позволило установить его эффективность при лечении основных вариантов деменций. По данным литературы, препарат демонстрирует комплексное терапевтическое воздействие на различные составляющие слабоумия: когнитивные и психопатологические расстройства, поведенческие нарушения, дезадаптацию больных в быту. Достоверное улучшение, согласно нашим данным, становится очевидным уже к концу первого месяца терапии и постепенно нарастает к моменту ее завершения. Обращает на себя внимание стабилизация показателей после двух месяцев терапии у больных с умеренной деменцией. Следует отметить, что, по данным шкалы CGI, не было отмечено ни одного случая ухудшения состояния больных в целом, а та или иная степень улучшения состояния выявлена у большей части больных (80%).
Несмотря на достаточно гармоничную редукцию проявлений слабоумия при всех его вариантах, наибольший терапевтический эффект в отношении состояния когнитивных функций и параметров общего состояния больных достигался при мягкой деменции (шкалы MMSE, ADAS-cog и CGI). Выраженное улучшение наблюдалось только при мягкой деменции (уже ко 2 месяцу терапии в 1/3 случаев). По завершении терапии улучшение состояния в целом констатировано в 2 раза чаще при мягкой, чем при умеренно выраженной деменции.
Редукция сопутствующих слабоумию продуктивных психопатологических симптомов и поведенческих расстройств, согласно динамике показателей шкал IADL и BEHAVE-AD, у больных с мягкой деменцией оказалась достоверной к концу 3 месяца терапии, тогда как у больных с умеренной деменцией таковой тенденции не отмечено.
Оценка эффективности терапии галантамином у больных с мягкой деменцией при СоД и БА показала, что при СоД показатели когнитивной сферы, навыки повседневной жизни улучшаются более отчетливо (по шкалам MMSE, ADAS-cog, IDAL). Состояние больных в целом при СоД определенно улучшалось уже ко второму, а при БА – к третьему месяцу лечения.
В изученной выборке больных умеренно выраженные нежелательные явления (преимущественно головная боль, тошнота) отмечены у двух пациентов. Они возникли при увеличении дозы препарата на втором месяце лечения до 16 мг/сут и исчезли после возвращения к первоначальной дозе. Это делает целесообразным лечение деменций даже низкими дозами препарата в тех случаях, где более высокие дозы приводят к нежелательным явлениям.
Таким образом, данное исследование продемонстрировало большую эффективность терапии галантамином СоД по сравнению с БА и его хорошую переносимость.
PsyAndNeuro.ru
В последние годы опубликовано несколько исследований, посвященных применению комбинации галантамин-мемантин при Болезни Альцгеймера (БА). В двухлетнем рандомизированном контролируемом исследовании (РКИ) продромальной стадии БА когнитивные функции пациентов, получавших комбинацию галантамин-мемантин, были значительно лучше когнитивных функций тех, кто принимал только галантамин [1].
В ретроспективном когортном исследовании комбинация галантамин-мемантин значительно улучшила когнитивные способности по сравнению с комбинацией донепезил-мемантин при лечении БА [2]. В натуралистическом исследовании пациенты с деменцией с телами Леви получали галантамин в течение 6 месяцев. Затем пациентам, которые ответили на лечение, также назначали мемантин. Добавление мемантина к галантамину значительно улучшило когнитивные способности и поведение по сравнению с одним галантамином [3].
Несмотря на убедительные доказательства, комбинация галантамин-мемантин все еще недостаточно используется в клинической практике. В США галантамин и мемантин одобрены для лечения БА. Комбинация донепезил-мемантин тоже одобрена для лечения БА, но комбинация галантамин-мемантин – нет.
Галантамин превосходит донепезил, поскольку он является положительным аллостерическим модулятором альфа7-никотиновых ацетилхолиновых рецепторов и действует как ингибитор ацетилхолинэстеразы. Наконец, помимо когнитивных нарушений, при БА часто наблюдаются психозы и негативная симптоматика. Комбинация галантамин-мемантин может не только улучшать когнитивные функции, но и использоваться против психоза и негативной симптоматики.
При анализе результатов РКИ, посвященных лечению БА, нужно учитывать то, что многие из них дают отрицательный результат из-за того, что к участию часто привлекаются пациенты на поздней стадии заболевания. Лечение на поздних стадиях БА может быть неэффективным, потому что хронические нейровоспалительные процессы со временем вызывают необратимые повреждения. Как правило, в РКИ участвуют пациенты, у которых количество бляшек и степень нейродегенерации уже весьма высоки, поэтому заболевание в их случае, вероятно, уже стало необратимым. Клинические данные говорят, что лечение БА на ранних стадиях более перспективно. Лучшие результаты достигаются у пациентов на продромальной стадии или у пациентов с легкими когнитивными нарушениями. Это положение можно сравнить с карциномой in situ и 1-й или 2-й стадией рака в сравнении со стадиями 3 и 4; на поздних стадиях вмешательство обычно не дает результат.
Вероятно, часто бывает так, что одного лекарства недостаточно для стабилизации всех патофизиологических механизмов и ослабления симптоматики БА. Нейродегенеративные заболевания включают в себя множество патологий, поэтому комбинированное лечение представляется наиболее рациональным выбором.
При этом, прием значительного количества лекарств пациентами с БА оказывает серьезную финансовую нагрузку на их семьи. Ранее мы опубликовали анализ с целью выяснить прием какого из мемантинов экономически более выгоден. В РФ в аптеках представлен мемантин 11 производителей, из них 6 имеют в своем составе индийскую субстанцию, а 5 – европейскую. Однако производство таблеток у трех из них локализовано в РФ, и только два мемантина – Акатинол и Меманталь – полностью производятся в Европе. Примечательно, что первый из них – оригинальный препарат, а второй – единственный дженерик с доказанной терапевтической эквивалентностью.
Комбинация галантамин-мемантин может быть эффективной не только при БА, но и при черепно-мозговой травме, аутизме и других психоневрологических заболеваниях. У 22 пациентов с БА мемантин улучшил биомаркеры окислительного стресса, такие как небелковые тиолы и 3-нитротирозин в спинномозговой жидкости [4]. К дисфункции синапсов могут быть причастны окислительно-восстановительные реакции, опосредованные NMDA-рецепторами и их взаимодействием с другими молекулами.
Одновременное воздействие на никотиновые и NMDA-рецепторы может быть весьма успешным методом улучшения основных параметров когнитивных функций мозга [5].
Автор: Филиппов Д.С.
Источники:
[1] Peters, O. et al. 2012. A combination of galantamine and memantine modifies cognitive function in subjects with amnestic MCI. J. Nutr. Health Aging 16 (6), 544–548
[2] Matsuzono, K. et al. 2015. Combination therapy of cholinesterase inhibitor (donepezil or galantamine) plus memantine in the okayama memantine study. J. Alzheimers Dis. 45 (3), 771–780
[3] Vasenina, E.E., Gankina, O.A., Levin, O.S, 2021. The addition of memantine to galantamine increases treatment efficacy in patients with moderate dementia with Lewy bodies. Zh Nevrol Psikhiatr Im S Korsakova 118 (6. Vyp. 2), 32–36
[4] Valis, M. et al. 2021. The Concentration of Memantine in the Cerebrospinal Fluid of Alzheimer’s Disease Patients and Its Consequence to Oxidative Stress Biomarkers. Front. Pharmacol. 10, 943
[5] Koola, Maju. (2020). Galantamine-Memantine Combination in the Treatment of Alzheimer’s Disease and Beyond. Psychiatry Research. 293. 113409.

![Таблица 3. Фармакокинетические и фармакодинамические параметры фторхинолонов при однократном приеме стандартной дозы внутрь [7, 13]](https://irknotary.ru/wp-content/uploads/tablica-3-farmakokineticheskie-i-farmakodinamicheskie-parametry-ftorhinolonov-pri-odnokratnom-prieme-330x140.jpg)