Фармакологические свойства препарата Темодал
Фармакодинамика. Темодал (темозоломид) — средство имидазотетразиновое алкилирующее средство с противоопухолевой активностью. При поступлении в системную циркуляцию (при физиологических значениях рН) подвергается быстрой химической трансформации с образованием активного соединения — монометилтриазеноимидазолкарбоксамида (МТИК). Полагают, что цитотоксичность последнего обусловлена главным образом алкилированием гуанина в положении О6 и дополнительным алкилированием в положении N7. Цитотоксическое повреждение, которое развивается впоследствии, скорее всего запускает механизм аберрантного восстановления метилового остатка. Фармакокинетика. Темозоломид быстро всасывается после приема внутрь и выводится из организма с мочой. Быстро проникает через ГЭБ и поступает в СМЖ. Максимальная концентрация в плазме крови достигается в среднем через 0,5–1,5 ч (уже через 20 мин) после приема препарата. Период полувыведения из плазмы крови составляет приблизительно 1,8 ч. Клиренс, объем распределения и период полувыведения не зависят от дозы. Темозоломид слабо связывается с белками плазмы крови (10–20%), в связи, с чем не следует ожидать взаимодействия препарата с соединениями, которые значительно связываются с белками плазмы крови. После перорального приема выделение темозоломида с меткой 14С средняя степень выведения изотопа 14С с калом на протяжении 7 дней составляла 0,8%, что свидетельствует о его полной абсорбции. Основной путь выведения темозоломида — через почки. Через 24 ч после приема внутрь приблизительно 5–10% принятой дозы экскретируется в неизмененном виде с мочой, остальная часть выводится в виде кислотной формы темозоломида — 5-аминоимидазол-4-карбоксамида и неидентифицированных полярных метаболитов. Анализ фармакокинетики показал, что клиренс темозоломида в плазме крови не зависит от возраста, функции почек или курения. В отдельном фармакокинетическом исследовании было выявлено, что фармакокинетический профиль препарата у пациентов со слабым или умеренно выраженным нарушением функции печени аналогичен таковому у лиц с нормальной функцией печени. У детей показатель AUC выше, чем у взрослых, однако максимальная переносимая доза у детей и взрослых одинакова и составляет 1000 мг/м2 н а цикл лечения.
Применение препарата Темодал
Терапию препаратом Темодал должен проводить врач с опытом лечения таких злокачественных заболеваний. Взрослые пациенты с впервые выявленной мультиформной глиобластомой Фаза лечения Темодалом в сопровождении радиотерапии. Темодал применяют внутрь в дозе 75 мг/м2 к аждый день на протяжении 42 дней одновременно с радиотерапией (60 Гр за 30 фракций) с последующим курсом адъювантного лечения в течение 6 циклов. Снижение дозы не рекомендуется; однако прерывание в дозировании возможно в зависимости от переносимости терапии пациентом. В такой дозе применение Темодала может быть продлено с 42 дней сопроводительной терапии до 49 дней при наличии всех нижеперечисленных условий: абсолютное количество нейтрофилов 1,5•109/л; количество тромбоцитов ≥100•109/л; критерии общей токсичности (КОТ) негематологическая токсичность ≤1-й степени (за исключением алопеции, тошноты и рвоты). Коррекция дозы. Во время лечения еженедельно следует выполнять развернутый общий анализ крови. Применение Темодала следует прервать или прекратить совсем во время сопроводительной фазы, учитывая критерии гематологической и негематологической токсичности в соответствии с табл.1. Таблица 1Прерывание или прекращение применения Темодала во время сопроводительной терапии (Темодал + радиотерапия)
Токсичность | Прерывание* применения Темодала | Прекращение применения Темодала |
| Абсолютное количество нейтрофилов | ≥0,5 и ≤1,5•109/л | ≤0,5•109/л |
| Количество тромбоцитов | ≥10 и ≤100•109/л | ≤ 10•109/л |
| КОТ — негематологическая токсичность (за исключением алопеции, тошноты и рвоты) | Степень 2 | Степень 3 или 4 |
*Применение Темодала возобновляют при наличии всех нижеперечисленных состояний: абсолютного количества нейтрофилов ≥1,5•109/л; количества тромбоцитов ≥100•109л; КОТ — негематологическая токсичность ≤1-й степени (за исключением алопеции, тошноты и рвоты).
Адъювантная фаза Через 4 нед после завершения фазы лечения Темодал + радиотерапия, Темодал назначают для 6 дополнительных циклов адъювантной терапии. Доза во время Цикла 1 (адъювантный цикл) составляет 150 мг/м2 о дин раз в сутки на протяжении пяти дней 28-дневного цикла (5 дней — прием Темодала, 23 дня — без приема Темодала). Доза Темодала для Цикла 2 повышается до 200 мг/м2/сут, если КОТ — негематологическая токсичность во время цикла 1 составлял ≤2-й степени (за исключением алопеции, тошноты и рвоты), абсолютное количество нейтрофилов ≥1,5•109/л, количество тромбоцитов ≥100•109/л. Если повышение дозы не произошло в цикле 2, в последующих циклах дозу также не повышают. Доза 200 мг/м2/сут в течение первых 5 дней каждого последующего цикла остается, за исключением случаев развития токсичности. В каждом цикле прием Темодала осуществляют в течение 5 дней подряд с последующим 23-дневным перерывом. Снижение дозы или прекращение применения Темодала во время адъювантной терапии следует проводить согласно табл. 2 и 3. Во время лечения следует выполнить развернутый общий анализ крови на 22-й день (21-й день после приема первой дозы). Таблица 2Уровни доз Темодала для адъювантной терапии
Уровень дозы | Доза, мг/м2/сут | Примечание |
| –1 | 100 | Снижение при предшествующей токсичности |
| 0 | 150 | Доза во время цикла 1 |
| 1 | 200 | Доза во время циклов 2–6 при отсутствии токсичности |
Таблица 3Снижение дозы или прекращение применения Темодала во время адъювантной терапии
Токсичность | Снижение дозы Темодала на 1 уровень* | Прекращение применения Темодала |
| Абсолютное количество нейтрофилов | ≤1,0•109/л | b |
| Количество тромбоцитов | ≤50•109/л | b |
| КОТ — негематологическая токсичность (за исключением алопеции, тошноты и рвоты) | Степень 3 | Степень 4 |
*уровни дозы Темодала, указанные в таблице; b — прием Темодала прекращают, если требуется снижение дозы до ≤100 мг/м2/сут или если степень 3 негематологической токсичности (за исключением алопеции, тошноты и рвоты) остается после снижения дозы.
Взрослые пациенты с рецидивом или прогрессированием глиомы или злокачественной меланомы. Больным, которым раньше не проводили химиотерапию, Темодал назначают перорально в дозе 200 мг/м2 о дин раз в сутки на протяжении 5 дней 28-дневного цикла. Для пациентов, которые раньше лечились химиотерапией, начальная доза составляет 150 мг/м2 о дин раз в сутки; во втором цикле доза может быть повышена до 200 мг/м2 в сутки, если в первый день этого цикла абсолютное количество нейтрофилов ≥1,5•109/л, а количество тромбоцитов ≥100•109/л. Пациенты детского возраста с рецидивом или прогрессированием глиомы. Детям в возрасте старше 3 лет Темодал назначают перорально в дозе 200 мг/м2 о дин раз в сутки в течение 5 дней 28-дневного цикла. Для детей, которые ранее получали химиотерапию, начальная доза составляет 150 мг/м2 о дин раз в сутки в течение пяти дней с повышением до 200 мг/ м2 в сутки в течение последующего цикла, если не отмечается признаков токсичности. Лабораторные показатели для модификации дозирования при рецидиве или прогрессировании глиомы или злокачественной меланомы. Перед началом применения препарата должны быть такие значения лабораторных показателей: абсолютное количество нейтрофилов ≥1,5•109/л, количество тромбоцитов ≥100•109/л. Развернутый общий анализ крови должен быть выполнен на 22-й день (21-й день после приема первой дозы) или в пределах 48 ч после этого дня и затем еженедельно до тех пор, пока абсолютное количество нейтрофилов не будет выше 1,5•109л, а количество тромбоцитов не превысит 100•109/л. Если абсолютное количество нейтрофилов ≤1,0•109/л или если количество тромбоцитов ≤50•109/л во время любого цикла, доза в последующем цикле должна быть ниже на один уровень. Возможные уровни доз в сутки: 100 мг/м2, 150 мг/м2 и 200 мг/м2. Минимальная рекомендованная доза составляет 100 мг/м2/сутки. Длительность лечения составляет максимально 2 года. При появлении признаков прогрессирования заболевания лечение Темодалом следует прекратить. Темодал следует принимать натощак не менее чем за час до приема пищи. Назначенная доза должна быть применена, используя минимально возможное количество капсул. Капсулы Темодала глотают целыми, запивая стаканом воды; капсулы не следует вскрывать или разжевывать. При повреждении капсулы следует избегать контакта ее содержимого с кожей или слизистыми оболочками. При попадании порошка на кожу или слизистую следует промыть это место водой. Капсулы следует хранить в оригинальном флаконе, в сухом месте.
Применение парентеральной формы препарата Темодал® (темозоломид) в терапии глиобластом
В статье на конкретном примере рассмотрена эффективность темозоломида, назначенного на раннем этапе диагностики глиобластомы. Показано, что химиолучевая терапия с использованием темозоломида и последующая монохимиотерапия парентеральным Темодалом (темозоломид) хорошо переносятся, способствуют значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими схемами терапии и являются золотым стандартом первой линии терапии у пациентов с глиобластомой.
Рис. 1. Результаты МРТ: эффективность химиолучевой терапии у пациентки с глиобластомой (А – после операции, Б – после лучевой терапии и шести курсов монохимиотерапии)
Рис. 2. Результаты МРТ: эффективность химиолучевой терапии у пациента с глиобластомой (А – после операции, Б – после лучевой терапии и монохимиотерапии темозоломидом, В – после шести курсов монохимиотерапии)
Введение
Злокачественные глиомы составляют 50–60% всех первичных опухолей центральной нервной системы. Прогноз их лечения неблагоприятный, а качество жизни больных снижается вследствие тяжелых неврологических нарушений и осложнений на фоне применяемой терапии. Алгоритм лечения предусматривает хирургическую резекцию с последующей лучевой терапией и химиотерапией [1]. При глиальных опухолях используются противоопухолевые препараты: темозоломид, нитрозопроизводные (ломустин, нимустин, кармустин, фотемустин), винкристин, прокарбазин, комбинация «ломустин + прокарбазин + винкристин», производные платины (цисплатин, карбоплатин), этопозид, бевацизумаб (в монотерапии или в комбинации с иринотеканом). Наиболее эффективным препаратом в лечении злокачественных глиом признан темозоломид [2].
Темозоломид – алкилирующий препарат, механизм действия которого состоит в присоединении метильной группы к ДНК, что приводит к нарушению структуры последней и гибели клетки [3]. Пероральный темозоломид обладает 100%-ной биодоступностью, а также быстрой и полной всасываемостью в кишечнике.
Необходимо отметить, что препарат включен в стандарты лечения злокачественных глиом в России и доступен для пациентов. При лечении злокачественных глиом темозоломид назначают в дозе 150–200 мг/м2 в течение пяти суток каждые 28 дней [4]. Длительный прием темозоломида – в течение всего курса радиотерапии приводит к истощению метилгуаниновой метилтрансферазы (МГМТ) – фермента, обеспечивающего клеточную репарацию ДНК и влияющего на прогноз эффективности химиотерапии, даже в отсутствие метилирования МГМТ, что дает надежду на успех лечения [5, 6].
На сегодняшний день стандартом лечения пациентов с глиобластомой в качестве первой линии после удаления или биопсии (после гистологической верификации опухоли) считается проведение комбинированной химиолучевой терапии с использованием темозоломида (его ежедневный прием во время лучевой терапии с последующими поддерживающими курсами химиотерапии данным препаратом) [2]. Добавление темозоломида к лучевой терапии на самых ранних этапах лечения глиобластом обеспечивает статистически значимое увеличение общей выживаемости и увеличение времени до прогрессирования [3]. Результаты клинических исследований показали, что все больные, получавшие темозоломид в обеих лекарственных формах, отмечали лучшую переносимость внутривенной инфузии по сравнению с пероральным приемом капсул. Наличие двух лекарственных форм расширяет возможности применения темозоломида при злокачественных глиомах, позволяет проводить лечение с наименьшей токсичностью и обеспечивать наиболее высокое качество жизни пациентов в процессе лечения [4].
Клинический случай 1
Женщина, 40 лет. Заболела остро в июле 2015 г., имел место приступ с потерей сознания. Пациентка была доставлена в клинику бригадой скорой помощи. При выполнении компьютерной томографии (КТ) головного мозга выявлена опухоль головки хвостатого ядра с поражением мозолистого тела и паравентрикулярных отделов лобной доли справа. 13 июля выполнена операция – удаление новообразований больших полушарий головного мозга с применением нейрохирургической техники под контролем навигации. Гистологически – глиобластома G4. После операции отмечался небольшой неврологический дефицит, обусловленный онемением в левой верхней конечности. Результаты магнитно-резонансной томографии (МРТ) головного мозга, проведенной 30 июля, показали наличие опухоли правой височно-лобной области с распространением на базальные ядра мозга справа и передние отделы корпуса мозолистого тела, послеоперационной порэнцефалической кисты правой височно-лобной области. Назначены химиолучевая терапия, затем шесть курсов монохимиотерапии темозоломидом. С учетом наличия в послеоперационном периоде периодических головокружений, тошноты и рвоты после приема пищи выбрана парентеральная форма препарата Темодал®. Лучевая терапия начиналась через 25 дней после операции. 3D-планирование выполнялось на планирующей системе Aмфора 2.13 с использованием КТ-топометрии и совмещения данных МРТ-сканирования режима T1 для визуализации остаточной опухоли. Облучению (доза 30 Гр) подвергался весь объем головного мозга, затем уменьшенными полями – остаточная опухоль с краем безопасности 1–2 см (суммарная доза до 60 Гр). Лечение проводилось в режиме стандартного фракционирования на гамма-терапевтическом аппарате АГАТ-Р1. Одновременно с лучевой терапией (30 фракций в суммарной дозе 60 Гр) пациентка получала темозоломид в дозе 75 мг/м2 ежедневно внутривенно в течение 42 дней. Во время лечения еженедельно проводилось исследование крови с подсчетом числа клеток. Гематологической токсичности на протяжении всего периода химиолучевого лечения не зарегистрировано. Снижения дозы и временной отмены препарата не потребовалось. Спустя четыре недели по завершении комбинированной терапии выполнено шесть курсов монохимиотерапии темозоломидом. Во время первого курса препарат назначали в дозе 150 мг/м2 внутривенно в течение пяти дней с последующим 23-дневным перерывом. С учетом того что на первом цикле гематологической и негематологической токсичности не зафиксировано, на втором курсе доза увеличена до 200 мг/м2 внутривенно. В такой же суточной дозе препарат назначали и в последующих циклах. В каждом цикле пациентка принимала препарат в течение пяти дней подряд с последующим 23-дневным перерывом. На фоне лечения неврологического дефицита не отмечалось. Контрольная МРТ головного мозга показала значительное уменьшение размера зоны патологического накопления контраста и зоны перифокального отека (рис. 1).
Ситуация на март 2021 г.: пациентка жива, продолжает работать и вести активный образ жизни, неврологическая симптоматика полностью купирована. Гематологической и негематологической токсичности на протяжении всего периода лечения не зафиксировано. Планируется продолжить монохимиотерапию парентеральной формой темозоломида до прогрессирования заболевания с оценкой эффекта (МРТ головного мозга) каждые три месяца.
Клинический случай 2
Мужчина, 39 лет. Заболел остро, в конце марта 2015 г. появились выраженные головные боли, слабость в правых конечностях, замедленная речь. Бригадой скорой медицинской помощи пациент был доставлен в клинику. При выполнении КТ головного мозга выявлено объемное образование левой лобной доли головного мозга. 13 апреля проведена операция – микрохирургическое удаление опухоли левой лобной доли, островка с применением интраоперационной навигации. Гистологически – глиобластома G4. После операции наблюдался неврологический дефицит в виде правостороннего гемипареза и нарушения речи. Контрольная МРТ головного мозга, проведенная 28 апреля, показала состояние после субтотального удаления опухоли лобно-теменной области головного мозга слева, латеральную дислокацию срединных структур вправо. Лучевая терапия начата через 28 дней после операции. 3D-планирование выполнено на планирующей системе Aмфора 2.13 с использованием КТ-топометрии и совмещения данных МРТ-сканирования режима T1 для визуализации остаточной опухоли. Облучению (доза до 30 Гр) подвергался весь объем головного мозга, затем уменьшенными полями – остаточная опухоль с краем безопасности 1–2 см (суммарная доза до 60 Гр). Лечение проводилось в режиме стандартного фракционирования на гамма-терапевтическом аппарате АГАТ-Р1. Одновременно с лучевой терапией (30 фракций в суммарной дозе 60 Гр) пациент получал Темодал® (темозоломид) в дозе 75 мг/м2 ежедневно внутривенно в течение 42 дней. Во время лечения еженедельно проводилось исследование крови с подсчетом числа клеток. Гематологической токсичности на протяжении всего периода химиолучевого лечения не зафиксировано. Снижения дозы и временной отмены препарата не потребовалось. Спустя четыре недели по окончании комбинированной терапии проведено шесть курсов монохимиотерапии темозоломидом. Во время первого курса препарат назначали в дозе 150 мг/м2 внутривенно в течение пяти дней с последующим 23-дневным перерывом. С учетом того что на первом цикле гематологической и негематологической токсичности не наблюдалось, во время второго курса дозу увеличили до 200 мг/м2 внутривенно. В такой же суточной дозе препарат назначали и на последующих циклах. В каждом цикле пациент принимал препарат в течение пяти дней подряд с последующим 23-дневным перерывом. На фоне лечения наблюдались клинически выраженная положительная динамика, уменьшение неврологического дефицита. Контрольная МРТ головного мозга продемонстрировала значительное уменьшение размера зоны патологического накопления контраста и зоны перифокального отека (рис. 2).
Ситуация на март 2021 г.: пациент жив, не работает, но выполняет всю работу по дому, полностью себя обслуживает, сохраняется незначительное нарушение речи. Гематологической и негематологической токсичности на протяжении всего лечения не зарегистрировано. Планируется продолжить монохимиотерапию парентеральной формой темозоломида до прогрессирования заболевания с оценкой эффекта (МРТ головного мозга) каждые три месяца.
Обсуждение
Рассмотренные клинические случаи иллюстрируют потенциальный благоприятный эффект темозоломида, назначенного на ранних этапах диагностики глиобластомы совместно с лучевой терапией, а также в виде адъювантной монохимиотерапии. Оба пациента продолжают получать парентеральную форму темозоломида с отмечающейся частичной ремиссией.
Данная схема лечения позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования и сохранить качество жизни и социальный статус больных.
Низкая токсичность препарата Темодал® (темозоломид) при внутривенном введении позволяет рекомендовать проведение инфузий в условиях дневного стационара или амбулаторно. При адъювантной химиотерапии риск нежелательных негематологических эффектов выше, в связи с чем расширяются показания к внутривенному введению темозоломида: нарушение глотания, трудности при проглатывании капсул, тяжелая тошнота и рвота при предшествующем приеме капсул, хронические заболевания органов желудочно-кишечного тракта. Таким образом, наличие двух лекарственных форм расширяет возможности применения темозоломида при злокачественных глиомах [4].
При выборе и проведении терапии глиобластом с дифференцировкой G4 следует учитывать, что заболевание неизлечимо. Медиана выживаемости, как правило, менее года с момента постановки диагноза. Даже в самых благоприятных ситуациях большинство пациентов умирают в течение двух лет. Именно поэтому основными задачами лечения являются увеличение продолжительности жизни больных (одно- и двухлетняя выживаемость), улучшение качества жизни (компенсация неврологического дефицита, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни пациентов [7].
В настоящее время использование лучевой терапии совместно с темозоломидом признано стандартом лечения мультиформной глиобластомы в большинстве стран, в том числе в России. Химиотерапию при глиобластоме предпочтительно начинать совместно с лучевой терапией.
На фоне лучевой терапии и применения темозоломида (75 мг/м2 ежедневно в течение всего курса лучевой терапии, а затем 150–200 мг/м2 в течение пяти суток каждые 28 дней) наблюдалось повышение двухлетней выживаемости при глиобластомах до 27,2%, трехлетней – до 16,7%, четырехлетней – до 13% (при проведении лучевой терапии без темозоломида – 11,2, 3,7 и 3,2% соответственно) [2, 7].
Возможность молекулярной диагностики глиальных опухолей позволяет прогнозировать успех химиотерапии. Пациенты со злокачественными глиомами, у которых отмечается метилирование промотора МГМТ, лучше отвечают на терапию темозоломидом. Пациенты с глиобластомой, получавшие терапию темозоломидом на фоне лучевой терапии, при наличии метилированного промотора МГМТ имели общую выживаемость 21,7 месяца, а в его отсутствие – только 15,3 месяца. При хромосомном анализе оценка потери гетерозиготности 1p/19q (1p/19q loss) в олигодендроглиальных опухолях предопределяет успех химиотерапии по схеме «ломустин + прокарбазин + винкристин». Однако результаты ряда работ показывают, что потеря гетерозиготности 1p/19q является показателем меньшей агрессивности опухоли. В лаборатории нашего центра сегодня это становится рутинным исследованием с умеренной стоимостью. Изучается определение корреляции генетических аберраций в опухолевой ткани и в плазме крови, что позволяет определять тактику лечения и прогноз заболевания на этапе дооперационного обследования [3, 5, 6].
Следующим этапом в развитии лекарственного лечения онкологических заболеваний центральной нервной системы скорее всего станет использование комбинаций современных схем с таргетной терапией. Если предварительные данные проводимых исследований подтвердятся, можно будет говорить о том, что выживаемость больных в недалеком будущем увеличится до 25 месяцев при комбинации лучевой терапии с темозоломидом и бевацизумабом. Дальнейшее понимание патогенеза глиальных опухолей поможет разделить их на несколько нозоформ с разным патогенезом, но с общими клиническими и морфологическими проявлениями. Более четкое представление о механизмах развития опухоли будет способствовать целенаправленному и точному использованию таргетных препаратов [8, 9].
Немаловажен и вопрос переносимости химиотерапевтического лечения: в рассмотренных клинических случаях в отсутствие гематологической и негематологической токсичности удалось сохранить качество жизни и социальный статус пациентов на протяжении всего периода лечения [7, 8].
Заключение
Химиолучевая терапия с темозоломидом и последующая монохимиотерапия парентеральным препаратом Темодал® (темозоломид) хорошо переносятся и приводят к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими схемами лечения. Подобная схема является золотым стандартом первой линии терапии пациентов с глиобластомой и служит основой для разработки новых высокоэффективных режимов лечения [2, 7–9].
Побочные эффекты препарата Темодал
В табл. 4 приведены побочные явления (причинная связь не определялась во время клинического исследования), которые возникали при терапии пациентов с впервые выявленной мультиформной глиобластомой в течение сопроводительной и адъювантнои фазы лечения и требовали немедленного лечения. Распределение по частоте побочных эффектов было произведено в соответствии со следующей градацией: очень часто 10%, часто 1%–≤10%, нечасто 0,1%–≤1%. Таблица 4
Частота реакции | Темодал + радиотерапия (сопроводительная фаза) | Темодал (адъювантная фаза) | |
| Инфекционные проявления | Часто | Кандидоз ротовой полости | |
| Нечасто | Кандидоз ротовой полости, herpes simplex, фарингит, инфицирование ран | Нerpes simplex, herpes zoster, гриппоподобные симптомы | |
| Нарушения со стороны крови и лимфатической системы | Часто | Лейкопения, лимфопения, Нейтропения, Тромбоцитопения | Анемия, фебрильная нейтропения, лейкопения, тромбоцитопения |
| Нечасто | Анемия, фебрильная нейтропения | Лимфопения, петехии | |
| Эндокринные нарушения | Часто | ||
| Нечасто | Кушингоид | Кушингоид | |
| Нарушения метаболизма и питания | Очень часто | Анорексия | Анорексия |
| Часто | Гипергликемия, уменьшение массы тела | Уменьшение массы тела | |
| Нечасто | Гипокалиемия, повышение щелочной фосфатазы, увеличение массы тела | Гипергликемия, увеличение массы тела | |
| Психические нарушения | Часто | Беспокойство, эмоциональная лабильность, бессонница | Беспокойство, эмоциональная лабильность, бессонница, депрессия |
| Нечасто | Ажитация, апатия, нарушение поведения, депрессия, галлюцинации | Галлюцинации, амнезия | |
| Нарушения нервной системы | Очень часто | Головная боль | Головная боль, судороги |
| Часто | Головокружение, афазия, нарушение равновесия и концентрации внимания, спутанность сознания, потеря сознания, судороги, нарушение памяти, нейропатия, парестезия, сонливость, нарушение речи, тремор | Головокружение, афазия, нарушение равновесия и концентрации, спутанность сознания, дисфазия, гемипарез, нарушение памяти, неврологические расстройства, нейропатия, периферическая нейропатия, парестезия, сонливость, нарушение речи, тремор | |
| Нечасто | Атаксия, когнитивные расстройства, дисфазия, экстрапирамидные расстройства, нарушение походки, гемипарез, гиперестезия, гипоестезия, неврологические расстройства, периферическая нейропатия, эпилептический статус | Атаксия, нарушение координации и походки, гемиплегия, гиперестезия, сенсорные расстройства | |
| Нарушения со стороны органа зрения | Часто | Помутнение зрения | Помутнение зрения, диплопия, дефекты полей зрения |
| Нечасто | Боль в глазных яблоках, гемианопсия, расстройства зрения, снижение остроты зрения, дефекты полей зрения | Боль в глазных яблоках, сухость глаз, снижение остроты зрения | |
| Нарушения со стороны органа слуха и лабиринтные нарушения | Часто | Ухудшение слуха | Ухудшение слуха, звон в ушах |
| Нечасто | Ушная боль, гиперакузия, звон в ушах, средний отит | Потеря слуха, ушная боль, головокружение | |
| Сердечно-сосудистые нарушения | Часто | Отеки, отеки ног, геморрагии | Отеки ног, геморрагии, тромбоз глубоких вен |
| Нечасто | Ощущение сердцебиения, гипертензия, церебральные геморрагии | Отеки, периферические отеки, эмболия легочной артерии | |
| Респираторные нарушения | Часто | Кашель, одышка | Кашель, одышка |
| Нечасто | Пневмония, инфекции верхних дыхательных путей, заложенность носа | Пневмония, синусит, инфекции верхних дыхательных путей, бронхит | |
| Желудочно-кишечные нарушения | Очень часто | Запоры, тошнота, рвота | Запоры, тошнота, рвота |
| Часто | Боль в животе, диарея, диспепсия, дисфагия, стоматит | Диарея, диспепсия, дисфагия, стоматит, сухость во рту | |
| Нечасто | Вздутие живота, недержание кала, гастроинтестинальные расстройства, гастроэнтерит, геморрой | ||
| Дерматологические нарушения | Очень часто | Алопеция, сыпь | Алопеция, сыпь |
| Часто | Дерматит, сухость кожи, эритема, зуд | Сухость кожи, зуд | |
| Нечасто | Реакции фоточувствительности, нарушение пигментации, шелушение кожи | Эритема, нарушение пигментации, повышение потливости | |
| Нарушения скелетно-мышечной системы и соединительной ткани | Часто | Артралгия, мышечная слабость | Артралгия, мышечно-скелетные боли, миалгия, мышечная слабость |
| Нечасто | Боль в спине, мышечно-скелетная боль, миалгия, миопатия | Боль в спине, миопатия | |
| Нарушение мочевыделительной системы | Часто | Императивные позывы, недержание мочи | Недержание мочи |
| Нечасто | Дизурия | ||
| Нарушения репродуктивной системы и со стороны молочных желез | Нечасто | Импотенция | Аменорея, боль в молочных железах, меноррагия, вагинальная геморрагия, вагинит |
| Другие нежелательные явления | Очень часто | Утомляемость | Утомляемость |
| Часто | Лихорадка, боль, аллергические реакции, радиационные повреждения, отек лица, изменение вкуса | Лихорадка, боль, аллергические реакции, радиационные повреждения, изменение вкуса | |
| Нечасто | Гиперемия, приливы, астения, ухудшение самочувствия, озноб, изменение окрашивания языка, паросмия, жажда | Астения, ухудшение самочувствия, боль, озноб, дентальные нарушения, отек лица, изменение вкуса | |
| Лабораторные исследования | Часто | Повышение АлАТ | Повышение АлАТ |
| Нечасто | Повышение γ-глутамил-трансферазы, повышение печеночных ферментов, повышение АсАТ | ||
| Миелосупрессия, нейтропения (у 8% пациентов — 3-й и 4-й степени гематологической токсичности), тромбоцитопения (у 14% пациентов — 3-й и 4-й степени гематологической токсичности) | |||
Побочные эффекты, которые могут отмечать у пациентов с рецидивом или прогрессированием глиомы или злокачественной меланомы Наиболее частыми нежелательными явлениями являются желудочно-кишечные расстройства, в частности тошнота (43%) и рвота (36%). Эти явления обычно были 1-й или 2-й степени, проходили самостоятельно или легко контролировались при стандартном использовании антиэметиков. Частота случаев сильной тошноты и рвоты составляла 4%. Другие нежелательные явления, которые часто возникали, — утомляемость (22%), запоры (17%), головная боль (14%). Сообщалось также об анорексии (11%), диарее (8%), сыпи, лихорадке и сонливости (6% в каждом случае). Реже (2–5% случаев) возникали (в порядке уменьшения) астения, боль (включая боль в животе), головокружение, уменьшение массы тела, недомогание, одышка, алопеция, озноб, зуд, диспепсия, изменение вкуса, парестезия. При лечении пациентов с глиомой и метастазирующей меланомой были отмечены случаи тромбоцитопении и нейтропении 3-й или 4-й степени в 19 и 17% соответственно при первом заболевании и в 20 и 22% соответственно — при втором заболевании. При развитии этих нежелательных явлений приходилось госпитализировать больных и (или) отменять Темодал больным с глиомой в 8 и 4% случаев соответственно и в 3 и 1,3% — больным с меланомой. Угнетение костного мозга было прогнозируемым (это явление отмечали обычно в течение первых нескольких циклов лечения, причем максимальную остроту наблюдали между 21-м и 28-м днем); восстановление проходило быстро (как правило, в течение 1–2 нед). Признаков кумулятивного угнетения костного мозга не наблюдалось. Также сообщалось о панцитопении, лейкопении и анемии. Часто развивалась лимфопения. Редко сообщалось о развитии оппортунистических инфекций, включая пневмоцистную пневмонию, вызванную Pneumocystis carinii. Очень редко выявляли мультиформную эритему, аллергические реакции, в том числе анафилаксия. При применении Темодала очень редко сообщалось о развитии миелодиспластического синдрома (МДС) и вторичной малигнизации, включая миелоидную лейкемию. Очень редко возникала затяжная панцитопения, которая может стать причиной апластической анемии.
Темодал, 140 мг, капсулы, 5 шт.
Инструкция по применению
ОДОБРЕНО ФК МЗ РФ 26.10.2000, пр. № 12
Показания к применению.
Темодал показан для лечения больных мультиформной глиобластомой или анапластической астроцитомой, при наличии рецидива или прогрессирования заболевания после стандартной терапии. Кроме того, Темодал показан в качестве терапевтического средства первого ряда при лечении больных с распространенной метастазирующей злокачественной меланомой. Темодал по перечисленным показаниям должен назначаться врачом, имеющим опыт лечения подобных заболеваний.
Дозировка и способ применения.
Темодал в капсулах предназначен для приема внутрь.
Взрослые:
больным, ранее не получавшим химиотерапии, Темодал назначается внутрь, в дозе 200 мг/м2 1 раз в день на протяжении 5 дней подряд в пределах цикла лечения, составляющего 28 дней. Для больных, ранее проходивших курс химиотерапии, начальная доза составляет 150 мг/м2 1 раз в день; во втором цикле доза может быть повышена до 200 мг/м 2 в день при условии, что в первый день следующего цикла абсолютное число нейтрофилов не ниже 1,5·109/л, а число тромбоцитов не ниже 100·109/л.
Дети:
детям в возрасте от 3 лет Темодал назначают внутрь в дозе 200 мг/м2 1 раз в день на протяжении 5 дней в пределах 28-дневного цикла. Для детей, ранее подвергавшихся химиотерапии, начальная доза составляет 150 мг/м2 1 раз в день в течение 5 дней. Со следующего цикла доза может быть повышена до 200 мг/м2, если не отмечено признаков гематологической токсичности.
Лечение продолжают до прогрессирования заболевания; длительность лечения составляет максимально 2 г.
Темодал следует принимать внутрь натощак, не менее чем за 2 ч до приема пищи. Назначенная доза должна быть принята с использованием минимально возможного числа капсул. Капсулы нельзя вскрывать или разжевывать, а следует проглатывать целиком, запивая стаканом воды. Если капсула повреждена, необходимо избегать попадания порошкообразного содержимого капсулы на кожу или слизистые оболочки. При попадании порошка на кожу или слизистую следует промыть это место водой.
Антиэметики можно принимать до или после приема Темодала. Если после приема однократной дозы Темодала отмечена рвота, не следует повторять прием препарата в тот же день.
Противопоказания.
Темодал противопоказан лицам, обладающим повышенной чувствительностью к компонентам препарата или к дакарбазину (ДТИК). Темодал противопоказан больным, имеющим признаки выраженной миелосупрессии. Темодал противопоказан беременным и кормящим женщинам.
Применение при беременности и лактации.
Изучение Темодала у беременных не проводилось.
Особые предупреждения.
Необходимым условием для начала применения Темодала является достижение следующих значений лабораторных показателей: абсолютное число нейтрофилов 1,5·109/л, число тромбоцитов 100·109/л. Полный клинический анализ крови должен быть выполнен на 22 день (21 день после приема первой дозы), но не позднее 48 ч после этого дня, далее — еженедельно, пока абсолютное число нейтрофилов не станет выше 1,5·109/л, а число тромбоцитов не превысит 100·109/л. Если абсолютное число нейтрофилов ниже 1,0·109/л или число тромбоцитов ниже 50·109/л в ходе любого цикла лечения, доза в следующем цикле должна быть снижена на 1 ступень. Возможные дозы: 100 мг/м2, 150 мг/м2 и 200 мг/м2. Минимальная рекомендованная доза составляет 100 мг/м2.
Больным с сильной рвотой (более 5 приступов в течение 24 ч) может потребоваться проведение антиэметической терапии до начала лечения Темодалом.
Фармакокинетические показатели Темодала у лиц с нормальной функцией печени и у больных с нарушением функции печени слабой или умеренной степени тяжести, близко сопоставимы. Данных о применении Темодала у больных с выраженным нарушением функции печени (класс III по классификации Чайлд-Пью) или нарушением функции почек не имеется. На основании данных изучения фармакокинетических свойств Темодала представляется маловероятным, что больным даже с выраженным нарушением функции печени или почек может потребоваться снижение дозы препарата. Тем не менее, при назначении Темодала таким больным следует проявлять осторожность.
У больных пожилого возраста (старше 70 лет) риск развития нейтропении и тромбоцитопении выше, чем у более молодых. Поэтому пожилым больным Темодал следует назначать с осторожностью.
Применение Темодала может вызвать сонливость и чувство усталости, тем самым отрицательно сказываться на способности водить автомобиль и управлять сложными механизмами.
Побочное действие.
В клинических испытаниях наиболее часто встречавшимися нежелательными явлениями при применении Темодала были желудочно-кишечные расстройства, в частности, тошнота (43%) и рвота (36%). Эти явления обычно были средней или слабой степени выраженности (не более 5 приступов рвоты в сутки), проходили самостоятельно или легко снимались стандартной антиэметической терапией. Сильная тошнота и рвота отмечались в 4% случаев.
В числе прочих часто встречавшихся нежелательных явлений можно назвать утомляемость (22%), запор (17%), головную боль (14%). Сообщалось также об анорексии (11%), диарее (8%), высыпаниях, лихорадке и сонливости (по 6%). Менее частыми (2–5% случаев) нежелательными явлениями были — в порядке убывания частоты — астения, боль, включая боль в животе, головокружение, снижение массы тела, недомогание, одышка, диспепсия, алопеция, озноб, зуд, искажение вкуса и парестезии.
Изменение лабораторных показателей:
при лечении больных с глиомой и метастазирующей меланомой были отмечены случаи тромбоцитопении и нейтропении 3 или 4 степени. Госпитализация больного и/или отмена Темодала при этом потребовалась в 8 и 4% случаев соответственно при глиоме и в 3 и 1,3% — при меланоме. Угнетение костного мозга было предсказуемым (проявлялось обычно в течение первых нескольких циклов лечения, с максимумом между 21 и 28 днями); восстановление происходило быстро — как правило, в течение 1–2 нед. Признаков кумулятивной миелосупрессии не отмечено.
Взаимодействие.
Прием Темодала совместно с ранитидином не приводит к изменению степени всасывания Темодала. Совместный прием дексаметазона, прохлорперазина, фенитоина, карбамазепина, ондансетрона, антагонистов H2 — рецепторов или фенобарбитала не изменяет клиренс Темодала.
Исследований, направленных на выяснение воздействия темозоломида на метаболизм и выведение других препаратов не проводилось. Однако в связи с тем, что темозоломид не метаболизируется в печени и слабо связывается с белками, маловероятно, чтобы он мог влиять на фармакокинетику других ЛС.
Применение Темодала совместно с другими веществами, угнетающими костный мозг, может увеличить вероятность миелосупрессии.
Передозировка.
При разовом приеме больших доз Темодала (до 1000 мг/м2) возникали ожидаемые эффекты, такие как нейтропения и тромбоцитопения.
Форма выпуска.
Капсулы по 5, 20, 100 или 250 мг, во флаконах из стекла янтарного цвета; флаконы снабжены крышками, не допускающими открывания детьми. Во флаконе 5 или 20 капсул, в коробке 1 флакон.
Условия хранения.
При температуре 2–30 °C. Беречь от детей.
Срок годности.
2 года. Препарат с истекшим сроком годности использовать не следует.
Условия отпуска из аптек.
По рецепту врача.
Особые указания по применению препарата Темодал
Пациенты, получающие терапию Темодалом в сопровождении радиотерапии при 42-дневном цикле (максимально 49 дней), относятся к группе особого риска по развитию пневмонии, вызванной Pneumocystis carinii. Поэтому все пациенты при таком режиме лечения требуют профилактических мероприятий, направленных против развития пневмонии, вызываемой Pneumocystis carinii. Существует большая вероятность развития пневмонии, вызванной Pneumocystis carinii, при применении темозоломида в течение длительного периода. Однако следует тщательно наблюдать за всеми пациентами, получающими темозоломид, особенно за больными, получающими стероиды, на предмет развития данной пневмонии, несмотря на режим терапии. Антиэметическая терапия. Тошнота и рвота очень часто ассоциируются с применением Темодала, поэтому следует придерживаться следующих рекомендаций: пациентам с впервые выявленной мультиформной глиобластомой антиэметическая профилактика рекомендована перед начальной дозой сопроводительной терапии Темодалом и настойчиво рекомендуется во время адъювантной фазы; пациентам с рецидивом или прогрессированием глиомы антиэметическая терапия может быть необходимой при тяжелой рвоте (3-й или 4-й степени) в предыдущих циклах лечения. Пациенты с нарушением функции печени или почек. Фармакокинетические показатели темозоломида сравнимы у лиц с нормальной функцией печени и у пациентов с нарушением функции печени в слабой или умеренной степени. Нет данных о назначении препарата лицам с выраженным нарушением функции печени (класс III по классификации Чайлд-Пью) или почек. С учетом фармакокинетических свойств темозоломида вряд ли можно предположить, что при наличии тяжелого нарушения функции печени или почек будет необходимо снижение дозы. Однако при назначении Темодала таким пациентам следует соблюдать осторожность. Применение у детей. Клинический опыт использования препарата Темодал при лечении детей в возрасте до 3 лет с мультиформной глиобластомой отсутствует. Есть ограниченный опыт лечения детей в возрасте старше 3 лет с глиомой. В случае меланомы клинический опыт лечения детей в возрасте до 18 лет отсутствует. Применение у пациентов пожилого возраста. Пациенты пожилого возраста (старше 70 лет) подвержены повышенному риску развития нейтропении и тромбоцитопении по сравнению с пациентами молодого возраста. Поэтому следует с осторожностью назначать Темодал пациентам этой возрастной категории. Период беременности и кормления грудью. Исследования на беременных женщинах не проводились. При проведении доклинических исследований на крысах и кроликах, получающих препарат в дозе 150 мг/м2, были получены данные о тератогенезе и/или токсичности относительно плода. Поэтому Темодал, как правило, не назначают беременным женщинам. При возникновении необходимости применения препарата в период беременности женщину необходимо проинформировать о потенциальном риске для плода. Женщины репродуктивного возраста должны быть проинформированы о необходимости избегать беременности во время приема препарата Темодал и в течение 6 мес после окончания терапии препаратом. Неизвестно, выделяется ли Темодал с грудным молоком, поэтому его не следует принимать в период кормления грудью. Пациенты мужского пола. Темозоломид может проявлять генотоксический эффект. Поэтому мужчины, принимающие Темодал, должны использовать эффективные средства контрацепции. Мужчины, принимающие темозоломид, не должны планировать рождение ребенка во время лечения и в течение 6 мес после прекращения лечения. Мужчинам рекомендуется обратиться за консультацией по поводу криоконсервации спермы до начала лечения из-за возможности необратимого бесплодия, вызванного лечением темозоломидом. Влияние на способность управлять транспортными средствами и работать с механизмами. Способность управлять транспортными средствами и работать с механизмами может быть нарушена при приеме препарата Темодал в связи с возможностью развития утомляемости и сонливости.
Диагностика опухолей головного мозга (ОГМ) затруднена в связи с начальной бессимптомной стадией болезни. В связи с этим, а также из-за невозможности адекватного оперативного вмешательства, связанного с локализацией опухолей, как правило, необходимо использовать дополнительные методы лечения. Вместе с тем заболеваемость ОГМ растет и составит в ближайшее время 127 тыс. новых случаев в год. В последние десятилетия драматически увеличивается число вновь диагностируемых первичных ОГМ, особенно у пожилых больных [1, 2]. Сложно сказать, связано ли это непосредственно с заболеваемостью или с улучшением диагностики.
Большинство ОГМ являются глиомами астроцитарного, олигодендроцитарного, эпендимального и смешанного происхождения. Ранее проведенные крупные многоцентровые рандомизированные исследования по сравнению адъювантной лучевой терапии, химиотерапии и химио-лучевой терапии показали, что химиотерапия (одна или в сочетании с лучевой терапией) не влияет на выживаемость больных ОГМ [3, 4]. Поэтому в последние 20 лет адъювантная лучевая терапия в дозе 60 грей за 30 фракций оставалась стандартом для подобных больных.
В течение этого периода была разработана шкала прогностических факторов и выделены группы больных, которым, по мнению некоторых авторов, необходима адъювантная химиотерапия – например, при анапластических астроцитомах или анапластических олигодендроглиомах как наиболее чувствительных опухолях. Тем не менее общий подход оставался прежним: лучевая терапия в качестве адъювантного лечения, химиотерапия – в случаях рецидива болезни.
Длительное время химиотерапия не имела заметного успеха и была ограничена в основном препаратами из класса нитрозопроизводных средств. Комбинация прокарбазина, кармустина и винкристина (PCV), имея невысокую эффективность в случае рецидивов, нередко вызывала гематологическую токсичность (56 % циклов) и кожные реакции (20 % циклов) [5]. Недавно появился новый препарат из класса алкилирующих агентов – темозоломид (Темодал; Шеринг Плау), который системно изучается наряду с другими новыми (в т. ч. таргетными) агентами, такими как эрлотиниб (Тарцева), иматиниб, гефитиниб (Иресса), при ОГМ.
Темодал – алкилирующий препарат, производное имидазотетразина, активным метаболитом которого является монометил-триазено-имидазол-карбоксамид (MTIC). Темодал назначают перорально в виде 5-дневного режима по 150 мг/м2/сут больным, ранее получавшим химиотерапию, и по 200 мг/м2/сут – нелеченым пациентам. Существует более продолженный режим, чаще используемый при химио-лучевой терапии.
Дозолимитирующей токсичностью Темодала является гематологическая. Препарат удобен как для монотерапии, так и в комбинациях с другими лекарствами и/или лучевой терапией, а также и для амбулаторного лечения; он продемонстрировал хорошую переносимость и безопасность во время I и II фаз клинического изучения. Препарат быстро абсорбируется после перорального приема и претерпевает спонтанный гидролиз с образованием MTIC. Механизмом действия является реакция алкилирования в О6 позиции гуанина и дополнительное алкилирование в позиции N7. В ОГМ Темодал накапливается интенсивнее, чем в контралатеральной нормальной ткани головного мозга [6].
Европейская организация исследований и лечения рака (EORTC) в соответствии с Программой развития новых лекарств (NDDP – New Drug Development Program) провела серию исследований с целью улучшения лечения ОГМ (табл. 1).
II фаза клинического многоцентрового исследования Темодала (темозоламида) была проведена на 162 больных с первым рецидивом злокачественной астроцитомы. У 111 пациентов определялись анапластические астроцитомы или анапластические смешанные олигоастроцитомы. Больные, ранее не получавшие химиотерапию, получали Темодал по 200 мг/м2/сут. (5 дней). У ранее леченных больных дозу снижали до 150 мг/м2/сут (5 дней), затем она могла быть повышена в случае отсутствия токсичности при предыдущем курсе. Курсы повторяли каждые 28 дней. Лечение продолжалось до развития непереносимой токсичности или до прогрессирования, максимально в течение 2 лет. Выживаемость без прогрессирования к 6 месяцам составила 46 %, к 12 – 24 %. Медиана выживаемости без прогрессирования была 5,4 месяца, медиана общей выживаемости – 13,6 месяца; 6- и 12-месячная выживаемость составила 75 и 56 % соответственно. Объективный эффект был достигнут у 35 % больных, с полным регрессом – у 8 %; дополнительно у 26 % пациентов наблюдалась стабилизация процесса с медианой времени без прогрессирования 4,4 месяца. Гематологическая токсичность не превышала 10 %, побочные явления были легкими, лечение сопровождалось улучшением качества жизни больных [7].
Сравнительное рандомизированное исследование темозоломида (Темодал) и прокарбазина, включавшее 225 больных с первым рецидивом мультиформных глиобластом, показало преимущество Темодала, который, помимо прочего, хорошо переносился и обеспечивал довольно высокое качество жизни. Шестимесячная выживаемость без прогрессирования в группе Темодала составила 21 против 8 % в группе прокарбазина (p = 0,008), медиана времени без прогрессирования – 12,4 против 8,3 недель (p = 0,0063),
6-месячная выживаемость – 60 против 44 % (p = 0,019) [8].
В 2002 г. было начато изучение Темодала в сочетании с лучевой терапией в адъювантном режиме при мультиформных глиобластомах, которое затем было продолжено с рандомизацией и подключением к работе других исследовательских групп. Результаты этого исследования, доложенные на пленарном заседании Американского общества онкологов (ASCO) в 2004 г., были сенсационными. Рандомизированное изучение одновременной химио-лучевой терапии с Темодалом в сравнении с одной лучевой терапией, проводившееся у 573 больных в 85 центрах (Европа и Канада), показало достоверное преимущество комбинированного метода (табл. 2) [9].
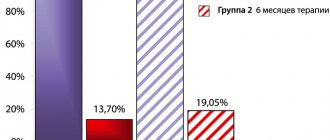
Темодал назначали перорально по 75 мг/м2/сут ежедневно в течение до 42 дней одновременно с лучевой терапией в том же режиме, что и в группе больных без Темодала (60 грэй – 30 ежедневных фракций по 2 грэя). Затем пациентам из группы комбинированной терапии назначали еще до 6 циклов Темодала (по 150–200 мг/м2/сут ежедневно 5 дней) каждые 28 дней. Гематологическая токсичность 3–4 степени была отмечена лишь у 7 % больных при химио-лучевой терапии и у 16 % – во время монохимиотерапии Темодалом. В целом больные переносили лечение вполне удовлетворительно.
Таким образом, химио-лучевая терапия с Темодалом должна стать новым стандартом адъювантного лечения злокачественных глиом.
В настоящее время проводится II фаза изучения Темодала в комбинации с пегилированным липосомальным доксорубицином (Келикс, Доксил) в качестве адъювантной 1 линии терапии при глиобластомах [10]. Темодал назначают вместе со стандартной лучевой терапией, а затем в 1–5 дни 28-дневного цикла начиная через 4 недели после окончания лучевой терапии. Дозу доксорубицина повышают от 5 до 15 мг/м2.
Довольно успешно Темодал применяется и при рецидивах ОГМ. Neyns B. и соавт. (2004), используя у 117 взрослых больных стандартные дозы препарата, получили в 29 % случаев полный и частичный регресс опухолей со стабилизацией процесса еще у 34 % пациентов [11].
Особенно интересно сочетание Темодала с иринотеканом (Кампто). Иринотекан изучали в комбинации с кармустином при рецидивах глиобластом у 42 больных в качестве 2 линии химиотерапии [9]. У 9 пациентов (21,4 %) был достигнут частичный эффект, у 21 (50 %) – стабилизация заболевания. Медиана выживаемости составила 11,7 месяцев. Режим был признан высокоэффективным [12]. Во II фазе изучения иринотекана у 60 больных с рецидивами злокачественных глиом частичный эффект был достигнут у 15 % больных, минимальный регресс – у 7 %, стабилизация процесса – у 48 %.
Reardon D. и соавт. [13] провели I фазу исследования Темодала (200 мг/м2/сут * 5 дней) и иринотекана с эскалацией дозы от 40 до 225 мг/м2 у 48 больных с рецидивами злокачественных глиобластом, получавших дополнительно такие антиконвульсанты, как фенитоин, карбамазепин или фенобарбитал (группа А), и у 32 пациентов, не получавших этих лекарств (группа Б). Метаболизм иринотекана значительно возрастает при одновременном приеме указанных антиконвульсантов [14]. Предварительные результаты этого исследования приведены в табл. 3.
Гипотеза о целесообразности сочетания иринотекана и Темодала основана на данных об усилении цитотоксичности иринотекана после предварительного удаления метилгуаниновой метилтрансферазной (MGMT) метиловой группы в результате лечения Темодалом.
Комбинация была апробирована у 32 больных с рецидивами злокачественных глиом. Темодал назначали по 200 мг/м2/сут в течение 5 дней, иринотекан – в дозе 350 мг/м2 в течение 2 часов на 6 день. Циклы повторяли каждые 28 дней (максимум 6 циклов), затем продолжали лечение одним Темодалом до 6 месяцев. Все больные принимали дополнительно карбамазепин или фенитоин. Все они ранее получали лучевую терапию, 81 % – химиотерапию, 34 % – оба режима. У 10 из 32 больных был зарегистрирован объективный эффект, у 19 – стабилизация. Таким образом, у 28 % пациентов был достигнут объективный эффект. Шестимесячная выживаемость без прогрессирования составила 39 %. При анапластических астроцитомах эти показатели соответственно составили 36 и 71 %. Нами данная комбинация была апробирована у нескольких больных.
Приводим выписной эпикриз пациента, получавшего лечение в отделении химиотерапии РОНЦ РАМН.
Диагноз: глиобластома головного мозга с поражением лобных долей полушарий с переходом на левую височно-теменную область. Состояние после химио-лучевого лечения. Гистология 01/14857: полиморфноклеточный вариант глиобластомы.
Из анамнеза: с марта 2001 г. – упорные головные боли, нарушение памяти, судорожные эпизоды. При обследовании выявлена полиморфноклеточная глиобластома головного мозга. В связи с распространенностью процесса оперативное лечение признано невозможным. В сентябре – октябре 2001 г. проведена лучевая терапия на весь мозг: 34 грей и локально на область опухоли (СОД 63 грей). С декабря 2001 по март 2002 г. проведено 4 курса химиотерапии Кампто и Темодалом со стабилизацией опухолевого процесса и частичным регрессом неврологической симптоматики. Повторные курсы Темодалом в монорежиме проводились амбулаторно с октября по декабрь 2002 г. и с июня по август 2003 г. Сохранялась стойкая стабилизация опухолевого процесса. Через 1 месяц после последнего курса химиотерапии Темодалом – в сентябре 2003 г. – отмечено ухудшение неврологической симптоматики.
МРТ головного мозга 03.10.03: в правом полушарии парасагитально опухолевый узел 2,7 * 3 см без четких контуров с выраженным перифокальным отеком на уровне желудочков мозга сливается с опухолью, расположенной в левой лобной и теменной долях. Желудочки мозга деформированы и сдавлены, больше слева. Общий размер опухолевого поражения 6,7 * 8 см в поперечнике, в структуре узлов участки повышенной интенсивности МР-сигнала, вероятнее всего зоны распада. Срединные структуры незначительно смещены. По сравнению с исследованием от февраля 2002 г. – отрицательная динамика в виде увеличения размеров опухолевого поражения и зоны перифокального отека.
09.10.03 предпринята попытка химиотерапии нитрозопроизводными: нимустин в дозе 2,5 мг/кг, суммарно введено 200 мг. Лечение перенес удовлетворительно. Побочных явлений не было. Отмечено ухудшение неврологической симптоматики. В декабре развился приступ почечной колики, после удаления камня правого мочеточника и антибактериальной терапии возобновлена химиотерапия Темодалом и Кампто. Проведено 7 курсов с интервалами в 3–4 недели с медленно нарастающей положительной динамикой со стороны общего состояния и неврологического статуса. При контрольной МРТ головного мозга от 19.02.04: некоторое уменьшение перифокального отека и размеров опухолевого поражения, менее выражено сдавление левого бокового желудочка. При контрольной МРТ от 09.06.04 по сравнению с исследованием от 19.02.04 существенной динамики не отмечено, по сравнению с 03.10.03 – положительная динамика. По восстановлении показателей крови с 12.08 по 17.08.04 проведено лечение: Темодал по 300 мг внутрь с 1 по 5 день (суммарно 1500 мг), Кампто – 500 мг внутривенно в виде 90-минутной инфузии на 6 день. Лечение перенес удовлетворительно.
Таким образом, при значительном улучшении общемозговой симптоматики и длительной стабилизации процесса (минимальный эффект) лечение продолжается более 2,5 лет.
Темодал с интересом изучается многими клиницистами у больных с метастазами злокачественных опухолей в головной мозг. Serrone L. и соавт. [15] сообщили о применении Темодала после лучевой терапии по поводу метастазов меланомы в головной мозг. Первоначально проводили лучевую терапию в общей дозе 24 грэя, а с 7 недели назначали Темодал в дозе 150 мг/м2/сут в течение 5 дней каждые 4 недели, всего 6 циклов. Предварительно 15 больных были оценены. У 3 пациентов был достигнут частичный регресс, у 5 – стабилизация процесса.
Схему Темодал по 200 мг/м2 в течение 5 дней в сочетании с липосомальным доксорубицином в дозе 40 мг/м2 в 1 день (повторение каждые 28 дней) Caraglis M. и соавт. использовали также для лечения 12 больных с метастазами в головной мозг различных солидных опухолей, преимущественно немелкоклеточного рака легкого (НМРЛ) и рака молочной железы. При применении данной комбинации были достигнуты 2 полных и 2 частичных регресса. Выживаемость больных с полным регрессом составила 27+ месяцев. Клинический эффект был достигнут еще у 4 пациентов (1 – с меланомой, 3 – с НМРЛ).
В отделении химиотерапии РОНЦ РАМН изучена монотерапия Темодалом в стандартных дозах (150–200 мг/м2/сут * 5 дней, каждые 28 дней) у 11 больных с метастазами НМРЛ, рака молочной железы и меланомы в головной мозг. Клиническая эффективность (частичный регресс + стабилизация болезни) составила 36,3 %; частичный регресс был достигнут у одного больного с меланомой. Стабилизация процесса в течение 6 месяцев наблюдалась у 3 пациентов с метастазами НМРЛ.
Токсичность оценивалась при 32 курсах химиотерапии; 3–4 степень гематологической токсичности встречалась крайне редко (табл. 4). Негематологическая токсичность не превышала 1 и 2 степени (табл. 5)
Четырнадцати больным с метастазами в головной мозг проводили химио-лучевое лечение в следующем режиме: Темодал по 75 мг/м2/сут в 1–14 дни на фоне лучевой терапии в дозе 30 грей (3 грея * 10 фракций). Результаты комбинированного лечения представлены в табл. 6. Общий эффект составил 71 %, стабилизация – 22 %. Данные о выживаемости больных представлены в табл. 7.
При метастазах в головной мозг возможны попытки лечения Темодалом и Кампто. В качестве примера приводим выписной эпикриз пациента, получавшего лечение в отделении химиотерапии РОНЦ РАМН.
Диагноз: диссеминированная меланома центральной нервной системы. Состояние после оперативных вмешательств в 1996, 2002 гг., химио-лучевого лечения.
Гистология 02/17635: эпителио- и веретеноклеточная пигментсодержащая меланома с большим количеством кровоизлияний.
Операция в области задней черепной ямки по поводу опухоли в Израиле в 1996 г. Операция по поводу рецидива 24.06.2002 там же (паллиативная). В августе 2002 г. при МРТ выявлено полное опухолевое обсеменение ЦНС с интрадуральной блокадой на уровне L1–L2, выполнена паллиативная ламинэктомия. При поступлении: выраженные неврологические симптомы, включая атаксию, но без головных болей. При МРТ опухолевый узел в проекции нижнего червя мозжечка с прорастанием в боковую цистерну продолговатого мозга, рядом – второй интракраниальный узел. При исследовании всего позвоночника и спинного мозга выявляются множественные опухолевые узлы до 1 см, преимущественно расположенные в нижнегрудном и поясничном отделах позвоночника. При рентгенографии легких и УЗИ органов брюшной полости, а также физикальном осмотре опухолевой патологии не выявлено.
02–06.11.02 и 16–20.12.02 на фоне активной симптоматической терапии (противосудорожные и противоотечные средства) проведено 2 курса химиотерапии Темодалом по 150 мг (дозы несколько редуцированы в связи с одновременно проводившейся лучевой терапией, интервал между циклами увеличен в связи с тромбоцитопенией и нейтропенией 2 ст.). На фоне применения ондансетрона перенес лечение удовлетворительно.
10–21.11.02 облучение всего головного мозга с 2 боковых полей (РОД 3 грея, СОД 30 грей, фотоны 6 мэв).
27.11–25.12.02 облучение всего спинного мозга в 3 этажа (РОД 2 грея, СОД 40 грей, дополнительно на область L2– S1 подведена доза 5 грей).
20–25.12.02 на область мозжечка подведено 4 фракции по 3 грея. Отмечалось усиление неврологической симптоматики при дозе 21 грей, которое было купировано. В относительно удовлетворительном состоянии больной выписывается под наблюдение районного онколога.
Через 3 недели – повторная МРТ с контрастированием для оценки эффекта и решения вопроса о продолжении лечения Темодалом амбулаторно. Учитывая длительные периоды тромбоцитопении до 3 ст. с большими интервалами, по настоящее время получает повторные курсы Темодала и Кампто без признаков прогрессирования. Длительность лечения составляет около 2 лет.
Таким образом, на сегодняшний день Темодал не только возродил интерес к лекарственному лечению ОГМ и метастазов злокачественных опухолей в головной мозг, но и позволил разработать новые стандарты адъювантной терапии злокачественных глиом, значительно продвинув вперед возможности лечения подобных больных.
Возможность применения Темодала одновременно или последовательно с другими видами лечения открывает новые многообещающие перспективы.
Взаимодействия препарата Темодал
Совместное применение Темодала с ранитидином или с пищей не приводит к клинически значимым изменениям всасывания препарата. Совместный прием дексаметазона, прохлорперазина, фенитоина, карбамазепина, ондансетрона, антагонистов Н2-рецепторов гистамина или фенобарбитала не изменяет клиренс Темодала. Совместный прием вальпроевой кислоты вызывал слабовыраженное, но статистически значимое снижение клиренса темозоломида. Применение препарата Темодал с другими веществами, угнетающими костный мозг, может повысить вероятность развития миелосупрессии.
Передозировка препарата Темодал, симптомы и лечение
Клинически на пациентах были оценены дозы 500, 750, 1000 и 1250 мг/м2 (общая доза за 5-дневный цикл). Дозозависимая гематологическая токсичность развивалась при всех дозах, но, как и ожидалось, была более выраженной при более высоких дозах. Превышение дозы 2000 мг/сут в течение 5 дней допустил один пациент, что привело к панцитопении, пирексии, мультиорганной недостаточности и смерти. Сообщалось о пациентах, принимавших рекомендованные дозы (150–200 мг/м2) более 5 дней (до 64 дней), с развитием супрессии костного мозга (с инфицированием или без), в некоторых случаях тяжелых и продолжительных, с летальным исходом. В случае передозировки рекомендуется сделать гематологическое исследование и провести при необходимости поддерживающее лечение.