Магния оротат в практике терапевта и кардиолога
Магний поступает в организм с пищей. Основными источниками его поступления в организм являются бобовые и злаковые, шпинат, салаты (в т. ч. руккола), брокколи, ревень. Много магния в тыквенных семечках и кунжуте. Особенно богаты магнием миндальные, кедровые орехи и арахис, какао и шоколад, но существенное увеличение потребления данных продуктов может привести к прибавке в весе в связи с их высокой калорийностью. Кроме этого, необходимо помнить, что усваивается не более 30–40% магния, поступающего с пищей. При этом для его хорошей усвояемости также требуется поступление в организм в достаточном количестве кофакторов: молочной, аспарагиновой, оротовой кислот и витамина В6. В развитии алиментарного дефицита магния важную роль играют такие факторы, как его низкое содержание в пище, воде, а также избыточное потребление кальция, натрия, белка или жира с пищей, что существенно снижает поступление магния в организм из-за образования его невсасывающихся комплексов. Частота гипомагниемии достаточна высокая и составляет от 10 до 40%. Для обозначения нарушений обмена магния используют 2 термина: «магниевый дефицит», под ним понимают снижение общего содержания магния в организме, и «гипомагниемия» – подразумевается снижение концентрации магния в сыворотке (в норме 0,8–1,2 ммоль/л). Умеренной недостаточности магния в организме соответствует его уровень в сыворотке крови 0,5–0,7 ммоль/л, выраженной (угрожающей жизни) – ниже 0,5 ммоль/л. Выделяют первичный (генетически обусловленный) и вторичный (алиментарный, физиологический и т. д.) дефицит магния. Причинами дефицита магния могут быть различные эндокринные нарушения (гиперкальциемия, гиперальдостеронизм и др.), диабет, состояние хронического стресса, алкоголизм, а также медикаментозное лечение, в т. ч. длительный прием диуретиков. Экскреция магния значительно возрастает при повышении уровня катехоламинов и глюкокортикостероидов. Также существенные потери магния могут иметь место при усиленном потоотделении [1, 4–6]. Основные проявления недостатка магния в организме представлены в таблице 1. Нормальный уровень магния в организме человека признан основополагающей константой, контролирующей здоровье человека. При изучении внутриклеточной молекулярной биокинетики установлено наличие не менее 290 генов и белковых соединений в последовательности генома человека, которые способны связывать Mg2+ как кофактор множества ферментов, участвующих в более чем 300 внутриклеточных биохимических реакциях. Ионы магния стабилизируют молекулы субстрата – нейтрализуют отрицательный заряд субстрата, активного центра фермента, способствуют поддержанию третичной и четвертичной структур белковой молекулы фермента, облегчают присоединение субстрата к ферменту и тем самым облегчают протекание химической реакции, комплекс «магний – аденозинтрифосфат (ATФ)», стабилизируя молекулу АТФ, способствует ее присоединению и «правильной» ориентации в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу. В ряде случаев ион магния может помогать присоединению кофермента, способствуя активации металлоэнзимов. Магний способствует устойчивости структуры клетки в процессе роста, принимает участие в процессе регенерации клеток организма. Mg2+ – естественный физиологический антагонист Са2+, что обусловливает наличие у него миотропного, спазмолитического и дезагрегационного эффектов, способствует фиксации К+ в клетках, обеспечивая поляризацию клеточных мембран, контролирует спонтанную электрическую активность нервной ткани и проводящей системы сердца. Магний оказывает влияние на функциональное состояние практически всех органов и систем (табл. 2) [4, 7–9]. Установлена важная роль магния в развитии эндотелиальной дисфункции. Было показано, что назначение препаратов магния способно через 6 мес. существенно улучшить (почти в 3,5 раза больше по сравнению с плацебо) эндотелийзависимую дилатацию плечевой артерии. При этом также была выявлена прямая линейная корреляция – зависимость между степенью эндотелийзависимой вазодилатации и концентрацией внутриклеточного магния. Одним из возможных механизмов, объясняющих благоприятное влияние магния на эндотелиальную функцию, может быть его антиатерогенный потенциал [4, 10]. В настоящее время препараты магния широко применяются в лечении сердечно-сосудистых заболеваний. Экспериментальные данные указывают на важную роль ионов магния в регуляции сосудистого тонуса и АД. Магний оказывает гипотензивный эффект за счет отрицательного хроно- и инотропного действия, снижения тонуса сосудов, угнетения передачи в вегетативных ганглиях, угнетения вазомоторного центра. Установлена обратная зависимость между уровнем альдостерона и ренина плазмы, свидетельствующая о том, что низкий уровень магния связан с повышением активности ренин-ангиотензин-альдостероновой системы. Ионы магния подавляют активность ренин-ангиотензин-альдостероновой системы, поэтому на фоне гипомагниемии часто имеет место выраженная вазоконстрикция. Напротив, при парентеральном введении магния наблюдается выраженная вазодилатация, сопоставимая с эффектом антагонистов кальция. Следовательно, дополнительный прием магния можно рекомендовать больным с артериальной гипертензией (АГ), у которых имеется высокий риск гипомагниемии (например, при терапии тиазидными диуретиками) [4, 8, 14–19]. Также оправданным является применение магнийсодержащих препаратов при ишемической болезни сердца (ИБС). Антиишемический эффект магния обусловлен восстановлением эндотелийзависимой вазодилатации, нормализацией показателей липидного спектра, улучшением реологических свойств крови, уменьшением агрегационной активности тромбоцитов, депрессорного влияния на инотропную функцию сердца. По данным эпидемиологических исследований, дефицит магния в питьевой воде повышает риск развития сердечно-сосудистых заболеваний (особенно ИБС) и внезапной смерти. Известно, что миокард больных, умерших от сердечно-сосудистой патологии, содержит почти в 2 раза меньше магния, чем у пациентов, скончавшихся от других причин. Дефицит магния ассоциируется с повышением уровня атерогенных липидов. По данным исследования ARIC (The Atherosclerosis Risk in Communities), частота развития ИБС выше у тех лиц, у которых выявляется более низкий уровень магния в крови. В Финляндии в результате реализации правительственной программы по профилактике магниевого дефицита у населения страны в течение последних 15 лет удалось снизить частоту инфарктов миокарда (ИМ) в популяции почти в 2 раза. Анализ обобщенных данных 7 рандомизированных исследований у 1301 больного острым ИМ выявил благоприятное влияние магния на больничную летальность. В многоцентровом исследовании LIMIT-II (2316 пациентов) было выявлено снижение риска смерти на 24%, риска развития сердечной недостаточности – на 25% (в группе больных острым ИМ, которые в течение первых 28 дней получали дополнительно к стандартной терапии инфузии сульфата магния). Дефицит магния был обнаружен при сердечной недостаточности, развившейся на фоне АГ и ИБС. Следовательно, дополнительный прием магния в составе комплексной терапии можно рекомендовать больным с ИБС и хронической сердечной недостаточностью [4, 8, 20–27]. Кроме того, показано, что на фоне дефицита магния гораздо чаще развиваются нарушения ритма и проводимости при терапии сердечными гликозидами. Препараты магния широко используются при лечении аритмий на фоне дигиталисной интоксикации благодаря способности восстанавливать функцию калий-натриевой помпы. По данным исследования FHS (Framinghem Heart Study), экстрасистолы выявлены у 5,5% пациентов (n=3327, средний возраст 44 года). При этом длительная гипомагниемия коррелирует с высокой частотой возникновения желудочковых экстрасистол, тахикардии, фибрилляции желудочков (р=0,01). Эта закономерность оставалась значимой даже после учета поправок на массу левого желудочка, в т. ч. и у добровольцев без клинически выраженного заболевания. В исследовании PROMISE Study были выявлены большая частота желудочковой экстрасистолии и высокая летальность в группе пациентов с гипомагниемией в сравнении с группами, в которых отмечалась нормо- и гипермагниемия [28–30]. Препараты магния давно используются как антиаритмические средства, сочетающие свойства антиаритмиков I (мембраностабилизирующие) и IV (антагонисты кальция) классов. Магний оказывает мембраностабилизирующее действие, депрессорное влияние на возбудимость и проводимость клетки. Истощение запасов магния вызывает выраженное неблагоприятное воздействие на миокард. Нарушение содержания ионов калия и магния и их соотношения является существенным фактором риска развития аритмий. Магний предотвращает потерю калия клеткой и уменьшает вариабельность длительности интервала QT, которая является прогностически неблагоприятным фактором развития фатальных аритмий. Кроме того, магний способен ингибировать симпатические влияния на сердце. В качестве антиаритмика соли магния наиболее эффективны (препарат выбора) при пируэт-желудочковой аритмии (torsades de pointes) благодаря способности угнетать развитие следовых деполяризаций и укорачивать длительность интервала QT. Магний также используется как при врожденном синдроме удлиненного интервала QT, так и при его удлинении вследствие применения антиаритмиков I класса. Результаты рандомизированного многоцентрового плацебо-контролируемого двойного слепого исследования MAGICA позволили рассматривать препараты магния и калия как общепринятый европейский стандарт при лечении аритмий у пациентов на фоне приема сердечных гликозидов, диуретиков, антиаритмиков. Антиаритмический эффект препаратов магния проявляется спустя 3 нед. от начала лечения и позволяет снизить число желудочковых экстрасистол на 12% и общее число экстрасистол на 60–70% [4, 6, 8, 28, 31–35]. Применение препаратов магния эффективно при пролапсе митрального клапана. Так, у больных, регулярно принимавших магния оротат, установлено достоверное изменение эхокардиографических параметров, свидетельствующее о положительном влиянии магния на диспластические изменения: уменьшение глубины пролабирования митрального клапана, степени митральной регургитации, размера левого предсердия и частоты миксоматозной дегенерации створок митрального клапана [11, 36, 37]. Сегодня в клинической практике применяются несколько лекарственных препаратов, содержащих магний. Одним из наиболее удачных является препарат Магнерот (фармацевтическая , Германия) – магниевая соль оротовой кислоты. Одна таблетка содержит 500 мг оротата магния (32,8 мг магния). К настоящему времени накоплен значительный клинический материал об эффективности этого препарата в различных областях медицины, и в первую очередь в кардиологии и неврологии. Оротовая кислота стимулирует синтез АТФ. Поскольку 90% внутриклеточного магния связано с АТФ, относительное увеличение внутриклеточного депо АТФ посредством оротовой кислоты улучшает фиксацию магния в клетках. Перспективным в клинической практике считается использование препаратов на основе именно органических солей магния, характеризующихся более высокой биодоступностью по сравнению с неорганическими солями. Оротат магния в отличие от неорганических оксида или сульфата магния более эффективен при коррекции дефицита магния, особенно у больных с острым коронарным синдромом и сердечной недостаточностью, протекающими с нарушениями ритма сердечной деятельности. Кардиопротективный эффект оротовой кислоты опосредован через регуляцию фермента N-ацетилглюкозаминтрансферазы, ингибирование внутриклеточной фосфодиэстеразы и модулирование кофермента PQQ с противовоспалительным, антиоксидантным и нейропротекторным эффектами [7, 9, 38, 39]. При уровне магния в сыворотке крови ниже 0,5 ммоль/л имеют место различной степени тяжести нарушения со стороны ЦНС, что требует интенсивной возместительной терапии препаратами магния, такими как Магнерот для перорального применения до 3–6 г/сут [7]. Таким образом, включение препаратов магния, в т. ч. оротата магния (Магнерот), в комбинированную терапию сердечно-сосудистых заболеваний способствует более эффективному снижению метаболических нарушений, нормализации гликемического и липидного профилей, реологических свойств крови, что суммарно ведет к снижению АД, профилактике атеросклероза и сердечно-сосудистых осложнений. Препарат магния оротата Магнерот следует считать препаратом выбора в комплексном лечении и профилактике стенокардии, ИМ, хронической сердечной недостаточности, аритмий сердца, вызванных дефицитом магния, спастических состояний, атеросклероза, дислипидемий. Многолетний опыт клинического применения препаратов магния свидетельствует об их хорошей эффективности и высоком профиле безопасности в профилактике и лечении пациентов с различной кардиологической, неврологической патологией, а также другими заболеваниями, обусловленными дефицитом магния.
Литература 1. Dreosti E. Magnesium status and health // Nutr. Rev. 1995. Vol. 53. P. 23–27. 2. Городецкий В.В., Талибов О.Б. Препараты магния в медицинской практике. Малая энциклопедия магния. М.: Медпрактика, 2008. 43 с. 3. Petroianu A., Barquete J., Plentz E. G. Acute effects of alcohol ingestion on the human serum concentrations of calcium and magnesium // J. Int. Med. Res. 1991. Sep.-Oct. Vol. 19 (5). P. 410–413. 4. Недогода С.В. Роль препаратов магния в ведении пациентов терапевтического профиля // Лечащий врач. 2009. №.6. C. 16–19. 5. Schimatchek H.F., Rempis R. Prevalence of hypomagnesemia in an unselected German population of 16,000 individuals // Magnes. Res. 2001. Vol. 14. P. 283–290. 6. Школьникова М.А., Чупрова С.Н., Калинин Л.А. и др. Метаболизм магния и терапевтическое значение его препаратов. Пособие для врачей. М.: Медпрактика, 2002. 32 с. 7. Шилов А.М., Осия А.О. Препараты магния (Магнерот) и сердечно-сосудистые заболевания в практике врача первичного звена здравоохранения // Трудный пациент. 2013. № 12. С.12–19. 8. Морозова Т.Е., Дурнецова О.С. Препараты магния в кардиологической практике // Лечащий врач. 2014. № 4. С. 95–99. 9. Коровина Н.А., Творогова Т.М., Гаврюшева Л.П. Применение препаратов магния при сердечно-сосудистых заболеваниях у детей // Лечащий врач. 2006. № 3. С.10–13. 10. Shechter M., Sharir M., Labrador M. J. et al. Oral magnesium therapy improves endothelial function in patients with coronary artery disease // Circulation. Nov. 2000. Vol. 102. P. 2353–2358. 11. Мартынов А.И., Урлаева И.В., Акатова Е.В., Николин О.П. Значение дефицита магния в кардиологии // Consilium Medicum. 2014. № 01. С. 43–46. 12. Акарачкова Е.С. Дефицит магния. Случаи из практики врача-невролога // РМЖ. 2010. № 26 (1628). 13. Шилов А.М., Авшалумов А.Ш., Синицина Е.Н. и др. Метаболический синдром и «дефицит магния»: особенности течения и лечения // Врач. 2008. № 9.С. 44–48. 14. Cappuccio F.P., Markandu N.D., Beynon G.W. et al. Lack of effect of oral magnesium on high blood pressure: a double blind study // BMJ. 1985. Vol. 291. P. 235–238. 15. Ekmekci O.B., Donma O., Tunckale A. Angiotensin-converting enzyme and metals in untreated essential hypertension // Biol. Trace Elem. Res. 2003. Vol. 95 (3). P. 203–210. 16. Geleijnse J.M., Witteman J.C., Bak A.A. et al. Reduction in blood pressure with a low sodium, high potassium, high magnesium salt in older subjects with mild to moderate hypertension // BMJ. 1994. Vol. 309 (6952). P. 436–440. 17. Mizushima S., Cappuccio F.P., Nichols R., Elliott P. Dietary magnesium intake and blood pressure – a qualitative overview of the observational studies // J. Hum. Hypertens. 1998. Vol. 12. P. 447–453. 18. Shechter M., Sharir M., Labrador M.J. et al. Oral magnesium therapy improves endothelial function in patients with coronary artery disease // Circulation. Nov. 2000.Vol.102. P. 2353–2358. 19. Wirell M.P., Wester P.O., Segmayer B.J. Nutritional dose of magnesium in hypertensive patients on beta blockers lowers systolic blood pressure: a double-blind, cross-over study // J. Intern. Med. 1994. Vol. 236. P. 189–195. 20. Liao F., Folsom A.R., Brancati F.L. Is low magnesium concentration a risk factor for coronary heart disease? The Atherosclerosis Risk in Communities (ARIC) Study // Am. Heart J. 1998. Vol. 136 (3). P. 480–490. 21. Shechter M. Does magnesium have a role in the treatment of patients with coronary artery disease? // Am. J. Cardiovasc. Drugs. 2003. Vol. 3 (4). P. 231–239. 22. Лазебник Л.Б., Дроздова С.Л. Коррекция магниевого дефицита при сердечно-сосудистой патологии // Кардиология. 1997. № 5. С. 103–104. 23. Diaz R., Paolasso E.C., Piegas L.S. et al. on behalf of the ECLA (Estudios Cardiologicos Latinoamerica) collaborative group. Metabolic modulation of acute myocardial infarction. The ECLA glucose-insulin-potassium pilot trial // Circulation. 1998. Vol. 98. P. 2227–2234. 24. Fath-Ordoubadi F., Beatt K.J. Glucose-insulin-potassium therapy for treatment of acute myocardial infarction. An overview of randomized placebo – controlled trials // Circulation. 1997. Vol. 96. P. 1152–1156. 25. Shechter M., Hod H., Chouraqui P. et al. Magnesium therapy in acute myocardial infarction when patients are not candidates for thrombolytic therapy // Am. J. Cardiol. 1995. Vol. 75. P. 321–323. 26. Teo K.K., Yusuf S., Collins R. et al. Effects of intravenous magnesium in suspected acute myocardial infarction. Overview of randomised trials // Brit. Med. J. 1991. Vol. 303. P. 1499–1503. 27. Woods K.L., Fletcheer S., Foffe C., Haider Y. Intravenous magnesium sulphate in suspected acute myocardial infarction. Results of the second Leicester Intravenous Magnesium Intervention Trial (LIMIT – 2) // Lancet. 1992. Vol. 343. P. 816–819. 28. Zehender M., Meinertz T., Just H. Magnesium deficiency and magnesium substitution. Effect on ventricular cardiac arrhythmias of various etiology // Herz. 1997. Jun. 22 (Suppl. 1). P. 56–62. 29. Tsuji H., Venditti F.J. Jr, Evans J.C. et al. The associations of levels of serum potassium and magnesium with ventricular premature complexes (the Framingham Heart Study) // Am. J. Cardiol. 1994. Vol. 74. P. 232–235. 30. Eichhorn E.J., Tandon P.K., Dibianco R. et al. The Study Group Clinical and prognostic significance of serum magnesium concentration in patients with severe chronic congestive heart failure: The Promise Study // J. Am. Coll. Cardiol. 1993. Vol. 21 (3). P. 634–640. 31. Давыдова С., Яровой С. Препараты магния в лечении и профилактике суправентрикулярных тахиаритмий у больных урологического профиля // Врач. 2011. № 9. С. 44–49. 32. Chakraborti S., Chakraborti T., Mandal M. et al. Protective role of magnesium in the cardiovascular diseases: A review // Mol. Cell. Biochem. 2002. Vol. 238. P. 163–179. 33. Sueta C.A., Clarke S.W., Dunlap S.H. Effect of acute magnesium administration on the frequency of ventricular arrhythmia in patients with heart failure // Circulation. 1994. Vol. 89. P. 660–666. 34. Шилов А.М. и др. Применение препаратов магния для профилактики нарушений ритма сердца у больных острым инфарктом миокарда // Рос. кардиол. журн. 2002. № 1. С. 16–19. 35. Hoshino K., Ogawa K., Hishitani T. et al. Successful uses of magnesium sulfate for torsades de pointes in children with long QT syndrome // Pediatr. Int. 2006. Vol. 48 (2). P. 112–117. 36. Мартынов А.И., Акатова Е.В., Николин О.П. Клиническая эффективность оротата магния у пациентов с нарушениями ритма и артериальной гипертонией при пролапсе митрального клапана // Кардиоваск. терапия и профилактика. 2009. № 8. С. 8–12. 37. Мартынов А.И., Акатова Е.В. Опыт пятнадцатилетнего применения препаратов магния у больных с пролапсом митрального клапана // Кардиология. 2011. № 6. С. 60–65. 38. Торшин И.Ю., Громова О.А., Федотова Л.Э. и др. Хемоинформационный анализ молекулы оротовой кислоты указывает на противовоспалительные, нейропротективные и кардиопротективные свойства лиганда магния // Фарматека. 2013. № 13. С. 95–103. 39. Jellinek H., Takacs E. Morphological aspects of the effects of orotic acid and magnesium // Arzneimittelforschung. 1995. Vol. 45 (8). P. 836–842. 40. Altura B.M. Basic biochemistry and physiology of magnesiym; A brief reviem // Mag-nesium and Frace Elements. 1991. Vol. 10. P. 167–171.
Роль оротата магния в лечении аритмического синдрома на фоне дисплазий соединительной ткани
При дисплазиях соединительной ткани одним из наиболее частых патологических нарушений со стороны сердечно-сосудистой системы является аритмический синдром, который, проявляясь уже с 5–6-летнего возраста и максимально прогрессируя в подростковом, может приводить к развитию жизнеугрожающих нарушений ритма сердца у молодых лиц [1, 2]. Ведущую роль среди модифицируемых факторов риска формирования клинически значимых аритмий при дисплазиях соединительной ткани (ДСТ) отводят дисбалансу вегетативной нервной системы [3]. При этом, согласно результатам большинства исследований, посвященных изучению роли симпатического тонуса при патологии сердечно-сосудистой системы, ассоциированной с ДСТ, сложилось представление о прогностически неблагоприятном значении гиперсимпатикотонии, в том числе как независимого фактора риска развития фатальных нарушений ритма [3–5]. Необходимо отметить, что концентрация катехоламинов в плазме крови лишь косвенно характеризует активность симпатической нервной системы. Выраженность физиологического эффекта катехоламинов во многом определяется степенью их связывания с адренорецепторами, локализованными на мембранах клеток органов и тканей, а также — эритроцитов [6, 7]. Данные обстоятельства послужили основанием считать β-адренореактивность мембраны эритроцитов (β-АРМ) системным показателем адренореактивности организма [7, 8].
Между тем установлены корреляционные взаимосвязи между содержанием магния в слюне и наличием жизнеугрожающих аритмий [9]. Кроме того, литературные данные свидетельствуют об эффективности магния оротата дигидрата в снижении средней и максимальной частоты сердечных сокращений, количества эпизодов тахикардии и частоты пароксизмов суправентрикулярной тахикардии, а также уменьшении выраженности синдрома вегетативной дисфункции, в том числе — у пациентов с пролапсом митрального клапана (ПМК) [10–13].
Целью данного исследования было изучение влияния магния оротата дигидрата на состояние адренореактивности у пациентов с аритмическим синдромом, ассоциированным с ДСТ.
Материал и методы исследования
В исследование включено 72 пациента с нарушением ритма на фоне ДСТ (38 мужчин и 32 женщины) в возрасте от 18 до 35 лет. Критерии включения в исследование: пациенты с нарушением сердечного ритма при наличии признаков дисплазий соединительной ткани; возраст пациентов от 18 до 40 лет; добровольное информированное согласие пациента на участие в исследовании. Критерии исключения: пациенты с повышенным давлением по малому кругу кровообращения, травматические повреждения грудной клетки в анамнезе, заболевания сердечно-сосудистой системы (кардиомиопатия, врожденные и приобретенные пороки сердца, миокардиты, сердечная недостаточность и др.), заболевания щитовидной железы, заболевания крови, электролитные нарушения, острые или обострение хронических воспалительных заболеваний, алкоголизм, наркомания, использование препаратов, которые могут повлиять на результаты исследования, противопоказания к применению магния оротата дигидрата, беременность и лактация, нежелание пациента участвовать в исследовании.
Всем пациентам, принимавшим участие в исследовании, проведены: общеклиническое обследование (жалобы, анамнез, полное физикальное обследование), электрокардиография (ЭКГ) по общепринятой методике (электрокардиограф Schiller), мониторирование ЭКГ по Холтеру в течение 24 часов (монитор МТ-200 фирмы Schiller (Швейцария)), оценка уровня β-адренореактивности организма методом изменения осморезистентности эритроцитов под влиянием β-адреноблокаторов с использованием диагностического набора реактивов («АГАТ Мед», Москва) [6, 8].
По результатам электрокардиографических методов исследования были сформированы группы пациентов с учетом расположения эктопического очага: I группа — 23 пациента (11 мужчин и 12 женщин), медиана возраста — 23 года (Р25–75% = 22 ± 32), с зарегистрированными полиморфными желудочковыми экстрасистолами (n = 11), мономорфными парными желудочковыми экстрасистолами (n = 7), полиморфными парными желудочковыми экстрасистолами (n = 5); II группа — 20 пациентов (9 мужчин и 11 женщин), медиана возраста — 27,5 лет (Р25–75% = 23,5 ± 33), с зарегистрированной желудочковой экстрасистолией в виде мономорфной одиночной с частотой не более 30 эктопических комплексов за любой час мониторирования (n = 13) и мономорфной одиночной с частотой более 30 экстрасистолических комплексов за любой час мониторирования (n = 7); III группа — 29 пациентов (20 мужчин и 9 женщин), медиана возраста 25 лет (Р25–75% = 21 ± 29), с мономорфной одиночной суправентрикулярной экстрасистолией (СВЭ) с частотой менее 100 комплексов за любой час мониторирования (n = 3), мономорфной частой СВЭ (n = 12), политопной одиночной СВЭ (n = 6), монофокусной пароксизмальной суправентрикулярной тахикардией (n = 5), неустойчивым пароксизмом суправентрикулярной тахикардии (n = 2), атриовентрикулярной пароксизмальной тахикардией (n = 1). Группу контроля составили 30 здоровых добровольцев (20 мужчин и 10 женщин), медиана возраста составила 23 года (Р25–75% = 21 ± 29).
Пациенты исследуемых групп (I–III) после проведенного обследования в течение 4 месяцев принимали магния оротат дигидрат согласно инструкции по применению препарата (по 2 табл. 3 раза в сутки в течение 7 дней, затем — по 1 табл. 3 раза в сутки ежедневно до 4 месяцев). После приема магния оротат дигидрата вновь была проведена оценка уровня адренореактивности в исследуемых группах с целью изучения восстановления чувствительности β-адренорецепторов эритроцитов.
Анализ на однородность групп по возрасту и полу проводился с использованием непараметрического критерия Манна–Уитни U Test для числовых данных (возраст) и критерия χ2 с учетом поправки Yates, для дихотомических данных (пол). Сравниваемые группы были сопоставимы по полу и возрасту.
Для обработки данных использовался пакет статистических программ Statistica 7.0 и стандартные математические таблицы Microsoft Exel. Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05.
Для определения типа распределения изучаемых выборок применялся графический метод построения гистограмм с визуальной оценкой полученного распределения и с применением теста Шапиро–Уилка W. При получении значимых показателей критерия, нулевая гипотеза о соответствии анализируемых данных закону нормального распределения отвергалась. В случае несоответствия данных закону нормального распределения, для описания данных вместо среднего арифметического использовалась медиана (Ме), с указанием межквартильного размаха (интервал между 25-м и 75-м процентилями). Для выявления различий между анализируемыми группами был применен метод Крускала–Уоллиса ANOVA, для уточнения выявленных различий был применен метод попарного сравнения групп с использованием непараметрического критерия Манна–Уитни U Test. Учитывая множественность сравнений, применялась поправка Бонферрони, уточняющая уровень значимости, при котором значения р ниже рассчитанного расценивались как достоверные.
Результаты и обсуждение
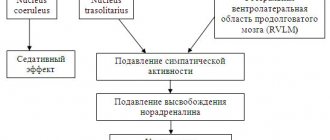
С целью восстановления чувствительности β-адренорецепторов у пациентов с аритмическим синдромом, ассоциированным с ДСТ, был выбран магния оротат дигидрат, имеющий ряд преимуществ: ионы магния участвуют в процессах возбуждения клетки, являясь физиологическим антагонистом кальция; при дефиците ионов магния нарушается обмен катионов на мембране клеток, нередко приводя к электрической перевозбудимости; ионы магния необходимы для нормального обмена нейромедиаторов (катехоламинов, тирозина, дофамина, норадреналина, серотонина, γ-аминомасляной кислоты). Кроме того, в ряде работ был доказан дефицит данного макроэлемента у пациентов с ДСТ [12, 13].
В целом пациенты отмечали хорошую переносимость препарата, не было зарегистрировано ни одного случая нежелательных явлений. По окончании курса терапии у пациентов исследуемых групп была отмечена достоверная положительная динамика по ряду субъективных проявлений. Так, уменьшилась частота регистрации жалоб астенического характера (p < 0,01), на сердцебиение жаловались меньше трети пациентов, перебои в работе сердца стали реже, и их отмечали меньше половины пациентов, кардиалгии беспокоили лишь каждого четвертого пациента, а также достоверно улучшилась переносимость умеренной физической нагрузки (p < 0,001).
По данным суточного мониторирования ЭКГ, уменьшение количества желудочковых экстрасистол в группах I и II отмечено у трети пациентов, у каждого седьмого пациента из I группы исчезли экстрасистолы высокой градации, у четверти пациентов из II группы желудочковые экстрасистолы после лечения не зарегистрированы (р < 0,05). В III группе у 10 пациентов вместо политопных и парных суправентрикулярных экстрасистол были отмечены монотопные и одиночные эктопии. На наш взгляд, антиаритмическая активность оротата магния в данном случае была связана прежде всего с тем, что магний, являясь естественным антагонистом кальция, обладает мембраностабилизирующим свойством, присущим антиаритмическим препаратам I класса, способствуя тем самым замедлению потери калия клеткой, уменьшению дисперсии длины интервала QT на ЭКГ, а также ингибированию симпатического влияния на сердце [12, 14].
В ходе исследования β-адренорецепции мембран эритроцитов методом оценки изменения осморезистентности эритроцитов под влиянием β-адреноблокаторов у пациентов исследуемых групп было выявлено, что медиана показателя β-адренореактивности мембран эритроцитов (β-АРМ) в I группе составила 52,07 условных единицы (Р25–75% = 48,03 ± 55,22), у пациентов II группы 43,54 условных единицы (Р25–75% = 39,56 ± 45,75), в III группе 36,7 условных единицы (Р25–75% = 35,1 ± 40,64), в то время как в группе здоровых добровольцев значимо ниже — 17,43 условных единицы (Р25–75% = 13,22 ± 22,08), не выходя за пределы нормальных значений (2–20 условных единиц). При проведении попарного сравнения между группами были получены следующие результаты. Наибольшие значения показателя β-АРМ зарегистрированы у пациентов с желудочковыми нарушениями сердечного ритма, с максимальными значениями в группе пациентов с высокой градацией экстрасистол по Lown, что достоверно отличало их от группы с суправентрикулярными нарушениями ритма и группы контроля (табл.).
Таким образом, у пациентов с ДСТ были выявлены более высокие значения показателя β-АРМ мембран эритроцитов, чем в группе здоровых добровольцев, что соответствовало десентизации адренорецепторов (р < 0,001).
После курсового приема магния оротата дигидрата в течение 4 месяцев было отмечено снижение β-АРМ у пациентов с аритмическим синдромом на фоне ДСТ (группы I–III), что могло свидетельствовать о процессе ресенситизации адренорецепторов. Так, в I группе медиана показателя β-АРМ составила 40,42 условных единицы (Р25–75% = 35,1 ± 45,7), во II группе — 32,73 условных единицы (Р25–75% = 28,83 ± 36,62), в III группе — 28,05 условных единицы (Р25–75% = 24,3 ± 31,09). В целом в I и II исследовательских группах целевых уровней β-АРМ, при котором клетки чувствительны к β-адреноблокаторам, удалось достигнуть больше чем у половины пациентов, однако у каждого 10-го пациента, несмотря на снижение индивидуальных значений АРМ, была необходима дальнейшая коррекция десенситизации адренорецепторов. По окончании курса терапии в III группе не зарегистрировано ни одного случая со значениями β-АРМ выше 40 условных единиц, между тем у трети пациентов данный показатель был в пределах 30–40 условных единиц. При сравнении показателя β-АРМ во всех исследуемых группах (I–III) до и по окончании курса лечения отмечена статистически достоверная положительная динамика (Wilcoxon Test, p = 0,00000), однако нормальных значений (по условиям метода) достигнуть не удалось, что говорит о необходимости дальнейшего поиска способов ранней фармакологической коррекции процесса десенситизации адренорецепторов.
Таким образом, у пациентов с ДСТ выявляются более высокие значения показателя β-адренорецепции мембран эритроцитов, чем в группе здоровых добровольцев, что соответствует десентизации адренорецепторов. Причины десентизации в большинстве случаев точно не установлены. В ряде работ приводятся данные, что на потерю чувствительности адренорецепторов оказывает влияние стресс [15, 17]. Причем скорость десентизации и ресентизации адренорецепторов во многом сопоставима с продолжительностью воздействия стрессорного фактора [17]. Кроме того, у пациентов с ДСТ, по мнению ряда исследователей, повышены процессы перекисного окисления липидов [5, 18, 19], приводящие к более стремительному процессу десентизации адренорецепторов у данных пациентов. Между тем, согласно результатам проведенного исследования, применение магния оротата дигидрата у пациентов с аритмическим синдромом на фоне ДСТ патогенетически обоснованно и эффективно. Назначение магния оротата дигидрата привело к улучшению субъективного самочувствия и электрофизиологических показателей сердечной деятельности (уменьшило выраженность и частоту регистрации аритмических эпизодов) у большинства пациентов; увеличило осморезистентность эритроцитов в присутствии β-адреноблокаторов, что может свидетельствовать о процессе ресентизации адренорецепторов, что очень важно при ведении пациентов с аритмическим синдромом.
Выводы
- У пациентов с аритмическим синдромом на фоне ДСТ присутствует десенситизация адренорецепторов с максимальными значениями показателя в группе пациентов с желудочковыми экстрасистолами высоких градаций (p < 0,001).
- Прием магния оротата дигидрата в течение 4 месяцев восстанавливает чувствительность адренорецепторов (Wilcoxon Test, p = 0,0000) у пациентов с нарушениями сердечного ритма на фоне ДСТ.
- В программу обследования больных с нарушениями сердечного ритма на фоне ДСТ целесообразно включение метода оценки адренореактивности организма по величине β-АРМ, что позволит индивидуализировать подбор и оценку эффективности антиаритмической терапии у данной категории пациентов.
Литература
- Клинические рекомендации российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани (первый пересмотр) // Медицинский вестник Северного Кавказа. 2018; 1.2 (13): 137–210. https://doi.org/10.14300/mnnc.2018.13037.
- Шилова М. А., Мамедов М. Н. Внезапная сердечная смерть лиц молодого возраста: факторы риска, причины, морфологические эквиваленты // Кардиология. 2015; 7 (55): 78–83. https://dx.doi.org/10.18565/cardio.2015.7.78–83.
- Друк И. В., Нечаева Г. И., Осеева О. В. и др. Персонифицированная оценка риска развития неблагоприятных сердечно-сосудистых осложнений у пациентов молодого возраста с дисплазией соединительной ткани // Кардиология. 2015; 3: 75–84. 10.18565/cardio.2015.3.75–84.
- Земцовский Э. В., Тихоненко В. М., Реева С. В. Функциональная диагностика состояния вегетативной нервной системы. СПб: ИНКАРТ, 2004.
- Нечаева Г. И., Яковлев В. М., Друк И. В. Тихонова О. В. Нарушения ритма сердца при недифференцированной дисплазии соединительной ткани // Лечащий Врач. 2008; 6: 43–47.
- Сергеев П. В., Шимановский Н. Л. Рецепторы физиологически активных веществ. М., 1987. 400 с.
- Bristow M. R. β-Adrenergic receptor blockade in chronic heart failure // Circulation. 2000; vol. 10: 558–569.
- Малкова М. И., Булашова О. В., Хазова Е. В. Определение адренореактивности организма по адренорецепции клеточной мембраны при сердечно-сосудистой патологии // Практическая медицина. 2013; 3 (71): 20–23.
- Тихонова О. В., Дрокина О. В., Моисеева Н. Е., Нечаева Г. И., Мартынов А. И. Оценка информативности методов определения содержания магния в организме на примере пациентов с признаками дисплазии соединительной ткани // Архив внутренней медицины. 2014; 1 (15): 19–24.
- Мартынов А. И., Акатова Е. В., Николин О. П., Урлаева И. В. Влияние магния оротата на кардиоваскулярные риски // Терапия. 2016; 5: 52–57.
- Мартынов А. И., Акатова Е. В. Опыт пятнадцатилетнего применения препаратов магния у больных с пролапсом митрального клапана // Кардиология. 2011; 6: 60–65.
- Torshin I. Y., Gromova O. A., Kalacheva A. G., Oshchepkova E. V., Martynov A. I. Meta-analysis of clinical trials of cardiovascular effects of magnesium orotate // Ter. Archive. 2015; 87 (6): 88–97. 10.17116/terarkh201587688–97.
- Сологова С. С., Максимов М. Л., Тарасов В. В. Фармакологическая эффективность препаратов магния. Оротат магния (Магнерот) в клинической практике // РМЖ. Медицинское обозрение. 2014; 127: 1966.
- Городецкий В. В., Талибов О. Б. Препараты магния в медицинской практике. Малая энциклопедия магния. М.: Медпрактика, 2003. 44 с.
- Torda T., Yamaguchi I., Kopin I.J., Axelrod J Quinacrine-blocked desensitization of adrenoreceptors after immobilization stress or repeated injection of isoproterenol in rats // J. Pharmacol. Exp. Ther. 1981; vol. 216: 334–338
- Земцовкий Э. В. Спортивная медицина. СПб: Гиппократ, 1995. 448 с.
- Стрюк Р. И., Длусская И. Г. Адренореактивность и сердечно-сосудистая система. М.: Медицина, 2003. 160 с.
- Пономарева Д. А., Нагаева Т. А., Балашева И. И. Особенности состояния органов пищеварительного тракта и системы перекисного окисления липидов при дисплазии соединительной ткани у школьников по результатам скрининговых осмотров // Сибирский вестник гепатологии и гастроэнтерологии. 2007; 21: 71–73.
- Нечаева Г. И., Мартынов А. И. Дисплазия соединительной ткани: сердечно-сосудистые изменения, современные подходы к диагностике и лечению. М: ООО «Медицинское информационное агентство». 2017; 400.
Е. Н. Логинова1, кандидат медицинских наук Ю. В. Москвина, кандидат медицинских наук Г. И. Нечаева, доктор медицинских наук, профессор И. В. Друк, доктор медицинских наук, профессор А. А. Семенкин, доктор медицинских наук, профессор М. И. Шупина, кандидат медицинских наук Ю. В. Терещенко, кандидат медицинских наук
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
1 Контактная информация
Роль оротата магния в лечении аритмического синдрома на фоне дисплазий соединительной ткани/ Е. Н. Логинова, Ю. В. Москвина, Г. И. Нечаева, И. В. Друк, А. А. Семенкин, М. И. Шупина, Ю. В. Терещенко Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 50-53 Теги: сердечно-сосудистая система, аритмический синдром, молодые пациенты
Более века известно, что метаболизм макронутриентов (таких как жиры, белки и углеводы) сильно затруднен при дефиците в организме микронутриентов (ионов металлов, элементоорганических соединений, витаминов). Микронутриенты непосредственно воздействуют на физиологические процессы, т.к. в подавляющем большинстве случаев они являются кофакторами ферментов или же факторами стабилизации пространственных структур белков и РНК. Функционирование сердца и всей сердечно-сосудистой системы практически невозможно без ряда определенных микронутриентов, в частности магния.
В случае магния были проведены крупномасштабные исследования доказательного характера. Например, достаточно давно известна корреляция между смертностью от сердечно-сосудистых заболеваний и уровнями магния в питьевой воде. Сравнительно недавнее шведское исследование, включившее 1679 пациентов, показало, что риск смерти от инфаркта миокарда был ниже в группе с высокими уровнями магния в плазме крови (>0,83 ммоль/л), чем в группе с меньшими его уровнями (<0,75 ммоль/л). Риск смерти от острого инфаркта миокарда по отношению к содержанию магния в питьевой воде составил 0,64 (95% доверительный интервал [ДИ] – 0,42–0,97) для группы с самым его высоким содержанием.
Изучение когорты 5511 из участников 28–75 лет без артериальной гипертензии на момент начала исследования, проведенного в течение 8 лет, показало, что риск гипертензии (систолическое артериальное давление [САД] ≥140 мм рт.ст. или диастолическое артериальное давление [ДАД] ≥90 мм рт.ст.) снижался с увеличением уровня магния в суточной моче. Более высокие уровни магния в моче указывают на более высокое его потребление с пищей и препаратами. Увеличение уровня магния на каждые 2 ммоль приводило к снижению риска артериальной гипертензии на 21% (отношение шансов [ОШ] – 0,79; 95% ДИ – 0,71–0,88).
Мета-анализ проспективных когортных исследований суммарно включил 532 979 участников из 19 исследований, в т.ч. 19 926 случаев установленной сердечно-сосудистой патологии. Сравнение подгрупп с самым высоким и самым низким уровнями потребления магния с пищей показало, что у участников 1-й подгруппы риск сердечно-сосудистых заболеваний снижался в среднем на 15% (ОШ – 0,85; 95% ДИ – 0,78–0,92; рис. 1). Группировка пациентов в соответствии с уровнями магния в плазме крови указала на снижение риска при его высоких концентрациях на 23% (ОШ – 0,77; 95% ДИ – 0,66–0,87). Подтвержденный кардиопротекторный эффект магния был дозозависимым – увеличение уровня магния в плазме крови на 0,2 ммоль/л соответствовало снижению риска сердечно-сосудистой патологии в среднем на 25% (рис. 1).
Таким образом, с точки зрения результатов клинических исследований и т.н. доказательной медицины кардиопротекторный эффект магния не подлежит сомнению. С точки зрения физиологии систем при недостатке магния сердечная мышца становится неспособной выдерживать значительную физическую нагрузку, быстрее изнашивается, что приводит к инфаркту вследствие физической перегрузки миокарда. Магний поддерживает энергетические и пластические процессы, стабилизирует уровень АТФ, участвует в окислении жирных кислот, гликолизе и биосинтезе белка, синтезе оксида азота в эндотелии сосудов и др. Магний также является физиологическим регулятором возбудимости клетки и совершенно необходим для нормального функционирования процессов деполяризации нервных и мышечных клеток.
Магний-зависимые белки, поддерживающие функцию сердечной мышцы
Известно, что уровни магния значительно влияют на сократимость миокарда и дефицит этого минерала приводит к ослаблению сердечной функции и аритмиям. Например, исследование эффектов длительного магниевого голодания у крыс (8 недель на диете, обедненной магнием) показало снижение содержания внутриклеточных адениннуклеотидов, повышенный уровень креатинфосфата и уменьшение силы сокращений миокарда без изменения частоты пульса. Эти и другие последствия дефицита магния опосредуются рядом магний-зависимых белков, непосредственно влияющих на функцию сердечной мышцы. Эти белки можно подразделить на ферменты, регулирующие уровни сигнальных молекул, магний-зависимые белки, управляющие потоком катионов через мембраны, и белки, поддерживающие цитоскелет мышечных клеток (рис. 2).
В целом в магний-зависимое регулирование состояния соединительной ткани вовлечены по меньшей мере 20 белков. Возможные механизмы влияния дефицита магния на синтез и деградацию соединительной ткани включают активацию матриксных металлопротеиназ, лизилоксидазы, глутаминазы, замедление синтеза коллагена, эластина и гиалуронана, а также снятие ингибирования магнием металлопротеиназ и гиалуронидаз, деградирующих соединительную ткань.
При дефиците Mg2+ белковый синтез соединительной ткани замедляется, активность металлопротеиназ увеличивается и внеклеточный матрикс прогрессивно деградирует, т.к. структурная поддержка ткани (в частности, коллагеновые волокна) разрушается быстрее, чем синтезируется. На структуру соединительной ткани (в частности, хряща) могут также оказывать влияние магний-зависимые белки сигнальных путей пролиферации клеток и прежде всего рецептор активина типа 2B (ACVR2B), активирующий SMAD-транскрипционные регуляторы, что приводит к активации фибробластов и ускорению заживления ран.
«Энергетический метаболизм» является достаточно широким понятием, включающим анаболические и катаболические процессы со стороны белков, жиров и углеводов, в конечном итоге приводящие к накоплению резерва клеточного АТФ, этой универсальной молекулы энергопереноса в биологических системах. Всего лишь 1 мМ ионов магния находится в организме в свободном состоянии, остальная часть биометалла связана с белками и растворимыми соединениями, такими как АТФ, миозин скелетной мышцы, тропонин-С миокарда, аминокислотами (в частности, с глицином, аланином, аспарагиновой кислотой и т.д.) и различными ферментами. Взаимодействия магния с АТФ наиболее важны для энергетического метаболизма: Mg2+ стабилизирует молекулу АТФ путем нейтрализации избыточного отрицательного заряда фосфатов.
В дополнение к влиянию на взаимодействие магния с АТФ, имеющее важное значение для энергетического метаболизма, дефицит магния также негативно сказывается на функционирование многих белков сердечно-сосудистой системы, которые поддерживают энергетический метаболизм и требуют магний в качестве кофактора.
Эти магний-зависимые белки участвуют в синтезе важных коферментов, в метаболизме углеводов (в частности, в гликолизе), а в митохондриях они задействованы в метаболизме пирувата и жирных кислот. Понижение активности этих ферментов (прежде всего гликолитических) является наиболее вероятным объяснением формирования инсулинорезистентности.
О терапевтическом применении органических солей магния
Магний оказывает разностороннее воздействие на метаболизм, структуру и функцию сердца и всей сердечно-сосудистой системы. Принимая во внимание, что частота встречаемости дефицита магния в различных популяциях составляет 30–50%, становится очевидным, что у значительного числа кардиологических больных он наблюдается в той или иной степени. Соответственно, многие из описанных выше молекулярных функций будут замедлены, что приведет к большей восприимчивости к неблагоприятным сердечно-сосудистым событиям. Восстановление функционального состояния сердечной мышцы также будет затруднено при дефиците магния (вследствие дисбаланса апоптоза и пролиферации, ослабленной структуры соединительной ткани и т.д.).
Помимо непреходящей роли магния в физиологии сердечно-сосудистой системы существует другая сторона вопроса в отношении фармакологической коррекции дефицита магния – биодоступность магния в различных препаратах. Наилучшей биодоступностью обладают натуральные источники магния – овощи, фрукты, орехи и т.д. Однако восполнение его дефицита при заболеваниях сердечно-сосудистой системы не может проводиться только за счет коррекции диеты. Фармакологическая поддержка магниевыми препаратами необычайно важна. Препараты неорганического магния, такие как магния сульфат, характеризуются крайне низкой его биодоступностью и рядом выраженных побочных эффектов. Использование в магниевой фармакотерапии препаратов второго поколения, основанных на органических солях магния и обладающих высокой биодоступностью, намного более перспективно. Одним из таких препаратов является оротат магния – соль магния и оротовой кислоты. Оротовая кислота – один из продуктов биосинтеза пиримидинов.
В фармакологии соли оротовой кислоты используются в качестве переносчика минералов, т.к. оротовая кислота повышает клеточную биодоступность катионов и имеет ряд дополнительных преимуществ перед неорганическими солями. Например, оротат магния не вступает в реакцию с кислотой желудка и не оказывает слабительное действие. Показана эффективность оротата магния при состояниях, сопровождающихся дефицитом магния, в т.ч. у больных, подвергшихся коронарным хирургическим вмешательствам. Он оказывает антиаритмическое, сосудорасширяющее и кардиопротективное воздействия. Повышая устойчивость миоцитов к ишемии, оротат магния благоприятно влияет на клиническое течение инфаркта миокарда и сердечной недостаточности.
Эксперименты показывают, что оротовая кислота и оротат магния способствуют улучшению липидного профиля плазмы крови (соотношение липопротеидов низкой и высокой плотности). Действие оротовой кислоты на липиды опосредовано, вероятнее всего, также пуринергическими рецепторами, которые действуют на транскрипцию многих генов с помощью фосфорилирования транскрипционного регулятора CREB.
Результаты клинического применения оротата магния подтверждают результаты фундаментальных исследований. Исследование 79 больных тяжелой сердечной недостаточностью, получавших лечение оротатом магния, показало, что их однолетняя выживаемость составила 76% по сравнению с 52% в группе плацебо. Использование оротата магния увеличивает переносимость физических нагрузок у больных ишемической болезнью сердца (ИБС). Прием препарата пожилыми пациентами с ИБС улучшал параметры качества жизни и психоэмоционального статуса. Позитивное влияние оротата магния в этих случаях может быть связано с вазодилатацией и повышением энергетического метаболизма кардиомиоцитов. С физиологической точки зрения совместное применение магния и оротата является синергичным. На практике показано, что применение оротата магния в комплексной терапии имеет положительный эффект на выживаемость и качество жизни пациентов с ИБС.
В случае идиопатического пролапса митрального клапана (ПМК), который часто рассматривается как разновидность дисплазии соединительной ткани, положительный эффект оротата магния обеспечивается не только через вазодилатацию и улучшение энергетического метаболизма, но и за счет структурных изменений соединительной ткани. Систематическое использование оротата магния оказалось эффективным при лечении пациентов с синдромом соединительнотканной дисплазии сердца (в частности, с ПМК и аномальными chordae tendineae). Исследование 144 пациентов с идиопатическим ПМК показало, что использование оротата магния приводило к снижению максимального САД и ДАД, а также среднего ДАД, уменьшению числа эпизодов тахикардии. Шестимесячная терапия оротатом магния полностью или частично купирует симптомы ПМК более чем у половины пациентов.
Цитрат магния – одна из органических солей, используемых для изготовления современных магний-содержащих препаратов. Поскольку цитрат является органической и хорошо растворимой формой магния, это в значительной степени обусловливает его высокую биоусвояемость. Однако хорошая растворимость в воде – далеко не единственная особенность цитрата магния, который также характеризуется рядом специфических молекулярных эффектов. Это участие магния в качестве центрального субстрата цикла Кребса (который даже имеет альтернативное название – «цитратный цикл»), взаимодействие с белками – транспортерами дикарбоксилатов и наконец эффекты, обусловленные физико-химическими особенностями самой молекулы цитрата. Следует подчеркнуть, что все метаболиты цитрата – эссенциальные эндогенные молекулы. Практически полная утилизация цитрата (превращение в углекислый газ и воду) делает его идеальным переносчиком магния.
Анализ литературы по медицинскому применению препаратов цитрата магния показывает, что он применяется в терапии более 50 лет и используется для профилактики образования почечных камней (25 исследований), при лечении и профилактике гипомагнезиемии и гипокалиемии (8), при сосудистых заболеваниях (5) и в акушерстве (4 исследования). Другие медицинские показания к применению цитрата магния (3 исследования) включают нормализацию минеральной плотности костной ткани, лечение синдрома беспокойных ног и бронхиальной астмы.
К механизмам молекулярных функций магний-зависимых белков тканей сердца относятся, в частности, управление ионными каналами, регулировка уровней сигнальных молекул, гликолиз, везикулярный транспорт, внутриклеточная сигнализация от цитокинов, влияние на метаболизм соединительной ткани, апоптоз и деление клеток. Сформулированная обобщенная картина влияния магния на сердечно-сосудистую систему на молекулярном уровне указывает на множественные механизмы, через которые осуществляется терапевтическое воздействие препаратов органического магния у кардиологических больных. Восполнение дефицита магния посредством пищевых добавок или правильно сбалансированной диеты будет способствовать восстановлению нормального функционирования данных молекулярных каскадов, оказывая таким образом положительное влияние на сердечно-сосудистую систему. В целом магний положительно воздействует на энергетический метаболизм, структуру соединительной ткани и сосудистый тонус, способствуя уменьшению уровня катехоламинов в плазме.