Давыдов М.И., Полоцкий Б.Е., Мачаладзе З.О., Тюляндин С.А., Карселадзе А.И., Савелов Н.А., Ахмедов Б.Б. (РОНЦ им. Н.Н.Блохина)
В материалах РОНЦ им. Н.Н.Блохина 1980-2005 гг. отражен опыт диагностики, хирургического и комбинированного лечения свыше 500 больных. Среди анализированных случаев – опухоли органов и тканей собственно средостения: вилочковой железы (16,9%), нейрогенные (17,7%) и мезенхимальные (10,4%) опухоли; новообразования из тканей, дистопированных в средостение (внегонадные герминогенные опухоли, тератомы, дермоидные кисты) – 22,7%, а также – процессы с изолированным поражением лимфатических узлов средостения: лимфомы Ходжкина и неходжкинске лимфомы (25,7%), случаи саркоидоза Бека (29), ангиофолликулярной гиперплазии (4) и др.
Обобщение опыта, накопленного, в особенности, в 1990-х – 2000-х гг., с учетом современных возможностей клинической онкологии, позволило оптимизировать уточняющую диагностику, обосновать расширение показаний к хирургическому и комбинированному лечению, повторным и паллиативным операциям. Результаты операций по поводу новообразований средостения, прежде всего при массивных опхолевых поражениях, сопряженных со сдавлением дыхательных путей, пищевода, магистральных сосудов (при условии должного реанимационно-анестезиологического обеспечения) характеризуются сравнительно низкой летальностью, улучшением качества жизни и увеличением ее продолжительности.
ОБЩИЕ ПОЛОЖЕНИЯ (КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ…)
Материалы РОНЦ подтверждают известные сведения о локализации и преимущественно злокачественном характере опухолей осредостения. Соотношение злокачественных и доброкачественных новообразований составило 3:1. Тимомы, лимфомы, внегонадные герминогенные опухоли (ВГО), мезенхимомы локализовались в переднем средостении, нейрогенные опухоли – в заднем; несоответствие локализации и структуры новообразования отмечено у 15% больных нейрогенными опухолями – в тех случаях, когда новообразования локализовалась в переднем средостении. Определение исходной локализации процесса было затруднено при «гигантских» опухолях, когда (в 10-20% случаев) наблюдались поражения как переднего, так и заднего средостения с распространением процесса на б?льшую часть гемиторакса.
Длительность клинических проявлений составляла от нескольких месяцев до 3 лет. При небольших опухолях, не связанных с прилежащими анатомическими образованиями не отмечалось клинических проявлений (до 30-40% случаев). В остальных наблюдениях регистрировались проявления, обусловленные наличием опухоли – миастения (5%), осиплость (часто сопряженная с ВГО), медиастинальный компрессионный синдром (до 30-40% случаев, в особенности при злокачественных процессах); а также различные неспецифические симптомы (повышение температуры тела, кашель, боли и чувство сдавления за грудиной, др.). Рентгенологическое исследование, безусловно, позволяло определять локализацию и размеры опухоли. Для уточнения топографии новообразований, выявления связей с прилежащими анатомическими образованиями применялись КТ и МРТ. Чувствительность. специфичность и точность * этих методов соответствовали 90-80%, достигая 97-98% значимости оценки – как например, МРТ в диагностике распространенности тимом. Повышение уровня опухолевых маркеров сыворотки крови (АФП и ХГЧ) наблюдалось при несеминомных герминогенных опухолях средостения. Морфологическое подтверждение диагноза, кроме пункционной биопсии (информативность, при лимфопролиферативных заболеваниях, соответствует 48%), достигалось хирургическими методами диагностики. При этом, вместо медиастиноскопии и парастернальной медиастинотомии (16 и 43 исследования 1990-х гг.) в 2000-х гг. стала применяться видеоторакоскопия (53 исследования).
Следует отметить, что современные возможности диагностики позволяют устанавливать морфологический диагноз во всех случаях лимфопролиферативных заболеваний с поражением средостения. При этом, агрессивность применяемых методов лечения вынуждает считать недопустимой попытку лечения при данных новообразоованиях без морфологического диагноза.
Хирургический метод – основа лечения больных опухолями средостения. Исключения составляют злокачественные внегонадные герминогенные и лимфопролиферативные заболевания основу лечения которых составляют консервативные методы лечения. Учитывая низкую эффективность химио-лучевой терапии в отношении остальных медиастинальных новообразований хирургическое лечение, в том числе и с паллиативной целью, с выполнением повторных операций, способствует существенному продлению жизни. Выполнение боковой торакотомии в 73% случаев обеспечивало возможность удаления опухоли. Локализация процесса, безусловно, определяла особенности хирургического доступа. Так, при нейрогенных опухолях, растущих в форме «песочных часов» торакотомия дополнялась одномоментной ляминэктомией для радикального удаления внутригрудной и внутрипозвоночной частей опухоли – по N.Guleke (1916) в модификации H.Grillo et al. (1983). Для удаления местнораспространенных и «гигантских» опухолей выполнялась двусторонняя торакотомия, полная продольная стернотомия (4), иные комбинированные доступы.
Введение
«Опухоли средостения» — собирательный термин, служащий для обозначения новообразований различного генеза, происходящих из разнородных тканей и объединенных в одну нозологическую форму лишь благодаря единым анатомическим границам.
Средостением называют часть грудной полости, ограниченную с боков медиастинальной плеврой, сзади грудным отделом позвоночного столба и шейками ребер, спереди грудиной, снизу диафрагмой, а сверху условной границей считается уровень верхней апертуры грудной клетки.
С анатомической точки зрения средостение представляет собой единое пространство, но с практических соображений его принято делить на отделы. Предложенные B. Felson [1] условные линии проходят по ориентирам на боковых рентгенологических снимках грудной клетки, деля средостение на три отдела: переднее, среднее и заднее. В последующие годы границы и условные отделы средостения на подвергались коррекции [2]. В горизонтальной плоскости рассматривались линии, проходящие по уровню верхней границы тени дуги аорты и проекции нижней легочной вены; в вертикальной — по передней и задней стенке трахеи, а также заднему контуру тени сердца. Таким образом, средостение условно могло быть разделено на 9 отделов: передневерхний, переднесредний, передненижний, средневерхний, средний, средненижний, задневерхний, заднесредний, задненижний. На практике более часто используют понятия «переднее и заднее средостение».
Внедрение компьютерной томографии (КТ) в диагностику патологии средостения потребовало разработки новых ориентиров в оценке границ данной области. Так, японская ассоциация по изучению патологии тимуса (JART) в 2009 г. предложила границы отделов средостения, основанные на ориентирах, визуализируемых на поперечных плоскостных срезах КТ органов грудной клетки. Выделено 4 отдела средостения: верхнее, переднее (предсосудистое пространство), среднее (перитрахеоэзофагеальная зона) и заднее (паравертебральная область) [3].
Верхнее средостение
определяется как пространство, ограниченное сверху условной горизонтальной плоскостью, проходящей по уровню апертуры грудной клетки; снизу — по уровню проекции пересечения левой плечеголовной вены трахеи по срединной линии грудной клетки (рис. 1, 2).
Рис. 1. Верхнее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне грудиноключичного сочленения. Рис. 1. Верхнее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне грудиноключичного сочленения.
Рис. 2. Верхнее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне левой плечеголовной вены. Рис. 2. Верхнее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне левой плечеголовной вены. Спереди данный отдел средостения ограничен грудиной, сзади — телами позвонков, поперечными их отростками и головками ребер.
К переднему средостению
относят зону, ограниченную сверху нижней стенкой левой плечеголовной вены (т.е. нижняя граница верхнего средостения), снизу диафрагмой, спереди грудиной, сзади перикардом, передними полуокружностями стенок дуги аорты, плечеголовного ствола, верхней полой вены, легочного ствола, а с боков медиастинальной плеврой, наружными полуокружностями стенок внутренних грудных сосудов (рис. 3—5).
Рис. 4. Переднее, среднее и заднее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне бифуркации трахеи. Рис. 4. Переднее, среднее и заднее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне бифуркации трахеи.
Рис. 5. Переднее, среднее и заднее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне легочных артерий. Рис. 5. Переднее, среднее и заднее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне легочных артерий.
Рис. 3. Переднее, среднее и заднее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне дуги аорты. Рис. 3. Переднее, среднее и заднее средостение. Аксиальный скан КТ-изображения в мягкотканном окне на уровне дуги аорты.
Область среднего средостения
начинается сверху от нижней границы верхнего средостения, простираясь до диафрагмы (нижняя граница). Передняя граница среднего отдела средостения проходит по задним полуокружностям стенок магистральных сосудов средостения, а нижняя — на 1 см кзади от передней полуокружности тел позвонков и нисходящей аорты (см. рис. 3—5).
Заднее средостение
начинается от уровня нижней границы верхнего средостения до диафрагмы. Передней ее границей является условная линия, проведенная по задней границе среднего отдела средостения (см. выше). Как и в верхнем средостении, задняя граница проходит по телам и поперечным отросткам позвонков, головкам ребер (см. рис. 3—5).
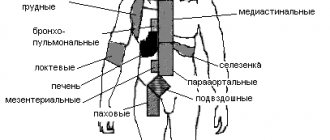
В средостении расположены следующие структуры и органы: вилочковая железа, трахея, главные бронхи, аорта, пищевод, сердце и его крупные артериальные и венозные магистральные сосуды, блуждающий и диафрагмальные нервы, грудной лимфатический проток. Между этими образованиями находится ткань собственно средостения
, представляющая собой рыхлую волокнистую соединительную и жировую ткань, мелкие кровеносные и лимфатические сосуды, нервы, скопления лимфатических узлов (см. рис. 1—5).
Источником развития опухолей средостения могут послужить:
• органы, расположенные и проходящие в средостении;
• ткани, отграничивающие средостение;
• ткани, расположенные между органами, т. е. собственно ткань средостения
;
• ткани, смещенные в средостение при нарушении эмбриогенеза (зачатки щитовидной и околощитовидной железы, недифференцированные половые клетки).
В средостении также встречаются патологические процессы и пороки развития, сопровождающиеся образованием кист, что должно быть учтено при проведении дифференциальной диагностики у больных с выявленными образованиями данной локализации.
ОСОБЕННОСТИ, ОБУСЛОВЛЕННЫЕ ЛОКАЛИЗАЦИЕЙ НОВООБРАЗОВАНИЙ
Опухоли вилочковой железы. Из 85 наблюдений в 44,7% случаев диагностированы доброкачественные новообразования, в 55,3% – злокачественные. Клиническое течение заболевания не всегда определялось гистологическим строением опухоли и характером её роста. Оперированы 70 (82,4%) больных; остальным проведено консервативное лечение из-за распространенности опухолевого процесса.
Радикальные операции составили 59 (84,3%) случаев; у остальных пациентов удаление опухоли выполнено с паллиативной целью, у 6 (8,6%) операция ограничена эксплоративной торакотомией. Адекватным объемом оперативного вмешательства при новообразованиях вилочковой железы является тимомэктомия – удаление опухоли и всей ткани вилочковой железы с жировой клетчаткой и лимфоузлами переднего средостения. Такой объем операции выполнен 44 больным. Кроме того, 15 пациентам выполнены расширенно-комбинированные тимомэктомии в связи с инвазией опухолей в окружающие структуры. Дополнительная лучевая и химиотерапия проведена в 19,2% случаев (в основном – при III-IV стадиях тимом типов В2, В3 и С). Отдаленные результаты хирургического лечения. Более 3 лет после радикального хирургического лечения прожили 84,8%, более 5 лет – 82,6% и более 10 лет – 73,9% больных. Отдаленные результаты определялись распространенностью процесса (инвазия капсулы, поражение плевры), гистологическим типом опухоли. Так, тимомы типов А и В1 прогностически наиболее благоприятны (10-летний срок переживают 90% пациентов). Для тимом типов АВ, В2 и В3 5-летняя выживаемость соответствовала 64-68%; прогноз при тимомах типа С достоверно хуже – 32%. При отсутствии инвазивного роста гистологическая форма тимомы не влияет на отдаленные результаты хирургического лечения. Тимомы с инвазией в пределах капсулы являются злокачественными по клиническому течению и требуют назначения послеоперационного лучевого лечения.
Нейрогенные опухоли (89 случаев) распределены в две гистогенетические группы: новообразования из клеток нервной ткани (22; 24,7%) и из оболочек периферических нервов (67; 75,3%). Доброкачественные опухоли (шванномы, нейрофибромы, ганглионевромы, параганглиомы) выявлены у 69,7%, злокачественные (саркомы Юинга, нейробластомы, ганглионейробластомы, др.) – у 30,3% пациентов. Решение лечебных задач определялось характерной локализацией нейрогенных опухолей и особенностями их распространения.
Оперированы (большинство из них – радикально) 86 (96,6%) пациентов. Радикальные операции в основном выполнены при доброкачественных нейрогенных опухолях; при злокачественных новообразованиях радикальные хирургические вмешательства составили 54,2%, паллиативные – 45,8%. Типичный вариант операции, в объеме удаления опухоли средостения, осуществлен в 81,4%, комбинированный – в 18,6% случаев. При злокачественных опухолях это соотношение составило 62,5 и 37,5% соответственнои 7 больных), а комбинированные рогенными опухолями средостения типичные опурации выполнены. Проведение послеоперационной лучевой или химиотерапии показано при сомнении в радикализме операции, выявлении значительной распространенности опухоли. Назначение дополнительной лучевой или химиотерапии обосновывается сведениями о патоморфозе опухолей и наблюдениях опухолевой регрессии. Частота рецидивов после радикальных операций соответствовала 4,8%. Продолженный рост опухоли после паллиативных операций в 72,8% случаев выявлялся уже в конце первого года наблюдения. В связи с этим, очевидна целесообразность повторных (и многократных) хирургических вмешательств по поводу рецидивов нейрогенных медиастинальных опухолей – лишь хирургический метод позволяет добиться продления жизни, устранения тягостных местных проявлений заболевания. Общая 3-5-летняя выживаемость после повторных операций составила 70,8-38,6%, сравнительно с 25,0-12,5% среди больных, леченных консервативно.
Мезенхимальные опухоли (52 наблюдения) представлены различными гистологическими формами: сосудистые опухоли – 17 (32,6%); жировые – 15 (28,8%); фибробластические – 6 (11,5%), фиброгистиоцитарные – 2 (3,8%); костно-хрящевые – 5 (9,6%); мезенхимомы – 2 (2,8%), а также опухоль из скелетных мышц – 1 (1,9%); синовиальная саркома – 1 (1,9%); саркомы неясного генеза – 3 (5,8%). Доброкачественные опухоли составили 42,3%, злокачественные – 57,7% случаев. Лечение больных мезенхимальными опухолями, в особенности – злокачественными, в условиях низкой эффективности химиолучевой терапии, является только хирургическим. Оперативные вмешательства отличаются большой сложностью, что обусловлено, как правило, распространенностью процесса. Хирургическое лечение проведено 40 пациентам, консервативное – 12. В плане дополнительного лечения только 7 больным проведена пред- или послеоперационная химиолучевая терапия. После хирургического лечения в группе из 19 больных злокачественными новообразованиями рецидивы выявлены в 13 случаях (68,4%) – в том числе, в 9 из 11 паллиативных и в 4 из 8 радикальных операций (81,8 и 50% соответственно). По поводу рецидивов выполнялись повторные операции, один из больных оперирован трижды, другой – четырежды. Показатели общей и безрецидивной 5-летней выживаемости при доброкачественных мезенхимальных опухолях стремятся к 100%. При злокачественных – 1-3-5-летняя продолжительность жизни составила 75; 62,5; 48,6% после радикальных операций и 63,6; 27,2; 18,1% – после паллиативных.
Таким образом, даже при распространенном опухолевом процессе и при локорегиональных рецидивах должна применяться активная хирургическая тактика. Повторные (и многократные) операции, в том числе и с паллиативной целью, позволяют вновь добиться продления жизни. Присущий мезенхимальным опухолям агрессивный местный рост и склонность к рецидивам обосновывают целесообразность дальнейшего поиска вариантов комбинированного лечения, с применением неоадъювантной или адъювантной химиолучевой терапии. Каждую составляющую лечения следует использовать в полном объеме, постоянно развивая и совершенствуя.
Внегонадные герминогенные опухоли (ВГО). Наблюдались 114 пациентов с внегонадными герминогенными опухолями средостения: мужчин – 97 (85,1%), женщин – 17 (14,9%) в возрасте от 14 до 72 лет, средний возраст – 26 лет. Семинома диагностирована в 17,5%, несеминома – в 82,5% случаев. Среди больных несеминомными ВГО был выявлен эмбриональный рак, опухоли желточного мешка, хориокарциномы, тератомы различной степени зрелости, дермоидные кисты. Общие принципы диагностики и лечения. При повышении уровня опухолевых маркеров (АФП, ХГ, ЛДГ) без признаков поражения яичек необходима компьютерная томография органов грудной клетки, брюшной полости и забрюшинного пространства. При морфологическом подтверждении диагноза злокачественной внутригрудной герминогенной опухоли показано проведение 4-6 курсов химиотерапии (схемы ВЕР, ВР, др), лучевой терапии (РОД= 2-3 Гр; СОД – до 60-70 Гр). Полный эффект лечения больных внегонадными семиномами регистрируется в 80%, несеминомами – в 23% случаев. Частота рецидивов выше в группе внегонадных несеминомных опухолей (6,7 и 29,4%; р<0,05). При сохранении опухоли семиномного строения после индукционной химиотерапии показано динамическое наблюдение. При наличии остаточной несеминомной опухоли после окончания индукционной терапии рекомендуется хирургическое лечение. Рост маркеров является показанием к проведению химиотерапии второй линии. Выявление жизнеспособных герминогенных клеток в резидуальной опухоли обусловливает проведение послеоперационной химиотерапии.
Лимфомы (с поражением лимфоузлов средостения) без иных проявлений заболевания выявлены у 129 больных. Лимфомы Ходжкина диагностированы у 82, неходжинские лимфомы – у 47 пациентов. Морфологический диагноз был установлен с применением хирургических методов диагностики. Хирургический этап завершался на стадии диагностики. В последующем больным проводилось лечение в соответствии с вариантом лимфомы и комплексом прогностических признаков по программам химио- и лучевой терапии, применявшимся в РОНЦ в анализируемые исторические этапы.
*
Как работает хирургический робот да Винчи
Работа хирургического робота da Vinci полностью контролируется опытным хирургом через небольшие разрезы размером не более 2 см. Видеокамера эндоскопа, введенная через одно из разрезов, транслирует врачу детальное трехмерное изображение органа. В результате, врач может тщательно спланировать операцию. Хирург управляет инструментами, которые имеют 7 степеней свободы движения, благодаря технологии «EndoWrist» и контролирует их движения внутри тела пациента дистанционно с помощью специальных джойстиков. Проведение операции с использованием робота da Vinci требует высокой квалификации хирурга и специальных навыков.