Фармакологические свойства
Фармакодинамика. тизанидин — релаксант скелетных мышц центрального действия. основной точкой приложения его влияния является спинной мозг. стимулируя пресинаптические α2-адренорецепторы, он угнетает высвобождение аминокислот, которые стимулируют рецепторы n-метил-d-аспартата (nmda-рецепторы). в результате подавляется полисинаптическая передача сигнала на уровне межнейронных связей в спинном мозге, которая отвечает за избыточный тонус мышц, и тонус мышц снижается. сирдалуд эффективен как при острых болезненных спазмах мышц, так и при хронической спастичности спинномозгового и церебрального происхождения. он снижает сопротивление пассивным движениям и подавляет спазм и клонические судороги и улучшает силу активных сокращений мышц.
Фармакокинетика
Всасывание и распределение. Тизанидин быстро всасывается. Cmax в плазме крови достигается приблизительно через 1 ч после применения. Средняя абсолютная биодоступность составляет 34%. Средний объем распределения стабильного состояния (Vss) после в/в применения составляет 2,6 л/кг массы тела. Связывание с белками плазмы крови — 30%. Относительно низкое среди пациентов отклонение фармакокинетических параметров (Cmax и AUC) облегчает достоверную предварительную оценку уровней в плазме крови после применения перорально.
Метаболизм/выведение. Препарат подвергается быстрому и экстенсивному метаболизму в печени. Тизанидин метаболизируется in vitro преимущественно CYP 1A2. Метаболиты неактивны. Они выделяются преимущественно почками (70%). Выведение суммарной радиоактивности (то есть субстанции в неизмененном виде и метаболитов) двухфазное, с быстрой начальной фазой (T½ — 2,5 ч) и более медленной фазой элиминации (T½ — 22 ч). Только небольшое количество субстанции в неизмененном виде (около 2,7%) выделяется почками. Средний T½ субстанции в неизмененном виде составляет 2–4 ч.
Фармакокинетика у отдельных групп больных. У больных с почечной недостаточностью (клиренс креатинина 25 мл/мин) среднее значение Cmax в плазме крови вдвое превышает этот показатель у здоровых добровольцев, а конечный T½ увеличивается приблизительно до 14 ч, в результате чего AUC увеличивалась в среднем в 6 раз.
Исследований у пациентов с нарушениями функции печени не проводили.
Тизанидин метаболизируется изоферментом CYP 1A2 в печени. У пациентов с нарушениями функции печени могут проявляться более высокие концентрации субстанции в плазме крови.
Сирдалуд противопоказан лицам с тяжелыми нарушениями функции печени.
Фармакокинетические данные о пациентах пожилого возраста ограничены.
Пол не влияет на фармакокинетические свойства тизанидина.
Влияние этнической и расовой принадлежности на фармакокинетику тизанидина не изучали.
Влияние пищи. Одновременный прием пищи не влияет на фармакокинетический профиль таблеток Сирдалуд. Хотя значение Cmax возрастает на треть, это не является клинически значимым. Существенного влияния на всасывание не отмечено.
Возможности применения препарата тизанидин (Сирдалуд®) у пациентов с постинсультной спастичностью
Постинсультная спастичность в значительной степени ограничивает двигательные возможности пациентов, затрудняет уход за больным, способствует формированию болевых синдромов. В статье представлен современный взгляд на патофизиологию постинсультной спастичности, обсуждаются подходы к лечению. Рассматриваются механизмы действия и возможности препарата тизанидин (Сирдалуд®) для коррекции повышенного мышечного тонуса у пациентов, перенесших инсульт. Сравнивается эффект тизанидина с эффектом других миорелаксантов.
Введение
Спастичность является одним из наиболее распространенных двигательных дефектов у пациентов, перенесших инсульт. В течение первого года после инсульта спастичность отмечают 17–43% пациентов [1, 2]. Как правило, спастичность сопровождается парезом соответствующих мышц, однако строгой взаимосвязи между указанными симптомами нет.
Для гемипареза – классического клинического примера спастического пареза после инсульта – характерно формирование позы Вернике – Манна: плечо приведено к туловищу, предплечье согнуто, кисть пронирована и согнута, бедро и голень разогнуты, стопа в положении подошвенного сгибания. Из-за «удлинения» ноги больной вынужден при ходьбе заносить ее через сторону, описывая полукруг. Данные изменения возникают вследствие повышения тонуса преимущественно в антигравитационных группах мышц. Однако в ряде случаев наблюдаются другие варианты распределения повышенного мышечного тонуса, например гиперпронация предплечья с разгибанием пальцев, причудливые установки кисти и пальцев, повышение тонуса в мышцах-сгибателях ноги, гиперсупинация предплечья и разгибателей кисти [3].
Чаще всего спастичность выявляется одновременно в верхней и нижней конечностях (68%), однако возможно и изолированное появление данного симптома в руке (15%) или ноге (18%) [4].
Патофизиология спастичности
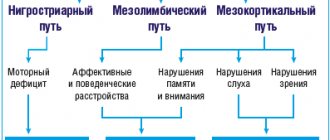
На сегодняшний день вопрос патогенеза постинсультной спастичности остается открытым. Известно, что данный симптом возникает вследствие структурных и функцио-нальных изменений в центральной нервной системе и на уровне периферического нейромоторного аппарата. Так, при спастичности наряду с активацией корковых зон, участвующих в организации движения, и экстрапирамидных путей ствола головного мозга происходит структурно-функциональная реорганизация сегментарных структур спинного мозга. Кроме того, изменения нейронального контроля периферической части двигательного аппарата активируют процессы трансформации белкового состава мягких тканей, прежде всего скелетных мышц.
В ответ на нарушение мозгового кровообращения и развитие структурного и функционального дефекта головного мозга меняется функциональная активность коры как с пораженной, так и с клинически интактной стороны. Кроме того, происходит формирование новых нейрональных связей, расширяется зона представленности пораженной части тела в моторной и сенсорной коре. При этом возникает дисбаланс между внутрикорковым возбуждением и торможением в сторону преобладания возбуждения [5–7]. В ответ на указанные изменения активируются экстрапирамидные пути ствола головного мозга, которые начинают генерировать спонтанную активность, не связанную с моторной активностью коры [6].
Главными возбуждающими медиаторами нервной системы, участвующими в регуляции мышечного тонуса, являются глутамат и аспартат, основным тормозным нейротрансмиттером – гамма-аминомасляная кислота (ГАМК). Определенную роль в реализации нарушений мышечного тонуса играют серотонин-ергические и норадренергические системы ствола головного мозга, которые могут оказывать как возбуждающее, так и тормозное влияние на уровне спинальных нейрональных сетей [8].
Изменение функционального взаимодействия между различными отделами центральной нервной системы приводит к реорганизации сегментарного аппарата спинного мозга. Образуются новые контакты между нейронами спинного мозга и нисходящими путями головного мозга, что сопровождается повышением рефлекторной возбудимости на сегментарном уровне и реализуется клинически формированием «динамических» феноменов спастичности в виде клонусов и синкинезий [6].
Одним из методов оценки функционального состояния сегментарного аппарата спинного мозга является изучение параметров Н-рефлекса (ответ мышцы на раздражение чувствительных волокон периферического нерва). Установлено, что при спастичности зона вызывания Н-рефлекса значительно расширяется [9].
Нарушение нейронального контроля скелетных мышц приводит к трансформации их белковой структуры, прежде всего миозинового фенотипа, а также к изменению свойств окружающих мягких тканей (сухожилий и капсул суставов). В результате в мышце значительно увеличивается доля «быстрых», но легкоутомляемых волокон, а ретракция сухожилий приводит к формированию контрактур [8, 10].
Спастичность различных групп мышц неодинаково влияет на двигательную активность пациента. Например, спастичность четырехглавой мышцы бедра в условиях пареза может способствовать поддер-жанию вертикальной позы за счет сохранения опорной функции ноги. В то же время спастичность мышц кисти всегда ограничивает ее функциональные возможности. В целом постинсультная спастичность негативно сказывается на двигательной активности и обычно сопровождается рядом динамических двигательных феноменов: непроизвольными движениями, клонусами или спазмами, спастическими синкинезиями. Помимо ухудшения двигательных функций постинсультная спастичность может способствовать развитию постинсультного болевого синдрома в области плеча, распространенность которого варьирует от 16% в раннем восстановительном периоде до 36% в позднем восстановительном периоде [11].
Выраженность клинической симп-томатики при постинсультной спастичности и ее влияние на качество жизни оцениваются врачом, пациентом, а также лицами, ухаживающими за больным. Прежде всего определяется степень спастичности в покое, для чего используется шкала Эшуорта, потом оценивается функциональное состояние конечности при движениях, а также наличие сопутствующих спастичности симптомов (боли, неприятных ощущений, патологических синкинезий). С учетом всех перечисленных факторов разрабатывают план лечебных мероприятий.
Лечение
Пациентам с постинсультной спастичностью показано проведение как немедикаментозного, так медикаментозного лечения.
Немедикаментозное лечение включает физические упражнения, лечение положением, использование ортезов, массаж, теплолечение, криотерапию, электромиостимуляцию, методы биологической обратной связи [3, 12]. Поскольку данные мероприятия, как правило, имеют непродолжительный эффект, их следует проводить постоянно, не ограничиваясь одним-двумя курсами в год. В этой связи необходимо обучать больных и ухаживающих за ними лиц методикам, применение которых возможно в домашних условиях.
Оптимальным медикаментозным методом коррекции локальной спастичности считаются местные инъекции препаратов ботулотоксина, который состоит из нейротоксина типа А и некоторых других белков. Ботулотоксин блокирует высвобождение ацетилхолина в синаптическую щель. К наиболее значимым результатам ботулинотерапии относятся улучшение ходьбы и расширение возможностей самообслуживания. Эффект развивается через четыре – семь дней и сохраняется в большинстве случаев на протяжении 12–16 недель [13]. Однако максимальная эффективность действия препарата достигается при его введении под контролем электромиографии, что не всегда доступно. Кроме того, инъекции препарата не рекомендованы пациентам, принимающим терапевтические дозы антикоагулянтов [13]. В целом, несмотря на развитие помощи больным, перенесшим инсульт, на сегодняшний день возможности ботулинотерапии ограниченны.
Еще одним методом локального воздействия является применение алкогольного и фенольного невролиза моторных ветвей нервов, что приводит к необратимой их деструкции и фиброзу окружающих тканей. Процедура проводится под контролем электромиографии и/или ультразвукового исследования [13]. Недостаток данного метода – побочные эффекты в виде дизестезии, слабости и локальной отечности в месте инъекции [1]. В настоящее время невролиз применяется редко (преимущественно у лежачих пациентов), как правило, в сочетании с ботулинотерапией. Эффект сохраняется от двух до 36 месяцев [13].
Из пероральных медикаментозных средств первой линии, используемых при постинсультной спастичности, в международных рекомендациях указываются миорелаксанты центрального действия: тизанидин и баклофен. Возможно также применение толперизона, диазепама, габапентина [13]. При лечении церебральной спастичности наиболее часто используют тизанидин, при спинальной спастичности – тизанидин и баклофен [14].
Тизанидин в лечении постинсультной спастичности
Тизанидин (Сирдалуд®) – центральный агонист имидазолиновых и альфа-2-адренорецепторов как на спинальном, так и на супраспинальном уровне [13, 15]. Тизанидин усиливает пресинаптическое ингибирование мотонейронов за счет снижения высвобождения возбуждающих аминокислот (аспартата и глутамата) из спинальных интернейронов, а также за счет ингибирования активности облегчающих цереброспинальных путей. Помимо этого тизанидин препятствует высвобождению субстанции Р тонкими чувствительными волокнами, способствует снижению функциональной активности области голубого пятна в стволе головного мозга и снижению возбудимости сегментарного аппарата спинного мозга [16].
Контролируемые клинические исследования показали эффективность тизанидина при постинсультной спастичности. Так, одно из исследований показало, что тизанидин в дозе 8 мг/сут снижает уровень фасилитации Н-рефлекса у всех пациентов (n = 14) с постинсультной спастичностью. Этого не происходит при использовании плацебо. Снижение фасилитации наблюдалось как на пораженной, так и на клинически интактной стороне. В то же время при приеме тизанидина не отмечается изменение показателя Нmax/Мmax и порога вызывания Н-рефлекса, что, вероятно, свидетельствует об отсутствии влияния препарата на возбудимость спинальных мотонейронов. Наблюдалось достоверное уменьшение степени спастичности с 2,9 до 1,9 балла по шкале Эшуорта [17].
В нескольких исследованиях был выявлен дозозависимый антиспастический эффект тизанидина. В группе пациентов с рассеянным склерозом (n = 17) и степенью спастичности в нижних конечностях два-три балла по шкале Эшуорта была показана связь между концентрацией препарата в крови и его антиспастическим эффектом. При этом связи между определенными значениями концентрации препарата и антиспастическим эффектом в обследованной группе выявлено не было, что свидетельствует о необходимости индивидуального подбора дозы. Было отмечено, что эффект 2 мг тизанидина не отличался от такового при назначении плацебо. Так, степень спастичности через два часа после приема 2 мг препарата снижалась на 29% (при приеме плацебо – на 28%), при приеме 8 мг тизанидина – на 38%. Антиспастический эффект не сопровождался снижением мышечной силы. В указанном исследовании данные клинической оценки степени спастичности подтверждались результатами количественного исследования мышечного тонуса с помощью электрогониометра (прибор показал высокую степень чувствительности и надежности) [8].
Зависимость антиспастического эффекта от дозы тизанидина у пациентов с постинсультной спастичностью изучалась в мультицентровом исследовании, включавшем 47 пациентов, степень спастичности составляла два-три балла по шкале Эшуорта, время после инсульта – шесть месяцев [16]. Проводилось титрование дозы препарата с доведением ее до 36 мг (достижение максимальной дозировки у 21% пациентов). В результате приема тизанидина за 16 недель снизились степень спастичности без изменения мышечной силы, интенсивность болевого синдрома и, как следствие, улучшилось качество жизни пациентов [16].
Таким образом, в исследованиях подтвержден дозозависимый клинический эффект препарата, лечение спастичности требует применения более высоких доз тизанидина, нежели лечение болевых синдромов. Отсутствие эффекта в некоторых случаях может быть обусловлено недостаточной дозой препарата [8, 18].
Анализ результатов нескольких исследований, изучавших антиспастический эффект тизанидина в сравнении с плацебо и другими пероральными миорелаксантами, показал снижение степени спастичности при приеме тизанидина на 21–37%, в то время как для плацебо данный показатель варьировал от 4 до 9%. При этом тонус мышц снизился у 60–80% пациентов в группе тизанидина, у 60–65% в группе баклофена, у 60–83% в группе диазепама. Переносимость препарата была оценена как очень хорошая у 44–100% пациентов в группе тизанидина, у 38–90% в группе баклофена и 20–54% в группе диазепама. При этом в группе тизанидина пациенты не ощущали нарастания мышечной слабости в отличие от пациентов, принимавших баклофен. Все препараты вызывали сонливость [19]. По совокупности показателей эффективности и переносимости тизанидин продемонстрировал выраженные преимущества в лечении постинсультной спастичности по сравнению с другими пероральными миорелаксантами [16, 19, 20].
Исследования, в которых сравнивалось лечебное воздействие тизанидина и ботулотоксина при постинсультной спастичности в верхней конечности, показали, что оба препарата являются эффективными. При этом для достижения оптимальных результатов необходимо точно соблюдать дозировки и определять места инъекций ботулотоксина [18]. В другом исследовании изучалось совместное применение ботулотоксина с пероральными антиспастическими препаратами в группе детей с детским церебральным параличом. Установлено, что комбинация ботулотоксина с тизанидином является более эффективной, чем комбинация ботулотоксина и баклофена [21].
При приеме внутрь тизанидин быстро всасывается, максимальная концентрация в плазме крови достигается через один-два часа. Оптимальный терапевтический эффект, как правило, развивается при назначении препарата в суточной дозе 12–24 мг, разделенной на три приема; диапазон эффективных доз составляет 2–36 мг [22]. Максимальная суточная доза составляет 36 мг. Увеличение и снижение дозировки следует проводить постепенно. Метаболизируется тизанидин в печени преимущественно изоферментом СYP1А2. Следует помнить: такие препараты, как ципрофлоксацин и флувоксамин, ингибируют данный фермент, в результате чего может значительно усилиться гипотензивное действие тизанидина. Особую осторожность следует проявлять при сочетании препарата с антигипертензивными средствами. Резкое прекращение приема тизанидина может приводить к развитию синдрома отмены, особенно при длительном лечении совместно с антигипертензивными препаратами.
Чаще всего на фоне приема тизанидина наблюдаются такие побочные эффекты, как сонливость, головокружение, снижение артериального давления. Возможно также появление общей слабости, сухости во рту, нарушение сна, галлюцинации [8, 17]. Следует отметить, что все побочные эффекты являются дозозависимыми и могут быть минимизированы при правильном титровании дозы. При их появлении следует снизить дозировку до предыдущего уровня на несколько дней, после чего возобновить наращивание дозы [8]. Как правило, при плохой переносимости побочные эффекты появляются уже при минимальных дозировках препарата [8, 22].
В настоящее время тизанидин доступен также в дозировке 6 мг в форме капсул с модифицированным высвобождением (Сирдалуд® МР). Для большинства пациентов оптимальной является доза 12 мг/сут, в редких случаях – 24 мг/сут [22]. Лечение начинают с одной капсулы в сутки, при необходимости дозу увеличивают с частотой раз в семь дней. Следует отметить, что Сирдалуд® МР показал высокую эффективность в отношении центральной сенситизации при развитии постинсультного болевого синдрома в области плеча [11].
Другие миорелаксанты
Еще одним препаратом первой линии для лечения постинсультной спастичности является баклофен – агонист рецепторов В-типа ГАМК, расположенных в зоне окончаний первичных сенсорных афферентов спинного мозга. Усиливая поляризацию мембран интернейронов, баклофен препятствует току кальция в пресинаптические терминали и высвобождению эндогенных трансмиттеров, за счет чего происходит ингибирование моно- и полисинаптических рефлексов спинного мозга [13].
Максимальная дозировка составляет 120 мг/сут, изменение дозы в большую или меньшую сторону следует проводить раз в неделю и не более чем на 15 мг. Побочные эффекты баклофена также являются дозозависимыми: чаще всего отмечаются общая слабость, сонливость. В экспериментальных исследованиях на животных показано, что ГАМКергические препараты могут снижать пластичность мозга в раннем восстановительном периоде после инсульта, в связи с чем нежелательно назначать их в указанное время. Препарат также не рекомендован пожилым пациентам из-за развития выраженной сонливости [13].
Следует обратить внимание на возможность интратекального введения баклофена с помощью помпы. Это высокоэффективный метод лечения при выраженной спастичности, в том числе у пациентов, перенесших инсульт, который значительно снижает частоту побочных эффектов. Однако данный метод используется относительно редко, что связано с высокой стоимостью оборудования [13].
В нашей стране широко применяется толперизон – миорелаксант центрального действия, близкий по структуре к лидокаину. Препарат стабилизирует мембраны нервных клеток. Применение толперизона показало высокую эффективность и безопасность в отношении снижения мышечного тонуса при спастичности в нескольких контролируемых исследованиях [23, 24].
В России проведено сравнительное исследование эффективности различных миорелаксантов у пациентов с постинсультной спастичностью, по результатам которого было показано уменьшение степени спастичности и улучшение бытовой адаптации у пациентов, принимавших толперизон и тизанидин. При этом толперизон назначался в дозе до 900 мг/сут. В ходе исследования существенных побочных эффектов при приеме толперизона выявлено не было [23]. Однако крупных международных исследований в отношении данного препарата при постинсультной спастичности не проводилось. Лечение толперизоном целесообразно начинать с суточной дозы 300 мг, которая при необходимости может быть увеличена до 900 мг.
Другими пероральными лекарственными препаратами, применяемыми для снижения мышечного тонуса при спастичности, являются бензодиазепины, габапентин и дантролен (в России не зарегистрирован). Однако данных об их эффективности при постинсультной спастичности получено не было [13].
В литературе обсуждается возможность комбинации различных миорелаксантов с целью достижения максимального эффекта. Доказательной базы для рекомендации каких-либо сочетаний препаратов на сегодняшний день нет, при этом повышается вероятность суммации побочных эффектов, в связи с чем попытки комбинировать пероральные миорелаксанты представляются нерациональными [13].
Заключение
Вне зависимости от степени выраженности постинсультной спастичности следует помнить, что спастичность значительно нарастает при наличии болевых синдромов, пролежней, констипации, инфекции мочевыводящих путей. Лечение указанных состояний, а также обеспечение комфортной обстановки являются необходимыми условиями коррекции спастичности и улучшения качества жизни пациента. Фармакологическое лечение должно подбираться индивидуально и проводиться длительно. Дозу выбранного препарата следует наращивать постепенно до достижения клинического эффекта. В отсутствие значимого эффекта от пероральных медикаментозных средств необходимо рассмотреть вопрос о комбинации фармакотерапии и хирургических методов лечения постинсультной спастичности.
Применение
Сирдалуд имеет узкий терапевтический диапазон и высокую вариабельность концентрации тизанидина в плазме крови у разных пациентов. поэтому важным является применение его в оптимальных дозах согласно потребности пациента. начинать лечение следует с низкой дозы в 2 мг, что делает риск возникновения нежелательных эффектов от приема препарата минимальным. при необходимости дозу препарата можно постепенно повышать с соблюдением всех требуемых предосторожностей.
Взрослые
Облегчение болезненных мышечных спазмов. Применяют 2–4 мг 3 раза в сутки. В тяжелых случаях перед сном можно принять дополнительную дозу 2 или 4 мг.
Спастичность при неврологических нарушениях. Дозу следует подбирать индивидуально для каждого пациента.
Начальная суточная доза не должна превышать 6 мг, разделенных на 3 приема. Ее можно повышать постепенно до 2–4 мг 2 раза с интервалами 3–7 дней. Обычно оптимальный терапевтический эффект достигается при суточной дозе 12–24 мг, разделенной на 3 или 4 приема. Не следует превышать общую суточную дозу 36 мг.
Особые популяции пациентов
Применение у детей и подростков. Опыт применения препарата Сирдалуд у детей и подростков ограничен, поэтому не рекомендуется к использованию у этой категории пациентов.
Применение у лиц пожилого возраста. Опыт применения препарата у больных пожилого возраста ограничен, поэтому следует соблюдать осторожность при применении препарата Сирдалуд у этой категории пациентов. Рекомендуется начинать лечение с минимальной дозы и постепенно с осторожностью повышать его «малыми шагами» до достижения оптимального соотношения индивидуальной переносимости и терапевтической эффективности препарата.
Применение у пациентов с нарушением функции почек. Для пациентов с нарушениями функции почек (клиренс креатинина 25 мл/мин) рекомендуемая начальная разовая суточная терапевтическая доза составляет 2 мг. Повышение дозы происходит постепенно и с осторожностью, «малыми шагами», до достижения оптимального соотношения индивидуальной переносимости и терапевтической эффективности препарата. С целью повышения терапевтической эффективности следует сначала повысить разовую дозу, прежде чем перейти к более частому приему препарата в течение суток.
Применение у пациентов с нарушением функции печени. Лечение лиц с тяжелыми нарушениями функции печени противопоказано. Сирдалуд в значительной степени метаболизируется в печени. Сирдалуд следует с осторожностью применять при лечении пациентов с умеренно выраженными нарушениями функции печени. Лечение требуется начинать с минимальной дозы, возможное повышение дозы необходимо проводить с осторожностью и с учетом индивидуальной переносимости пациентом препарата Сирдалуд.
Прерывание лечения. В случае необходимости прерывания лечения дозу следует снижать медленно и постепенно. Особенно это касается пациентов, применявших препарат в повышенной дозе в течение длительного времени. Таким образом снижается риск развития рикошетного повышения АД и тахикардии.
Сравнение удобства применения Тизанидин-тевы и Сирдалуда
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Тизанидин-тевы примерно одинаковое с Сирдалудом. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-04 13:48:04
Побочные эффекты
Побочные реакции — такие как сонливость, усталость, головокружение, сухость во рту, сниженное ад, тошнота, нарушения со стороны пищеварительного тракта и повышенные уровни трансаминаз в плазме крови — обычно слабо выражены и преходящи у пациентов, применяющих препарат в низких дозах, рекомендуемые для купирования болезненного мышечного спазма.
При приеме в дозах, превышающих рекомендуемые, для устранения спастичности вышеперечисленные побочные реакции возникают чаще и более выражены, однако они редко бывают настолько серьезными, чтобы прекратить лечение. Также могут возникнуть такие побочные реакции: артериальная гипотензия, брадикардия, мышечная слабость, нарушение сна, галлюцинации и гепатит.
Появление таких симптомов зарегистрировано после внезапной отмены тизанидина, особенно после длительного лечения и/или приема в высоких суточных дозах и/или сопутствующей терапии антигипертензивными препаратами. При таких обстоятельствах у пациентов могут возникнуть АГ и тахикардия. В отдельных случаях такая рикошетная АГ может вызвать инсульт. Поэтому лечение тизанидином не следует прекращать внезапно, а только путем постепенного снижения дозы.
Для оценки частоты возникновения различных побочных реакций использовали следующую классификацию: очень часто (≥1/10), часто (≥1/100, 1/10), нечасто (≥1/1000, 1/100), редко (≥1/10 000, 1/1000), очень редко (1/10 000), включая отдельные сообщения.
Психические нарушения: часто — бессонница, нарушение сна.
Со стороны ЦНС: очень часто — сонливость, головокружение; частота неизвестна — спутанность сознания, вертиго.
Со стороны сердца: нечасто — брадикардия
Со стороны сосудистой системы: часто — артериальная гипотензия; незначительное снижение АД.
Со стороны пищеварительного тракта: очень часто — сухость во рту, гастроинтестинальные расстройства; часто — тошнота.
Гепатобилиарные нарушения: часто — повышенные уровни трансаминаз в плазме крови.
Со стороны костно-мышечной системы: очень часто — мышечная слабость.
Общие нарушения: очень часто — повышенная утомляемость.
Постмаркетинговые исследования
О дополнительных побочных реакциях на препарат сообщалось в пострегистрационных исследованиях.
Сообщения об этих побочных реакциях поступали от неопределенного числа пациентов, поэтому невозможно достоверно оценить их частоту.
Со стороны иммунной системы: реакции повышенной чувствительности (включая анафилаксию, отек горла, одышку и крапивницу).
Психические нарушения: галлюцинации, спутанность сознания.
Со стороны ЦНС: вертиго.
Со стороны сердечно-сосудистой системы: синкопе.
Со стороны органа зрения: затуманивание зрения.
Гепатобилиарные нарушения: гепатит, печеночная недостаточность.
Со стороны кожи и подкожной клетчатки: сыпь, эритема, зуд, дерматит.
Общие нарушения: астения, синдром отмены.
Особые указания
Одновременное применение cyp 1a2 ингибиторов с тизанидином не рекомендуется.
После внезапной отмены препарата или быстрого снижения дозы у пациентов могут возникнуть АГ и тахикардия. В отдельных случаях такая рикошетная АГ может вызвать инсульт. Лечение тизанидином не следует прекращать внезапно, а только постепенно снижая дозу.
Для пациентов с почечной недостаточностью (клиренс креатинина 25 мл/мин) начальная доза составляет 2 мг 1 раз в сутки. Дозу следует повышать последовательно, небольшими «шагами», с учетом эффективности и переносимости. Для достижения более выраженного эффекта рекомендуется сначала повысить дозу, назначаемую 1 раз в сутки, после чего увеличивать кратность приема.
Сообщалось о печеночной недостаточности, связанной с применением тизанидина, однако у пациентов, получавших суточные дозы до 12 мг, это отмечали редко. В связи с этим рекомендуется контролировать функцию печени 1 раз в месяц в течение первых 4 мес терапии у пациентов, применявших тизанидин в дозе ≥12 мг, и у пациентов с клиническими симптомами, указывающими на печеночную недостаточность (например тошнота, потеря аппетита или повышенная утомляемость неизвестной этиологии). Применение препарата Сирдалуд следует прекратить, если уровень АлАТ или АсАТ в плазме крови превышает верхнюю границу нормы в ≥3 раза в течение длительного периода.
Рекомендуется проведение тщательного мониторинга пациентов в течение 1 или 2 дней после приема первой дозы тизанидина. В случае развития анафилаксии или отека горла с анафилактическим шоком или одышкой применение препарата Сирдалуд следует немедленно прекратить и назначить пациенту необходимое лечение.
Артериальная гипотензия может возникнуть при применении тизанидина, а также как результат лекарственного взаимодействия с ингибиторами CYP 1A2 и/или антигипертензивными препаратами. Сообщалось о тяжелых формах артериальной гипотензии, таких как потеря сознания и циркуляторный коллапс.
Следует соблюдать осторожность при применении данного препарата со средствами, удлиняющими интервал Q–T (например цизаприд, амитриптилин, азитромицин).
Осторожность необходима для пациентов с ИБС и/или сердечной недостаточностью. Следует проводить контроль ЭКГ с регулярными интервалами в начале применения препарата Сирдалуд у этих пациентов.
Перед применением данного препарата пациентам с миастенией gravis необходимо тщательно оценивать соотношение риск/польза.
Опыт применения у детей и подростков ограничен, поэтому применение препарата Сирдалуд не рекомендуется у этой категории пациентов.
Следует соблюдать осторожность при применении данного препарата у лиц пожилого возраста.
Таблетки Сирдалуд содержат лактозу. Пациентам с редкими наследственными заболеваниями — непереносимостью галактозы, тяжелой недостаточностью лактазы или глюкозо-галактозным синдромом мальабсорбции — таблетки Сирдалуд применять не рекомендуется.
Применение в период беременности и кормления грудью
Женщины детородного возраста. Женщины детородного возраста, которые живут половой жизнью, должны провести тест на беременность до начала лечения препаратом Сирдалуд. Женщинам детородного возраста следует сообщить, что результаты исследований на животных свидетельствуют о том, что Сирдалуд негативно воздействует на плод. Женщины детородного возраста, которые живут половой жизнью, должны применять эффективные методы контрацепции (методы, которые допускают беременность в менее чем 1% случаев) на протяжении всего периода лечения препаратом Сирдалуд и в течение 1 дня после прекращения лечения препаратом.
Беременность. Данные о применении препарата Сирдалуд у беременных ограничены, поэтому не следует назначать в период беременности, за исключением тех случаев, когда потенциальная польза для матери превышает возможный риск для плода.
Кормление грудью. При применении тизанидина у крыс и кроликов тератогенного действия не наблюдали. Опыты на животных показали, что тизанидин проникает в грудное молоко в незначительном количестве. Поэтому женщинам, кормящим грудью, назначать препарат не следует.
Фертильность. Не отмечено нарушения фертильности у самцов крыс, получавших препарат в дозе 10 мг/кг/сут и у самок крыс, получавших препарат в дозе 3 мг/кг/сут. Снижение фертильности выявлено у самцов крыс, получавших препарат в дозе 30 мг/кг/сут, и у самок крыс, получавших препарат в дозе 10 мг/кг/сут. При применении препарата в этих дозах также отмечены седация, уменьшение массы тела и атаксия.
Дети. Опыт применения препарата в педиатрии ограничен. Назначать Сирдалуд детям не рекомендуется.
Способность влиять на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Тизанидин может вызвать сонливость, головокружение и/или артериальную гипотензию, таким образом ослабляя способность пациента управлять транспортными средствами или работать с механизмами. Риски возрастают при одновременном употреблении алкоголя.
Поэтому следует воздерживаться от деятельности, требующей высокой концентрации внимания и быстрой реакции, например от управления транспортными средствами или работы с машинами и механизмами.
Сравнение привыкания у Тизанидин-тевы и Сирдалуда
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром о, у Тизанидин-тевы достаточно схоже со аналогичными значения у Сирдалуда. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Тизанидин-тевы значения «синдрома о достотачно малое, впрочем также как и у Сирдалуда.
Взаимодействия
Одновременное применение известных ингибиторов cyp 1a2 может повысить уровень тизанидина в плазме крови. повышение уровня тизанидина в плазме крови может привести к появлению симптомов передозировки, таких как удлинение интервала q–t.
Одновременное применение известных индукторов CYP 1A2 может снижать уровень тизанидина в плазме крови. Снижение уровня тизанидина в плазме крови может привести к снижению терапевтического эффекта Сирдалуда.
Одновременное применение мощных ингибиторов CYP 1A2, таких как флувоксамин или ципрофлоксацин, с тизанидином противопоказано. Одновременное применение тизанидина с флувоксамином увеличивает AUC тизанидина в 33 раза, тогда как одновременное применение тизанидина с ципрофлоксацином увеличивает AUC тизанидина в 10 раз. Это может привести к клинически значимому и долговременному снижению АД, сопровождающемуся сонливостью, головокружением и сниженной психомоторной производительностью.
Одновременное применение тизанидина с другими ингибиторами CYP 1A2, такими как антиаритмические препараты (амиодарон, мексилетин, пропафенон), циметидин, некоторые фторхинолоны (эноксацин, пефлоксацин, норфлоксацин), рофекоксиб, пероральные контрацептивы и тиклопидин, не рекомендуется.
Повышение уровня тизанидина в плазме крови может вызвать симптомы передозировки, в том числе удлинение интервала Q–T.
Одновременное применение препарата Сирдалуд с антигипертензивными препаратами, включая диуретики, может иногда вызывать артериальную гипотензию и брадикардию. У некоторых пациентов, применявших одновременное лечение антигипертензивными препаратами, отмечали рикошетную АГ и рикошетную тахикардию при резкой отмене тизанидина. В отдельных случаях рикошетная АГ может вызвать инсульт.
Сочетанное применение препарата Сирдалуд с рифампицином может привести к 50% снижению концентрации тизанидина. Таким образом, терапевтический эффект может быть снижен при применении рифампицина в ходе терапии препаратом Сирдалуд, что может быть клинически значимым для некоторых пациентов. Длительного одновременного применения следует избегать, и если это необходимо, то требуется очень осторожно корригировать дозу.
Применение препарата Сирдалуд приводит к 30% снижению системного влияния тизанидина у курящих (более 10 сигарет в день). Длительное применение препарата у пациентов, которые много курят, требует применения препарата в более высоких дозах.
Одновременное применение препарата Сирдалуд и других лекарственных средств центрального действия (например седативных и снотворных средств (бензодиазепин или баклофен), некоторых антигистаминных препаратов и анальгетиков, психотропных средств, наркотических средств) может увеличивать выраженность эффектов каждого из препаратов и усиливать снотворный эффект Сирдалуда. Это касается, в частности, одновременного употребления алкоголя, что может непрогнозированно изменить или усилить эффект Сирдалуда и повысить риск возникновения побочных реакций, поэтому следует воздержаться от употребления алкоголя.
Применения препарата Сирдалуд одновременно с α2-адренергическими агонистами (например с клонидином) следует избегать в связи с их потенциальным аддитивным гипотензивным эффектом.
Сравнение эффективности Тизанидин-тевы и Сирдалуда
У Сирдалуда эффективность больше Тизанидин-тевы – это означает, что способность лекарственного вещества оказывать максимально возможное действие разное.
Например, если терапевтический эффект у Сирдалуда более выраженный, то у Тизанидин-тевы даже в больших дозах добиться данного эффекта невозможно.
Также скорость терапии – показатель быстроты терапевтического действия у Сирдалуда и Тизанидин-тевы тоже разное, как и биодоступность – количество лекарственного вещества, доходящее до места его действия в организме. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Передозировка
Получено очень мало сообщений относительно передозировки препарата сирдалуд. у всех пациентов, у которых зарегистрированы единичные случаи передозировки данного препарата, включая 1 пациента, который принял 400 мг препарата сирдалуд, выздоровление прошло без осложнений.
Симптомы: тошнота, рвота, артериальная гипотензия, брадикардия, удлинение интервала Q–T, головокружение, миоз, респираторный дистресс, кома, беспокойство, сонливость.
Лечение. Для выведения препарата из организма рекомендуется многократное применение активированного угля в высоких дозах. Форсированный диурез, возможно, ускорит выведение препарата. В дальнейшем следует проводить симптоматическое лечение.
Обратите внимание!
Описание препарата Сирдалуд табл. 4мг №30 на этой странице — упрощенная авторская версия сайта apteka911, созданная на основании инструкции/ий по применению. Перед приобретением или использованием препарата вы должны проконсультироваться с врачом и ознакомиться с оригинальной инструкцией производителя (прилагается к каждой упаковке препарата).
Информация о препарате предоставлена исключительно с ознакомительной целью и не должна быть использована как руководство к самолечению. Только врач может принять решение о назначении препарата, а также определить дозы и способы его применения.