ПИРИБЕДИЛ
Фармакологическое действие
Противопаркинсоническое средство. Механизм действия связан со стимуляцией допаминовых рецепторов преимущественно в ядрах экстрапирамидной системы. Увеличивает кровоснабжение тканей и стимулирует передачу нервных импульсов, что способствует улучшению мозгового метаболизма.
Оказывает вазодилатирующее действие, обусловленное влиянием на допаминовые рецепторы, расположенные в гладкой мускулатуре периферических сосудов.
Фармакокинетика
После приема внутрь пирибедил быстро абсорбируется из ЖКТ, Cmax достигается через 1 ч. Связывание с белками плазмы низкое. Характеризуется высокой степенью метаболизма с образованием 2 основных метаболитов — гидроксилированного и дегидроксилированного. Концентрация пирибедила в плазме крови снижается двухфазно — T1/2 от 1.7 ч до 6.9 ч. Выводится главным образом в виде метаболитов с мочой: почками — 68%, с желчью — 25%.
PIRIBEDIL (ПИРИБЕДИЛ) — Показания
Болезнь Паркинсона (как в виде монотерапии, так и в комбинации с леводопой), хронические нарушения когнитивной функции и нейросенсорный дефицит (в т.ч. расстройства внимания и памяти) при старческой деменции (в качестве дополнительной симптоматической терапии), перемежающаяся хромота вследствие облитерирующих заболеваний артерий нижних конечностей (в качестве дополнительной терапии), ишемические нарушения кровообращения глаза.
Режим дозирования
При приеме внутрь суточная доза составляет 50-250 мг. Частота и длительность применения зависят от показаний, реакции пациента на лечение, компонентов комбинированной терапии.
Побочное действие
Со стороны пищеварительной системы:
редко — тошнота, рвота, метеоризм.
Со стороны ЦНС:
редко — беспокойство, возбуждение.
Со стороны сердечно-сосудистой системы:
в отдельных случаях — ортостатическая гипотензия.
Противопоказания
Острый инфаркт миокарда, острая сосудистая недостаточность, повышенная чувствительность к пирибедилу.
Применение при беременности и кормлении грудью
Адекватных и хорошо контролируемых исследований безопасности применения пирибедила при беременности не проводилось.
В экспериментальных исследованиях
не установлено тератогенного действия пирибедила.
Особые указания
При применении у пациентов с артериальной гипертензией необходимо одновременное проведение антигипертензивной терапии.
Не следует применять одновременно с антагонистами допаминовых рецепторов.
Лекарственное взаимодействие
При одновременном применении с антагонистами допаминовых рецепторов возможно взаимное уменьшение эффективности.
Возможности применения пирибедила с точки зрения доказательной медицины
Первый неэрголиновый агонист дофаминовых рецепторов (АДР) — пирибедил был разработан в 1970-х годах для дополнительной терапии болезни Паркинсона (БП). На сегодняшний день по всему миру широко применяется таблетированная форма пирибедила замедленного действия. Показания к назначению пирибедила (Проноран
) за это время расширились и теперь выглядят следующим образом: болезнь Паркинсона (БП) (монотерапия ран- них стадий, комплексная терапия развернутых стадий); нарушения когнитивных функций и нейросенсорный дефицит; перемежающаяся хромота вследствие облитерирующих заболеваний артерий нижних конечностей; офтальмологические заболевания ишемического генеза (снижение остроты зрения, сужение поля зрения, снижение контрастности цветов и др.). Такое разноплановое применение препарата при заболеваниях, в патогенезе которых важную роль играет дофамин (рис. 1), обусловлено своеобразными механизмами действия, отличающими его от других АДР: частичный агонизм к дофаминовым D2- и D3-рецепторам; антагонизм к α2А- и α2С-адренорецепторам; низкое сродство к серотониновым 5-HT рецепторам (низкий риск развития психотических нарушений); незначительное сродство к гистаминергическим и холинергическим рецепторам.
Применение пирибедила при болезни Паркинсона
Основными направлениями фармакотерапии БП можно считать: нейропротективное лечение (предотвращение гибели клеток и замедление скорости нейродегенерации) и симптоматическую терапию (коррекцию двигательных и немоторных проявлений БП). Симптоматическая терапия БП
на сегодняшний день является ведущей и основывается на компенсации дофаминергического дефицита и коррекции двигательных симптомов паркинсонизма (гипокинезии, тремора покоя, ригидности). Предпринимаются также попытки воздействовать на другие звенья патогенеза БП (адренергический, холинергический, серотонинергический дисбаланс), обусловливающие дофаминорезистентные симптомы БП [1, 2]. Наиболее эффективным симптоматическим средством лечения БП остаются препараты леводопы, но в связи с рядом побочных эффектов в большинстве случаев (исключением является старческий возраст, наличие тяжелого моторного дефицита, непереносимость, противопоказания или неэффективность других противопаркинсонических средств) терапию БП не рекомендуется начинать непосредственно с препаратов леводопы. Предпочтение отдается АДР, ингибиторам МАО-В, амантадину [3], у которых предполагается нейропротективный эффект [4]. По мере прогрессирования БП назначение леводопы становится неизбежным, однако сочетание ее с другими противопаркинсоническими средствами дает возможность долгое время принимать небольшие дозы леводопы, тем самым снижая риск возникновения нежелательных явлений [5].
Эффективность пирибедила в отношении двигательных симптомов БП
(гипокинезии, ригидности, дрожания, постуральных расстройств) доказана в большой серии наблюдений [6–8]. Рабочая группа MDS-EBM (Международное общество по изучению БП и расстройств движения) оценила пирибедил как «эффективный» и «клинически полезный» для симптоматического лечения пациентов на ранних стадиях БП как в качестве монотерапии, так и в сочетании с леводопой. Из-за отсутствия результатов рандомизированных плацебо-контролируемых исследований «имеющихся доказательств недостаточно» для того, чтобы сделать вывод об эффективности пирибедила в лечении и предупреждении моторных флюктуаций [9].
Эффективность монотерапии
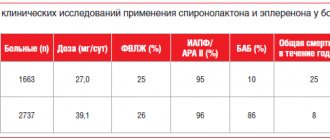
пирибедилом показана в двух крупных исследованиях. В плацебо-контролируемом исследовании REGAIN [10] нелеченые пациенты на ранней стадии БП в течение 7 мес. получали терапию пирибедилом (до 300 мг/день) или плацебо, было достигнуто улучшение в виде снижения суммарного балла на 4,9 (против ухудшения в группе плацебо на 2,6 балла) по Унифицированной рейтинговой шкале болезни Паркинсона (UPDRS) III субшкале двигательной активности (табл. 1) [10] и улучшение по UPDRS II субшкале повседневной активности. В другом, открытом исследовании участвовали 113 больных с БП, ранее не получавших лечения, результаты этого исследования подтвердили положительный эффект монотерапии пирибедилом относительно основных двигательных симптомов и настроения [11].
Эффективность пирибедила
в комбинации с препаратами леводопы
была оценена в 4-х плацебо-контролируемых [12–15] и ряде открытых исследований [16–20]. Результаты всех исследований показали достоверное уменьшение двигательных симптомов БП при присоединении пирибедила к терапии леводопой. При использовании средней дозы пирибедила 150 мг/день в течение 6 мес. уменьшились все основные двигательные симптомы: тремор — на 72,2%, ригидность — на 66,6%, гипокинезия — на 72,1% [13]. Ряд авторов подчеркивают преимущественное влияние препарата на тремор [9, 16], однако большинство исследований показывают эффективность в отношении всех моторных симптомов [21]. Эффективность пирибедила (150 мг/день) сравнивалась с бромокриптином (25 мг/день), в результате была показана одинаковая эффективность этих препаратов (через 12 мес. терапии произошло улучшение по UPDRS III: -7,9±9,7 и -8,0±9,5 соответственно) [22]. Влияние пирибедила на
моторные флюктуации
изучено недостаточно. Показано, что введение пирибедила реже приводит к развитию дискинезий у животных, и их интенсивность значительно ниже, чем при введении леводопы [23]. По данным плацебо-контролируемого исследования [24] однократная внутривенная инфузия пирибедила через 15 мин эффективно уменьшала двигательные расстройства по шкале UPDRS III и купировала состояние «выключения» у 7 из 10 пациентов. В другом плацебо-контролируемом перекрестном исследовании 30 пациентов по эффективности прерывания эпизодов «выключения» с помощью ородиспергируемой сублингвальной формулы пирибедил достоверно превосходил плацебо (-13 про- тив -7) [25]. Приведенные результаты свидетельствуют об эффективности пирибедила у пациентов с поздними стадиями БП и флюктуациями, но требуют дальнейшей проверки на более многочисленных выборках.
Действие пирибедила на немоторные симптомы БП
изучалось в исследованиях [22, 26, 27], в которых определялось положительное действие на эмоциональные, мотивационные и когнитивные нарушения. Авторами подчеркивается продолжительность оказываемого эффекта в течение года [22]. Схожие результаты получены в отечественном исследовании эффективности пирибедила (150–250 мг/день) у 60 пациентов с БП, у которых в течение 6 мес. терапии отмечалось улучшение нейродинамических характеристик, памяти и регуляторных функций [4]. При сравнении пирибедила с другими АДР, выявляется его превосходство в плане влияния на когнитивные функции. Например, в сравнительном исследовании пирибедила с бромокриптином достоверное улучшение по Висконсинскому тесту сортировки карточек (оценка исполнительных функций) показано при приеме пирибедила, но не бромокриптина [22]. Дополнительные преимущества пирибедила в отношении когнитивных функций авторы объясняли влиянием на кортико-лимбическую адренергическую и холинергическую трансмиссию [16]. Уменьшение депрессии у пациентов с БП на фоне приема пирибедила получено в ряде исследований [11, 28]. Антидепрессивный эффект препарата в данном случае очень полезен, поскольку тревожно-депрессивными расстройствами страдают приблизительно треть пациентов с БП [29]. Частое возникновение депрессии при БП во многом объясняется нейрохимическими нарушениями, главным образом дефицитом норадреналина и серотонина, возникающим при дегенерации ядер шва, а также недостатком дофаминергического возбуждения орбитофронтальной коры [30]. Умеренное по выраженности антидепрессивное действие пирибедила связывают с дофаминергическим влиянием на мезолимбическую систему, а также с норадренергическими эффектами (см. рис. 1). Многие пациенты с БП также имеют мотивационные нарушения и страдают от симптомокомплекса «анергия, ангедония, апатия». Этот комплекс выделяют отдельно от депрессии, скорее всего он имеет иную природу: такие пациенты не имеют характерных для депрессии черт (чувства печали, вины, безнадежности, пессимизма) и плохо отзываются на терапию традиционными антидепрессантами. Апатия наблюдается в среднем у 40–45% пациентов с БП, может возникнуть вне зависимости от депрессии и когнитивных нарушений. Данный симптом очень плохо поддается терапии, и обнаружение у пирибедила способности снижать его выраженность стало неожиданной и полезной находкой. Положительное влияние пирибедила (300 мг/день) на апатию и аффективные расстройства было показано в 12-недельном плацебо-контролируемом исследовании 37 пациентов с БП и апатией [26]: показатель апатии улучшился на 34,6% (в группе плацебо — на 3,2%) по шкале апатии Starkstein и на 46,6% (в группе плацебо ухудшился на 2,3%) по шкале апатии Robert Inventory score; показатель депрессии по шкале Бека улучшился на 19,8% (в группе плацебо ухудшился на 1,4%); показатель тревоги по шкале Бека улучшился на 22,8% (в группе плацебо — на 8,3%); показатель ангедонии по шкале Бека улучшился на 49% (в группе плацебо — на 5,6%). Предполагается, что апатия при БП развивается под влиянием мезолимбического дофаминергического дефицита. Таким образом, влияние пирибедила патогенетически обоснованно и скорее всего связано с действием на дофаминовые D3-рецепторы [23]. Следует подчеркнуть, что очень немногие препараты доказали свою эффективность в отношении апатии [31], и важно, что эффективность пирибедила доказана в рандомизированном двойном слепом плацебо-контролируемом исследовании.
Применение пирибедила при легких и умеренных когнитивных расстройствах различного генеза
Пирибедил (Проноран) выгодно отличается от множества других препаратов большой доказательной базой в плане терапии умеренных когнитивных расстройств (УКР). Его действие обусловлено недостаточностью дофаминергической и адренергической медиации, развивающейся в мозге в процессе нормального и патологического старения [32, 33]. Даже небольшая «возрастная» дофаминовая недостаточность играет значимую роль в снижении когнитивных функций у пожилых людей. Естественно, что при нейродегенеративных и цереброваскулярных заболеваниях гибель нейронов и медиаторная дисфункция увеличиваются во много раз, поэтому восполнение дофаминергического дефицита является полезным для любых вариантов УКР [34]. Поскольку пирибедил сочетает в себе дофаминергические и адренергические свойства, соответственно он улучшает не только дофаминергическую, но и норадренергическую передачу, которая не менее важна для когнитивной деятельности (поддержания активного бодрствования, адекватного уровня внимания, процессов запоминания). Такое сочетанное действие усиливает ноотропный эффект. Кроме того, показано, что на фоне применения Пронорана увеличивается церебральное и периферическое кровоснабжение, что важно для терапии пациентов с когнитивными нарушениями при цереброваскулярных заболеваниях [35]. Положительное влияние пирибедила при УКР различного генеза было показано более чем в 10 зарубежных клинических исследованиях с участием около 7000 пациентов и в значительном количестве отечественных работ, из которых наиболее известны: исследование эффективности Пронорана при легких и умеренных когнитивных нарушениях сосудистого характера с участием 29 пациентов — продемонстрировало достоверное уменьшение выраженности нарушений памяти, абстрагирования и нарушений праксиса [36]; исследование «Прометей» с участием более 2000 пациентов с дисциркуляторной энцефалопатией и УКР — через 12 нед. терапии Пронораном показало «умеренное» или «значительное» улучшение показателей когнитивных функций у 67% пациентов [37]; исследование «ФУЭТЕ» с участием 189 пациентов с УКР на фоне артериальной гипертензии и церебрального атеросклероза — обнаружило регресс объективных когнитивных расстройств и субъективных жалоб во всех 4-х сравниваемых терапевтических группах (Проноран, пирацетам, экстракт гинкго билобы, винпоцетин), однако выраженность улучшения была достоверно большей в группе Пронорана [38]; исследование эффективности Пронорана у 55 пациентов с УКР различной этиологии — показало умеренное/выраженное улучшение у пациентов как с дизрегуляторным (сосудистым) типом УКР (36 и 43% пациентов), так и с амнестическим (альцгеймеровским) типом УКР (44 и 36% пациентов) [39]; сравнительное исследование эффективности Пронорана с гинкго билоба (35 пациентов с УКР на фоне дисциркуляторной энцефалопатии в 3-х терапевтических группах (Проноран, Проноран + гинкго билоба, гинкго билоба) — показало достоверное улучшение в группе Пронорана, значительно превосходящее улучшение в группе монотерапии препаратом гинкго билоба [40]. За рубежом был проведен ряд многоцентровых рандомизированных плацебо-контролируемых исследований эффективности и безопасности пирибедила. В частности, 90-дневное двойное слепое исследование обнаружило улучшение когнитивных показателей по Краткой шкале оценки психического статуса (MMSE) [41, 42], положительное влияние на мышление (осмысление, рассуждение, разработка стратегий и решение проблем) [43]. В исследовании С. Corradino [44] было показано, что терапия Пронораном 50 мг в течение 3-х месяцев приводит к улучшению когнитивных функций на 33% (особенно памяти) и повышению уровня бодрствования на 34%. На фоне применения дозы 50 мг отмечается улучшение не только когнитивных функций, но и ряда сенсорных показателей астено-депрессивного характера, происходит достоверное уменьшение зрительных, слуховых расстройств и головокружений (у 41, 71 и 84% пациентов соответственно) [45, 46], депрессивной и тревожной симптоматики, пациенты меньше жалуются на забывчивость, головные боли, утомляемость, шум в голове. Таким образом, для терапии когнитивных расстройств не требуется назначения высоких доз препарата, достаточной является доза 50 мг (1 таблетка) в день. Данная дозировка считается эффективной и безопасной, хорошо переносится пациентами и не вызывает серьезных нежелательных реакций.
Побочные эффекты пирибедила
Побочные эффекты (ПЭ) пирибедила сравнимы по спектру и частоте возникновения с аналогичными показателями других неэрголиновых АДР [11]. Большинство ПЭ дозозависимые и уменьшаются или исчезают при уменьшении дозы принимаемого препарата. Наиболее частыми, по данным клинических исследований, являются желудочно-кишечные симптомы тошнота/рвота (0–33% случаев, по разным источникам) и гипотензия/головокружение (3–30%). Стратегия борьбы с данными ПЭ включает прием препарата после еды и прием блокатора периферических дофаминовых рецепторов домперидона, который устраняет дофаминергическое действие леводопы и АДР вне центральной нервной системы. Есть данные, что домперидон усиливает эффект пирибедила, вызывая более интенсивное и длительное повышение двигательной активности и уменьшение когнитивного дефицита [47]. Довольно распространенным ПЭ при терапии АДР являются приступы дневной сонливости (2–30%), однако различий между пирибедилом и плацебо в ряде работ не найдено [48]. Кроме того, в рандомизированном слепом исследовании было показано, что переход на пирибедил пациентов с БП, испытывающих внезапную дневную сонливость на терапии прамипексолом или ропиниролом, приводил к значительному сокращению сонливости, улучшению показателей шкалы сонливости Эпворта и общего впечатления от проводимого лечения, при отсутствии изменений двигательных характеристик [26]. Такие результаты позволяют предположить более низкий риск сонливости при использовании пирибедила, что объясняется дополнительными адренергическими свойствами, повышающими уровень бодрствования и внимания. Психические расстройства — еще один тип ПЭ, ожидаемый при назначении АДР, особенно у пожилых пациентов и при наличии когнитивного дефицита. В данном случае рекомендуется более длительное титрование и меньшие терапевтические дозы АДР. На терапии пирибедилом психотические расстройства наблюдались с различной частотой (4–23%), но нужно отметить, что в ряде исследований их уровень был сопоставим с уровнем у принимавших плацебо. Например, в исследовании О. Rascol et al. [25] о психиатрических нарушениях при приеме пирибедила сообщалось в 2,3% случаев, а плацебо — в 1,8% случаев. В другом сравнительном исследовании пирибедила (150 мг/день) и бромокриптина (25 мг/день) с леводопой у пациентов с ранними стадиями БП частота галлюцинаций на пирибедиле составила 8,1%, на бромокриптине — 2,8%, вышли из исследования в связи с этим ПЭ 2,9% и 1,4% пациентов соответственно [20].
Заключение
Подводя итоги, необходимо отметить, что применение пирибедила в терапии БП эффективно в качестве монотерапии на ранних стадиях и в сочетании с препаратами леводопы на развернутых стадиях. Не вызывает сомнения его благоприятное влияние на двигательные проявления БП, а также на ряд немоторных расстройств, предполагается его нейропротективное действие. Пирибедил не уступает по эффективности и переносимости другим неэрголиновым АДР, кроме того, имеет адренергические свойства, предполагающие дополнительные возможности воздействия на немоторные симптомы БП, такие как депрессия, апатия и когнитивный дефицит. Эффективность и безопасность применения пирибедила у пациентов с легким и умеренным когнитивным дефицитом на сегодняшний день подтверждена многократными клиническими исследованиями. Препарат оказывает положительное действие на когнитивные функции у большинства пациентов, улучшая мышление, память и внимание, кроме того, положительно влияет на нейросенсорный дефицит у пожилых. Рекомендуется начинать лечение как можно раньше, поскольку терапия пирибедилом эффективна на додементных стадиях когнитивных нарушений.
Болезнь Паркинсона (БП) — хроническое прогрессирующее заболевание головного мозга, связанное с дегенерацией дофаминергических нейронов черной субстанции и образованием внутриклеточных телец Леви. БП проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психические, вегетативные, сенсорные и др.).
По данным разных исследователей, распространенность БП в среднем составляет 100 случаев на 100 000 населения. Заболеваемость Б.П. увеличивается с возрастом и достигает 55 человек на 100 000 у 70-летних и 220 на 100 000 в возрасте старше 85 лет [1, 2].
В последние годы для лечения БП на разных стадиях все чаще применяются агонисты дофаминовых рецепторов (АДР), которые благодаря своим химическим свойствам напрямую стимулируют дофаминовые рецепторы, воспроизводя эффект дофамина. С 1971 г. они сначала назначались больным БП в качестве дополнения к леводопе, однако в последующем было установлено, что на ранних стадиях БП АДР обладают сопоставимым по эффективности с леводопой действием. Кроме того, их раннее назначение приводит к уменьшению риска возникновения моторных флюктуаций и лекарственных дискинезий. С их помощью эффективно контролируют основные симптомы БП, в том числе и тремор, они уменьшают выраженность депрессии и тревоги.
АДР не взаимодействует с белками пищи при транспорте через желудочно-кишечный тракт и гематоэнцефалический барьер в отличие от препаратов леводопы. Кроме того, у АДР более длительный период полужизни в плазме. Этот класс лекарственных средств обеспечивает более длительную, близкую к физиологическим условиям, избирательную стимуляцию дофаминовых рецепторов. При метаболизме АДР не образуются свободные радикалы, которые могут ускорять апоптоз нейронов при БП [3, 4].
В последние годы активно изучается возможность нейропротективного действия АДР при БП и влияния на темп прогрессирования заболевания. Возможный нейропротективный эффект АДР связывают со снижением синтеза дофамина, антиоксидантным эффектом, стимуляцией аутотрофической функции нейронов [5, 6].
АДР применяют как на ранних стадиях БП в виде монотерапии или в комбинации с амантадинами, ингибиторами МАО типа Б, холинолитиками, так и на развернутых стадиях болезни в качестве дополнения к леводопе.
В статье приведены 2 клинических наблюдения больных БП на ранней и развернутой стадиях заболевания.
Наблюдение 1.
Пациентка
В.
, 46 лет, обратилась с жалобами на дрожание в состоянии покоя и неловкость в правой руке. Впервые симптомы появились 6 мес назад, когда больная заметила, что ей стало трудно писать, изменился почерк, стала медленнее и хуже выполнять мелкие движения правой рукой, затем появился тремор в этой руке, возникающий в состоянии покоя.
В клинической картине: гипомимия, редкое мигание, брадилалия, гипокинезия, повышение тонуса по экстрапирамидному типу, выраженный тремор покоя в правых конечностях, ахейрокинез справа. Постуральной нестабильности нет.
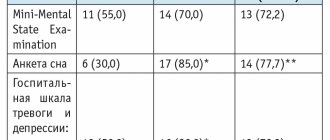
При осмотре отмечались симптомы тревоги и депрессии в виде подавленности, снижения круга интересов, апатии, повышенной утомляемости, снижения способности к концентрации внимания, нарушений сна. Выявлены легкие когнитивные нарушения подкоркового характера в виде снижения скорости выполнения нейропсихологических тестов. При исследовании когнитивных функций с помощью краткой шкалы обследования психического статуса (ММSE) было получено 27 баллов.
Был выставлен диагноз «БП, смешанная форма, 1-я стадия по Хену и Яру. Легкие когнитивные нарушения. Аффективные расстройства (депрессивный синдром)». Была назначена терапия: пирибедил (проноран) 50 мг с постепенным увеличением дозы 1 раз в неделю до 150 мг/сут. При повторном осмотре через 3 мес пациентка отметила положительную динамику в состоянии, уменьшилась выраженность тремора, гипокинезии и ригидности в правых конечностях, улучшилась походка. Пациентка стала лучше выполнять повседневную работу, улучшился почерк, восстановилась работоспособность. Кроме того, значительно повысились настроение, концентрация внимания, нормализовался сон. Повторная оценка по шкале ММSE составила 30 баллов.
Наблюдение 2.
Пациентка
И.
, 63 года, обратилась с жалобами на замедленность движений, общую скованность, дрожание в руках, больше слева, неустойчивость при ходьбе, частые падения и застывания, насильственные движения в конечностях. Впервые симптомы появились 12 лет назад, когда возникли тремор в состоянии покоя в левой руке, затем неловкость, замедленность движений в левых руке и ноге. Через 2 года присоединились дрожание и неловкость в правых конечностях. В поликлинике был поставлен диагноз БП и назначен амантадин 300 мг/сут. На фоне терапии каких-либо изменений в самочувствии пациентка не заметила.
Через несколько месяцев появилась неустойчивость при ходьбе, в связи с чем был назначен препарат леводопа/бензеразид 300 мг/сут. Больная отметила кратковременное улучшение, она стала лучше удерживать равновесие, уменьшились скованность, замедленность движений и тремор, нарушения ходьбы. Однако болезнь продолжала неуклонно прогрессировать, симптомы стали нарастать. Доза леводопы в течение 10 лет увеличилась до 900 мг/сут. В последние 3 года стала замечать сокращение продолжительности действия однократной дозы леводопы до 2 ч и появление насильственных движений в конечностях через 1 ч после приема разовой дозы леводопы. В клинической картине: гипомимия, редкое мигание, гипофония, брадилалия, аксиальная ригидность, гипокинезия с обеих сторон, больше слева, повышение тонуса по экстрапирамидному типу с обеих сторон, больше слева, выраженный тремор покоя с обеих сторон, больше слева, лекарственные дискинезии пика дозы в виде генерализованного хореоатетоза, выраженная постуральная неустойчивость, микробазия с частыми застываниями. Был поставлен диагноз «БП смешанная форма, 4-я стадия по Хену и Яру. Феномен истощения однократной дозы препаратов леводопы. Лекарственные дискинезии пика дозы».
К терапии был добавлен пирибедил в дозе 50 мг с постепенным увеличением до 150 мг/сут, параллельно постепенно уменьшена доза леводопы до 650 мг/сут. В результате коррекции терапии стали реже отмечаться застывания и падения, уменьшилась выраженность насильственных движений; увеличилась продолжительность периода включения.
В 1-м клиническом наблюдении относительно молодой пациентке с ранней стадией БП, аффективными и легкими когнитивными расстройствами пирибедил (проноран) был назначен в виде монотерапии, что обеспечило хороший контроль двигательных нарушений, регресс легких когнитивных и депрессивных нарушений.
Во 2-м наблюдении пирибедил (проноран) был назначен в комбинации с препаратом леводопы, что дало возможность постепенного снижения суточной дозы леводопы и уменьшение выраженности леводопа-индуцированных дискинезий. Кроме того, сократились и моторные флюктуации (феномен «истощения дозы»).
Пирибедил (проноран) — неэрголиновый агонист дофаминовых рецепторов. Он является единственным агонистом, повышающим активность как дофаминергической, так и норадренергической систем.
Пирибедил (проноран) стимулирует D3-подтип D2-рецепторов, а также блокирует пресинаптические α2-адренорецепторы, способствуя таким образом усилению норадренергической передачи. Обеспечивает терапевтический эффект, приближающийся к действию леводопы, и тоническую стимуляцию дофаминовых рецепторов в полосатом теле, что сопряжено с низким риском развития флюктуаций и дискинезий. Кроме того, пирибедил (проноран) блокирует альфа-2-норадренорецепторы, устраняя малочувствительные к леводопе симптомы БП — нарушения позы, походки, постуральную нестабильность. Двигательные застывания являются особым видом нарушения походки при БП, их связывают с утратой постуральных рефлексов, а также активацией мышц-антагонистов. Этот феномен может быть своеобразным эквивалентом специфической дистонии действия, возникающей при ходьбе. Считается, что застывания развиваются в результате нарушения высвобождения норадреналина во фронтальной коре [7—9]. Кроме нигростриарного дофаминергического пути, который связан с регуляцией движений, существуют мезолимбический и мезокортикальный дофаминергические пути. Мезолимбический путь связан с функциями настроения, эмоций и мотивации, мезокортикальный — обеспечивает процессы внимания, концентрации и памяти. Стимуляция D3-потипа D2-рецепторов в лимбической системе сопряжена с антидепрессивным эффектом АДР. Поскольку пирибедил является антагонистом α2-адренорецепторов, он улучшает норадренергическую передачу в коре, лимбической системе и голубом пятне. Ключевым источником восходящей норадренергической медиации является голубое пятно ствола мозга. Аксоны норадренергических нейронов голубого пятна проецируются во все отделы коры головного мозга. Посредством повышения активности норадренергической системы пирибедил стимулирует холинергическую передачу в коре головного мозга, что улучшает позу и походку у больных, страдающих БП, а также когнитивные функции и внимание. Роль в когнитивных процессах норадренергической медиации обусловлена обеспечением концентрации внимания и мнестических процессов, обработкой сенсорной информации. С недостаточностью норадренергической системы связаны замедленность психических процессов, снижение внимания, депрессия, нарушения ходьбы у больных БП. [10, 11]. Также норадренергическая активность пирибедила (проноран) способствует предотвращению вегетативных нарушений, прежде всего ортостатической гипотензии, свойственной больным БП [7].
Таким образом, 2 клинических наблюдения демонстрируют целесообразность назначения пирибедила (проноран) на ранних и развернутых стадиях БП с целью коррекции моторных, аффективных и легких когнитивных расстройств, а также коррекции моторных флюктуаций. Назначение пронорана больным с поздними стадиями БП приводит к увеличению продолжительности периода «включения», снижению продолжительности периода «выключения», нарастанию продолжительности и эффективности действия однократной дозы дофамин-содержащих средств.
Монотерапия пирибедилом (проноран) позволяет отсрочить назначение леводопы и предотвратить моторные флюктуации и дискинезии. Кроме того, возможно, при этом предотвращается гибель дофаминергических нейронов, обусловленная действием леводопы. По разным данным, АДР позволяют отложить необходимость назначения леводопы на 3—5 лет.
Пирибедил (проноран) занимает особое место среди других АДР в связи с действием на адренергическую и норадренергическую нейротрансмиссию, что позволяет влиять на аффективные, когнитивные нарушения и ряд немоторных симптомов БП.