Рисперидон является одним из популярных и эффективных антипсихотических препаратов (нейролептиков). Само активное вещество является производным бензизоксазола. Впервые к применению это лекарство было одобрено в 1993-м году. Применяется в психиатрической и неврологической практике. Обычно его назначают при всевозможных продуктивных расстройствах, например, галлюцинациях, бреде и пр. Кроме того, препарат снижает раздражительность, аутоагрессию.
Одним из преимуществ Рисперидона выступает то, что при его применении скорость устранения психических и психосоматических симптомов в два раза выше, чем при использовании типичных нейролептиков. Кроме того, такое лечение оказывается более безопасным.
Способ действия
Препарат после его приема внутрь полностью абсорбируется в органах ЖКТ и быстро распределяется по всему организму. При этом пища никак не влияет на процесс. Благодаря этому удается достичь оптимальной концентрации вещества в плазме – она соответствует употребляемой дозе.
Через неделю после приема препарата он практически полностью выводится из организма – 70% выходит с мочой, 14% с калом. Однако стоит учитывать, что в некоторых ситуациях может наблюдаться замедленное выведение. Чаще всего это связано с плохой работой печени и почек (в пожилом возрасте, при почечной недостаточности и т. п.).
Повышение качества и доступности медицинской помощи, совершенствование системы здравоохранения приводят к увеличению продолжительности жизни и соответственно увеличению доли пожилых людей в структуре населения. С ростом продолжительности жизни наблюдается увеличение частоты когнитивных нарушений и деменции. Так, по данным B. Plassman и соавт. [49], распространенность деменции среди лиц старческого возраста колеблется с 5,0% в возрастной группе 71—79 лет до 37,4% в возрасте 90 лет и старше.
Деменцию определяют как приобретенное снижение интеллектуальных функций. Нарушение интеллектуальных функций при деменции характеризуется одновременным расстройством памяти, речи, внимания, праксиса, гнозиса и более тонких функций, например таких, как способность принимать решения, планировать и контролировать свои действия. Деменция ограничивает возможности больного к самообслуживанию, нарушает его бытовую независимость и социальную адаптацию, делает его неспособным к профессиональной деятельности. Актуальность проблемы деменции неуклонно растет в связи с высокой ее распространенностью, инвалидизирующим течением заболевания и большими экономическими затратами на лечение и уход за больными, которые на поздних стадиях болезни требуют пожизненной госпитализации в специализированные учреждения (интернаты для хронических психически больных). Деменция чаще возникает в результате дегенеративных, атрофических и сосудистых поражений головного мозга, в соответствии с чем выделяют деменцию альцгеймеровского типа, сосудистую деменцию и смешанную (альцгеймеровско-сосудистую) деменцию.
Наряду с интеллектуальным дефицитом более чем у 50% больных деменцией наблюдаются психотические симптомы (бред и галлюцинации) и поведенческие нарушения (агрессия, возбуждение, ажитация, раздражительность, нарушения активности, апатия, расторможенность и др.), а также аффективные расстройства (депрессия, тревога, фобия) [44]. Это коррелирует с данными исследования S. Bergh и соавт. [12], в котором установлено, что у 91,7% пациентов имелся по меньшей мере один из симптомов психических и поведенческих расстройств, таких как раздражительность (у 63,5%), ажитация (у 51,0%), расторможенность (у 37,8%) и депрессия, причем бредовые расстройства, ажитация и раздражительность носили стойкий характер и были постоянными.
По мере увеличения продолжительности и тяжести деменции наблюдается повышение частоты связанных с ней психических, поведенческих и невротических расстройств. Так, согласно данным B. Plassman и соавт. [49], распространенность деменции в США среди лиц старше 71 года составляет 13,9%, и 70% из этих больных имеют симптомы психоза в течение 7 лет после постановки диагноза. Отмечено, что в течение каждого следующего года заболевания у пациентов наблюдается прирост суммарного количества галлюцинаторно-бредовых инцидентов: 20,1% в 1-й год, 36,1% во 2-й, 49,5% в 3-й и 51,3% в 4-й [18, 46, 57].
Анализ посвященной проблеме деменции литературы показывает, что наибольшее внимание исследователи уделяют когнитивным расстройствам, и гораздо меньше внимания уделяется психотическим и поведенческим нарушениям, хотя именно эти расстройства ведут к более быстрому развитию когнитивного дефицита, нарушению нормального функционирования и социального поведения, приводя к ухудшению качества жизни и прогноза [46]. Психотические и поведенческие расстройства, а не интеллектуально-мнестическое снижение, часто создают и наибольшие трудности для лиц, осуществляющих уход за больными деменцией, и приводят к росту числа госпитализаций и, соответственно, увеличению стоимости терапии.
Для определения стратегии и тактики терапии всеми специалистами признана необходимость проведения полного диагностического обследования больных деменцией, сопровождающейся психотическими расстройствами. Необходимо определить этиологию синдрома деменции и психических расстройств и исключить какие-либо иные ее причины, например опухолевый генез или развитие лекарственно спровоцированной спутанности сознания.
Целью терапии больных деменцией с психотическими и поведенческими расстройствами являются возможно более полное купирование психопатологической симптоматики, сохранение и по возможности улучшение когнитивных функций. Учитывая, что больные пожилого возраста, как правило, страдают коморбидной соматической патологией и они в большинстве случаев вынуждены принимать комбинированную терапию, а также то, что у пожилых часто нарушены функции печени и почек и, как следствие, снижены уровень лекарственного метаболизма и процессы выведения метаболитов лекарственных средств, при выборе терапии врач в первую очередь должен руководствоваться безопасностью назначаемых препаратов и их комбинаций.
Для терапии некогнитивных расстройств у больных применяют различные группы психотропных препаратов: антипсихотики, антидепрессанты, транквилизаторы, антиконвульсанты и др. С 50-х годов основными средствами для коррекции психозов и поведенческих расстройств при деменции были и остаются нейролептики. Источником восстановления и улучшения когнитивных функций у больных при применении нейролептиков является их способность редуцировать позитивные, негативные и другие симптомы.
В целом ряде исследований [8, 11, 16, 24, 35] установлено, что при купировании позитивной и негативной симптоматики восстанавливаются и улучшаются когнитивные функции. Важным фактором, влияющим на динамику когнитивных функций, является также выраженность возникающих на фоне терапии антипсихотиками экстрапирамидных симптомов, и, как следствие, необходимость использования антихолинергических препаратов.
Антипсихотические препараты первого поколения, или типичные нейролептики, активно применяются у больных на протяжении многих десятилетий. Их недостатком являются те или иные побочные явления, развивающиеся почти у 90% больных [47].
У больных с когнитивными расстройствами и деменцией наиболее нежелательными являются антихолинергические побочные эффекты, способные усугубить нарушения когнитивных функций, на которые сами традиционные антипсихотики действуют мало. Даже относительно непродолжительное применение традиционных антипсихотиков с выраженным холинолитическим действием может сопровождаться нарастанием когнитивных нарушений; безусловно, усугубляет эти расстройства прием корректоров, связанный с экстрапирамидными нарушениями [13, 36, 37, 40, 43, 51, 52, 55, 61]. При применении антипсихотиков могут наблюдаться и другие нежелательные холинолитические эффекты, такие как сухость во рту, тахикардия, нарушения аккомодации, нарушения выделения мочи и задержка мочеиспускания, запор, ортостатическая гипотензия и др. Указанные побочные эффекты осложняют течение основного заболевания, приводя к усилению когнитивных расстройств и аффективных нарушений, что сопровождается утяжелением социальной дезадаптации больных. Можно с сожалением констатировать, что до сих пор не определены эффективные и безопасные дозы антипсихотиков первого поколения для применения у пожилых больных деменцией. Можно лишь отметить, что многие специалисты предпочитают использование низких доз.
Более современной группой препаратов для лечения психотических и поведенческих расстройств являются атипичные нейролептики. Как и типичные антипсихотики, они блокируют D2-рецепторы, способны блокировать серотонинергические рецепторы, такие как 5-HT2, что обусловливает их действие не только на позитивные, но и негативные симптомы, а также на когнитивные функции. Эти препараты имеют более высокую эффективность и безопасность, реже вызывают экстрапирамидные симптомы, такие как паркинсонизм и поздняя дискинезия [57].
Важно подчеркнуть, что применение атипичных антипсихотиков сопровождается меньшим риском возникновения цереброваскулярных нарушений [21, 30, 41].
В этом отношении особый интерес представляют два ретроспективных исследования [23, 33], в которых сопоставлялась частота цереброваскулярных нарушений у пожилых пациентов, получавших атипичные и типичные нейролептики.
В большом числе исследований [1—6, 13, 15, 17, 20, 25, 27—29, 31, 36—40, 42, 43, 50—52, 54—56, 58, 60—62] было установлено, что применение атипичных антипсихотиков улучшает когнитивные функции. Так, рисперидон способствует восстановлению таких когнитивных функций, как зрительная память, праксис, гнозис, вербальное, невербальное и вербально-логическое мышление; амисульприд воздействует на праксис, особенно за счет кинестетического, кинетического и целевого компонентов; кветиапин улучшает вербальное и вербально-логическое мышление, праксис, нейродинамику, произвольную регуляцию деятельности, оланзапин влияет на слухоречевую и зрительную память, несколько отсроченно на праксис; сертиндол улучшает время реакции, рабочую память, исполнительскую функцию (проблемно-решающее поведение).
Одним из наиболее хорошо изученных атипичных нейролептиков является рисперидон. Препарат воздействует главным образом на передачу возбуждения дофаминовыми (D2) и серотониновыми (5-HT2) рецепторами [10]. В дозах, не превышающих средние терапевтические, рисперидон не оказывает воздействия на холинергическую систему, во время терапии препаратом крайне редко возникают холинолитические побочные эффекты, а также минимален риск развития седации, это обусловлено низкой тропностью препарата соответственно к М1- и Н1-рецепторам. Установлено, что рисперидон обнаруживает наименьшее сродство с ацетилхолиновыми рецепторами по сравнению с другими атипичными антипсихотиками [26].
Эффективность рисперидона при лечении психотических и поведенческих расстройств у больных с деменцией исследовалась с начала 90-х годов, и тем не менее этот вопрос остается недостаточно изученным. В небольшом количестве зарубежных исследований было показано более выраженное действие рисперидона на психотические и поведенческие расстройства в сравнении с плацебо и галоперидолом, но без учета влияния препарата на когнитивный дефицит [14, 19, 34, 59]. В одном из исследований [34] лечили 625 пациентов с болезнью Альцгеймера, сосудистой и смешанной деменцией, причем 95% пациентов страдали тяжелой деменцией с психотическими и поведенческими расстройствами (психоз, агрессия, ажитация и др.). Пациенты были рандомизированы на сопоставимые группы и принимали плацебо или соответственно 0,5, 1 или 2 мг/сут рисперидона в течение 12 нед. Было подтверждено, что рисперидон в дозе 0,5, 1 и 2 мг/сут более эффективно купирует по сравнению с плацебо (p=0,02, p=0,005 и p<0,001) симптомы психоза и агрессивности. Побочные явления, такие как сонливость, экстрапирамидные симптомы, незначительные периферические отеки, отмечались у небольшого числа больных, частота возникновения экстрапирамидных симптомов на фоне приема 1 мг/сут рисперидона и плацебо существенно не отличалась. Исследователи сделали вывод, что рисперидон более эффективен по сравнению с плацебо в отношении симптомов психоза и агрессивного поведения у пациентов с тяжелой деменцией (при этом доза рисперидона 1 мг/сут является адекватной для большинства пациентов). В работе H. Brodaty и соавт. [14] у 345 пациентов с деменцией, сочетавшейся с психотическими и поведенческими симптомами, на фоне терапии рисперидоном (средняя суточная доза 0,95±0,03 мг) в течение 12 нед были получены сходные результаты. Был сделан вывод, что терапия малыми дозами рисперидона в сравнении с плацебо приводит к более значительному регрессу всего спектра симптомов психоза, связанных с деменцией [45]. Частота проявлений экстрапирамидных симптомов на фоне приема рисперидона и плацебо существенно не различалась — 23 и 16% соответственно.
В одном из многоцентровых исследований [19], которое продолжалось 13 нед, 344 больных деменцией различной этиологии с нарушениями поведения, ажитацией и агрессивностью были разделены на 3 группы: пациентам 1-й группы назначали рисперидон (в дозе от 0,5 до 4 мг/сут), больным 2-й группы назначали эквивалентные дозы галоперидола, 3-й — плацебо. Было установлено, что на момент окончания исследования средние эффективные дозы рисперидона и галоперидола составляли 1,1 и 1,2 мг/сут соответственно; у достоверно большего числа пациентов на фоне терапии рисперидоном по сравнению с галоперидолом и плацебо наблюдалась редукция выраженности поведенческих и психотических симптомов (на 30% и более по шкале BEHAVE-AD) и агрессии по опроснику CMAI), а также по шкале общего клинического впечатления (CGI). Терапия рисперидоном хорошо переносилась больными, достоверных различий в появлении экстрапирамидных симптомов в группах больных, получавших плацебо (у 11%) и рисперидон (у 15%) установлено не было, тогда как в группе больных, леченных галоперидолом, они встречались достоверно чаще (у 22% больных).
В двойном слепом перекрестном исследовании [59] с участием 120 пациентов с деменцией различного генеза (болезнь Альцгеймера, сосудистая и смешанная деменция) были изучены эффективность и переносимость терапии рисперидоном (0,5—1,5 мг/сут) и галоперидолом в течение 18 нед. При приеме рисперидона в сравнении с галоперидолом у пациентов достигнуто значительно более выраженное улучшение по всем шкалам, применявшимся для оценки купирования психотических симптомов и расстройств поведения — по шкалам BEHAVE-AD-K (корейская версия — BPSD), CGI, опроснику Коен-Мансфилд — Cohen-Mansfield Agitation Inventory (корейская версия — CMAI-K). Рисперидон имел дополнительное преимущество в снижении агрессивности и тревожно-фобических расстройств. Кроме того, было выявлено дополнительное преимущество у рисперидона в отношении купирования агрессивности и тревоги и фобий. Риск антипсихотически-индуцированных экстрапирамидных расстройств на протяжении всего исследования был значительно ниже при использовании рисперидона.
Только в нескольких исследованиях изучалось влияние рисперидона на психотические и поведенческие расстройства у пациентов с деменцией с учетом воздействия препарата на когнитивный дефицит.
В 8-недельном открытом исследовании [63] у 58 пациентов с болезнью Альцгеймера, средний возраст которых составил 75,7 года, оценивали эффективность рисперидона в дозе 0,25—2,0 мг/сут. Завершили исследование 48 (83%) пациентов. Средняя доза рисперидона в начале и в конце исследования составила 0,6 и 1,0 мг/сут соответственно.
С высокой степенью достоверности была достигнута редукция уровня выраженности почти всех поведенческих и психотических симптомов (по шкале BEHAVE-AD-K), так, например, уменьшились параноидные, бредовые, галлюцинаторные, аффективные симптомы, понизилась агрессивность. Достоверных изменений когнитивных функций (по корейской версии MMSE (Mini-Mental State Examination — краткая шкала оценки психического статуса) [22] отмечено не было. Побочные явления при лечении рисперидоном у большинства больных оценивались как незначительные.
В открытом 8-недельном исследовании [53] у 34 пациентов с деменцией, средний возраст которых был 76 лет, оценивали эффективность рисперидона в различных дозах — от 0,5 до 2,0 мг/сут. В конце исследования рисперидон в дозе 0,6 мг/сут принимали 18% пациентов, 1,0 мг/сут — 50% и больше 1 мг/сут — 32%. Оценка динамики состояния пациентов по CGI показала, что у 82% больных имело место значительное или очень значительное улучшение. По данным опросника психотического состояния Neuropsychiatric Inventory (NPI), частота и тяжесть бредовых, галлюцинаторных симптомов, ажитации, агрессии и раздражительности достоверно уменьшилась в сравнении с исходным уровнем (p<0,001), но достоверных изменений когнитивных функций по шкале MMSE и другим шкалам отмечено не было. Переносимость рисперидона была оценена как хорошая, не было выявлено клинически значимых экстрапирамидных симптомов, изменений жизненно важных функций и массы тела.
Исследование D. Jeste и соавт. [32] показало, что у пожилых пациентов с шизофренией, осложненной деменцией, традиционные антипсихотики действуют на негативную симптоматику менее эффективно в сравнении с атипичными, в том числе с рисперидоном, при этом атипичные нейролептики лучше влияют на когнитивные функции.
Приведенные данные позволяют считать, что атипичные антипсихотики должны рассматриваться как препараты первой линии терапии у пожилых пациентов с деменцией в сочетании с психотическими и поведенческими расстройствами. При выборе терапевтической стратегии следует руководствоваться принципом использования минимальных доз и проводить дифференцированное назначение лечения в соответствии со спектром психотропной активности препаратов, особенностями их влияния на нейрокогнитивный дефицит и профилем побочных эффектов.
Нам встретилось только одно отечественное исследование [7], посвященное изучению эффективности и безопасности рисперидона у больных деменцией с психотическими и поведенческими расстройствами. Однако в нем не оценивалась динамика изменения когнитивных функций.
Цель настоящей работы — оценка клинической эффективности малых доз рисперидона при лечении больных с психотическими расстройствами и нарушениями поведения при деменции различного генеза, а также оценка его влияния на когнитивные функции у данных пациентов.
Материал и методы
Исследование было проведено в 2010 г. на базе 6-го отделения Санкт-Петербургской городской психиатрической больницы №6. В открытое перспективное плацебо-неконтролируемое исследование были включены 30 женщин с различными клиническими формами деменции. Их возраст колебался от 65 до 89 лет (средний — 77,6±5,7 года).
Распределение больных по диагнозам приведено в табл. 1.
| Таблица1 |
У 24 пациенток имелась инвалидность по психическому заболеванию.
До включения в исследование 8 пациенток получали антипсихотики (хлорпротиксен, галоперидол, тиапридал, кветиапин).
Критериями включения в исследование являлись: клинический диагноз деменции, отсутствие сопутствующей тяжелой или нестабильной соматической патологии (любое состояние, непосредственно угрожающее жизни больного, злокачественные новообразования, острый инфаркт миокарда, нестабильная стенокардия, угрожающие аритмии или неконтролируемая артериальная гипертензия, декомпенсированный сахарный диабет или другие эндокринопатии в стадии декомпенсации, декомпенсированная сердечная, легочная, печеночная или почечная недостаточность; туберкулез, ВИЧ, сифилис).
Продолжительность исследования составляла 4 нед. Больным, включенным в исследование, назначали таблетированный рисполюкс (рисперидон) производства Sandoz—Novartis. Он назначался в дозе от 1 до 2 мг/сут в 1 прием, как правило, на ночь. В процессе лечения рисполюксом исключались другие нейролептики. Допускалось лишь использование транквилизаторов в качестве снотворного средства, антипаркинсонических препаратов при появлении экстрапирамидных симптомов, а также средств для лечения сопутствующих соматических заболеваний.
Клиническое исследование выполнялось в соответствии с правилами GCP по специально разработанному протоколу и с использованием унифицированных индивидуальных карт больных. Психометрическая оценка проводилась по шкалам MMSE [48] и CGI-I (Clinical Global Impression Scale — Improvement) [30]. Она проводилась дважды — до начала терапии и после 4 нед приема препарата. Оценка экстрапирамидных нарушений проводилась по шкале ESRS (Extrapyramidal Symptom Rating Scale). До включения в исследование и после его окончания измеряли массу пациентки и окружность талии.
При обработке данных использовали программу Statistica 8.0.
Результаты и обсуждение
Из 30 включенных в 4-недельное исследование пациенток полностью завершили его 29 человек. Одна пациентка умерла от внезапно развившейся острой сердечной недостаточности, не связанной с антипсихотической терапией, на 5-й день исследования.
При завершении курса терапии больные, получавшие разные дозы препарата, распределились следующим образом: дозировку 1 мг/сут получали 14 (48,2%) больных, 1,5 мг/сут — 12 (41,3%), 2 мг/сут — 3 (10,3%). Средняя суточная доза рисперидона составила 1,31±0,33 мг.
К моменту завершения исследования у большинства пациенток отмечалась положительная динамика психического состояния. Средняя оценка по шкале CGI-I статистически достоверно (p<0,01) снизилась с 5,41±0,63 (в начале исследования) до 3,21±0,56 балла (к моменту окончания исследования).
К моменту завершения курса терапии улучшение психического состояния было установлено у 23 (76,6%) больных. В ходе терапии рисперидоном плавно редуцировались бредовые, галлюцинаторные и поведенческие расстройства. Как правило, психотические и поведенческие расстройства купировались в течение первых 2 нед лечения, и в дальнейшем состояние существенно не менялось. У больных редуцировались делириозные расстройства, спутанность сознания, психомоторное возбуждение, склонность к агрессии (уменьшились угрозы расправы и попытки нападения на окружающих их лиц, агрессия на вербальном уровне), расторможенность и конфликтность, нарушения суточного ритма (сократилось количество проблем с засыпанием, частыми пробуждениями и укорочением ночного сна), нарушение активности (уменьшилась бесцельная деятельность, неадекватное поведение в виде излишней общительности с незнакомыми людьми или, наоборот, полной отстраненности от контактов, оголения, складирования предметов в неподходящих для этого местах и т.п.). В ходе терапии рисполюксом отмечено также уменьшение проявлений аффективных расстройств (депрессивное и тревожное настроение, плаксивость). Редукция психотических и поведенческих расстройств у больных сыграла ключевую роль в восстановлении когнитивных функций и, соответственно, в улучшении социального функционирования и качества жизни. Медицинский персонал, принимавший участие в терапии и уходе за больными, отметил, что в процессе терапии рисполюксом у больных упорядочились поведение и активность, улучшилось восприятие как общей информации, так и лечебных рекомендаций, больные стали более сознательными, что коррелирует с данными исследования В.И. Максимова [9]. При общении с окружающими у больных появились приветливость, доброжелательность, значительно снизились трудности в общении, стало легче проводить лечебно-реабилитационный процесс и уход за больными.
Что касается когнитивных функций, то по шкале MMSE отмечено статистически достоверное (p<0,01) их улучшение (табл. 2).
| Таблица2 |
| ]]> |
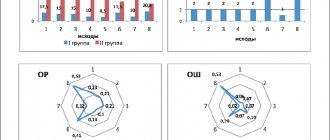
По сравнению с исходным уровнем (14,97±3,90) к моменту окончания курса лечения (16,69±3,97) выраженность улучшения этих показателей (по величине прироста оценки) составила 1,72±1,60 балла, t-критерий — 5,79. Наиболее выраженное статистически достоверное улучшение наблюдалось по таким субшкалам, как «ориентировка во времени», «ориентировка в месте», «восприятие» (табл. 3, рисунок).
| Таблица3 |
| ]]> |
| Динамика основных показателей психического и когнитивного статуса. |
| ]]> |
Несколько в меньшей степени улучшились показатели по субшкалам «концентрация внимания и счет», «речевые функции». Имеющееся улучшение по субшкале «память» было статистически недостоверно (t-критерий 1,8; p=0,083).
Экстрапирамидные нарушения, оцениваемые по шкале ESRS, отсутствовали в течение всего времени проведения исследования. Средние показатели массы тела и объема талии за время исследования существенно не изменились.
В заключение можно отметить, что проведенное исследование показало высокую эффективность рисперидона в ходе терапии психотических и поведенческих расстройств у больных деменцией. В течение первых 2 нед у больных редуцировались делириозные расстройства, спутанность сознания, психомоторное возбуждение, склонность к агрессии, расторможенность и конфликтность, что, несомненно, повлияло на восстановление когнитивных функций.
Изучение когнитивного статуса у исследованных больных выявило существенное увеличение общего балла по шкале MMSE. Наиболее выраженным улучшение было по субшкалам «ориентировка во времени», «ориентировка в месте», «восприятие».
Редукция психотических (галлюцинаторно-бредовых), поведенческих и когнитивных расстройств у больных способствовала восстановлению и улучшению социального функционирования и качества жизни.
Улучшение когнитивных функций, по-видимому, имело вторичный характер и было связано с редукцией психотических проявлений. Об этом, по нашему мнению, свидетельствует то, что улучшение по субшкале «память» шкалы MMSE не достигло статистически значимого уровня. Из данных, полученных в ходе проведенного исследования, следует, что при адекватной терапии атипичным антипсихотиком рисполюкс (рисперидон) когнитивные функции у больных деменцией могут улучшаться.
В использованных дозах (1—2 мг/сут) рисполюкс хорошо переносится больными деменцией с психотическими и поведенческими расстройствами. При оценке экстрапирамидных расстройств при помощи шкалы ESRS не было выявлено увеличения частоты побочных эффектов. За время исследования не отмечалось также статистически значимого изменения средней массы тела и объема талии больных.
Показания к применению
Существует ряд недугов, при которых таблетки Рисперидона являются особенно эффективным. К основным из них относятся:
- Шизофрения (острая или хроническая). Активное вещество дает возможность проводить лечение на симптоматическом уровне.
- Психотические состояния. Помогает устранить эмоциональную отрешенность, бред, скудную речь и т.д.
- Депрессия, если сопровождается тревожными состояниями.
- Поведенческие расстройства, включая вспышки гнева, сильное возбуждение.
- Деменция, если присутствует агрессивность.
- Биполярные расстройства. Лечение маний.
- Аутизм у детей и подростков. Средство позволяет бороться с аутоагрессией.
Также препарат используется при лечении рецидивов, если у человека диагностирована хроническая шизофрения, и периодически появляются острые психотические состояния.
Отдаленные перспективы длительного лечения рисперидоном детей, больных шизофренией
Рисперидон, введенный в практику около 10 лет назад, обладает уникальной активностью, воздействуя как на Д2–дофаминовые, так и 5НТ2А–серотониновые рецепторы. По отношению к a1–адренергическим, Н2–гистаминовым и М1–мускариновым рецепторам он обладает меньшим сродством, чем традиционные нейролептики, однако и при его применении возможно появление ряда побочных эффектов, таких как тошнота, повышение аппетита, избыток веса, галакторея и т.д. В настоящее время рисперидон с успехом применяется в лечении острых и хронических форм шизофрении у взрослых больных. Особенно настойчиво подчеркивается эффективность рисперидона в лечении негативных симптомов шизофрении и форм, резистентных традиционной терапии [3,4,7–11]. Анализ современных публикаций показывает, что рисперидон до настоящего времени еще мало используется в отечественной детской психиатрии. Вместе с тем зарубежные психиатры используют этот препарат у детей с целью лечения гиперактивности, импульсивности, агрессии, стереотипного поведения, обсессивно–компульсивных расстройств. Ряд зарубежных психиатров предполагает, что атипичные нейролептики, в частности, рисперидон, могут сыграть важную роль в лечении тяжелых аутистических расстройств [11,17–20]. Относительная безопасность рисперидона (отсутствие токсического и мутагенного воздействия в эксперименте, отсутствие осложнений при приеме средних суточных доз лицами среднего возраста), а также отмеченные факты преодоления терапевтической резистентности в лечении тяжелых форм эндогенных заболеваний у взрослых [4,19] делают рисперидон привлекательным для его применения в детской практике. С целью изучения клинической эффективности рисперидона в лечении малокурабельных рано начавшихся форм детской шизофрении проводилась терапия рисперидоном детей в возрасте 3–12 лет (средний возраст 6,4±2,3 г.), находившихся в 1999–2006 гг. под наблюдением в отделе раннего детского возраста НЦ психического здоровья РАМН. Настоящее сообщение посвящено катамнезу этих результатов. Критериями включения в группу наблюдения были выраженные негативные и позитивные психические расстройства, длительность заболевания более года, резистентность к ранее проводимой терапии. Случаи с психоорганическим синдромом, умственной отсталостью, судорожными приступами, тяжелыми соматическими заболеваниями в исследование не включались. До начала лечения все дети были обследованы психиатром, невропатологом, педиатром, а также психологом. Были проведены ЭЭГ, ЭКГ, клинические анализы крови, мочи и др. Кроме того, в динамике регулярно назначались контрольные обследования соматического состояния больных, контроль биохимических показателей и ЭКГ. На применение рисперидона у детей было получено информированное согласие родителей с условием регулярного посещения врача, а также фиксацией родителями по определенной схеме психического и физического состояния ребенка. Кроме того, на применение рисперидона у детей было получено разрешение этического комитета НЦ психического здоровья РАМН. Для оценки эффективности рисперидона использовались адаптированные к детскому возрасту стандартизованные шкалы: позитивных и негативных симптомов (PANSS), общего клинического впечатления (CGI). В них отмечались тяжесть клинических проявлений, их динамика, а также степень улучшения или ухудшения состояния по семибалльной системе [5]. Возможные осложнения и побочные эффекты терапии фиксировались по шкале UKU [5,6]. Действие препарата считалось эффективным при уменьшении суммарного показателя психического состояния по шкале PANSS на 20% и выше. Во избежание возможных побочных реакций рисперидона при использовании его у детей нами был рассчитан безопасный интервал дозировок препарата, основывающийся на теоретических разработках так называемого терапевтического «эффекта малых доз», известного в медицине. Вызываемый «малыми дозами» феномен специфических каскадных ответных реакций в организме позволяет добиться такого же результата в лечении, что и при приеме стандартной макродозы, и одновременно помогает избежать ненужных осложнений [7]. Детям в возрасте 3–4 лет назначали 1/20 средней дозы для взрослых, детям 4–5 лет – 1/10 дозы. Учитывая скорость выведения рисперидона из организма (36 и более часов), в ряде случаев применялась методика дробного (через день) приема препарата. В отдельных случаях максимальная доза рисперидона не превышала 0,5–0,6 мг/сут., что соответствовало рекомендациям ведущих зарубежных детских психиатров [1,11,20,21]. Лечение больных не ограничивалось монотерапией рисперидоном, а сочеталось в ряде случаев с приемом других нейролептиков – этаперазина, неулептила и галоперидола в малых дозах (1/5–1/4 средней лечебной дозы в сутки). Указанные препараты применялись в период обострения психотической симптоматики на короткий промежуток времени (1–1,5 недели). В нескольких случаях на ЭЭГ была выявлена медленно–волновая пикоподобная пароксизмальная активность, которая клинически выражалась дисфорическими вспышками, повышенной импульсивностью и агрессивностью. Для смягчения данных нарушений к основной терапии рисперидоном эпизодически добавлялся в малых дозах вальпроат натрия (50–150 мг в сутки). Кроме того, базисное лечение рисперидоном сочеталось с приемом биотиков – церебролизина, церебрамина, кортексина, биолана, дельтарана и др. Первое клиническое наблюдение эффективности рисперидона было проведено с 1999 по 2002 г. Второй этап изучения эффективности рисперидона проводился с 2002 по 2006 гг. у 49 детей в возрасте 4–12 лет (38 мальчиков и 11 девочек), также с рано начавшейся шизофренией. Диагноз заболевания и в той, и в другой группе квалифицировался по МКБ –10 и DSM–4, как недифференцированная форма шизофрении, детский тип. Средний возраст детей в обеих группах был 5,5±1,2 лет, средняя продолжительность заболевания 4,5±1,7 года. При отборе больных на лечение рисперидоном их состояние определялось выраженными психическими нарушениями в рамках злокачественной детской шизофрении, или соответственно по МКБ 10 – F20.8xx3. Клиническая характеристика случаев, вошедших в когорту наблюдения, определялась кататоно–регрессивными приступами, сопровождавшимися приостановкой психического развития, выраженными аутистическими проявлениями, ундулирующей психотической симптоматикой, мутизмом с последующим формированием специфического олигофреноподобного дефекта. На этом фоне отмечались повторные экзацербации заболевания в форме усиления аффективных, кататонических нарушений, рудиментов бреда и галлюцинаций. По шкале PANSS уровень нарушений определялся в диапазоне 102–165 баллов (в среднем – 132 балла). По шкале CGI тяжесть заболевания оценивалась в 6–7 баллов. С первых двух месяцев лечения у всех наблюдаемых детей отмечался отчетливый положительный эффект со значительной редукцией продуктивной и негативной симптоматики. Из продуктивных симптомов ушло импульсивное кататоническое возбуждение, уменьшилась острота бредовых и галлюцинаторных симптомов. К концу первого года особенно заметным было сглаживание негативных проявлений болезни. В то же время позитивная симптоматика в ряде случаев сохранялась, но была слабо выраженной и носила транзиторный характер. На этом фоне наблюдались сезонные экзацербации заболевания, которые, однако, не достигали по тяжести проявлений первичных эпизодов. У больных заметно редуцировалась аутистическая симптоматика. Значительно улучшилось их взаимодействие с окружающими детьми и взрослыми. При общении появлялся зрительный контакт, уменьшились негативизм, проявления псевдоглухоты и псевдослепоты. Социальное поведение также становилось более адекватным. Особенно позитивным был эмоциональный контакт с близкими и знакомыми людьми. В поведении детей появились элементы сопереживания, чувства такта, юмора, т.е. эмоционального резонанса адекватно настроению окружающих. Наметилось продвижение в когнитивном развитии – прежде всего увеличение словарного запаса в импрессивной речи, а также в ряде случаев экспрессивной в виде отдельных слов и словосочетаний, которые дети использовали в коммуникативных целях для выражения своих чувств и обмена впечатлениями с близкими. У нескольких детей расширились познавательные интересы (игровые, бытовые). Во всех случаях выявилось улучшение настроения и соматовегетативного статуса – нормализовались тургор и цвет кожи, появлялись блеск глаз, волос. Однако дальнейшая динамика заболевания в когорте больных оказалась различной, и по эффективности терапии рисперидоном когорта разделилась на две группы. У 17 (35%) больных, отнесенных в группу злокачественной шизофрении, психическое состояние в катамнезе оставалось относительно тяжелым, в связи с чем они вовремя не поступили в общеобразовательные учреждения и не обучались систематически на дому. Но в то же время дети были адаптированы в микросоциальных условиях семьи, овладели основными гигиеническими навыками самообслуживания, несложной элементарной фразовой речью. Некоторые из них смогли обучаться чтению и письму на компьютере, делали попытки сочинять простые рассказы бытового содержания, вели дневник, выполняли некоторые обучающие программы, хотя в целом познавательная деятельность оставалась диссоциированной, сохранялись специфические нарушения мышления (разноплановость, соскальзывания, обрывы ), а уровень отставания в интеллектуальном развитии достигал выраженной умственной отсталости. У других 32 больных (65%), также перенесших кататоно–регрессивные приступы в раннем детстве, динамика в процессе длительной терапии рисперидоном оказалась иной. У детей заметно изменилась прогредиентность заболевания и стала меньшей. На фоне проводимой терапии рисперидоном у детей сформировалась достаточно развитая речь. В 7–8–летнем возрасте эти дети смогли поступить в коррекционные школы, где обучались по массовой программе, но в щадящих условиях; 6 пациентов, находясь на лечении, поступили в вузы. В психическом состоянии этих больных до настоящего времени сохраняются легкие аутистические, аффективные и кататонические проявления в речи, моторике, поведении, а также отдельные шизотипальные стигмы на уровне эмоций, вегетативной нервной системы, отдельных моторных нарушений. Состояние 9 детей и подростков в настоящее время определяют неврозоподобная и психопатоподобная симптоматика, эпизодические, нередко сезонные, аффективные колебания, на фоне которых отмечается фрагментарная продуктивная симптоматика. В то же время на лечении рисперидоном у всех этих детей отмечаются достаточно высокая работоспособность, концентрация внимания, мышления и критика по отношению к своему состоянию. У некоторых из этих детей появились новые интересы, хобби (у одного к музыке, у другого – к организации бизнеса и заработку денег), появилась тенденция к развитию и обогащению личности, расширению круга возрастных интересов. По шкале PANSS спустя год от начала терапии отмечалось снижение среднего по группе суммарного балла с 132 до 84 баллов (в интервале от 90 до 42 баллов), спустя 6 лет – до 64 балов в подгруппе с неблагоприятным и до 48 баллов в подгруппе с благоприятным течением. На рисунке 1 представлена динамика снижения среднего суммарного балла шкалы PANSS, отражающего уменьшение тяжести психического состояния больных за время лечения (p<0,005). Средний процент улучшения по группе за время наблюдения с 1999 по 2006 г. составил 52%. Тяжесть состояния по шкале CGI снизилась до 4 баллов. По шкале UKU тяжесть осложнений не превышала 1–2 баллов. За время лечения рисперидоном некоторые из больных по инициативе родителей сделали длительный (до 3–6 месяцев) перерыв в приеме препарата. С периода перерыва в 4–5 месяцев у них наблюдался возврат прежней психотической симптоматики в меньшей степени, чем до лечения, однако больные утратили прежнюю работоспособность и активность, прервали учебный процесс в школе и институте. Возобновление лечения рисперидоном вновь улучшило их психическое состояние. Эти факты заставили сделать вывод о нецелесообразности прерывания лечения рисперидоном. Но в связи с необходимостью длительного приема препарата были предприняты и определенные меры профилактики терапевтического привыкания непосредственно к рисперидону. С этой целью в лечении делались перерывы на 1–2 летних месяца или назначался прерывистый курс лечения в виде 0,1–0,2 мг 2–3 раза в неделю, что фармакокинетически было оправдано, т.к. в крови больного в течение 2–3 дней сохранялась циркуляция до 75% препарата и его дериватов. В заключение следует добавить, что за время проведенной длительной терапии рисперидоном не было зафиксировано серьезных побочных, четко связанных с приемом препарата эффектов. По шкале UKU отмечены только незначительные, преимущественно в начале терапии вегетативные отклонения (субфебрилитет, нарушения сна, головные боли, неприятные ощущения в области эпигастрия); в единичных случаях отмечены аллергические проявления в виде кожной сыпи, небольшая прибавка в весе, которые ликвидировались самостоятельно и не повлекли отмены препарата. Таким образом, подводя итоги многолетней терапии рисперидоном, можно сделать вывод о том, что лечение малыми дозами препарата эффективно и безопасно в детском возрасте. Именно после годового срока лечения становились заметными улучшения когнитивных функций, внимания, работоспособности, мышления, речи, социального поведения. Лечение рисперидоном, по–видимому, не только облегчало текущее состояние больных, но и в целом оказывало влияние на патогенез заболевания. Эта гипотеза подтверждается тем, что к настоящему времени у подавляющего числа больных заболевание приобрело регредиентное течение, независимо от их исходного состояния. Поскольку редукция психопатологических проявлений достигалась в процессе комплексного лечения, целесообразно рекомендовать сочетание рисперидона с малыми дозами других нейролептиков и курсами биотиков. Наблюдение показывает, что щадящий режим терапии и индивидуальный подход к выбору лечебных дозировок, отказ от форсирования максимальных суточных дозировок позволяет применять рисперидон длительно без риска осложнений для физического здоровья детей.
Литература 1. Арена Д., Розенбаум Д. Фармакотерапия психических расстройств. Пер. с англ. – М.: БИНОМ, 2004. – С. 61–63. 2. Безнос С.А., Шапошников Н.Н., Рязанова Е.А. Опыт применения препарата «рисполепт» по материалам детского отделения МУЗ «Психиатрическая больница г. Краснодара » / Материалы Второй научно –практической конференции психиатров и наркологов Южного Федерального округа 21–23 июня 2006 года, Ростов –на –Дону. – С. 29–32. 3. Вовин Р.Я., Мазо Г.Э., Иванов М.В., Костерин Д. Н. Применение рисполепта для купирования обострений шизофрении // Психиатрия и психофармакотерапия. – 2000. – Прил. № 2. – С. 6–8. 4. Калинин В.В. // Социальная и клиническая психиатрия. – 1999, № 1. – С. 97–105. 5. Козловская Г.В., Калинина М.А., Горюнова А.В., Проселкова М.Е. Опыт применения рисполепта при лечении раннего детского аутизма и шизофрении у детей // Психиатрия и психофармакотерапия. – 2000. – Прил. № 2.– С. 10–12. 6. Козловская Г.В., Калинина М.А. Эффективность рисполепта у детей в пролонгированном (в течение 2 лет ) лечении шизофрении и раннего детского аутизма // Психиатрия и психофармакотерапия. – 2003. – Прил. № 1. – С. 10–13. 7. Козловская Г.В. Калинина М.А. Горюнова и др. Психофармакология в микропсихиатрии // Психиатрия и психофармакотерапия. – 2006, № 5, т. 7. – С. 256–259. 8. Колюцкая Е.В., Дороженок И.Ю., Ильина Н.А. // Социальная и клиническая психиатрия. – 1998, № 4. – С. 88–91. 9. Д.Н. Костерин, Г.Э. Мазо, М.В. Иванов // Социальная и клиническая психиатрия. – 2000, № 1. – С. 46–47. 10. Мосолов С.Н., Калинин В.В., Еремин А.В. и др. Сравнительное рандомизированное исследование эффективности и толерантности рисперидона и галоперидола при купировании острых состояний у больных шизофренией и шизоаффективным психозом // Психиатрия и психофармакотерапия. – 2000. – Прил. № 2. – С. 3–6. 11. Шинаев Н.Н., Акжигинов Р.Г., Волкова Н.П. Применение атипичного нейролептика рисполепт в клинике пограничных психических расстройств // Психиатрия и психофармакотерапия. – 2000. – Прил. № 2. – С. 8–10. 12. Руководство по клинической детской и подростковой психиатрии: Пер. с англ. / Под ред. К.С. Робсона. – М.: Медицина, 1999. – С. 227–255. 13. Armenteros J. L., Whitaker A. H., Welikson M., et al., Risperidon in ado–lescents with schizophrenia: an open pilot study // J Am Acad Child Adolesc Psy–chiatry 36: 5, 694–700, May, 1997. 14. Carlsson A., Waters N., Carlsson M. L., Neurotransmitter interactions in schizophrenia– therapeutic implications // Biol. Psychiatry. – 1999; 46: 1388–1395. 15. Crismon M. L, Dorson P. G. Schizophrenia in: Dipiro JT, Talbert RL, and Yee GC eds. Pharmacotherapy: A Pathophysiologic Approach. New York, NY: McGraw–Hil/Appleton and Lange; 1999. 16. Falkai P., Wobrock T., е t al. Guidelines for biological treatment of schizophrenia. Part 1 // World J Biological Psychiatry 6(3), 132–144, 2005. 17. Findling R. L., Maxwell K., Wiznizer M. An open clinical trial of risperi–don monotherapy in young children with autistic disorders // Psychopharmacol Bull 33: 1, 155–9, 1997. 18. Kapur S., Zipursky R. B., Remington G. Clinical and theoretical implica–tions of 5–HT2 and D2receptor occupancy of clozapine, risperidon and olanzapine in schizophrenia // Am J Psychiatry 158:286–293, 1999. 19. Kerwin R. W. Role of atypical antipsychotic in schizophrenia // Scizophr Bull: 25; 281–282, 2001. 20. Posey DJ, Walsh KH, Wilson GA, et al. Risperidon in the treatment of two very young children with autism // J Child Adolesc Psychopharmacol, 1999, 9, 273–276. 21. Stahl S. M. Psychopharmacology of Antipsychotics, 1999, М Dunits, London Reprinted, 2000, USA. – 77, 109–119. 22. Tasman A., Kay J., Lieberman J. A. Psychiatry, Second Ed, v. 1, Jwilly a Sons, LTD, 2004: 770–773. Статья напечатана в журнале «Вопросы психического здоровья детей и подростков». – 2006 (6), № 2, с 56–62.
Противопоказания и ограничения
Применение Рисперидона полностью запрещено в случаях:
- если у пациента приступообразная эпилепсия;
- при болезни Паркинсона;
- в период кормления грудью;
- при наличии повышенной чувствительности к самому препарату.
Что касается беременности, то применение лекарства в этот период не рекомендовано. Однако, если его употребление несет меньше вреда для плода, чем отказ от терапии с использованием данного вещества, лечащий врач имеет право выписать такой препарат. Однако само лечение должно проходить под контролем специалиста.
Выделяют также ряд заболеваний, при наличии которых прием таблеток должен проходит осторожно с четким контролем дозы и реакции организма. В их перечень входят такие:
- болезни сердечно-сосудистой системы;
- нарушение мозгового кровообращения;
- обезвоживание.
Кроме того, такое активное вещество не рекомендуется сочетать с прочими препаратами, влияющими на центральную нервную систему. Если такая терапия окажется обязательной, необходимо грамотно определить дозы каждого из используемых лекарств.
Рисперидон Органика, 4 мг, таблетки, покрытые пленочной оболочкой, 20 шт.
Переход от терапии другими антипсихотическими препаратами.
При шизофрении, в начале лечения Рисперидоном Органика, рекомендуется постепенно отменить предыдущую терапию, если это клинически оправдано. Если пациенты переводятся с терапии депо-формами антипсихотических препаратов, то прием Рисперидона Органика рекомендуется начинать вместо следующей запланированной инъекции. Периодически следует оценивать необходимость продолжения терапии противопаркинсоническими ЛС. В связи с α-адреноблокирующим действием Рисперидона Органика может возникать ортостатическая гипотензия, особенно в период начального подбора дозы. При снижении АД следует рассмотреть вопрос о снижении дозы. У пациентов с заболеваниями ССС, а также при обезвоживании, гиповолемии или цереброваскулярных нарушениях дозу следует увеличивать постепенно, согласно рекомендациям. Возникновение экстрапирамидных симптомов является фактором риска для развития поздней дискинезии. В случае возникновения признаков и симптомов поздней дискинезии следует рассмотреть вопрос об отмене всех антипсихотических препаратов.
Назначение антипсихотических препаратов, включая Рисперидон Органика, пациентам с болезнью Паркинсона или деменцией с тельцами Леви должно проводиться с осторожностью, т.к. у обеих групп пациентов увеличена чувствительность к антипсихотическим препаратам (включая притупление болевой чувствительности, спутанность сознания, постуральную нестабильность с частыми падениями и экстрапирамидные симптомы), а также повышен риск возникновения злокачественного нейролептического синдрома, характеризующегося гипертермией, мышечной ригидностью, нестабильностью автономных функций, нарушениями сознания и повышением активности КФК (также может наблюдаться миоглобинурия (рабдомиолиз) и острая почечная недостаточность), в этих случаях необходимо отменить все антипсихотические ЛС, включая Рисперидон Органика. При отмене карбамазепина и других индукторов печеночных ферментов доза Рисперидона Органика должна быть снижена.
У пожилых пациентов с деменцией при лечении атипичными антипсихотическими средствами, включая Рисперидон, наблюдается повышенная смертность по сравнению с плацебо. При применении Рисперидона для данной популяции частота смертельных случаев составила 4% для пациентов, принимающих Рисперидон, по сравнению с 3,1% для плацебо. Средний возраст умерших пациентов составляет 86 лет (диапазон 67–100 лет). У пожилых пациентов с деменцией, принимающих пероральные формы Рисперидона, наблюдалась повышенная смертность у пациентов, принимавших фуросемид и Рисперидон (7,3%, средний возраст 89 лет, диапазон 75–97 лет) по сравнению с группой, принимавшей только Рисперидон (4,1%, средний возраст 84 года, диапазон 75–96 лет) и группой, принимавшей только фуросемид (3,1%, средний возраст 80 лет, диапазон 67–90 лет). Не установлено патофизиологических механизмов, объясняющих данное наблюдение. Тем не менее, следует соблюдать особую осторожность при назначении препарата в таких случаях. Не обнаружено увеличения смертности у пациентов, одновременно принимающих другие диуретики вместе с Рисперидоном. Независимо от лечения, дегидратация является общим фактором риска смертности и должна тщательно контролироваться у пожилых пациентов с деменцией.
При лечении препаратом наблюдались гипергликемия, сахарный диабет или обострение уже имеющегося сахарного диабета. Установление взаимосвязи между применением атипичных антипсихотических препаратов и нарушениями обмена глюкозы осложнено повышенным риском развития сахарного диабета у пациентов с шизофренией и распространенностью сахарного диабета в общей популяции. Учитывая эти факторы, взаимосвязь между применением атипичных антипсихотических препаратов и развитием побочных действий, связанных с гипергликемией, не полностью установлена. У всех пациентов необходимо проводить клинический контроль на наличие симптомов гипергликемии и сахарного диабета.
При лечении Рисперидоном наблюдалось значительное увеличение массы тела. Необходимо проводить контроль массы тела пациентов при терапии препаратом Рисперидон. Следует соблюдать осторожность при назначении Рисперидона Органика пациентам с сердечными аритмиями в анамнезе, пациентам с врожденным удлинением интервала QT и при совместном применении с препаратами, увеличивающими интервал QT. Известна способность типичных нейролептиков снижать порог судорожной готовности. Следует с осторожностью назначать Рисперидон Органика пациентам с эпилепсией. Терапия мощным антагонистом D2-рецепторов Рисперидоном Органика может приводить к развитию опухолей гипофиза, гиперпролактинемии и галактореи.
Применение антипсихотических препаратов может вызвать дисфагию и нарушение моторики пищевода. Рисперидон Органика и другие антипсихотические средства нужно применять с осторожностью у больных с деменцией Альцгеймера, имеющих повышенный риск аспирационной пневмонии. Пациентам следует рекомендовать воздержаться от переедания в связи с возможностью увеличения массы тела.
Во время лечения необходимо воздержаться от приема алкоголя.
Рекомендуется постепенная отмена препарата, т.к. после резкого прекращения лечения высокими дозами нейролептиков возможно развитие синдрома отмены (рвота, тошнота, повышенное потоотделение, бессонница).
Побочные действия
Хотя препарат считается безопасным, в ряде случаев могут наблюдаться определенные побочные действия. К ним относятся:
- Сонливость, утомляемость, сниженная концентрация внимания, тремор или судороги.
- Боль в животе, тошнота, рвота, запоры, резкое изменение массы тела – снижение или повышение.
- Скачки давления.
- Снижение полового влечения и нарушение половой функции.
- Аутоиммунные нарушения.
- Сыпь на кожных покровах, сухость кожи, зуд.
- Аллергический ринит.
- Ухудшение зрения.
Чаще всего такие симптомы оказываются временными и проходят после окончания курса приема таблеток. Однако при выявлении тех или иных побочных действий нужно обязательно сообщить об этом лечащему врачу.