Эндометриоз является хроническим мультифакториальным заболеванием, поражающим каждую десятую женщину репродуктивного возраста. Установить точную распространенность эндометриоза сложно из-за многообразия симптомов и инвазивности методов достоверной диагностики. По данным нескольких источников [1, 2], авторы которых использовали разные методологические подходы, эндометриозом страдают приблизительно 5,5 млн женщин в США и Канаде, находящихся в репродуктивном возрасте, а также 16 млн женщин в Европе.
Главными симптомами эндометриоза являются бесплодие и хроническая тазовая боль. Хронический болевой синдром ведет к снижению или временной потере трудоспособности, что приводит к серьезным социальным и экономическим последствиям. В последние годы отмечается повышение интереса к изучению влияния эндометриоза на качество жизни. Хроническая природа заболевания создает проблемы во многих аспектах жизни пациентки — профессиональной, социальной и личной сфере, эмоциональности и сексуальности, приводя к достоверному снижению качества жизни [3—6].
Относительно расходов на здравоохранение, очевидна необходимость хирургического вмешательства для постановки окончательного диагноза и оценки рецидивов, а также госпитализация из-за болевого синдрома. Результаты многоцентрового исследования, проведенного S. Simoens и соавт. [7], показали, что затраты, связанные с эндометриозом, складываются из расходов на оперативное лечение (29%), диагностические методы обследования (19%), госпитализации (18%) и лекарственные препараты (18%). Величина затрат также зависит от степени распространенности эндометриоза, наличия тазовой боли, бесплодия и продолжительности заболевания до постановки диагноза. Затраты на лечение эндометриоза в США (включая обезболивание, гормональную терапию, консультации специалистов, стационарное и хирургическое лечение, дни, пропущенные по болезни, а также снижение репродуктивного потенциала) составляют около 20 млрд долл. в год, что значительно превышает затраты на лечение других хронических заболеваний, таких как болезнь Крона или мигрень [8].
Кроме того, у большинства женщин с эндометриозом был отмечен высокий уровень тревожности и депрессии [9, 10]. Согласно другому исследованию [11—14], наличие эндометриоза также коррелирует с тревожными и депрессивными состояниями и часто ведет к неудовлетворенности в профессиональной и социально-экономической сфере, высокому уровню психологического стресса. Известно, что с момента возникновения хронической тазовой боли у женщин с эндометриозом начинает прогрессировать социальная изоляция. Все вышеперечисленное подчеркивает необходимость мультидисциплинарного подхода к лечению этой болезни [15].
Итак, эндометриоз оказывает большое влияние на профессиональную и личную жизнь пациенток, а эффективное лечение данного заболевания позволяет значительно улучшить качество жизни женщин.
В настоящее время в мире не существует единой стратегии выбора и назначения гормональной терапии у больных эндометриозом. Современные подходы к комбинированному лечению эндометриоза предполагают использование агонистов гонадотропин-рилизинг гормона (аГнРГ) в качестве эффективного медикаментозного лечения. Однако применение такой терапии сопровождается выраженными побочными эффектами, обусловленными гипоэстрогенемией, что снижает приверженность к данному виду лечения и обусловливает невозможность ее пролонгированного применения без дополнительного назначения add-back терапии.
Важным является следующий постулат — для эффективного лечения генитального эндометриоза необходимо, чтобы гормональный препарат подавлял овуляцию, т. е. обладал антигонадотропным свойством. Однако без овуляции невозможно планировать беременность. На первый взгляд, это две взаимоисключающие стратегии лечения. Однако, согласно подходам к выбору терапии, сначала необходимо проводить гормональную терапию эндометриоза с использованием препаратов с антигонадотропным действием, что позволит не только воздействовать на различные аспекты патогенеза заболевания, но и сохранить желанную беременность и проводить профилактику рецидива заболевания. На следующем этапе лечения пациентке назначаются препараты, на фоне которых планируется наступление беременности (прогестагены, не обладающие антигонадотропным свойством).
Согласно рекомендациям ESHRE (EuropeanSocietyforHumanReproductionandEmbryology), гестагены «…можно рассматривать как терапию выбора для лечения эндометриоза, так как они также эффективны для уменьшения тяжести заболевания по [лапароскопической] шкале оценки и для борьбы с болевым синдромом, как даназол и агонисты ГнРГ, более дешевые и характеризуются более низкой частотой побочных эффектов» [16].Поэтому, учитывая хорошую переносимость прогестагенов, минимальные метаболические эффекты и низкую стоимость, они могут рассматриваться как препараты выбора [17].
Известно, что возникновение и прогрессирование эндометриоидных гетеротопий зависят от системного и локального уровня эстрогенов и сопровождаются увеличением локальной концентрации цитокинов, хемокинов и факторов роста.
Механизм действия прогестагенов, обладающих антигонадотропным свойством, базируется на воздействии на гипоталамо-гипофизарно-яичниковую ось, приводящем к ановуляции, снижению уровня эстрогенов в сыворотке, децидуализации и последующей атрофии эндометриоидных гетеротопий, понижению уровня перитонеальных маркеров воспаления, а также модулированию иммунного ответа, вовлеченного в патогенез эндометриоидной болезни [18—20].
Диеногест является прогестагеном 4-го поколения и объединяет фармакологические свойства группы прогестерона и прогестероноподобных соединений, а также производных 19-нортестостерона. Специфичность его действия дополняется минимальными влияниями на метаболические параметры. Диеногест — первый гестаген, который дает клинически значимый антиандрогенный эффект, при этом не проявляя эстрогенной и андрогенной активности [21]. Исследования показали, что диеногест оказывает ановуляторное и антипролиферативное влияние за счет подавления секреции цитокинов в строме эндометриальных клеток [17].
Таким образом, диеногест характеризуется хорошей переносимостью, относительно умеренным ингибирующим действием на секрецию гонадотропинов, а также сильным прогестагенным влиянием на эндометрий и высокой биодоступностью при приеме внутрь (>90%) [22, 23].
Диеногест в дозе 2 мг был специально разработан для комплексного лечения эндометриоза и изучен в специальной программе исследований [24].
Известно, что, кроме эстрогенов, на прогрессирование заболевания в значительной мере оказывают влияние медиаторы воспаления, в большом количестве синтезирующиеся в эндометриоидных гетеротопиях [25]. Рецепторы прогестерона, являющиеся основной точкой приложения диеногеста, принимают участие в регуляции местной воспалительной реакции, подавляя ее через ядерный фактор κB (NF-κB — фактор транскрипции, отвечающий за синтез провоспалительных цитокинов) [26]. Кроме того, определено, что в эндометриоидной ткани существует обратная связь между NF-κB и экспрессией прогестероновых рецепторов В [27].
Таким образом, эффективность диеногеста во многом обусловлена его противовоспалительным действием. В 2015 г. группой ученых из Италии и Швейцарии был проведен систематический обзор о влиянии диеногеста на воспалительную реакцию в очагах эндометриоза. Проанализированы данные 15 исследований, на основании которых получено достоверное подтверждение противовоспалительного действия диеногеста на эпителиальные клетки в очагах эндометриоза через прогестероновые рецепторы [28]. Но при изучении стромальных клеток эндометриоидных гетеротопий было отмечено аналогичное влияние препарата, несмотря на блокирование прогестагенного воздействия. В эксперименте с созданием модели эндометриоза на крысах [29] антипролиферативный эффект диеногеста сохранялся даже при применении блокатора прогестероновых рецепторов, также как увеличение экспрессии матричной РНК интерлейкина (IL)-8, ассоциированное с диеногестом, не было подавлено при применении антигестагенов [30]. Полученные данные позволяют предположить наличие дополнительных механизмов противовоспалительного действия диеногеста. Это было подтверждено в исследовании 2015 г., в котором проводился сравнительный анализ изменения интенсивности тазовых болей и качества жизни у пациенток, принимавших диеногест и нестероидные противовоспалительные препараты (НПВП). Больные наружным генитальным эндометриозом (НГЭ), получавшие терапию диеногестом, отмечали снижение болевых ощущений во время менструации на 61% по визуально-аналоговой шкале (ВАШ), а также значительное улучшение качества жизни. Применение НПВП не оказало существенного влияния на оценку женщинами интенсивности болевых ощущений и качества жизни, 25% пациенток в этой группе отказались от участия во время исследования (по сравнению с 5% в группе диеногеста) [31].
В патогенезе болевого синдрома одну из главных ролей играет повышенный уровень медиаторов воспаления в эндометриоидном очаге, включающих простагландины, цитокины и факторы роста. Последние данные свидетельствуют о том, что фактор роста нервов (ФРН) является одним из ключевых медиаторов, который вызывает боль, ассоциированную с эндометриозом. ФРН способствует увеличению сенсорных нейронов в очаге эндометриоза и повышению количества ноцицептивных рецепторов на них. Активность этого фактора регулируется воспалительными цитокинами, такими как фактор некроза опухоли α (TNF-α) и IL-1β [22, 23].
В 2014 г. японскими учеными [32] в эксперименте invivo
было убедительно продемонстрировано, что диеногест уменьшает уровень TNF-α и IL-1β и тем самым подавляет экспрессию ФРН в эндометриоидной ткани, способствуя уменьшению болевого синдрома. При иммуногистохимическом анализе эндометриоидных гетеротопий женщин, получавших диеногест, было установлено его влияние на уровень ферментов, участвующих в локальном метаболизме эстрогенов в патологических очагах. Диеногест подавляет чрезмерную продукцию эстрогенов путем ингибирования ароматазы и 17β-гидроксистероиддегидрогеназы [33]. В одном из недавних исследований [34] было определено, что диеногест подавляет уровень фактора роста мидкайна в перитонеальной жидкости больных эндометриозом. Кроме того, диеногест также оказывает супрессивное влияние на экспрессию мидкайна в культуре эндометриальных стромальных клеток у больных эндометриозом. Важно отметить, что медроксипрогестерона ацетат и норэтистерона ацетат не продемонстрировали аналогичного эффекта. Полученные данные могут служить еще одним объяснением эффективности терапии диеногестом.
Таким образом, диеногест в настоящее время является патогенетически обоснованным препаратом выбора для лечения генитального эндометриоза. Однако опыт рутинного применения данного вида терапии в клинической практике и длительное наблюдение за пациентками имеют важное значение.
Цель исследования — оценить эффективность и переносимость длительного применения диеногеста 2 мг, а также возможность реализации репродуктивных планов, профилактику рецидивов у больных с НГЭ.
Результаты и обсуждение
Проанализированы результаты наблюдения 937 больных НГЭ, которые получили 6-месячный курс терапии диеногестом 2 мг, 572 пациентки в дальнейшем продолжили данный вид лечения. У всех больных диагноз НГЭ был установлен на основании лапароскопии и подтвержден результатами гистологического исследования. Согласно классификации Американского общества фертильности (R-AFS), I степень распространенности заболевания диагностирована у 66 (7%) больных, II степень — у 223 (23,8%), III степень — у 254 (27,1%) и IV степень — у 394 (42,1%). Таким образом, у большинства — 648 (69,2%) больных был отмечен распространенный эндометриоз. Позадишеечный эндометриоидный инфильтрат наблюдался у 246 (26,3%) пациенток, экстрагенитальный эндометриоз (аппендикс, толстая кишка, мочевой пузырь, диафрагма) был выявлен у 81 (8,7%) больной. У 628 (67%) женщин заболевание носило рецидивирующий характер. Одной из проблем лечения эндометриоза является снижение овариального резерва после хирургического лечения, что в свою очередь может оказывать негативное влияние на репродуктивную функцию. Наиболее часто определяемым предиктором низкого ответа яичников при стимуляции овуляции можно считать снижение уровня антимюллерова гормона (АМГ) в периферической крови. Доказано, что эндометриоидные кисты снижают овариальный резерв, причем цистэктомия оказывает еще большее негативное влияние на него, что выражается в снижении уровня АМГ. Таким образом, потенциальное влияние многих обычных хирургических процедур на овариальный резерв является значимым. У больных с рецидивирующим характером течения эндометриоза терапия аГнРГ в анамнезе имела место у 402 (64%) пациенток. На основании определения уровня АМГ в сыворотке крови сниженный овариальный резерв отмечен у 694 (74,1%) женщин с НГЭ, средний уровень АМГ составил 0,56±0,29 нг/мл.
Согласно данным литературы [35], эндометриоз обнаруживается у 15—80% женщин, подвергнувшихся лапароскопическому вмешательству по поводу хронической тазовой боли. В структуре жалоб пациенток с эндометриозом преобладает болевой синдром, который может выражаться в виде дисменореи, диспареунии, хронической тазовой боли, дизурии и дисшизии. Исследования показали, что в половине случаев женщины, оперированные по поводу эндометриоза, впоследствии продолжают страдать от диспареунии, что приводит к проблемам в сексуальной жизни и отношениях с партнером [36]. На основе изучения субъективной оценки состояния здоровья (SF-36v2) по 8 ключевым аспектам и общему результату было установлено значимое снижение показателей общего здоровья у больных эндометриозом по сравнению с контрольной группой [37]. Важно отметить, что выраженность негативного влияния эндометриоза была сопоставима с таковой у пациенток с болезнью Крона [37].
Многоцентровое исследование [38] профессиональной деятельности больных эндометриозом показало, что симптомы заболевания оказывают негативное влияние на производительность труда на рабочем месте, что соответствует потере около одного рабочего дня в неделю. В другом исследовании [14] было определено, что 85% пациенток с эндометриозом отмечали явное снижение качества их работы, 19% сообщили, что не могут работать из-за боли и 69% пациенток отметили, что продолжают работать, несмотря на болезненные ощущения. Известно, что рецидив дисменореи в течение года после лапароскопического вмешательства отмечен почти у каждой третьей пациентки, не получавшей медикаментозного лечения [39].
Поэтому применение гормономодулирующей терапии для устранения болевого синдрома является одной из наиболее важных задач. До начала терапии диеногестом 2 мг дисменорея отмечалась у 772 (82,4%) больных НГЭ, диспареуния — у 439 (46,9%), жалобы на тазовую боль, не связанную с менструальным циклом, предъявляли 384 (41%), дизурия во время менструальной реакции была характерна для 28 (3%), дисшизия — для 37 (3,9%) пациенток.
На фоне 6-месячного курса применения диеногеста отмечено достоверное уменьшение болевого синдрома: выраженность дисменореи снизилась в 4,4 раза (18,7%), диспареунии — в 2 раза (23,5%), тазовой боли — в 2,5 раза (16,4%), дизурии — в 3 раза (1% на фоне лечения), дисшизии — в 3,4 раза (1,2%). Также проведена оценка динамики болевого синдрома у 572 больных НГЭ на фоне пролонгированного применения диеногеста 2 мг. Продолжительность терапии составила от 10 до 37 мес (в среднем 29,5±8,2 мес). Наблюдалось дальнейшее достоверное уменьшение выраженности болевого синдрома: дисменореи на 89%, тазовых болей на 85,8%, диспареунии на 81,6%, дисшизии на 98,9%, дизурии на 99,3% (см. рисунок).
Динамика болевого синдрома на фоне терапии диеногестом.
Известными и ожидаемыми побочными эффектами на фоне терапии прогестагенами являются нарушения менструального цикла, проявляющиеся нерегулярными, различными по длительности и обильности кровяными выделениями. Для повышения приверженности терапии с больными до начала применения диеногеста 2 мг была проведена беседа относительно возможных изменений характера кровотечений. При назначении диеногеста 2 мг в течение 6 мес регулярный менструальный цикл сохранился у 72 (12,6%) больных, однако менструации стали значительно более скудными. Нарушения менструального цикла по типу «межменструальных» мажущих кровяных выделений наблюдались у 261 (45,6%) женщины, эпизоды «прорывных кровотечений» были у 23 (4,0%). Отмечена достаточно высокая частота аменореи в данной группе — у 215 (37,6%) больных. На фоне пролонгированного приема диеногеста 2 мг регулярный менструальный цикл отмечен лишь у 6,8% больных. С увеличением продолжительности терапии наблюдалось снижение интенсивности, частоты и длительности межменструальных кровяных выделений — у 48,1% пациенток, нарушения менструального цикла по типу опсоменореи отмечены у 5,4%, увеличилось число пациенток с аменореей — 39,7%. Эпизоды «прорывных кровотечений» на фоне пролонгированного применения диеногеста наблюдались у 0,5% пациенток с НГЭ.
Любопытными являются данные о реализации репродуктивной функции у 314 больных НГЭ c бесплодием в возрасте от 27 до 39 лет после терапии диеногестом 2 мг. Первичное бесплодие отмечено у 216 (68,8%) пациенток, вторичное бесплодие — у 98 (31,2%). Длительность первичного бесплодия составила 6,3±2,8 года, вторичного — 5,4±2,3 года. Рецидивирующий характер течения заболевания в анамнезе до назначения диеногеста 2 мг отмечен у 135 (43%) пациенток, сниженный овариальный резерв — у 186 (59,2%). Учитывая собственный опыт, мы рекомендуем планирование беременности в естественном цикле или вступление в протокол экстракорпорального оплодотворения (ЭКО) сразу после окончания терапии прогестагеном. После гормономодулирующей терапии диеногестом беременность наступила у 106 (33,8%) женщин; из них в естественном цикле у 41,5% и в результате проведения процедуры ЭКО у 58,5% пациенток. У 33% женщин беременность наступила через 3—5 циклов после отмены диеногеста 2 мг. В связи с тем что диеногест оказывает умеренно выраженное действие на уровень гонадотропинов, его применение оправдано у больных со сниженным овариальным резервом.
Клинический пример
Больная В
., 32 лет. В 2008 г. был установлен диагноз НГЭ IV степени. Двусторонние эндометриоидные кисты. Позадишеечный эндометриоидный инфильтрат. Выполнена лапароскопия. Двусторонняя резекция яичников по поводу эндометриоидных кист, иссечение позадишеечного эндометриоидного инфильтрата. В течение 2 лет принимала комбинированный контрацептив (КОК), содержащий 30 мкг этинилэстрадиола.
В период с 2010 по 2013 г. выполнено три попытки ЭКО без эффекта.
В 2014 г. произведена повторная лапароскопия. Диагноз НГЭ III степени, рецидив. Эндометриоидная киста левого яичника. Позадишеечный эндометриоидный инфильтрат (рецидив). Произведена резекция левого яичника, иссечение позадишеечного эндометриоидного инфильтрата и очагов эндометриоза.
После операции получала гормональную терапию: аГнРГ в дозе 3,75 мг внутримышечно через 28 дней № 6. После окончания терапии пациентка вступила в протокол ЭКО — без эффекта.
В 2015 г. в связи с появлением болевого синдрома и рецидивом эндометриоза была выполнена третья лапароскопия, адгезиолизис, правосторонняя цистэктомия. Диагноз НГЭ IV степени, рецидив. Киста правого яичника. Установлен противоспаечный барьер.
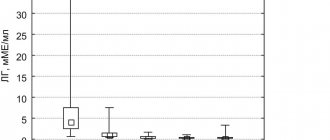
Уровень АМГ после операции (4-й день менструального цикла) составил 0,42 нг/мл, ФСГ —13,7 мМЕ/мл.
Пациентке был назначен диеногест в дозе 2 мг 1 раз в день в течение 6 мес. Сразу после окончания терапии больной была проведена стимуляция суперовуляции в программе ВРТ. Наступила беременность, которая сопровождалась явлениями угрозы прерывания беременности в I и во II триместрах. Пациентка была родоразрешена путем кесарева сечения при сроке 38—39 нед.
Заслуживает внимания следующий клинический случай, который нечасто заканчивается наступлением беременности в рутинной практике.
Пациентка В
., 36 лет, обратилась с жалобами на первичное бесплодие в течение 7 лет, мажущие темно-коричневого цвета выделения до и после менструации, диспареунию. Менархе c 11 лет, менструальный цикл регулярный, через 27—30 дней, по 5—6 дней, болезненные менструации.
В 2009 г. выполнена лапароскопия. Левосторонняя тубэктомия. Диагноз: хронический двусторонний сальпингоофорит. Пиосальпинкс слева. Результаты гистологического исследования: флегмонозный сальпингит. Получала КОК в течение года. Проведена гистеросальпингография — проходимость правой маточной трубы сохранена.
С 2011 по 2013 г. проведено 6 циклов стимуляции овуляции гонадотропинами — без эффекта. Результаты гормонального исследования: ФСГ — 8,4 мМЕ/мл, АМГ — 0,64 нг/мл.
В 2013 г. выполнена гистерорезектоскопия в связи с железистым полипом эндометрия. В дальнейшем проведено 4 цикла стимуляции овуляции — без эффекта.
В 2015 г. обратилась в ФГБНУ «НИИ АГиР им. Д.О. Отта». Учитывая жалобы и анамнез пациентки, проведена лапароскопия, гистероскопии и иммуногистохимическое исследование эндометрия.
Диагноз: НГЭ II степени. Бесплодие первичное 7 лет. Хромогидротубация справа — маточная труба проходима. Произведено иссечение очагов эндометриоза.
На основании результатов иммуногистохимического исследования эндометрия — хронический эндометрит.
Результаты гормонального исследования (на 3-й день менструального цикла): ФСГ — 10,1 мМЕ/мл, АМГ— 0,32 нг/мл. Учитывая сниженный овариальный резерв, пациентке был рекомендован прием диеногеста 2 мг в течение 6 мес. От проведения процедуры ЭКО пациентка категорически отказывалась, настаивала на планировании беременности в естественном цикле. Результаты спермограммы мужа — нормозооспермия.
Через два цикла после окончания курса терапии диеногестом у пациентки самостоятельно наступила беременность, в настоящее время — срок 22—23 нед.
Несомненно, каждый лекарственный препарат может вызывать побочные эффекты. На фоне лечения диеногестом 2 мг наиболее часто наблюдались изменения настроения — у 143 (15,3%) женщин, мастодиния — у 132 (14%), увеличение массы тела — у 91 (9,7%), аcnevulgaris
— у 78 (8,3%), жалобы на головную боль или головокружение — у 34 (3,6%). Вышеперечисленные побочные эффекты были легкими или умеренновыраженными и не явились причиной для досрочного окончания лечения.
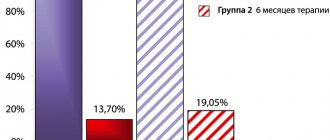
В мультицентровом исследовании VISADO [40] по применению диеногеста 2 мг у подростков с болевым синдромом, ассоциированным с эндометриозом, была отмечена безопасность и хорошая переносимость препарата в данной субпопуляции. Выраженность болевого синдрома, ассоциированного с эндометриозом, снизилась с 64,3 до 9 баллов (на основании ВАШ). Кроме того, в данном исследовании проводилось изучение минеральной плотности кости (МПК) на фоне применения диеногеста. После года лечения отмечалось минимальное снижение МПК (на 1,2%), постепенно восстанавливающейся в течение следующих 6 мес. У одной пациентки было выявлено снижение костной массы на 6,6%, что было оценено как непредвиденная нежелательная реакция. Данное исследование [40] показало безопасность и хорошую переносимость диеногеста у подростков с симптомами эндометриоза.
Известно, что современные женщины имеют индивидуальные факторы риска снижения МПК, связанные с образом жизни и питания, а также с наследственной предрасположенностью и медикаментозной терапией. Ряд препаратов для лечения эндометриоза (аГнРГ, антилюлиберины, ингибиторы ароматазы и депо-формы медроксипрогестерона ацетата) оказывает влияние на снижение МПК. Следует напомнить, что в представленной в нашем исследовании группе больных терапия агонистами ГнРГ в анамнезе отмечена у 64% пациенток. Поэтому при пролонгированном применении диеногеста 2 мг является целесообразным длительное назначение препаратов кальция с витамином D3, что мы и применяем в рутинной практике. Результаты повторных остеоденситометрий (поясничный отдел позвоночника и проксимальные отделы бедра) подтвердили отсутствие значимых изменений МПК на фоне такой терапии. У пациенток с диагностированным остеопорозом или выраженной остеопенией, установленными до начала применения диеногеста 2 мг, назначаются бисфосфонаты (преимущественно ибандроновая кислота) на фоне обязательного приема препаратов кальция с витамином D3 и остеотропными минералами.
Несомненно, особое внимание следует уделить современным аспектам назначения КОК для лечения эндометриоза. Известно, что механизм действия КОК осуществляется посредством торможения гипотоламо-гипофизарно-яичниковой системы, в результате в яичниках подавляется фолликулогенез и овуляция, снижается продукция эстрадиола. Использование КОК вызывает регресс пролиферативных процессов в первой фазе менструального цикла и неполноценную секреторную трансформацию во второй. При длительном приеме эстроген-прогестагенных контрацептивов происходит инволюция железистого эпителия эндометрия, а нередко его атрофия, строма подвергается децидуальной трансформации (состояние «псевдобеременности»), степень выраженности которой зависит от гестагенного компонента.
В последние годы в литературе появляются данные о возможном негативном влиянии КОК на течение эндометриоза. Учитывая, что эндометриоз характеризуется «прогестеронорезистентностью», а основным действующим компонентом в КОК является прогестаген, ряд исследователей предупреждают о возможном неполноценном взаимодействии комплекса гормон—рецептор и, как следствие, о недостаточном прогестагенном влиянии данного компонента и о негативной эстрогенной стимуляции, связанной с применением эстрогенного компонента в составе контрацептивного препарата. Несмотря на это, достаточно часто в условиях амбулаторного этапа лечения пациенткам после операции назначаются КОК. Длительное применение КОК, назначаемых в стандартном циклическом режиме, сопровождается так называемыми «масками ложного благополучия» эндометриоза, проявляющегося временным уменьшением симптомов, в первую очередь болевого синдрома (дисменореи, диспареунии, тазовой боли).
Согласно данным, полученным в ФГБНУ «НИИ АГиР им. Д.О. Отта», использование диеногестсодержащего КОК с 30 мкг этинилэстрадиола в циклическом режиме после оперативного лечения НГЭ характеризуется высокой частотой и степенью тяжести рецидивов заболевания [41]. Важно отметить, что рецидивы НГЭ, установленные на основании повторной лапароскопии после циклического применения вышеописанного КОК, в большинстве случаев сопровождались иссечением эндометриоидных инфильтратов. При проведении первой лапароскопии эндометриоидные инфильтраты обнаружены не были [41]. В одном из метаанализов также было показано, что у 95% больных, получавших КОК в связи с тяжелой первичной дисменореей, впоследствии был диагностирован глубокий инфильтративный эндометриоз [42].
Очевидно, что КОК не являются причиной возникновения эндометриоза — они только «маскируют» его проявления, уменьшая выраженность болевого синдрома. Как уже было отмечено, у всех пациенток до назначения данной группы препаратов наблюдался важный патогномоничный симптом эндометриоза — тяжелая дисменорея. Полученные данные показывают нецелесообразность применения КОК в циклическом режиме у больных НГЭ. Кроме того, известно, что при применении КОК в стандартном циклическом режиме с 7-дневным перерывом, уже с 4-го дня этого перерыва происходит рост фолликула, который при достижении размеров 8—10 мм обладает ФСГ-зависимой ароматазной активностью и, следовательно, эстрогенной активностью. Таким образом, согласно исследованиям [43], в настоящее время невозможно исключить вероятность того, что защитный эффект КОК (временное уменьшение болевых симптомов) при эндометриозе приводит к несвоевременному, отсроченному оперативному вмешательству. Известно, что КОК снижают выработку эндогенного эстрадиола за счет антигонадотропного действия, при этом вопрос заключается в том, не будет ли эстрогенный компонент стимулировать прогрессирование заболевания?
Вышесказанное также подтверждается следующим клиническим примером:
Больная Б
., 34 лет, обратилась в ФГБНУ АГиР им. Д.О. Отта, 31.03.16 с жалобами на дисменорею, дизурические явления во время менструации, мажущие кровяные выделения до и после менструации, выраженную диспареунию. Из анамнеза известно: менархе с 13 лет, менструальный цикл регулярный, через 26—28 дней, по 5 дней, менструации болезненные. Половая жизнь с 24 лет. Беременностей не было. В связи с альгодисменореей с момента наступления менархе получала КОК
(в течение 20 лет!)
.
На фоне 14-летнего приема КОК в 2009 г. выполнена лапароскопия, двусторонняя цистэктомия, удаление единичного миоматозного узла. Послеоперационный диагноз: НГЭ IV степени. Миома матки. Аденомиоз. Гистологическое заключение: эндометриоидные кисты, лейомиома матки. В послеоперационном периоде получала КОК Жанин 6 мес, далее Фемоден в режиме контрацепции — 3 года.
В 2012 г. проведена повторная лапароскопия, двусторонняя цистэктомия, адгезиолизис, сальпинголизис, хромогидротубация. Диагноз: НГЭ IV степени, рецидив. Двусторонние кисты яичников. Эндометриоз тазовый брюшины. Аденомиоз. Спаечный процесс 3—4-й степени. При хромогидротубации правая маточная труба непроходима, левая маточная труба проходима. Гистологическое заключение: эндометриоидные кисты яичников. Назначен КОК Евра трансдермально, который пациентка получала до ноября 2015 г. После отмены КОК в связи с планированием беременности появились жалобы на отсутствие менструального цикла на протяжении 6 мес, приливы, потливость в течение дня. Отметила возобновление менструальной реакции 07.16 через 3 мес на фоне фитотерапии.
Объективно
: рост 173 см, масса тела — 73 кг, индекс массы тела — 24,5 кг/м2. АД 120/80 мм рт.ст. Молочные железы с умеренно выраженными признаками диффузного фиброаденоматоза. Лактореи нет.
Гинекологическое исследование
. В зеркалах: шейка матки с небольшой эктопией. Выделения слизисто-беловатые, скудные.
PV
: матка в интерпозиции, небольших размеров, неоднородной консистенции, подвижная, безболезненная. Пальпация заднего свода болезненная. Слева кзади от матки пальпируются придатки в виде тугоэластического образования, диаметром 6 см, в сращениях. Справа придатки отчетливо пропальпировать не удается. Признаки грубого рубцово-спаечного процесса в малом тазу.
Данные гормонального исследования от 07.16 (3-й день менструального цикла): АМГ — 0,22 нг/мл, ФСГ — 89,80 мМЕ/мл, ЛГ — 46,92 мМЕ/мл, пролактин — 263 мкМЕ/мл, прогестерон — 1,10 нг/мл, эстрадиол — 214 пг/мл. СА 125 от 03.16 — 69,40 МЕ/мл.
По данным магнитно-резонансной томографии (МРТ) органов малого таза от 05.16: состояние после повторных оперативных вмешательств. МР-признаки диффузного аденомиоза. МР-признаки кисты левого яичника, размером 52×35 мм, с геморрагическим содержимым (вероятно, эндометриоидная). Зона по ходу пузырно-маточной складки слева, наиболее вероятно, представлена очагом эндометриоза. Признаки спаечного процесса в малом тазу.
Клинический диагноз: НГЭ, рецидив? Киста левого яичника (эндометриоидная). Аденомиоз. Эндометриоз мочевого пузыря? Гипергонадотропная нормопролактинемическая недостаточность яичников. Отягощенный гинекологический анамнез (дважды — двусторонняя резекция яичников в анамнезе, НГЭ IV степени, рецидивирующий, миомэктомия).
Приведенный клинический пример еще раз подчеркивает необходимость определения овариального резерва у пациенток после оперативного вмешательства на яичниках для выбора гормономодулирующей терапии и реализации репродуктивной функции.
Несомненно, невозможно отказаться от применения КОК у больных эндометриозом, так как многие пациентки нуждаются в эффективной контрацепции, регуляции менструального цикла, коррекции болевого синдрома. Однако вопрос о необходимости пролонгированного режима применения КОК и минимальной дозе эстрогенного компонента в их составе у больных НГЭ имеет принципиальное значение [44].
Поэтому для лечения эндометриоза используются только монофазные препараты, с минимальной дозой эстрогенного компонента, возможен выбор препаратов с повышенной дозой гестагенного компонента и рекомендуется применять так называемый «пролонгированный» режим приема КОК, хотя данный режим зарегистрирован не у всех КОК. Возможно применение КОК, содержащих в своем составе эстрогены, биоидентичные натуральным, например, препарат, содержащий диеногест с 17β-эстрадиолом.
Следует помнить, что эффективность медикаментозной терапии и частота рецидивов также зависят от качества выполненного оперативного лечения. На основании данных ФГБНУ «НИИ АГиР им. Д.О. Отта» был проведен ретроспективный анализ эффективности различных видов гормональной терапии у больных НГЭ после оперативного лечения. 573 пациентки получали терапию аГнРГ 6 циклов, 464 — диеногест 2 мг в течение 6 мес, 176 — КОК в стандартном режиме (преимущественно содержащие 30 мкг этинилэстрадиола), 6—8 мес, 158 — ингибиторы ароматазы на фоне прогестагена (линестренола), 6 мес. Частота рецидивов заболевания в группе пациенток, получавших КОК для терапии эндометриоза, оказалась наиболее высокой — 67,1%; после терапии аГнРГ — 14,3%; после применения диеногеста 2 мг — 11,9%; после терапии ингибиторами ароматазы на фоне прогестагенов — 8,2%.
Современные прогестагены в лечении эндометриоза (обзор международных исследований)
Д.м.н., проф. Г.Е. ЧЕРНУХА Проблемы репродукции 2012;№ 4:68-71 Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития (дир. — акад. РАМН Г.Т. Сухих)
Эндометриоз можно считать распространенным гинекологическим заболеванием, встречается у 6-10% женщин репродуктивного возраста. При хронических тазовых болях и бесплодии наблюдается в 40-70% и 30-50% соответственно (1,2). Эндометриоз – это доброкачественное разрастание ткани, функционально и морфологически подобной нормальному эндометрию, которое характеризуется повышенным локальным образованием эстрогенов и чувствительностью к ним, а также резистентностью к прогестерону. Сопутствующий воспалительный процесс, иммунологическая дизрегуляция, ингибирование апоптоза, активация ангиогенеза – патогенетические факторы, способствующие выживанию и росту эндометриоидных имплантов (1).
Хирургическое лечение принято считать терапией первой линии, однако риск рецидивов высок (40-50% в течение 5 лет) (3). Гормонотерапию относят к альтернативе хирургическому лечению при симптомах, характерных для эндометриоза и отсутствии абсолютных показаний к оперативному лечению, гормонотерапию применяют также в качестве послеоперационной адьювантной терапии, снижающей риск возникновения рецидивов. Гормонотерапия эндометриоза основана на двух основных стратегиях. Это либо создание состояния «псевдоменопаузы» за счет блокады гипофизарно-яичниковой системы с инициацией гипоэстрогении, приводящей к атрофии очагов эндометриоза, (агонисты и антагонисты ГнРГ, ингибиторы ароматазы), либо индукция состояния псевдодецидуализации с последующей блокадой пролиферации и атрофией очагов эндометриоза (КОК, прогестагены, селективные модуляторы прогестероновых рецепторов). До недавнего времени «золотым стандартом» медикаментозной терапии считались агонисты ГнРГ. Однако при их применении более 6 месяцев (без «возвратной терапии» эстрогенами) возникают нежелательные гипоэстрогенные эффекты, как то: приливы, сухость влагалища, головная боль, снижение либидо, потеря минеральной плотности костной ткани (МПКТ) (4). В последние годы повышается внимание к антагонистам ГнРГ и ингибиторам ароматаз, однако их эффективность и безопасность нуждаются в углубленном изучении (5,6). Эндометриоз традиционно считают персистирующим, рецидивирующим заболеванием, требующим длительного лечения, поэтому нужно думать о безопасности и степени переносимости препаратов, в связи с этим ведущие специалисты Международных обществ к терапии первой линии относят КОК и прогестагены (7,8). Но лишь некоторые прогестагены в настоящее время одобрены регулирующими органами для лечения эндометриоза, к числу этих препаратов в нашей стране относят диеногест в дозе 2 мг в сутки. Преимущества прогестагенов.
Прогестагены используют для лечения и профилактики рецидивов эндометриоза, поскольку по эффективности они не уступают аГнРГ и КОК. Во — первых, прогестагены обладают «центральным воздействием», угнетая систему гипоталамус-гипофиз-яичники, вследствие этого снижается секреция эстрогенов, во-вторых, при непрерывном приеме они оказывают прямое влияние на очаги эндометриоза, вызывая дифференциацию стромальных клеток (децидуализацию) и атрофию железистого компонента эндометрия. В третьих, прогестагены активируют фермент 17 бета-гидроксистероид-дегидрогеназу, преобразующий эстрадиол в «слабый» эстрон, это меняет эстрогенный баланс на локальном уровне (9). Прогестагены оказывают также блокирующее влияние на ключевые звенья патогенеза – пролиферацию, ангиогенез и воспаление. Диеногест- прогестаген четвертого поколения.
Диеногест (ДНГ) относят к прогестагенам четвертого поколения, он сочетает свойства производных 19 – нортестостерона (доказаны высокая селективность и антипролиферативная активность, короткий период полувыведения из кровотока, высокая биодоступность при пероральном применении, низкий риск кумуляции при ежедневном приеме) и свойства прогестерона (хорошая переносимость, отсутствие негативных метаболических, сосудистых и печеночных эффектов (10-13). Особенность химической структуры ДНГ – отсутствие этинильного радикала, вероятно, обуславливает его метаболическую нейтральность. Это преимущество, позволяющее длительно использовать ДНГ. В настоящее время ДНГ, фактически, единственный пероральный прогестаген, эффективность и безопасность которого доказана в двух параллельных клинических программах, выполненных в Японии и Европе (в сравнении с плацебо или с аГнРГ). Клинические исследования диеногеста.
Рандомизированные контролируемые клинические исследования продолжительностью от 12 до 24 недель предоставили информацию об оптимальной эффективной дозе препарата (2 мг/сутки) и подтвердили его хорошую переносимость. По данным визуальной аналоговой шкалы (ВАШ) эта доза купирует, вызванную эндометриозом, боль: дисменорею, диспареунию, диффузную тазовую боль, этот эффект связан с атрофией эндометриоидных очагов по rAFS шкале (14,15).
Внимание заслуживают результаты трех независимых исследований, продолжительностью от 16 до 24 недель, в них проводилось прямое сравнение ДНГ с различными формами аГнРГ – стандартной терапией эндометриоза (16-18). В выполненном в Европе исследовании (17) 252 пациентки с эндометриозом получали ДНГ (2мг/мг) или депо-лейпролида ацетата (ЛПА) в стандартной дозе (3,75 мг внутримышечно каждые 4 недели). Лечение сопровождалось сходным по продолжительности уменьшением тазовой боли, к 24 неделе снижение среднего значения показателя ВАШ составило 47, 5 мм для ДНГ и 46,0 мм для ЛПА. Отмечалось также выраженное улучшение физического и ментального благополучия по данным анкетирования (модифицированный опросник здоровья – SF-36). В другом многоцентровом исследовании в течение 16 недель проводилось сравнение эффективности ДНГ (2 мг/сутки) и депо-трипторелина (3,75 мг внутримышечно, ежемесячно) в качестве послеоперационного лечения 142 женщин с эндометриозом II-IY стадии (16). Оба препарата оказались одинаково эффективными в купировании симптомов и признаков эндометриоза, в том числе, показателя распространенности эндометриоидных поражений при повторной лапароскопии (не было выявлено существенной разницы в степени тяжести эндометриоза и выраженности спаечного процесса). Эти результаты позволяют утверждать, что ДНГ также эффективен, как трипторелин, даже в отношении достаточно тяжелых форм эндометриоза, гипотеза о превосходстве одного препарата над другим оказалась несостоятельной. Цель третьего, проведенного в Японии, двойного слепого многоцентрового исследования продолжительностью в 24 недели состояла в сравнении эффективности и безопасности ДНГ (2 мг/сутки) и интраназальной формы бусерелина (900 мкг в сутки), в нем участвовала 271 пациентка с эндометриозом (18). ДНГ был также эффективен как бусерелин, выявлено уменьшение выраженности болевого синдрома и распространенности очагов эндометриоза, подтвержденного при повторной лапароскопии. Наибольшие улучшения показателей качества жизни в обеих группах касались снижения физической боли с тенденцией к более выраженному купированию этого симптома на фоне ДНГ.
В целом, в этих прямых сравнительных исследованиях число, характер и выраженность побочных эффектов на фоне лечения ДНГ и аГнРГ были сравнимы, за исключением гипоэстрогенных проявлений, которые встречались существенно чаще при приеме аГнРГ. В группе женщин, получавших ЛПА, выявлено снижение среднего показателя МПКТ в пояснично-крестцовом отделе позвоночника, в то время как на фоне ДНГ отмечался небольшой его прирост, через 6 месяцев установлены достоверные межгрупповые различия (17). В исследуемой популяции японских женщин снижение МПКТ отмечено в обеих группах, но статистически значимые различия оказались лишь на бусерелине (18). При применении ЛПА число дней с «приливами» составило в среднем 4,7 в неделю – на ДНГ лишь 0,82 (17). В другой работе при приеме трипторелина «приливы» отмечались у 61,2% женщин, на фоне диеногеста – только у 9,6% (16). Согласно гипотезе, предложенной Barbieri (19) еще в 1992 году, существует некоторая достаточно низкая пороговая концентрация эстрогенов в сыворотке крови (30-60 пк/мл), которая не позволяет стимулировать рост очагов эндометриоза и предотвращает появление признаков гипоэстрогении, обеспечивает стабильную МПКТ. Доклинические и клинические исследования показали, что ДНГ подавляет овуляцию при умеренном снижении синтеза эстрадиола в яичниках, уровни последнего находятся в пределах «терапевтического» окна действия эстрогенов (10,11). Это не приводит к повышению пролиферации в очагах эндометриоза, но позволяет избежать развития вышеупомянутых симптомов дефицита эстрогенов.
Диеногест – препарат для долгосрочного лечения эндометриоза
Женщинам, которые закончили европейское плацебо-контролируемое 12 – недельное исследование (17), предложили принять участие в открытом дополнительном 53-недельном клиническом испытании, на него дали согласие большинство из них (89%) (20). Общая продолжительность приема ДНГ составила 65 недель, при этом в дополнение к улучшению состояния женщин во время плацебо-контролируемой фазы испытания замечено значимое дальнейшее снижение интенсивности боли. Результаты европейского долгосрочного исследования согласуются с данными, полученными в ходе 52 недельного применения ДНГ (2мг/сутки) у 135 женщин с подтвержденным эндометриозом в Японии (21). Общее улучшение самочувствия определялось по тяжести пяти субъективных симптомов (боль внизу живота, боли в пояснице, дисхезия, диспареуния и боль при влагалищном исследовании) и двух объективных признаков (вовлечение в патологический процесс брюшины Дугласова пространства и подвижности матки). Важно отметить, что умеренное или значительное улучшение общего состояния было выявлено у 72,5% пациенток после 24 недель терапии и у 90,6% — после 52 недель лечения ДНГ. Это означает, что эффективность лечения была не только стабильной, но и возрастающей, не формировалось состояние резистентности. Терапевтический эффект сохранялся как минимум в течение 6 месяцев после отмены ДНГ.
Таким образом, результаты клинических программ, состоящих в подборе дозы препарата, сравнительных исследований с аГнРГ и долговременных исследований (52-65 недель) продемонстрировали высокую эффективность ДНГ (2мг/сутки) для лечения эндометрриоза, значительно превосходящую плацебо и сопоставимую с аГнРГ. Следует особо подчеркнуть, что во всех исследованиях побочные эффекты на фоне ДНГ были незначительными или умеренными. Число случаев маточных кровотечений «прорыва» и их интенсивность снижались по мере продолжительности лечения и не отражались на крайне низких показателях (4,4% и 5%) отказа от дальнейшего лечения (17,18).
Диеногест и вопросы фертильности
Известно, что эндометриоз оказывает негативное влияние на фертильность, его частота среди женщин с бесплодием составляет 30-50%. Ведение бесплодия, обусловленного эндометриозом, вызывает значительные трудности, поскольку до настоящего времени, несмотря на огромное число научных исследований, нет четкого представления о патофизиологических механизмах, препятствующих наступлению беременности, особенно при малых и умеренных формах заболевания. Долгое время не находили эффективного средства лечения эндометриоза, которое бы хорошо переносилось и предсказуемо влияло на овуляцию и сроки восстановления фертильности после прекращения лечения. Результаты мета-анализа многих РКИ (22) показали, что подавление функции яичников для улучшения фертильности при малых и умеренных формах эндометриоза малоэффективно и не рекомендуется пациенткам с единственной целью – восстановление фертильности. В таких случаях лечение должно включать хирургическое удаление эндометриоидных очагов и спаек для восстановления нормальной анатомии органов малого таза или применение вспомогательных репродуктивных технологий, когда самостоятельно беременность не наступает.
В международных рекомендациях последних лет с высоким уровнем доказательности приводятся данные о том, что лапароскопия повышает вероятность наступления беременности, тогда как последующая гормонотерапия при малых формах эндометриоза существенно не увеличивает фертильность и может приводить к отсрочке наступления беременности. Интересные данные приведены в статье M. Cosson и соавт. (16) у 86 женщин с эндометриозом и бесплодием из числа всех участниц. В качестве послеоперационного лечения в течение 16 недель им назначали ДНГ (2мг/сутки) (n=45) или трипторелин по общепринятой схеме (n=41). После отмены ДНГ беременность самостоятельно наступила в 33% случаев, после отмены трипторелина – в 29%, завершилась родами у 29% и 22% соответственно. Это свидетельствует о том, что при наличии бесплодия у женщин с распространенными формами эндометриоза терапия ДНГ по эффективности не уступает лечению аГнРГ и даже несколько снижает риск потерь беременности. В литературе имеются данные о том, что у женщин с эндометриозом, особенно с рецидивами заболевания, подавление функции яичников аГнРГ в течение 3-6 месяцев увеличивает результативность ЭКО (23). Принимая во внимание схожую эффективность ДНГ и некоторые дополнительные положительные воздействия представляется возможным назначение этого препарата перед проведением программ ЭКО, результаты сравнительных клинических исследований докажут целесообразность такого подхода.
Следует отметить и тот факт, что многие женщины с эндометриозом имеют овуляторный менструальный цикл и нуждаются в контрацепции. В настоящее время имеются данные, свидетельствующие о том, что ДНГ (2 мг/сутки) обеспечивает надежный антиовуляторный эффект за счет апоптоза гранулезных клеток доминантного фолликула (11,13, 24). Ингибирование овуляции осуществляется также за счет слабого центрального эффекта (подавления ФСГ и ЛГ) и умеренного снижения уровня эстрогенов в сыворотке крови, что является преимуществом ДНГ по сравнению с различными формами аГнРГ (10,11). Несмотря на подавление овуляции ДНГ пока не зарегистрирован как контрацептивное средство, поэтому женщинам на период лечения приходится рекомендовать использование негормональных методов предохранения от беременности. Во многих работах получены убедительные данные о быстром восстановлении фертильности (в среднем 30 дней) и об успешном наступлении беременности у женщин, получавших достаточно длительное время (сроком до одного года) ДНГ (2мг/сутки) для лечения эндометриоза (20,21,25).
Заключение
Резистентность к прогестерону рассматривается как один из ключевых патогенетических механизмов развития эндометриоза, поскольку отсутствует антагонистическое эстрогенам прогестагенное влияние. Это свидетельствует в пользу выбора прогестагена, обладающего не только выраженной антипролиферативной активностью, но и влиянием на другие патогенетические звенья заболевания и метаболической нейтральностью, обеспечивающей возможность длительного проведения терапии. Многочисленные экспериментальные и клинические исследования позволили раскрыть многие механизмы действия ДНГ и оценить его эффективность для лечения эндометриоза, превышающую таковую при использовании других прогестагенов, а также безопасность. Доказано, что этот прогестаген, схожий по эффективности с аГнРГ, может длительно использоваться для лечения болевого синдрома и профилактики рецидивов эндометриоза, не вызывая неблагоприятных гипоэстрогенных побочных эффектов. ДНГ ингибирует овуляцию на период лечения, при этом не оказывает негативного влияния на восстановление фертильности после отмены лечения. Существует очевидная взаимосвязь эндометриоза и бесплодия, доказано значительное снижение индекса фертильности. Перспективны исследования по эффективности применения ДНГ у женщин с эндометриозом и бесплодием перед проведением ЭКО.
Высокая эффективность терапии ДНГ, немногочисленные побочные действия, возможность длительного использования, способствуют обоснованному выбору оптимального лечения эндометриоза. Существенно, что во всех представленных выше научных исследованиях приводятся сведения о высокой приверженности терапии и желании большинства женщин продолжить лечение. В целом, результаты, выполненных в Европе и Японии научно-исследовательских программ, указывают на то, что ДНГ в спектре других методов гормонотерапии является перспективным средством долгосрочного лечения эндометриоза.
Ссылки
1. Giudice LC. Endometriosis. N Engl J Med 2010;362:2389-98.
2. Littman E, Giudice L, Lathi R, Berker B, Milki A, Nezhat C. Role of laparoscopic treatment of endometriosis inpatients with failed in vitro fertilization cycles. Fertil Steril 2005;84:1574-8
3. Guo SW. Recurrence of endometriosis and its control. Hum Reprod Updare 2009;15:441-61
4. Sagsveen M, Farmer JE, Prentice A, Breeze A. Gonadotrophin-releasing hormone analogues for endometriosis: bone mineral density. 2003;(4):CD001297
5. Küpker W, Felberbaum RE, Krapp M, Schill T, Malik E, Diedrich K. Use of GnRH antagonists in the treatment of endometriosis. Reprod Biomed Online 2002;5:12–16
6. Racine AC, Legrand E, Lefebvre-Lacoeuille C et al Treatment of endometriosis by aromatase inhibitors: efficacy and side effects. Gynecol Obstet Fertil 2010;38:318-23
7. Leyland N, Casper R, Laberge Ph, Singh SS et al. Endometriosis: diagnosis and management. SOGC Clinical and practical guideline. Journal of Obstetrics and Gynaecology Canada 2010;32(7):1-28
8. Management of endometriosis. Practical Bulletin No.114. The American College of Obstetricians and Gynecologists. Obstet Gynecol 2010;116:223-36
9. Bulun S.E. Endometriosis. N Engl J Med 2009;360:268—279
10. Sasagawa S, Shimizu Y, Kami H, Takeuchi T, Mita S, Imada K, et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potent oral endometrial activity due to its efficient pharmacokinetic profile. Steroids 2008;73:222-31.
11. Klipping C, Duijkers I, Faustmann TA, et al. Pharmacodynamic study of four oral dosages of dienogest. Fertil Steril 2010: 94 (suppl): S181
12. Sitruk-Ware R. New progestagens for contraceptive use. Human Reproduction Update, Vol.12, No.2 pp. 169–178, 2006
13. Oettel M, Breitbarth H, Elger W, et al. The pharmacological profile of dienogest. Eur J Contracept Reprod Health Care. 1999;4(S1):2–13
14. Kohler G, Faustmann TA, Gerlinger C, et al. A dose-ranging study to determine the efficacy and safety of 1, 2, and 4 mg of dienogest daily for endometriosis. Int J Gynecol Obstet 2010; 108: 21-5
15. Strowitzki T, Faustmann T, Gerlinger C, et al. Dienogest in the treatment of endometriosis-associated pelvic pain: a 12-week, randomized, double-blind, placebo-controlled study. Eur J Obstet Gynecol Reprod Biol. 2010;151:193–198
16. Cosson M, Querleu D, Donnez J, et al. Dienogest is as effective as triptorelin in the treatment of endometriosis after laparoscopic surgery:Results of a prospective, multicenter, randomized study. Fertil Steril. 2002;77(4):684–692
17. Strowitzki T, Marr J, Gerlinger C, Faustmann T, Seitz C. Dienogest is as effective as leuprolide acetate in treating the painful symptoms of endometriosis: A 24-week, randomized, multicentre, open-label trial. Hum Reprod. 2010;25(3):633–641
18. Harada T, Momoeda M, Taketani Y, et al. Dienogest is as effective as intranasal buserelin acetate for the relief of pain symptoms associated with endometriosis – a randomized, double-blind, multicenter,controlled trial. Fertil Steril. 2009;91(3):675–681
19. Barbieri RL. Hormone treatment of endometriosis: the estrogen threshold hypothesis. Am J Obstet Gynecol 1992;166:740-5.
20. Petraglia F, Hornung D, Seitz C, et al. Reduced pelvic pain in women with endometriosis: efficacy of long-term dienogest treatment. Arch Gynecol Obstet. 2011;285(1): 167–173
21. Momoeda M, Harada T, Terakawa N, et al. Long-term use of dienogest for the treatment of endometriosis. J Obstet Gynaecol Res. 2009;35(6):1069–1076
22. Hughes E, Brown J, Collins JJ, Farquhar C, Fedorkow DM, Vandekerckhove P. Ovulation suppression for endometriosis. Cochrane Database Syst Rev 2007 Jul18;(3):CD000155.
23. Sallam HN, Garcia-Velasco JA, Dias S, Arici A. Long-term pituitary down-regulation before in vitro fertilization (IVF) for women with endometriosis. Cochrane Database Syst Rev 2006 Jan 25;(1):CD004635
24. Moore C, Carol W, Graser T, Mellinger U, Walter F. Influence of dienogest on ovulation in young fertile women. Clin Drug Invest. 1999; 18:271–278
25. Momoeda M, Taketani Y. Randomized double-blind, multicentre, parallel-group dose–response study of dienogest in patients with endometriosis. Jpn Pharmacol Ther. 2007;35:769–783.