Соляная или хлороводородная кислота — раствор хлороводорода (HCl) в воде. Сильная одноосновная летучая кислота. Типичный представитель минеральных (неорганических) кислот, присутствует во многих химических реакциях как реагент или катализатор, например в реакциях этерификации — образовании сложного эфира из карбоновой кислоты и спирта.
Секретируется в желудке человека и других млекопитающих. Давайте узнаем, как выглядит соляная кислота, с чем реагирует и где применяется.
Физические свойства
Хлороводородная кислота — это прозрачная жидкость без цвета с характерным едким запахом. Образуется при пропускании хлороводорода через воду. В реакциях также участвует в жидком состоянии. Хорошо растворяется в воде, т. е. смешивается с ней. Соляная кислота, полученная промышленным путем, имеет слегка желтую окраску из-за примесей элементов. Концентрированная кислота, как и хлороводород, “дымит” во влажном воздухе.
Молекулярная кристаллическая решетка, в узлах которой находятся молекулы HCl, в молекуле — ковалентная полярная связь.
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
NaCl + H2SO4 →150oC NaHSO4 + HCl
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
2NaCl + H2SO4 →550oC Na2SO4 + 2HCl
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
MgCl2 ⋅ 6H2O →t,oC MgO + 2HCl + 5H2O AlCl3 ⋅ 6H2O →t,oC Al(OH)3 + 3HCl + 3H2O
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
MgCl2 + H2O → Mg2OCl2 + HCl
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Химические свойства хлороводородной кислоты
Являясь одноосновной кислотой, т. е. в составе имеет один атом водорода, она диссоциирует в одну ступень:
HCl = H+ + Cl-
Раствор имеет кислотную среду, pH раствора 1-2 в зависимости от концентрации ионов. Окрашивает лакмус в красный цвет, метилоранж — в розовый. Поэтому хлороводородная кислота проявляет кислотные свойства и вступает в реакцию с основными соединениями. Из-за присутствия хлора является довольно сильным окислителем. В данном случает Cl имеет валентность 1, степень окисления -1.
- Взаимодействие с активными металлами (стоят в ряду напряжения до водорода). Образуется соль кислоты и выделяется молекулярный водород:
- 2K + 2HCl → 2KCl + H2 Соли хлороводородной кислоты называются хлоридами.
- С оксидами всех металлов с образованием соли и выделением воды:
- ZnO + 2HCl → H2O + ZnCl2
- С гидроксидами (основаниями) всех металлов:
- Ca(OH)2 + 2HCl → CaCl2 + H2O Это реакция нейтрализации. В продуктах — хлорид и вода. Не образует кислых или основных солей, поскольку одноосновная.
- Вытеснение более слабых летучих кислот из солей металлов:
- Na2CO3 + 2 HCl → H2O + CO2 + 2 NaCl Обычно, в ходе таких реакций выделяется газ, т. к. большинство слабых кислот очень летучи, или выпадает осадок, например в случае с кремниевой кислотой H2SiO3, которая не растворяется в воде.
- Na2CO3 + 2 HCl → H2O + CO2 + 2 NaCl Обычно, в ходе таких реакций выделяется газ, т. к. большинство слабых кислот очень летучи, или выпадает осадок, например в случае с кремниевой кислотой H2SiO3, которая не растворяется в воде.
- Взаимодействие с сильными окислителями (хроматы, дихроматы, KMnO4):
- 2 KMnO4 + 16 HCl → 8 H2O + 5 Cl2 + 2 KCl + 2 MnCl2 Это окислительно-восстановительная реакция. Единственный случай, когда хлористоводородная кислота является восстановителем, а не окислителем.
- Специфическая реакция с аммиаком:
- NH3 + HCl → NH4 Cl По природе это реакция нейтрализации, где соляная кислота — окислитель, а аммиак выступает в роли гидроксида (имеет основных характер). Образующаяся в данной реакции соль выделяется в виде густого белого пара с мелкими кристаллами хлорида аммония.
Качественная реакция на хлорид-ион: реакция с растворимыми солями серебра (ацетатом или нитратом): AgNO3 + HCl → HNO3 + AgCl. Выпадает белый творожистый осадок AgCl, нерастворимый во всех кислотах, кроме серной, а также в избытке аммиака.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество
, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Применение кислоты
Поскольку хлороводородная кислота — едкое ядовитое вещество, оборот ее не должен превышать 15%, а при проведении опытов необходимо использовать перчатки и вентиляцию. Находит применение в нескольких отраслях:
- В металлургии используется для очистки и дезинфекции поверхности металлов при пайке и для получения хлоридов цинка, железа и др. металлов;
- Регулятор кислотности Е507;
- В медицине применяется для нормализации работы желудка при диспепсии. Выпускается в таблетках в смеси с пепсином (протеолитический фермент), активирует его действие при растворении лекарства. Такой раствор имеет pH 3-5.
Синоним: кислота хлористоводородная.
Свойства.
Бесцветная прозрачная летучая жидкость своеобразного запаха, кислого вкуса. Смешивается с водой и спиртом во всех отношениях, образуя растворы кислой реакции. Удельный вес 1,125-1,127.
Хранят по списку Б, в склянках с притертыми пробками.
В практике встречаются: а) кислота хлористоводородная, содержащая 25 % хлористого водорода б) кислота хлористоводородная крепкая реактивная, содержащая 35-37 % хлористого водорода в) кислота хлористоводородная разведенная — прозрачная бесцветная жидкость, смешивается с водой во всех соотношениях. Получают при смешивании 1 части соляной кислоты с 2 частями воды. Содержит 8,2-8,4 % хлористого водорода. Для лечебных целей применяют и прописывают в рецептах разведенную соляную кислоту.
Действие и применение.
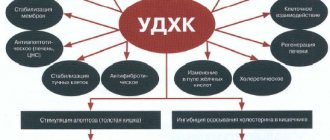
Изменяет пепсиноген в активный пепсин, обеспечивает кислую среду для его действия. В желудке способствует перевариванию белков, создает условия для эвакуации содержимого в кишечник, регулирует тонус привратника, усиливает секрецию поджелудочной железы и желчи, действует антимикробно, предотвращает развитие гнилостных и бродильных процессов и препятствует проникновению патогенных бактерий в кишечник. Оказывает сильное бактерицидное действие. С повышением температуры растворителя дезинфицирующая сила возрастает.
Убивает споровые и вегетативные формы микробов. В присутствии малых количеств хлорида натрия бактерицидная сила кислоты увеличивается, так как он усиливает проницаемость кислоты в толщу кожи, а в больших — ее активность понижается; 2 % соляная кислота в присутствии 10 % хлорида натрия убивает споры сибирской язвы в кожевенном сырье при температуре 40°С в течение девяти часов.
Внутрь применяют при пониженной кислотности желудочного сока, бродильных и гнилостных процессах в желудке, при отравлении щелочами, нарушении пищеварения с явлениями диспепсии. В том числе ее назначают при хронических гипо- и аноцидных гастритах, хроническом гастроэнтерите, при гипотонии и атонии рубца, при тимпании рубца, простой и токсической диспепсии. Для ускорения всасывания железа при анемии. При хроническом катаре желудка промывают желудок раствором кислоты (0,3 %). При воспалении зоба у птиц и холере кур 0,4 % раствор выпаивают вволю.1 % солянокислый раствор пепсина (1 л дистиллированной воды, 5 мл чистой соляной кислоты и пепсина) применяют при диспепсии молодняка животных (телятам 100 мл; поросятам 50 мл, ягнятам 30 мл 2-3 раза в день).
Соляную кислоту используют для получения искусственного желудочного сока. Ее применяют для дезинфекции питьевой воды, кожсырья неблагополучного по сибирской язве. Для дезинфекции кожсырья применяют 2,5 % раствор в расчете на хлористый водород с добавлением 10 % поваренной соли при температуре 40°С и экспозиции 9 часов. С учетом поглощения соляной кислоты кожами берут избыточное количество кислоты, но не более 5 % веса шкур. Дезинфицирующий раствор употребляется в 10 раз больше веса кожсырья. Исходя из этого, на 100 кг кожсырья надо взять 1000 л 2 % раствора соляной кислоты (20 л кислоты) и добавить для адсорбции кожами 5 л кислоты (получится 2,5 % раствор пикеля). Соляную кислоту с гипосульфитом натрия, по методу Демьяновича, применяют для лечения чесотки.
Внутрь соляную кислоту вводят в виде 0,1-0,4 % водного раствора, лучше с пепсином.
Дозы разведенной кислоты внутрь:
лошадям 10-20 мл; крупному рогатому скоту 15-30 мл, мелкому рогатому скоту 2-5 мл, свиньям 1-2 мл, собакам 0,1-0,5 мл, кошкам 0,1-0,2 мл, курам 0,1-0,5 мл.
Использование в пищевой промышленности
Пищевая промышленность использует Е507 при переработке различных продуктов. Основное ее применение в пищевой промышленности заключается в производстве кукурузных сиропов, особенно с высоким содержанием фруктозы. Также она часто встречается в майонезах, входит в состав лимонной кислоты, желатина, фруктозы.
Соляную кислоту можно также использовать для кислотного модифицирования кукурузного крахмала и для регулирования рН промежуточных и конечных продуктов.
Наиболее частое использование – это производство безалкогольных напитков, на которые приходится 70-75% спроса.
Е507 также используется в других областях пищевой промышленности, включая производство гидролизованного растительного белка и соевого соуса. Она используется для подкисления дробленых костей, для производства желатина и в качестве подкислителя для продуктов, таких как соусы, овощные соки и консервы.
Соляная кислота часто используется при производстве:
- искусственных подсластителей;
- лизина и хлорида холина (оба используются главным образом в качестве добавок для корма для животных);
- лимонной кислоты;
- кукурузного крахмала;
- безалкогольных напитков;
- соевого соуса.
Как добывают соляную кислоту в лабораторных условиях
Производство вещества масштабно, продажа свободна. В условиях лабораторных опытов добывают раствор воздействием серной кислоты высокой концентрации на обычную кухонную соль (натрия хлорид).
Существует 2 метода растворения хлороводорода в воде:
- Водород сжигается в хлоре (синтетический).
- Попутный (абгазный). Суть его в проведении органического хлорирования, дегидрохлорирования.
Вещество хорошо поддается синтезу при пиролизе отходов от хлороорганики. Это случается в результате распада углеводородов при полном дефиците кислорода. Можно использовать так же хлориды металлов, которые являются сырьем неорганических веществ. Если нет серной кислоты концентрированной (электролита), берите разведенную.
Что касается добывания реагента в природных условиях, то чаще всего эту химическую смесь можно встретить в водах вулканических отходов. Хлороводород – это составляющая минералов сильвина (калия хлорид, по виду напоминает кости для игр), бишофита. Все это – методы добыть вещество в промышленности.
В организме человека, данный фермент содержится в желудке. Раствор может быть как кислотой, так и основанием. Одним из распространенных способов добывания, называют сульфатный.
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Применение в быту
HCl является одним из самых сильных в настоящее время чистящих средств, она чрезвычайно эффективна и рекомендуется в качестве очистителя, может использоваться для очистки любого продукта, который может противостоять его последствиям.
HCl используется для нейтрализации воды, что делает ее безопасной для купальщиков.
Чаще всего уровень рН высокий; лучший способ снизить рН – это медленно заливать соляную кислоту непосредственно в глубокий конец бассейна, пока насос бассейна включен, а вода циркулирует.
Применение в промышленности
Большая часть соляной кислоты, потребляемой в промышленности, используется для регенерации ионообменных смол, которые используются для удаления примесей. Она используется в основном для непрерывных операций по травлению стали, также используется в травлении алюминия и для очистки металла.
HCl используется как для удаления ржавчины, окалины, так и нежелательных карбонатных отложений в нефтяных скважинах для стимулирования потока сырой нефти или газа в скважину.
Нейтрализация соляной кислоты известняком (CaCO3) вызывает образование хлорида кальция. Хлорид кальция используется для пылеулавливания, промышленной обработки, добычи нефти, обработки бетона и балластировку шин.
Водная соляная кислота используется во множестве различных применений. К ним относятся извлечение полудрагоценных металлов из использованных катализаторов, использование в качестве катализатора в синтезе, регулирование рН, регенерация ионообменных смол, используемых в очистке сточных вод и электроснабжения, нейтрализация щелочных продуктов или отходов, а также подкисление рассола для использования в производстве хлора и каустической соды.