Необутин и Необутин Ретард
Структурный аналог Тримедата – Необутин, который выпускается в Индии и в РФ, таблетизирован, имеет 100 мг активного вещества тримебутина малеат в основе. Показания к использованию и противопоказания идентичны.
Препарат рекомендован при синдроме раздраженного кишечника, неполной обтурации желчных ходов. Запрещен к приему детям до трех лет, аллергии на компоненты, во время вынашивания младенца, грудного вскармливания, при непереносимости галактозы и глюкозы.
Назначают Необутин перед едой, трижды/день, доза коррелируется возрастом пациента:
- от трех до пяти лет – 25 мг;
- до 12 лет – 50 мг;
- старше 12 – по 100 -200 мг в зависимости от веса, индивидуальных особенностей, формы заболевания.
Негативные эффекты во время приема ограничены диспепсией, сухостью слизистых, сонливостью, цефалгией, вертиго, аллергией, нарушением месячного цикла, нагрубанием молочных желез, задержкой мочи.
Тримедат Форте в качестве заменителя предполагает использование Необутина Ретард – таблеток с 300 мг активного начала, аналогичными показаниями, противопоказаниями и дозированием. Лекарство можно использовать у взрослых и детей по рекомендации врача.
Цена Необутина – 209 рублей, Необутина-Ретард – 396.
Тримебутин
Тримебутин
(лат.
Trimebutine
) — лекарственный препарат, миотропный спазмолитик, регулятор моторики органов желудочно-кишечного тракта. Некоторые гастроэнтерологи относят тримебутин также к прокинетикам (Алексеева Е.В. и др.). Часто применяется в виде соли малеиновой кислоты (тримебутина малеата). Тримебутина малеат — энкефалический лиганд рецептора [2-(диметиламино)-2-фенилбутилэфир 3,4,5-триметок-сибензойной кислот] действует в качестве агониста периферических μ, к- и δ- опиатных рецепторов, запуская III фазу моторного комплекса (Нижевич А.А. и др.).
Тримебутин — химическое соединение
Химически тримебутин представляет собой 2-(диметиламино)-2-фенилбутилэфир 3,4,5-триметоксибензойной кислоты. Эмпирическая формула тримебутина: C22H29NO5.
Тримебутин — лекарственный препарат
Тримебутин — международное непатентованное наименование (МНН) лекарственного средства. По фармакологическому указателю тримебутин относится к группам «Спазмолитики миотропные» и «Стимуляторы моторики ЖКТ, в том числе рвотные средства». По АТХ — к группе «Препараты для лечения функциональных расстройств кишечника», подгруппе «Синтетические холиноблокаторы — эфиры с третичной аминогруппой» и имеет код A03AA05.
Регуляция моторики желудочно-кишечного тракта обеспечивается взаимодействием нервных и гуморальных механизмов. На уровне стенки кишечника интрамуральные и вставочные нейроны объединены в сплетения — мейсснерово и ауербахово, состоящие примерно из 108 нервных клеток или 20 000 нейронов на 1 см2 поверхности кишечника. Медиаторами энтеральной нервной системы являются ацетилхолин (пре- и постганглионарные парасимпатические нейроны), норадреналин (постганглионарные симпатические нейроны), серотонин (серотонинергические нейроны), дофамин (дофаминергические нейроны), оксид азота (неадренергические нехолинергические нейроны), АТФ (пуринергические нейроны) и энкефалины (энкефалические нейроны). Последние являются лигандами периферических опиатных рецепторов 3 основных типов (ц, б, к), расположенных на клетках на всем протяжении ЖКТ, включая гладкие мышцы. Тримебутин является агонистом периферических опиатных рецепторов указанных типов, действуя на всем протяжении ЖКТ. Результатом этого агонизма ко всем 3 типам рецепторов является двойственный (регулирующий) эффект тримебутина на моторику пищеварительного тракта. Также он влияет на висцеральную чувствительность ЖКТ, оказывая умеренное анальгетическое действие, в частности, при СРК. В основе этого эффекта лежит влияние препарата на антиноцицептивную систему организма с повышением порога болевой чувствительности, модификации оценки боли, снижению чувствительности рецепторов к медиаторам воспаления. Более того, тримебутин обладает местным обезболивающим действием, которое в 17 раз превышает лидокаин. Тримебутин оказывает влияние и на гуморальную регуляцию моторики ЖКТ, повышая секрецию мотилина и снижая уровень гастрина, энтероглюкагона, панкреатического полипептида, инсулина и вазоактивного интенсинального полипептида (Бельмер С.В. и др.).
Тримебутина малеат используется во многих западных странах для лечения функциональных расстройств желудочно-кишечного тракта. Механизм действия тримебутина малеата у пациентов с функциональной диспепсией является недостаточно изученным. Высказывалось предположение, что ассоциация слабых опиоидных свойств тримебутина малеата связана с блокадой натриевых каналов и выраженные местные анальгезирующие свойства объясняют эффективность тримебутина малеата в терапии болей в животе. В то же время через опиатные рецепторы тримебутина малеата опосредует высвобождение гастроинтестинальных пептидов, таких как мотилин, и модулирует высвобождение других пептидов, включая вазоактивный интестинальный пептид, гастрин и глюкагон. Тримебутина малеат имеет высокий профиль токсикологической безопасности и демонстрирует отличную переносимость препарата. Нет никаких доказательств, что тримебутина малеат оказывает воздействие на центральную нервную систему и проникает через гематоэнцефалический барьер. Основным показанием к назначению тримебутина малеата являются диспептические расстройства при гастродуоденальных заболеваниях (боли в животе, нарушение пищеварения, тошнота, рвота), а также синдром раздраженного кишечника, гастроэзофагеальная рефлюксная болезнь (Нижевич А.А. и др.).
Применение тримебутина беременными и кормящими матерями
Тримебутин не рекомендован в первый триместр беременности и матерям, кормящим грудью.
Публикации для специалистов, касающиеся вопросов применения тримебутина в медицине и ветеринарии
- Акопян А.Н., Бельмер С.В., Выхристюк О.Ф. и др. Гастроэзофагеальный рефлюкс и нарушения моторики желудочно-кишечного тракта // Доктор.ру. Педиатрия. Гастроэнтерология. 2014. № 11 (99). С. 45-49.
- Тропская Н.С., Попова Т.С. Тримебутин в коррекции нарушений электрической активности органов ЖКТ при экспериментальной эндотоксемии // РЖГГК. – 2009. – Т.19. – №2. – С. 37–42.
- Бельмер С.В., Гасилина Т.В., Коваленко А.А., Карпина Л.М. Современные пути коррекции функциональных нарушений органов пищеварения у детей // Вопросы детской диетологии. – 2011. – Т. 9. – № 2. – с. 10–14.
- Успенский Ю.П., Барышникова Н.В., Белоусова Л.Н. Эффективность тримебутина в купировании абдоминального болевого синдрома: анализ данных ПЭГЭГ // XX Рос. Гастроэнтерологическая Неделя 6-8 октября. РЖГГК. 2014. №5. С. 134.
- Наринская Н.М. Роль функциональных нарушений моторики кишечника у детей с атопическим дерматитом. Автореферат дисс. к.м.н., 14.01.10 — Кожные и венерические болезни. РНИМУ им. Н.И. Пирогова, Москва, 2021.
- Короткий Н.Г., Наринская Н.М., Бельмер С.В., Ардатская М.Д. Коррекция функциональных нарушений моторики органов пищеварения при атопическом дерматите у детей // Вопросы детской диетологии. 2015. Т. 13. №4. С. 5-10.
- Пиджимян В.П. Влияние статуса курения и степени никотиновой зависимости на клинико-функциональные особенности течения ГЭРБ, возможность применения тримебутина в комплексной терапии. Автореферат дисс. к.м.н., 14.01.04 – вн. болезни. СПГМУ, СПб, 2017.
- Зохиров А.Н. Влияние транскраниальной электростимуляции на сократительную функцию ЖКТ животных. Автореферат дисс. к.м.н., 03.03.01 – физиология. КГСХА им. И.И. Иванова, Курск, 2014.
- Сеин О.Б., Зохиров А.Н. Влияние моделирующих эффектов тримебутина на моторику кишечника у собак // Вестник Курской ГСХА. 2014. № 5. С. 67–69.
- Шапорова Н.Л., Пиджимян В.П., Дудина О.В., Яблонская В.Н., Саркисян С.Р. Применение тримебутина в комплексной терапии ГЭРБ у курящих пациентов // Вестник Российской ВМА. Клинические исследования. – 2021. — 1 (53). С. 67-71.
- Нижевич А.А., Валеева Д.С., Сатаев В.У., Гафурова К.А., Ахмадеева Э.Н., Ахметшин Р.З. Современные подходы к лечению функциональной диспепсии в детском возрасте // Вопросы детской диетологии. 2021. Т. 15. №3. С. 5-11.
- Плотникова Е.Ю., Грачева Т.Ю. Место тримебутина в консервативной терапии дисфункции сфинктера Одди // Лечащий врач. — 2018. — №2.
- Андреев Д.Н., Дичева Д.Т. Оптимизация лечения пациентов с синдромом раздраженного кишечника: фокус на повышение комплаентности. Медицинский совет. 2019; 3: 118-124.
- Бельмер С.В., Абузин М.Н., Донюш Е.К., Малкова О.В., Кондрашова З.А., Боярчук Н.Г., М.Д. Ардатская. Гастроинтестинальная моторика у детей с хронической иммунной тромбоцитопенической пурпурой. Педиатрия. 2019;98(6):23–30.
- Пахомова И.Г. Нарушение моторики при функциональных расстройствах ЖКТ. Возможности терапевтической коррекции на клиническом примере. Медицинский совет. 2020;(5):18–23.
На сайте GastroScan.ru в разделе «Литература» имеется подраздел «Спазмолитики», содержащий публикации для профессионалов здравоохранения, затрагивающие вопросы применения спазмолитических препаратов при лечении заболеваний органов ЖКТ.
Видео (доклады и лекции) для профессионалов здравоохранения, касающиеся вопросов применения тримебутина
| Бельмер С.В. Перспективы электрогастроэнтерографии в педиатрии: достижения и проблемы | |
| Минушкин О.Н. Функциональная диспепсия — взгляд на проблему, диагностику, лечения | |
| Минушкин О.Н. Прокинетики в гастроэнтерологической практике |
Видео для студентов медицинского университета
Кадр «Тримебутин» из видеолекции для студентов 3-го курса лечебного факультета ПСПбГМУ им. акад. И.П. Павлова: Мельников К.Н. Средства, влияющие на ЖКТ
На сайте в разделе «Видео» имеются подраздел для пациентов «Популярная гастроэнтерология» и подразделы «Для врачей» и «Для студентов медицинских ВУЗов и ординаторов», содержащий видеозаписи докладов, лекций, вебинаров по различным направлениям гастроэнтерологии для профессионалов здравоохранения и обучающихся медицине.
Торговые наименования лекарств с действующим веществом тримебутин
Лекарства с действующим веществом тримебутин, зарегистрированные (или имевшие регистрацию в прошлом) в России: Необутин (производство ЗАО «Фармацевтическое предприятие «Оболенское»»), Необутин Ретард (Samil Pharm Co., Ltd, Корея и ЗАО «Фармацевтическое предприятие «Оболенское»»), Тримебутин СЗ (ЗАО «Северная звезда»), Тримедат (АО «Валента Фарм»), Тримедат Валента (ПАО «Валента Фарм»), Тримедат Форте (ПАО «Валента Фарм»).
На украинском и казахстанском фармрынке представлен препарат Тримспа 200 производства Маклеодс, Индия и другие.
В США тримебутин не имеет разрешения к применению. В некоторых странах Европейского союза тримебутин продается под торговыми наименованиями Debricalm, Debridat, Digerent, Garapepsin, Ircolon, Recutin, Polybutin, Transacalm, Tribux и другими. В Канаде: Apo-Trimebutine и Modulon. В Японии: Butikinon, Cerekinon, Mebucolon, Mebutit, Nepten, Sakion, Supeslon, Tefmetin, VeM и другими.
Официальные инструкции по применению препаратов с действующим веществом тримебутином
- «Инструкция по медицинскому применению препарата Тримедат» (pdf), согласованная Росздравнадзором 28.12.2007 г.
- «Инструкция по применению лекарственного препарата для медицинского применения Тримедат Валента» (pdf), согласованная Минздравом России 08.07.2014 г.
- «Инструкция по применению лекарственного препарата для медицинского применения Необутин» (pdf), согласованная Минздравом России 20.07.2015 г.
- «Инструкция по применению лекарственного препарата для медицинского применения НЕОБУТИН ретард» (pdf), согласованная Минздравом России 22.09.2015 г.
- «Инструкция по применению лекарственного препарата Тримедат форте» (pdf), согласованная Минздравом России 20.12.2017 г.
- «Инструкция по применению лекарственного препарата Тримебутин-СЗ» (pdf), согласованная Минздравом России 03.12.2018 г.
У тримебутина имеются противопоказания, побочные действия и особенности применения, необходима консультация со специалистом. Назад в раздел
Дюспаталин
Популярен аналог Тримедата – Дюспаталин. Это средство на иной активной основе – мебеверина гидрохлорид. Выпускается в таблетках по 135 мг действующего начала и капсулах – 200 мг. Суть действия – минимизация кишечных спазмов: Дюспаталин тормозит проникновение кальция в мышцы пищеварительной системы, блокирует соединение с белками, что автоматически расслабляет гладкую мускулатуру.
Параллельно препарат снимает спазм со сфинктера любого органа билиарной системы печени, что стимулирует переваривание пищи, поступившей в желудок.
Показанием к применению является: синдром раздраженного кишечника, абдоминальные боли, метеоризм, холецистит, холестаз, колики, диспепсия, коррекция консистенции каловых масс. Назначается Дюспаталин с 18 лет, в исключительных случаях – с 10. Противопоказан при индивидуальной непереносимости компонентов, лактозы, при дефиците галактозы, во время беременности и лактации.
Пьют таблетки и капсулы Дюспаталина по 1 штуке, дважды/день, не разжевывая, поскольку оболочка – гарантия пролонгированного действия.
Побочные эффекты: аллергия, анафилаксия, диспепсия, подташнивание, эпигастральные боли, цефалгия, бессонница, синдром хронической усталости, вертиго.
Цена – 545 рублей.
Введение
Синдром раздраженного кишечника (СРК) – это функциональное расстройство желудочно-кишечного тракта (ЖКТ), проявляющееся периодической болью в животе, связанной с изменением кратности дефекаций и/или изменением консистенции стула [1, 2]. Вариабельный паттерн клинического течения СРК обусловливает применение широкого спектра фармакологических препаратов для корригирования этого расстройства, включая спазмолитики, слабительные, противодиарейные препараты, пеногасители, пре- и пробиотики [3–6]. При этом в клинической практике нередко выбор оптимальной схемы терапии, обеспечивающей длительный период безрецидивной ремиссии СРК, оказывается сложной задачей [7, 8]. Более того, в повседневной клинической практике встречаются случаи этого заболевания, при которых использование ряда препаратов лимитировано, например в случае беременности [9, 10].
В настоящее время одним из самых эффективных и безопасных препаратов для лечения СРК является тримебутин, который с современных позиций рассматривается не просто как спазмолитик, а как средство, регулирующее моторику ЖКТ [9]. Данный препарат считается агонистом периферических µ-, δ-, и κ-опиатных рецепторов, действующим на всем протяжении ЖКТ [9, 11]. Результатом служит двойственный эффект тримебутина на моторику ЖКТ, который зависит от преобладания ингибиторных или возбуждающих влияний. Таким образом, модуляция пропульсивной моторики ЖКТ при применении тримебутина проявляется в нормализующем воздействии как при гипо-, так и при гиперкинетических нарушениях моторной функции [9, 12]. Антиспастический эффект тримебутина реализуется через блокаду Na+-каналов, а также через блокаду Ca2+-каналов L-типа [9, 13, 14]. Также в ряде экспериментальных исследований показано снижение токов К+ в гладким миоцитах, индуцируемое тримебутином, что также может играть роль в антиспастическом эффекте препарата [15, 16]. Анальгетический эффект тримебутина осуществляется путем воздействия на периферические окончания чувствительных нейронов, связанных с висцеральными афферентными C-волокнами [13].
Тримебутин обладает существенной доказательной базой в рамках терапии СРК. Согласно результатам мета-анализ 23 рандомизированных контролируемых исследований (1888 пациентов), спазмолитики оказались эффективнее плацебо при улучшении общего состояния пациента с отношением шансов (ОШ) 2,13 (95% доверительный интервал [ДИ] – 1,77–2,58) [17]. При этом наиболее эффективным оказался тримебутин (ОШ=3,45; 95% ДИ – 2,03–5,86) [17]. Согласно рекомендациям Российской гастроэнтерологической ассоциации (РГА) и Ассоциации колопроктологов России (АКР) по диагностике и лечению СРК (2017), тримебутин безопасен при длительном применении, эффективен в лечении сочетанной функциональной патологии (в частности, при сочетании СРК и функциональной диспепсии), а также эффективно уменьшает частоту и выраженность абдоминальной боли [18].
В настоящей статье нами представлены избранные клинические случаи, демонстрирующие объективные трудности, связанные с ведением пациентов с СРК, а также эффективность применения тримебутина в этих ситуациях.
Клиническое наблюдение № 1
Пациентка Н. 32 лет обратилась к гастроэнтерологу с жалобами на часто возникающую колющую, режущую, иногда ноющую боль, локализованную в околопупочной и подвздошной области, несколько уменьшающуюся после дефекации и отхождения кишечных газов, шумное урчание в животе, метеоризм. Стул кашицеобразной консистенции 2–3 раза после еды со значительной примесью слизи в каловых массах.
Анамнез
Считает себя больной в течение 14 лет, когда впервые эпизодически стала появляться ноющая боль внизу живота, нестабильность стула со склонностью к диарее. Самостоятельно принимала безрецептурные препараты (дротаверин, алюминий-содержащие антациды, сорбенты) без значительного улучшения. За прошедший период пациентка неоднократно обращалась к гастроэнтерологам. Специалистами назначались короткие курсы спазмолитиков (мебеверин, пинаверия бромид). На фоне приема указанных выше препаратов отмечалась положительная клиническая динамика различной степени выраженности, однако спустя некоторое время симптоматика рецидивировала. За прошедшие 2 года отмечает увеличение количества эпизодов абдоминальной боли, нарастание интенсивности боли. Пациентке проводилась колонофиброскопия в 01.2018 и 12.2018; органической патологии выявлено не было. Настоящее обострение возникло 2 недели назад на фоне привычной для пациентки диеты.
Вредные привычки отрицает. Аллергический анамнез отрицает. Наследственность не отягощена.
Объективные данные
Состояние удовлетворительное. Астенического телосложения. Индекс массы тела – 19,3 кг/м2. Кожа и видимые слизистые оболочки обычной окраски, нормальной влажности. При аускультации легких и сердца патологии не выявлено. Язык влажный, обложен у корня. Живот вздут за счет кишечных газов, умеренно болезненный в мезогастрии и правой подвздошной области. Печень по краю реберной дуги. Селезенка не пальпируется. Стул неоформленный до 3–4 раз в сутки, кашицеобразный, мелкими порциями со значительным количеством слизи. Макроскопичеких примесей крови в кале не отмечает. Пациентка тревожна, убеждена в наличии у нее тяжелого недиагностированного заболевания в силу частого рецидивирования жалоб.
Результаты лабораторных и инструментальных методов обследования
Общий анализ крови, биохимический анализ крови, общий анализ мочи без клинически значимых находок.
Копрология: стул неоформленный, консистенция мягкая, запах резкий, реакция на скрытую кровьотрицательная, небольшое количество переваренной и непереваренной клетчатки, мыла немного, лейкоциты и эритроциты не найдены, слизи большое количество.
Кальпротектин кала – 68 мкг/г (норма менее 50 мкг/г).
Реакция непрямой гемагглютинации (РНГА) с сальмонеллезным О3АГ, ОАГ; РНГА с шигеллезным Зоне АГ, Флекснера АГ; РНГА с псевдотуберкулезным АГ отрицательные.
Ультразвуковое исследование органов брюшной полости, а также эзофгогастродуоденоскопия без клинически значимых находок.
Колонофиброскопия: на всем протяжении осмотренных участков кишечника органической патологии не выявлено.
При общем анализе анамнеза, клинической картины и данных лабораторно-инструментальных методов обследования пациентки отсутствовали симптомы тревоги (ректальные кровотечения, наличие макро- и микропримесей крови в кале, снижение массы тела, анемия и другие изменения в анализах крови, лихорадка, начало болезни в возрасте старше 50 лет, рак и воспалительные заболевания кишечника у родственников, ночная симптоматика). Согласно рекомендациям РГА по диагностике и лечению СРК, в рамках скринингового исследования определились С-реактивный белок, тиреотропный гормон, IgA+IgG к тканевой трансглутаминазе – все показатели в пределах нормы.
Диагноз: СРК с преобладанием диареи
Терапия
Тримебутин 200 мг 3 раза в сутки за 30 минут до еды, а также симетикон 120 мг 3–4 раза в сутки, бифидосодержащие пробиотики в рекомендованной суточной дозе. На фоне данной терапии клиническая симптоматика заболевания купирована в течение 2 недель. Пациентка отметила улучшение общего самочувствия; исчез страх, связанный с императивными позывами к дефекации. По завершении курса лечения пациентке рекомендовано продолжить прием тримебутина в течение последующих трех недель.
Дальнейшее наблюдение больной и ведение ею пищевого дневника позволили выявить четкую связь рецидивирования болевого абдоминального синдрома с испытываемыми психоэмоциональными нагрузками. Усиление интенсивности и частоты возникновения болевых эпизодов в течение последних 2 лет удалось связать с фактом смены работы: пациентка стала главным консультантом предприятия, что потребовало от нее публичных выступлений с анализом проводимой работы как на предприятии, так и на конференциях. Больной рекомендован тримебутин по 200 мг 3 раза в сутки курсом в 7–10 дней с началом приема за 3 дня до планируемого публичного выступления. В результате рекомендованный нами профилактический прием тримебутина позволил либо полностью нивелировать появление болевого абдоминального синдрома, либо значительно снизить его длительность и интенсивность. От предлагаемой консультации психотерапевта пациентка неоднократно отказывалась.
Обсуждение
Рассмотренный клинический случай демонстрирует, что СРК характеризуется волнообразным течением с чередованием периодов ремиссии и обострений, нередко провоцируемых психоэмоциональным стрессом. Большая часть пациентов отрицает высказываемую врачом мысль о связи абдоминальной симптоматики с психоэмоциональными нагрузками, отказывается от консультации психотерапевта, даже если подобная консультация доступна в рамках бесплатного медицинского обслуживания. При динамическом наблюдении пациента после купированного обострения СРК нами рекомендуется ведение пищевого дневника, в котором больной отмечает динамику жалоб на фоне проводимой терапии, а после ее отмены при возникновении абдоминальных симптомов (вздутие живота, боль, флатуленция и т.д.) анализирует употреблявшуюся накануне пищу, наличие физических и психоэмоциональных нагрузок. Таким образом, отслеживая причинно-следственные связи, пациент сам приходит к выводу о большей роли психоэмоциональных или диетических факторов в генезе обострений СРК. Описанный выше профилактический прием тримебутина позволяет избегать выраженных обострений заболевания, часто сопряженных с потерей трудоспособности.
Клиническое наблюдение № 2
Пациентка А 25 лет направлена акушером-гинекологом на консультацию гастроэнтеролога в связи с возникновением жалоб на ноющую боль внизу живота, возникающую перед дефекацией, урчание, переливание в животе, задержку стула до 2–4 суток.
Анамнез
Считает себя больной в течение 3 месяцев. Пациентка стала отмечать необходимость натуживания, появились кратковременные невыраженные боли перед дефекацией. Прием лактулозы приносил облегчение, но потребовал увеличения суточной дозы препарата, в связи с чем в течение последнего месяца акушером был назначен полиэтиленгликоль, не приносивший выраженного клинического эффекта. Больная стала отмечать усиление абдоминальной боли перед дефекацией, самостоятельно дополнительно применяла микроклизмы и ректальные свечи.
При сборе анамнеза выявлено, что в возрасте от 15 до 22 лет часто отмечала возникновение различной по интенсивности боли, локализовавшейся внизу живота или принимавшей характер разлитой. В результате обследования, в т.ч. и стационарного, диагностирован СРК, смешанный вариант. Пациентке назначались курсы спазмолитиков (мебеверин, пинаверия бромид, алверина цитрат с симетиконом) с выраженным положительным эффектом. В возрасте от 23 до 25 лет отмечено относительное благополучие – эпизоды боли в животе возникали крайне редко, имели минимальную выраженность. В 2015 г. в возрасте 21 года пациентке проведена колонофиброскопия.
Вредные привычки отрицает. Аллергический анамнез отрицает. Наследственность не отягощена.
Объективные данные
Беременность сроком 21 неделя. Состояние удовлетворительное. Кожа и видимые слизистые оболочки обычной окраски, нормальной влажности. При аускультации легких и сердца патологии не выявлено. Язык влажный, обложен у корня. Живот увеличен в размерах за счет беременности. При пальпации отмечается болезненность в правой и левой подвздошных областях. Печень и селезенка не пальпируются. Стул за последнюю неделю 1 раз в 2–4 дня, требует сильного натуживания со значительным количеством слизи, прожилками крови.
Результаты лабораторных и инструментальных методов обследования
Общий анализ крови, биохимический анализ крови, общий анализ мочи без клинически значимых находок.
Копрология: стул оформленный, консистенция твердая, запах резкий, каловый, реакция на скрытую кровь положительная, небольшое количество переваренных и непереваренных мышечных волокон, солей жирных кислот немного, лейкоциты и эритроциты не найдены, слизи большое количество.
Кальпротектин кала – 30 мкг/г (норма менее 50 мкг/г).
Ультразвуковое исследование органов брюшной полости, а также эзофгогастродуоденоскопия без клинически значимых находок.
Пациентке назначена консультация проктолога. Заключение: хронический геморрой в стадии обострения.
При общем анализе анамнеза, клинической картины и данных лабораторно-инструментальных методов обследования пациентки отсутствовали симптомы тревоги (ректальные кровотечения, наличие макро- и микропримесей крови в кале, снижение массы тела, анемия и другие изменения в анализах крови, лихорадка, начало болезни в возрасте старше 50 лет, рак и воспалительные заболевания кишечника у родственников, ночная симптоматика). Согласно рекомендациям РГА по диагностике и лечению СРК, в рамках скринингового исследования определялись С-реактивный белок, тиреотропный гормон, IgA+IgG к тканевой трансглутаминазе – все показатели в пределах нормы.
Диагноз. СРК, ассоциированный с запором.
Терапия
Тримебутин 200 мг 3 раза в сутки за 30 минут до еды, а также диметикон и гвайазулен 3 г 3–4 раза в сутки, псиллиум 3,25 г 2 раза в сутки, терапия, назначенная проктологом. Проводимая терапия привела к купированию болевого абдоминального синдрома к концу первой недели приема препаратов, к нормализации дефекации с отхождением стула 1 раз в 1–2 дня, к полному прекращению выделения крови с каловыми массами.
В рамках динамического наблюдения наличия крови в каловых массах на фоне нормализации стула отмечено не было, через 1 месяц после окончания приема тримебутина (в 35-ю неделю беременности) рецидивировали боли внизу живота значительно меньшей интенсивности, непродолжительные, в связи с чем возобновлен прием тримебутина в течение 10 дней с полным регрессом симптоматики.
Обсуждение
Круг лекарственных средств, разрешенных к назначению во время беременности, ограничен. Из спазмолитиков единственным препаратом, не имеющим ограничений к применению со II триместра беременности, является тримебутин.
Особенностью случая было наличие прожилок крови в каловых массах данной пациентки, что требовало исключения дебюта воспалительного заболевания кишечника (ВЗК). Хотя в настоящее время преобладает мнение, будто характер течения ВЗК во время беременности зависит от активности заболевания на момент зачатия, тем не менее ряд авторов отмечают высокую частоту дебюта ВЗК у беременных, особенно в I–II триместрах.
Проведение колоно- и сигмоидоскопии во II и III триместрах ограничено в связи с риском возникновения преждевременных схваток. Положительная динамика клинических проявлений и гемотохезиса на фоне проведенной терапии спазмолитиками и слабительными позволила минимизировать вероятность ВЗК у данной пациентки.
Диагноз СРК был выставлен на основе предъявленных жалоб, результатов проведенного обследования, анамнестических данных. Анализ социальных факторов привел к мысли о частых обострениях СРК на фоне нагрузок, связанных с обучением (выпускные классы школы, высшее учебное заведение), при благоприятном течении заболевания в возрасте 23–25 лет, когда пациентка вышла замуж, занималась домашним хозяйством.
Заключение
Рассмотренные клинические наблюдения демонстрируют объективные трудности, связанные с фармакотерапией пациентов с СРК. В обоих случаях тримебутин являлся оптимальным препаратом с точки зрения как эффективности, так и безопасности. Таким образом, использование тримебутина, оказывающего нормокинетическое воздействие на моторику нижних отделов ЖКТ, а также антиспастический и анальгетический эффекты, считается приоритетной тактикой лечения пациентов, страдающих СРК.
Ниаспам
Аналог Тримедата – Ниаспам с активным действующим веществом – мебеверина гидрохлорид (Ниаспам также аналог Дюспаталина, Дютана, Мебеверина). Выпускается в капсулах по 200 мг активного начала. Назначается с 18 лет. Показан для снятия кишечных спазмов, противопоказан при индивидуальной непереносимости компонентов средства, беременности, лактации. Препарат может спровоцировать сыпь на коже, отек Квинке и другие проявления аллергии.
При патологии почек дозировку не корректируют.
Цена – 364 рубля.
Спарекс
Миотропный спазмолитик Спарекс – аналог Тримедата с активным компонентом в виде мебеверина гидрохлорид. Препарат выпускается в капсулах с 200 мг действующего вещества. Спарекс дешевый отечественный заменитель не только Тримедата, но и Дютана, Мебеверина. Суть действия – купирование спазмов кишечника без вовлечения в процесс коррекции перистальтики. Назначается с 12 лет.
Препарат не следует употреблять во время вождения автомобиля, управлением точной аппаратурой из-за риска головокружения, сонливости.
Дозировка индивидуальна: по капсуле три-четыре раза/день до наступления терапевтического эффекта, затем дозировка снижается до поддерживающей (дозу рассчитывает врач).
Побочные реакции при приеме препарата: цефалгия, вертиго, сонливость, аллергия, метеоризм, диспепсия, бронхоспазм.
Цена – 342 рубля.
Триган
Самый дешевый аналог Тримедата на базе дицикловерина гидрохлорид. Препарат выпускается в Индии таблетизированно, тогда плюс к основному активному компоненту добавляют парацетамол, и ампульно: в 1 ампуле – 20 мг активного вещества. Показаниями к приему служат: болевой синдром, воспаление и связанный с ним спазм гладкой мускулатуры кишечника. Таблетки купируют головную боль, снимают жар, используются при альгодисменорее, невралгии.
Назначается препарат в таблетках с 15 лет. Запрещен при ЯБЖ, гиповолемии, миастении, во время вынашивания плода, кормления грудью, аллергии на компоненты.
Раствор Тригана рекомендован для снятия колик любого генеза, но только с 6 лет. Остальные противопоказания общие с таблетизированной формой.
Цена – 92 рубля.
Энтеросан
Это ферментный аналог Тримедата (лиофилизат секрета простых желез слизистой оболочки желудка птиц), обладает бактериостатическим, липолитическим, детоксикационным и иммуномодулирующим действием, реставрирует нарушенное всасывание. Выпускается в России в капсулах по 300 мг активного вещества.
Препарат назначают для лечения гастрита, энтерита, колита, панкреатита, дисбиоза, синдрома раздраженного кишечника, дивертикулах, дерматозах, инфекциях ЖКТ, конкрементообразовании в желчном пузыре.
Противопоказан при аллергии на компоненты, в первом триместре беременности, лактации.
Принимают препарат за полчаса до еды, проглатывают капсулы целиком, запивая небольшим количеством воды.
Доза корректируется тяжестью патологии:
- острая фаза – 600 мг трижды/день в течение 12 дней;
- хроническая – 300 мг по три раза/сутки в течение 20 дней;
- для профилактики – 300 мг дважды/день в течение месяца.
Курс можно повторить через пару месяцев.
Побочные эффекты: аллергия, сухость кожи и слизистых, эритема, диспепсия, бессонница, синдром хронической усталости, вертиго.
Цена – 378 рублей.
Тримебутин – уникальный спазмолитик и прокинетик ЖКТ: научное досье и клинические исследования
Лечение функциональных заболеваний желудочно-кишечного тракта представляет нерешенную медицинскую проблему. К настоящему времени доказано, что в развитии этой патологии значительную роль играет висцеральная гиперчувствительность, которая во многих случаях формируется под влиянием хронического стресса и маркирует дисфункцию физиологических антистрессовых систем, в частности опиатергической системы. В этой связи перспективным представляется применение для лечения функциональных заболеваний «балансирующего» регулятора моторики желудочно-кишечного тракта агониста опиатных рецепторов тримебутина. Экспериментальные и клинические исследования позволяют рассматривать тримебутин как таргетный препарат для коррекции висцеральной гиперчувствительности при синдроме раздраженного кишечника и функциональной диспепсии. В настоящем обзоре рассматриваются механизм лекарственного действия тримебутина и его эффективность как уникального прокинетика и спазмолитика при функциональных заболеваниях желудочно-кишечного тракта.
Рис. 1. Ноцицептивные проводящие пути и место действия опиатов в терапии боли [4]
Рис. 2. Механизмы стрессорной индукции висцеральной гиперчувствительности [8]
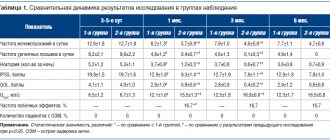
Таблица 1. Нормализация параметров опорожнения желудка под влиянием тримебутина у пациентов с ФД [41]
Рис. 3. Сравнительная эффективность прокинетиков при лечении ФД
Таблица 2. Выраженность эффекта прокинетиков
Рис. 4. Сравнительная эффективность схем лечения с включением тримебутина или спазмолитиков у пациентов с функциональными расстройствами ЖКТ (СРК, ФД, сочетание СРК и ФД) и влияние этих препаратов на основные симптомы функциональных расстройств (модифицир
Таблица 3. Доля пациентов со снижением выраженности боли/дискомфорта более чем на 30% к 29-му дню от начала лечения
Таблица 4. Снижение степени выраженности боли/дискомфорта к 29-му дню от начала лечения
Рис. 5. Динамика изменения суммарного балла по Шкале оценки желудочно-кишечных симптомов
Рис. 6. Динамика изменения симптомов функциональных заболеваний в баллах по Шкале оценки желудочно-кишечных симптомов за время лечения Тримедатом форте (А) и тримебутином 200 мг (Б)
Тримебутин был синтезирован Laboratoires Jouveinal (Франция) в 1969 г. На протяжении почти 50 лет в различных странах мира тримебутин как эффективный и безопасный спазмолитик успешно используется для лечения функциональных нарушений желудочно-кишечного тракта (ЖКТ) у детей и взрослых. За время клинического применения была накоплена обширная научная база данных, позволившая уточнить механизмы действия тримебутина. Установлено, что тримебутин обладает модулирующей прокинетической активностью, оказывает «балансирующее» воздействие на моторику ЖКТ, то есть является особым спазмолитиком для ЖКТ [1, 2].
Доказано, что лекарственное действие тримебутина обусловлено взаимодействием с опиатными рецепторами (ОР) ЖКТ. Тримебутин и его активный метаболит (нортримебутин) являются неспецифическими агонистами периферических, премущественно κ- (энкефалинергических) и ноцицептивных, ОР на всем протяжении чувствительных нервных путей, проводящих сигналы от механических и болевых рецепторов ЖКТ в центральную нервную систему (ЦНС).
У пациентов с функциональными заболеваниями ЖКТ механизмы физиологической регуляции существенно изменены. В частности, при функциональной диспепсии (ФД) и синдроме раздраженного кишечника (СРК) с запором нарушена ритмическая активность ЖКТ в покое: снижены частота мигрирующего моторного комплекса (ММК) кишечника и формирование пропульсивной перистальтики. Одновременно у пациентов с функциональными заболеваниями ЖКТ резко снижена толерантность энтеральной нервной системы к растяжению и восприятию боли, ассоциированной с избыточным растяжением (феномен висцеральной гиперчувствительности). Доказано, что гиперчувствительность к растяжению и воздействиям окружающей среды является основной причиной абдоминальной боли при СРК [3].
Формирование висцеральной гиперчувствительности при функциональных заболеваниях ЖКТ большинством исследователей расценивается как результат стрессорной нейромодуляции оси «мозг – ЖКТ» – сенсибилизации энтеральной и центральной нервной системы под влиянием хронического психологического и эмоционального стресса, который с детских лет испытывают эти пациенты. Известно, что при кратковременном стрессе и у пациентов без висцеральной гиперчувствительности стрессорной нейромодуляции оси «мозг – ЖКТ» противостоят так называемые стресс-лимитирующие системы. В ЖКТ стресс-лимитирующие системы включают ряд основных нейромедиаторов – антагонистов ацетилхолина: серотонин, норадреналин, дофамин и эндогенные опиатные пептиды. Эти амины могут действовать как центрально, так и на периферии, опосредуя эффекты симпатической системы.
Подавляя активность холинергических нейронов, стресс-лимитирующие системы уменьшают секрецию, подвижность и расслабляют сфинктеры, увеличивают болевой порог в оси «мозг – ЖКТ» (рис. 1). Однако длительное воздействие хронического стресса приводит к стойкой активации гипоталамо-гипофизарной оси на фоне постепенно развивающегося относительного дефицита стресс-лимитирующих систем.
У пациентов с функциональными заболеваниями ЖКТ хронический стресс является причиной стереотипной нейромодуляции в оси «мозг – ЖКТ», направленной в сторону уменьшения толерантности к восприятию боли и формирования висцеральной гиперчувствительности (рис. 2) [5–8]. По данным клинических исследований, нарушенное восприятие нормальных стимулов от кишечника зафиксировано как минимум у 60% пациентов с СРК [7].
Таким образом, обезболивающее и спазмолитическое действие тримебутина при СРК базируется на торможении проведения импульсации от нервных окончаний энтеральной нервной системы в стенке кишки в чувствительные нейроны задних ганглиев спинного мозга. Тримебутин, как и другие опиатные пептиды, блокаторы кальциевых каналов и ГАМКергические препараты, ингибиторы обратного захвата норадреналина или серотонина, уменьшает восприятие боли, прерывая проведение болевого импульса на уровне первичных афферентов, нейронов второго порядка или вставочных нейронов спинного мозга (см. рис. 1) [9, 10]. Выраженность блокады болевой импульсации на фоне терапии тримебутином сравнима с таковой у местных анестетиков ряда лидокаина [10].
В отличие от «классических» агонистов периферических ОР в клинических исследованиях тримебутин оказался наиболее эффективен при лечении абдоминальной боли и запора у пациентов с функциональными заболеваниями ЖКТ [14, 15].
В одном из первых клинических исследований с применением тримебутина K. Lüttecke была показана сфокусированность эффектов препарата на стресс-индуцированных нарушениях моторики и абдоминальной боли у пациентов с СРК [16, 17]. Несколько позднее M. Galeone и соавт. (1986) установили, что у пациентов с СРК прием 600–800 мг тримебутина внутрь увеличивает пропульсивную перистальтику толстой кишки, нивелирует стихийные и вибрирующие сокращения – в целом нормализует моторику толстой кишки [18]. В другом исследовании того же периода S. Shannon и соавт. (1989) показали, что прием внутрь даже 200 мг тримебутина способен синхронизировать постпрандиальную двигательную активность сигмовидной кишки у пациентов с СРК с запорами, не влияя при этом на моторику ЖКТ у здоровых волонтеров [19]. J.C. Schang и соавт. (1993) также показали, что, уменьшая время кишечного транзита с 105 ± 9 до 60 ± 11 часов у пациентов с СРК, тримебутин не влияет на нормальную тощаковую и постпрандиальную моторику ЖКТ [20].
Влияние тримебутина на симптомы СРК по данным рандомизированных клинических исследований (РКИ) было впервые оценено в метаанализе T. Poynard и соавт. [21]. В метаанализе 26 РКИ была впервые показана большая эффективность и безопасность тримебутина при коррекции симптомов СРК в сравнении с другими спазмолитиками и плацебо. Таргетность тримебутина в отношении симптомов СРК, обусловленных висцеральной гиперчувствительностью, была показана в систематическом обзоре M. Delvaux и D. Wingate [1]. На основании анализа экспериментальных данных и 12 РКИ авторы продемонстрировали, что тримебутин эффективно купирует характерный для СРК болевой синдром и увеличивает порог болевой чувствительности, уменьшая висцеральную гиперчувствительность и позитивно модифицируя субъективное восприятие висцеральной боли. Позднее в ряде исследований было также показано, что одновременно с коррекцией симптомов СРК тримебутин положительно влияет на психологический статус пациентов, уменьшая их тревожность и негативную вовлеченность в свое заболевание [22].
В 2008 г. эффективность тримебутина при лечении функциональной абдоминальной боли и диспепсии была подтверждена в метаанализе 22 РКИ, посвященном применению спазмолитиков с различным механизмом действия, включившем 1778 пациентов с СРК [23]. У пациентов с СРК эффективность спазмолитиков как класса препаратов составила 53–61% и была выше, чем плацебо (31–41%). Показатель NNT (количество пациентов, которых необходимо пролечить, чтобы добиться положительного результата у одного больного) при применении спазмолитиков варьировал от 3,5 до 9.
В 2009 г. эффективность тримебутина среди прочих спазмолитиков с разным механизмом действия (гиосцина, гиосциамина, отилония бромида, пинаверия бромида, альверина, мебеверина, пиренципина и некоторых других, не зарегистрированных в России) была проанализирована рабочей группой по изучению СРК [24]. В систематический обзор вошли 22 исследования, включившие 1778 пациентов. По данным экспертов, все спазмолитики, включая тримебутин, несмотря на некоторые неизбежные при изучении фукнциональных заболеваний методологические дефекты исследований, при лечении СРК оказались более эффективны, чем плацебо (отношение шансов (ОШ) 0,68, 95% доверительный интервал (ДИ) 0,57–0,81). В 2011 г. тримебутин был включен в Кохрейновский систематический обзор препаратов различной направленности действия, применяемых для лечения СРК. По данным L. Ruepert и соавт., тримебутин является эффективным спазмолитиком для купирования абдоминальной боли у пациентов с СРК [25].
L. Rurpert и соавт. [25] анализировали влияние терапии на выраженность боли в животе при СРК (56 РКИ, 3725 пациентов). Они сравнивали эффективность плацебо, растительной клетчатки и псиллиума (12 исследований), четырех спазмолитиков (29 исследований) – дицикломина, мятного масла, пинавериума, тримебутина, двух антидепрессантов (15 исследований) – ингибиторов обратного захвата серотонина и амитриптилина. Исследователи пришли к выводу, что растительная клетчатка не влияет на выраженность абдоминальной боли при СРК. Спазмолитики эффективны у пациентов с болью в животе при СРК. Ингибиторы обратного захвата серотонина и трициклические антидепрессанты также эффективны, но эффект зависит от индивидуальных характеристик пациентов.
Соответственно в 2013 и 2015 гг. эффективность тримебутина продолжали исследовать в сравнении с наиболее широко применяемыми для лечения СРК спазмолитиками: пинавериумом (G.S. Karabulut и соавт., 2013) и мебеверином (M.Z. Rahman и соавт., 2015). По данным обоих РКИ, тримебутин не менее эффективно, чем пинаверия бромид и мебеверин, уменьшал абдоминальную боль и увеличивал частоту дефекаций у пациентов с СРК [26, 27]. В 2015 г. эти данные были подтверждены в обзоре Канадского агентства по лекарствам и технологиям в здравоохранении, где также было показано, что тримебутин более эффективно, чем оба указанных спазмолитика, улучшает качество жизни пациентов с СРК, особенно в детской популяции [28]. При этом терапия тримебутином была более безопасной – лишена неблагоприятных эффектов, характерных для спазмолитиков других классов: миорелаксантов, антихолинергических средств и пинаверия бромида
. Склонность этих агентов самостоятельно вызывать запор, частое головокружение, сухость во рту, паралич аккомодации, задержку мочи и возможную спутанность сознания у пожилых пациентов ограничивает их полезность в клинической практике [29]. Таким образом,
уровень доказательности исследований, в которых подтверждалась эффективность тримебутина, соответствовал I категории, уровень практических рекомендаций – категории А
[30].
Во многих исследованиях были показаны влияние тримебутина на моторику верхних отделов ЖКТ и его эффективность как спазмолитика и прокинетика при лечении ФД. В уже упомянутом «раннем» систематическом обзоре M. Delvaux и D. Wingate (1997) показали, что у пациентов с ФД курсовой прием тримебутина эффективно уменьшает общее время нахождения пищи в желудке [1]. По данным A. Aktas (1999), это происходит потому, что при ФД тримебутин существенно сокращает лаг-период (VLAG) – время от начала поступления пищи в желудок до начала ее эвакуации и уменьшает объем удерживаемой в желудке пищи (R100 – процент от поступившего объема пищи, оставшегося в желудке через 100 минут) (табл. 1) [31].
Таким образом, тримебутин восстанавливает как нормальное время, через которое желудок должен начать эвакуацию пищи, так и нормальную продолжительность этого процесса посредством индукции III фазы ММК в тонкой кишке. Этот эффект не связан непосредственно с гиперацидностью в желудке и в полной мере сохраняется на фоне лечения ингибиторами протонной помпы [32]. По некоторым данным, тримебутин способен не менее эффективно стимулировать моторику выходного отдела желудка даже у коморбидных и тяжелобольных пожилых пациентов с гастропарезом на фоне цереброваскулярной патологии и сниженным уровнем сознания, а также способствовать разрешению послеоперационного пареза желудка и кишечника, гастропареза при инсулинзависимом сахарном диабете [33–35].
Метаанализ T. Hiyama и соавт. (2007), посвященный оценке сравнительной эффективности прокинетиков как основного класса препаратов для лечения ФД, включил 27 плацебоконтролируемых РКИ с применением тримебутина и других прокинетиков (1844 пациента получали лечение, 1591 – плацебо). Метаанализ продемонстрировал эффективность даже краткосрочного (семь дней в дозе 600 мг) назначения тримебутина для коррекции симптомов ФД [36].
В последнем метаанализе Y.J. Yang и соавт. (2017) также сравнивали эффективность различных прокинетиков при лечении ФД (25 РКИ, 4473 пациента). Тримебутин при курсовом назначении оказался вторым после метоклопрамида по интегральной эффективности в отношении симптомов ФД [37]. Терапевтическая эффективность тримебутина почти не отличалась от эффективности метоклопрамида (OШ 1,32, 95% ДИ 0,27–6,06) и была выше эффективности мозаприда (OШ 1,99, 95% ДИ 0,87–4,72), домперидона (OШ 2,04, 95% ДИ 0,92–4,60) и итоприда (OШ 2,79, 95% ДИ 1,29–6,21) (рис. 3, табл. 2).
Согласно выводам авторов, учитывая риск нежелательных явлений на фоне терапии метоклопрамидом или домперидоном, пациентам с ФД рекомендуется назначение коротких курсов этих препаратов или безопасная альтернатива – терапия тримебутином или мозапридом.
В большинстве РКИ с применением тримебутина подчеркивается наибольшая эффективность лечения у пациентов с изначально более выраженными симптомами и перекрестом симптомов функциональных заболеваний ЖКТ. Так, в популяции пациентов с сочетанием ФД и СРК, а также высокой частотой диарейного синдрома назначение тримебутина приводило к нормализации моторики толстой кишки, ускорению пропульсивной перистальтики и толстокишечного транзита (60 против 95 и 105 часов соответственно) за счет активизации электрофизиологической активности кишечника [38].
В России эффективность тримебутина у больных с ФД, СРК и пациентов с комбинацией ФД и СРК была подтверждена в наблюдательном исследовании (254 пациента, 30 – с СРК, 67 – с ФД, у 157 пациентов – сочетание СРК и ФД) [40]. Его целью было изучение практических алгоритмов фармакологического лечения и сравнительной эффективности регуляторов моторики и пробиотиков у пациентов с функциональными заболеваниями ЖКТ (тримебутин в схемах лечения применялся в стандартной дозе при курсовом приеме). Тримебутин достоверно более эффективно уменьшал выраженность каждого симптома функционального расстройства в сравнении со схемами, в которые были включены спазмолитики, за исключением запора и нарушения консистенции кала (твердый кал), в отношении этих симптомов эффективность тримебутина казалась сравнимой с таковой спазмолитиков (рис. 4).
В большинстве РКИ с применением тримебутина (за исключением исследований у пациентов отделений интенсивной терапии) проводилась оценка эффективности и безопасности курсового назначения препарата (две – четыре недели). Сравнивая эффекты курсового и краткосрочного (один – три дня) лечения тримебутина, авторы единодушно отмечают, что положительные свойства препарата в наибольшей мере проявляются не в первые дни, а после двух и более недель лечения [39]. С учетом активного пресистемного метаболизма тримебутина было высказано предположение, что при очень хорошей переносимости препарата увеличение разовой дозы тримебутина до 300 мг при сохранении суточной дозы 600 мг может привести к росту эффективности лечения при одновременном улучшении комплаентности больных, поскольку прием препарата будет сокращен до двух раз в день.
Исследование эффективности и безопасности назначения тримебутина 300 мг по одной таблетке два раза в день, суммарно 600 мг в день (Тримедат® форте, таблетки пролонгированного действия, покрытые пленочной оболочкой, АО «Валента Фарм», Россия) при курсовом (28 дней) лечении боли, обусловленной функциональными заболеваниями ЖКТ и/или желчевыводящих путей, было выполнено в ходе открытого многоцентрового проспективного рандомизированного сравнительного исследования эффективности и безопасности III фазы [40]. Эффективность и безопасность препарата Тримедат® форте сравнивали с тримебутином 200 мг производства Франции по одной таблетке три раза в день, суммарно 600 мг в день. Исследование проводилось в 2015–2016 гг. на базах 16 крупных гастроэнтерологических клиник Москвы, Санкт-Петербурга, Ярославля, Рязани, Нижнего Новгорода, Уфы, Челябинска, Пятигорска и Реутова. В исследование вошли пациенты с хронической абдоминальной болью в сочетании хотя бы с одним из симптомов диспепсии – изжогой, отрыжкой, тошнотой, метеоризмом, запором, поносом и верифицированным диагнозом одного из функциональных заболеваний ЖКТ (неэрозивная гастроэзофагеальная рефлюксная болезнь, функциональная тошнота/рвота, ФД, СРК, дисфункция желчевыводящих путей). Среди пациентов было 56 мужчин (27%) и 151 женщина (73%) в возрасте 43,3 ± 13,6 года (от 18 до 69 лет). Эффективность лечения оценивали по частоте положительного ответа на лечение – определяли долю пациентов в группе с уменьшением жалоб более чем на 30% по Шкале оценки желудочно-кишечных симптомов к 29-му дню от начала лечения (первичная конечная точка), динамике изменения суммарного балла по Шкале оценки желудочно-кишечных симптомов к 7, 14, 21 и 29-му дню от начала лечения, динамике на фоне лечения баллов Шкалы оценки желудочно-кишечных симптомов по отдельным синдромам, динамике изменения качества жизни по опроснику SF-36 к 29-му дню от начала лечения (вторичные конечные точки) (табл. 3, 4, рис. 5, 6).
Качество жизни, оцененное по физическому и психологическому компонентам опросника SF-36, к 29-му дню от начала лечения улучшилось в среднем в 1,2 раза по сравнению с исходным состоянием и также продемонстрировало не меньшую эффективность препарата Тримедат® форте и по сравнению с тримебутином 200 мг производства Франции по данному критерию.
Оценка влияния приема пищи на фармакокинетику препарата, проведенная у части пациентов в клиническом исследовании III фазы, показала, что прием препарата одновременно с высококалорийной пищей увеличивает биодоступность нортримебутина на 25,9% (отношение медиан AUC0-t) по сравнению с приемом натощак.
Данными проведенного клинического исследования была подтверждена высокая эффективность новой лекарственной формы препарата Тримедат® форте в купировании абдоминальной боли и проявлений диспепсического синдрома. Уменьшение кратности приема препарата привело к росту приверженности пациентов к назначенному лечению.
Таким образом, оказывая прокинетическое, спазмолитическое и обезболивающее действие, тримебутин занимает особое место в небогатом арсенале лекарственных препаратов для лечения функциональных заболеваний ЖКТ. Точка приложения тримебутина как периферического агониста ОР – разноуровневые афферентные нервные структуры ЖКТ. Взаимодействие тримебутина с ОР ЖКТ приводит:
- к ингибированию высвобождения ацетилхолина из нейронов энтеральных сплетений и нейромодуляции активности ацетилхолина в отношении гладких мышц ЖКТ;
- высвобождению эффектов эндогенных антихолинергических стресс-лимитирующих систем ЖКТ;
- блокировке передачи болевых и неболевых стимулов в NMDA-синапсах нейронов задних спинномозговых ганглиев на вставочные нейроны, что уменьшает передачу патологических стимулов в ЦНС с последующим уменьшением эффекторного ответа;
- увеличению толерантности к болевым и механическим стимулам – нивелированию висцеральной гиперчувствительности.
В медицинской практике соотношение центрального и периферического эффектов в лекарственном действии тримебутина часто понимают упрощенно. В механизме действия тримебутина значительную роль играет именно взаимодействие с чувствительными нервными структурами, обладающими существенно большей концентрацией ОР, чем стенка ЖКТ. По данным экспериментальных исследований, в стенке тонкой кишки содержание ноцицептивных ОР (δ-ОР) в 15–20 раз меньше, чем в задних ганглиях спинного мозга, и в 100 раз меньше, чем в головном мозге [41]. Именно широта воздействия тримебутина на разноуровневые ОР, расположенные «ниже» головного мозга (препарат не проникает через гематоэнцефалический барьер), позволяет оказывать устойчивое спазмолитическое и анальгетическое действие при функциональных заболеваниях ЖКТ, опосредованных патологией ЦНС и формированием висцеральной гиперчувствительности.
По данным многочисленных РКИ, тримебутин оказывает модулирующее влияние на ЖКТ, незаменимое при лечении заболеваний, основным звеном патогенеза которых служат висцеральная гиперчувствительность и высокий тонус гладкой мускулатуры у пациентов со стресс-индуцированной патологией: ФД, СРК с запором и смешанным вариантом СРК, хроническим идиопатическим запором. Модулирующeе влияние тримебутина на моторику и тонус мышц ЖКТ – коррекция нарушенной моторики кишечника путем индукции регуляции спонтанной активности без влияния на нормальную моторику – обусловлено различной степенью стрессорной нейромодуляции оси «мозг – ЖКТ», а следовательно, и сенситизации ОР у различных пациентов с функциональными заболеваниями. В целом ряде клинических исследований убедительно показано, что эффект тримебутина, по крайней мере характер влияния на моторику ЖКТ, зависит от вектора ее предшествовавшего нарушения. Так, влияние тримебутина на характерную для СРК абдоминальную боль вследствие растяжения кишки на фоне гиперчувствительности будет тем более выражено, чем выше чувствительность нервной системы к боли и чем ниже ее толерантность к любым периферическим проприоцептивным импульсам, которые в норме не должны осознаваться ЦНС. По мнению ряда авторов, тримебутин эффективен при СРК с запором потому, что у пациентов с висцеральной гиперчувствительностью имеют место адаптивная гиперреактивность периферических опиатергических структур, сенситизация и секреция новых ОР. Например, показано, что в кишечнике мышей экспериментальное воспаление и избыточный бактериальный рост стимулируют секрецию новых и увеличивают чувствительность μ-ОР [42]. Клинически это приводит к развитию нарушений функции ЖКТ, характерных для передозировки экзогенных опиатных анальгетиков: тошнота/рвота, анорексия, запор, чувство неполного опорожнения, вздутие живота, дискомфорт в животе, гастроэзофагеальный рефлюкс, псевдообструкция кишечника [9, 10, 43]. Причем считается, что все указанные эффекты реализуются посредством активации как центральных, так и периферических μ-ОР, поскольку их почти полностью устраняет неселективный антагонист ОР налоксон [44]. У таких пациентов тримебутин (неселективный агонист периферических ОР) демонстрирует эффекты не столько агониста, сколько конкурентного антагониста ОР, минимизируя указанные симптомы. Напротив, тримебутин ускоряет эвакуацию из желудка, индуцирует преждевременную фазу III ММК и модулирует сократительную способность толстой кишки. Вследствие гармонизации функций отдельных ОР тримебутин оказывает модулирующее (стимулирующее или расслабляющее) влияние на тонус гладкомышечных клеток и перистальтическую активность ЖКТ в зависимости от их исходного состояния. Тримебутин ослабляет рефлексы, вызванные расширением просвета кишки, и таким образом может модулировать висцеральную чувствительность и оказывать антиноцицептивное действие у больных с СРК [45]. Гипотеза о том, что периферические антагонисты ОР могут регулировать спазм и запор вследствие повышенной экспрессии ОР и/или увеличения активности опиоидергической системы ЖКТ как при хроническом стрессе, так и при длительном приеме опиатных анальгетиков, стимулирует поиск новых опиоидергических молекул [43, 46]. В исследованиях нового селективного периферического антагониста κ-ОР ЖКТ федотозина (fedotozine) были также продемонстрированы прокинетические свойства и эффективность при лечении пациентов с функциональными заболеваниями ЖКТ [47]. Однако в отличие от тримебутина большинство известных сегодня селективных агонистов ОР ЖКТ (лоперамид и новые препараты – ракекадотрил, элюксадолил, асимадолин) демонстрируют противоположное тримебутину влияние на моторику и применяются для лечения острой и хронической диареи. При СРК с диареей селективные агонисты уменьшают моторику и секрецию ЖКТ, не блокируют висцеральную гиперчувствительность и практически не влияют на абдоминальную боль, ассоциированную с растяжением кишки [29, 44, 48]. В целом на фоне несколько разочаровывающих результатов клинических исследований с применением новых селективных периферических агонистов ОР и высокоселективных модуляторов разных классов серотониновых рецепторов прокинетическое, спазмолитическое и обезболивающее лечебное действие тримебутина (Тримедат) является уникальным по критерию «эффективность/безопасность» и может быть рекомендовано как терапия первого ряда при абдоминальной боли, диспепсии и запоре у пациентов с функциональными заболеваниями ЖКТ [49, 50].