Особенности применения антикоагулянтов непрямого действия
Антикоагулянты непрямого действия нарушают процесс синтеза факторов свертывания в печени (протромбина и проконвертина). Их эффект проявляется через 8-12 часов после введения и длится от нескольких дней до двух недель. Самое важное преимущество этих препаратов в том, что они имеют накопительный эффект. Антагонисты витамина К (второе название непрямых антикоагулянтов) больше 50 лет используются для первичной и вторичной профилактики тромбоэмболии. Именно витамин К является неотъемлемой частью процесса коагуляции.
Антагонистами витамина К называют непрямые антикоагулянты
Варфарин и другие производные кумарина — наиболее часто используемые антикоагулянты непрямого действия. АВК (сокращенное название антагонистов витамина К) имеют множество ограничений, поэтому самостоятельно их прием начинать не стоит. Правильную дозу может подобрать только квалифицированный врач на основании результатов анализов. Регулярный контроль показателей крови имеет большое значение для своевременной корректировки дозировки. Поэтому нужно иметь в виду, что если врач назначил принимать варфарин 2 раза в день, то самостоятельно уменьшать или увеличивать дозу запрещено.
Также не рекомендуется возобновлять прием препарата в той же дозировке после долгого перерыва. Варфарин имеет период полураспада 40 часов и начинает действовать как минимум через 7 дней. Препарат метаболизируется в печени и выводится из организма с мочой. В настоящее время варфарин остается оптимальным вариантом лечения пациентов с ишемическим инсультом.
Будущее ОАК в профилактике и лечении артериальных и венозных тромбозов
После почти 60 лет применения ОАК, механизм действия которых опосредован антагонизмом к витамину К, два новых ОАК с различными механизмами действия были одобрены к применению в 2008 г. в Канаде, Европе (в т. ч. в России) и Австралии для профилактики тромбоэмболии у пациентов, перенесших операцию по поводу замены тазобедренного или коленного суставов. Оба препарата в настоящее время изучаются в крупных клинических исследованиях с участием больных сердечно-сосудистыми заболеваниями. Особый упор делается на профилактику системной тромбоэмболии у пациентов с фибрилляцией предсердий. Кроме того, ОАК проходят испытания у больных острым коронарным синдромом и для профилактики ВТЭ.
По сравнению с варфарином и его аналогами прямые ингибиторы тромбина и фактора Ха имеют более благоприятный фармакологический профиль. Они обладают прямым действием, которое не зависит от уровня плазменного антитромбина III, представлены малыми молекулами с предсказуемой фармакодинамикой, что позволяет использовать их однократно или 2 раза в сутки при фиксированных режимах дозирования без необходимости (в большинстве случаев) регулярного контроля над антикоагулянтными эффектами. Пока официальные показания к их применению ограничиваются ортопедическими вмешательствами (артропластикой тазобедренного или коленного суставов). Однако в дальнейшем клинические испытания могут существенно расширить сферу их использования. Короткий период полужизни новых ОАК может помочь предотвратить клинически значимые кровотечения, которые наблюдаются у пациентов, принимающих варфарин, а также обеспечить длительную антитромботическую защиту у лиц, резистентных к приему кумаринов, например, в отсутствие реакции МНО при недельной дозе варфарина более 70 мг.
Другая проблема, требующая тщательного анализа, заключается во взаимодействии новых ОАК с другими лекарственными препаратами. Например, дабигатран взаимодействует с амиодароном, верапамилом и хинидином, принадлежащим к группе ингибиторов Р-гликопротеина. Ривараксобан также имеет лекарственные взаимодействия. В частности, ингибиторы CYP3A4 (рифампицин) либо P-гликопротеина (кетоконазол, эритромицин, кларитромицин, ритонавир) изменяют уровни ривароксобана в плазме крови.
Еще одна потенциальная проблема, которую необходимо решать в будущем, заключается в выборе антидотов при применении новых ОАК в клинических ситуациях, требующих немедленного гемостаза, например при тяжелых кровотечениях. В настоящее время нет каких-либо рекомендаций по этому поводу. Тем не менее эффективным может быть применение рекомбинантного фактора VIIa (эптаког альфа) или концентрата активированного протромбинового комплекса, хотя нет достаточных данных, чтобы рекомендовать их к использованию для этой цели [26]. Другие подходы, находящиеся на стадии доклинических исследований, состоят в получении из плазмы фактора Ха с дальнейшей химической модификацией для конкурентного связывания его ингибитора [33]. Кроме того, разрабатываются антидоты на базе специфических анти-ДНК- или анти-РНК-антител [34]. Показано также, что использование системы биотин/авидин обеспечивает быструю инактивацию этих лекарственных препаратов [35, 36]. Вполне вероятно, что стратегия прямого ингибирования тромбина или прямое подавление фактора Ха с использованием препаратов, применяемых перорально, в ближайшем будущем станет альтернативой варфарину. Кроме того, можно предполагать возможность предпочтительного использования новых ОАК у определенных групп больных (например, с нарушениями функции печени или почек).
Перечень непрямых антикоагулянтов и механизм их действия
Список антикоагулянтов непрямого действия возглавляет варфарин (другое торговое название «Кумадин»). Это одно из самых популярных лекарств, которое назначают для предотвращения возникновения сгустков крови. Менее популярные препараты-антагонисты витамина К – синкумар, аценокумарол и дикумарол. Механизм действия этих лекарств идентичен: уменьшение активности поглощения витамина К, что приводит к истощению витамин К-зависимых факторов свертывания крови.
Пациенты, принимающие варфарин и антикоагулянты-синонимы, должны ограничивать ежедневное употребление витамина K с пищей и пищевыми добавками. Внезапные изменения в уровне витамина К в организме могут значительно увеличить или уменьшить эффект антикоагулянтной терапии.
Недостатки антагонистов витамина К
Варфарин — настоящий «старожитель» фармацевтического рынка
До конца 2010 года антагонист витамина К (варфарин) был единственным пероральным антикоагулянтом, одобренным всемирной организацией здоровья, для профилактики тромбоэмболических осложнений у пациентов с неклапанной фибрилляцией предсердий и лечения венозной тромбоэмболии. За полвека фармацевты подробно изучили эффективность препарата, а также четко определили недостатки и побочные эффекты.
К самым распространенным можно отнести:
- узкое терапевтическое окно (для отравления достаточно выпить минимальное количество таблеток);
- взаимодействие с продуктами, богатыми витамином K (прием таблеток в сочетании с ежедневным употреблением зеленых овощей может привести к гиперкалиемии);
- задержка антикоагулянтного эффекта (это значит, что между началом терапии и получением первых результатов должно пройти несколько недель). Для профилактики венозного тромбоза такой срок является слишком длительным;
- необходимость частого мониторинга состояния крови и корректировки дозы;
- возможность возникновения кровоподтеков и кровотечений.
Ингибиторы фактора Xa
Ривароксабан по механизму действия является пероральным прямым ингибитором фактора Ха, обратимо с ним связывающимся [22]. Ривароксабан имеет высокую биодоступность (60–80 %) и достигает пика концентрации в плазме примерно через 3 часа после приема [23]. Существует доказательство того, что ривароксабан может связываться с фактором не только Ха, но и Vа (протромбиназным комплексом). Это является одним из клинических преимуществ препарата по сравнению с гепарином, имеющим слишком большую молекулярную массу, чтобы блокировать фактор Ха в составе протромбиназного комплекса [22]. В отличие от дабигатрана на всасывание данного прапарата рН кишечной среды не влияет [24]. Период полужизни ривароксабана составляет около 5–9 часов у пациентов с нормальной функцией почек и печени [23, 25]. Более высокие уровни ривароксабана могут определяться у пациентов с нарушением почечной и печеночной функций, т. к. одна треть препарата выводится почками и около двух третей метаболизируется в печени, в первую очередь через систему цитохрома P450 [26].
Главным результатом фазы III клинических испытаний, которые привели к разрешению применения ривароксабана, были программы клинических испытаний, в которых оценивалась эффективность ривароксабана по сравнению с эноксапарином у 1000 больных, перенесших операции на коленном суставе или тотальное эндопротезирование тазобедренного сустава. Препарат был разрешен к применению в Канаде (в сентябре 2008 г.), в Европе (EMEA, в октябре 2008 г.), в Австралии (в ноябре 2008 г.) и в России (в декабре 2008 г.). В марте 2009 г. группа экспертов FDA (Food and Drug Administration) рекомендовала ривароксабан к клиническому применению, хотя и с поправками на необходимость получения более подробной информации о безопасности препарата. Утвержденная в настоящее время дозировка ривароксабана для профилактики ВТЭ у пациентов, перенесших операции на бедре или коленном суставе, составляет 10 мг однократно через 6–10 часов после операции, затем ежедневно в течение 5 недель после вмешательства на тазобедренном и двух недель на коленном суставах.
В настоящее время утверждение правил приема ривароксабана строится на основе доз, использованных в двойных слепых рандомизированных клинических испытаниях RECORD-1, -2, -3 и -4 (табл. 2). В частности, в RECORD-1 [27] и RECORD-2 [28] исследовался ривароксабан у пациентов, перенесших протезирование тазобедренного сустава, а в RECORD-3 [29] и RECORD-4 [30] – после операций на коленном суставе. Исследования RECORD-1 и RECORD-2 показали превосходство ривароксабана по сравнению с 40 мг эноксапарина, вводимого однократно. Превосходство над эноксапарином, в т. ч. в дозировках 30 мг 2 раза/сут (североамериканские дозы эноксапарина), показано в RECORD-3 и RECORD-4. Ривароксабан в целом был лучше эноксапарина во всех этих испытаниях, несмотря на незначительное, статистически незначимое увеличение числа кровотечений.
В клинике сердечно-сосудистых заболеваний ривароксабан все еще находится в фазе III клинических испытаний – для профилактики тромбоэмболических событий у пациентов с неклапанной фибрилляцией предсердий (ROCKET-AF), для вторичной профилактики ВТЭ (EINSTEIN), для первичной профилактики ВТЭ у пациентов с острыми заболеваниями (MAGELLAN) и для вторичной профилактики неблагоприятных сердечно-сосудистых событий у пациентов с острым коронарным синдромом (ATLAS ACS 2 TIMI 51).
В испытании MAGELLAN ривароксабан применялся в дозе 10 мг в течение 31–39 дней по аналогии с дозами, использованными в RECORD, в сравнении с 40 мг эноксапарина однократно подкожно в течение 6–14 дней у 8000 госпитализированных больных (идентификатор: NCT00571649). В исследовании ROCKET-AF предусмотрено изучение ривароксобана в дозе 20 мг/сут по сравнению с варфарином с целевым диапазоном МНО от 2–3 для профилактики тромбоэмболии у 14 тыс. пациентов с неклапанной фибрилляцией предсердий (идентификатор: NCT00403767). Установлено, что ривароксабан имеет дополнительный эффект по сравнению со стандартным лечением ацетилсалициловой кислотой или комбинацией ацетилсалициловой кислоты с клопидогрелом для профилактики неблагоприятных сердечно-сосудистых событий у пациентов с недавним острым коронарным синдромом – клинические испытания III фазы ATLAS ACS 2 TIMI 51 (идентификатор: NCT00809965). Данный препарат принимается по 2,5 или 5,0 мг 2 раза/сут. Эта доза регламентирована IIb фазой клинических испытаний ATLAS ACS TIMI 46, которые показали не только тенденцию к снижению риска неблагоприятных сердечно-сосудистых событий, но и зависимое от дозы увеличение клинически значимых кровотечений [31].
В исследовании EINSTEIN-DVT проанализировано действие ривароксабана в дозе 15 мг дважды/сут в течение 3 недель, затем по 20 мг 1 раз/сут в течение до 12 месяцев. В исследование были включены 2900 пациентов с острым ТГВ, но без ТЭЛА; эффекты ривароксабана сравнивались с результативностью использования варфарина (www.clinicaltrials. идентификатор: NCT00440193).
В исследование EINSTEIN-PE, идентичное по дизайну EINSTEINDVT, были включены 3300 пациентов с ТЭЛА (идентификатор: NCT00439777). Об окончательных результатах как EINSTEIN-DVT, так и EINSTEIN-PE не было доложено (на июнь 2010 г.), однако результаты предварительного испытания EINSTEIN-EXTENSION (идентификатор: NCT00439725), в котором больные получали ривароксабан в дозе 20 мг/сут в сравнении с плацебо, были приведены в 2009 г. на ежегодном совещании Американского общества гематологов [32]. По результатам исследования 1197 пациентов со средней продолжительностью лечения 190 дней повторные ВТЭ зарегистрированы в 7,1 % случаев в группе плацебо и в 1,3 % в группе пациентов, получавших ривароксабан (р < 0,001) [32]. Не было существенных различий в числе крупных кровотечений, в то время как клинически значимые небольшие кровотечения отмечены в 1,2 % случаев в группе плацебо у 5,4 % пациентов, проходивших тромбопрофилактику ривароксабаном [32].
Преимущества и недостатки антикоагулянтных препаратов прямого действия
За последние 6 лет на фармацевтическом рынке появились новые прямые антикоагулянты. Они являются альтернативой антагонистам витамина К для лечения тромбоэмболии и профилактики тромбоза. Прямые пероральные антикоагулянты (ППА) представляют собой более эффективный и безопасный аналог антагонистов витамина К.
Прямые антикоагулянты — единственная альтернатива антагонистам витамина К
Популярность ППА среди кардиологов и пациентов не удивительна, ведь среди преимуществ можно отметить:
- быстрое начало действия;
- относительно короткий период полураспада;
- наличие специфических агентов-антидотов (может быть полезным при лечении острых ишемических инсультов, а также для устранения постинсультных негативных симптомов);
- фиксированную дозировку;
- отсутствие прямого влияния диетических добавок на ежедневную дозу препарата;
- отсутствие необходимости в прохождении регулярного лабораторного контроля крови.
Самым распространенным побочным эффектом, возникающим после приема ППА, является повышенный риск развития кровотечения. Но предполагаемая угроза сильного кровотечения довольно невелика в сравнении с преимуществами, которые дают прямые антикоагулянты.
Возможные осложнения терапии антикоагулянтами
Основным побочным эффектом терапии оральными антикоагулянтами являются кровотечения, которые могут проявляться в форме длительных кровотечений из ран и порезов, носовых кровотечений, появления синяков на теле, изменения цвета мочи (розовый или красный) и кала (черный цвет, появление примеси крови) и др. Эти осложнения возникают редко, но могут быть очень опасными.
Риск развития осложнений значительно повышается, если МНО выходит за рамки индивидуального «коридора». Таким образом, Ваши усилия должны быть направлены на поддержание свертываемости крови в границах Вашего «коридора».
Факторы, которые могут повышать риск кровотечения:
- Сопутствующие заболевания (даже обычная простуда)
- Применение других препаратов, влияющих на свертываемость крови
- Неточное следование инструкции по применению
Симптомы, о появлении которых нужно немедленно сообщить врачу:
- Черная окраска стула
- Розовый или красный цвет мочи
- Рвотные массы, напоминающие «кофейную гущу»
- Легко возникающие без видимой причины синяки и припухлости на теле
- Кровотечения из носа
- Обильные кровотечения из десен (особенно заметно при чистке зубов)
- Длительные кровотечения из мелких ран и порезов
А также:
- Появление одышки, сердцебиения, боли в груди
- Головокружение, затруднение речи
- Нарушение зрения
- Онемение или нарушение движений одной либо нескольких конечностей
- Резкое похолодание, боль в конечностях
- Боли в животе
- Резкое нарастание массы тела
- Отеки нижних конечностей
Торговые названия прямых антикоагулянтов и механизм их действия
Классификация препаратов прямого действия чуть более обширна. Дабигатрана этексилат (торговое название «Прадакса») — это прямой ингибитор тромбина. Данный препарат был первым прямым пероральным антикоагулянтом среди одобренных медицинским сообществом. Буквально в течение нескольких лет к перечню прямых антикоагулянтов были добавлены ингибиторы ривароксабана (ксалерто и эдоксабан). Длительные клинические испытания показали высокую эффективность вышеперечисленных препаратов в профилактике инсульта и лечения тромбозов. ППА имеют явные преимущества перед варфарином, а самое главное, препараты могут быть введены без регулярного мониторинга показателей крови.
Прадакса — наиболее исследованный антикоагулянт прямого действия
Механизм действия ППА значительно отличается от механизма антагонистов витамина К. Каждый антикоагулянт прямого действия содержит в составе небольшие молекулы, которые избирательно связываются с каталитическим участком тромбина. Поскольку тромбин способствует коагуляции путем превращения фибриногена в нити фибрина, дабигатран создает эффект блокировки этих нитей.
Дополнительные эффективные механизмы прямых антикоагулянтов включают дезактивацию тромбоцитов и уменьшение активности свертывания крови. Период полураспада этой группы препаратов составляет 7-14 часов, время возникновения терапевтического эффекта колеблется от одного до четырех часов. Прямые антикоагулянты аккумулируются в печени с образованием активных метаболитов и выводятся из организма с мочой.
Также в качестве антикоагулянтов используются два типа гепаринов – нефракционный (НФГ) и низкомолекулярный (НМГ). Низкофракционный гепарин используется для профилактики и лечения нетяжелого тромбоза в течение нескольких десятилетий. Недостатки НФГ в том, что он имеет переменный антикоагулянтный эффект, а также ограниченную биодоступность. Низкомолекулярный гепарин получают из низкофракционного путем деполимеризации.
Низкомолекулярный гепарин имеет удельное молекулярно-массовое распределение, которое определяет его антикоагулянтную активность и продолжительность действия. Преимущество НМГ в том, что можно достаточно легко рассчитать необходимую дозировку, а также не опасаться тяжелых побочных эффектов. По этим причинам именно низкомолекулярный подвид гепарина применяется в большинстве больниц мира.
В качестве антикоагулянта используют раствор гепарина
Последовательность и регулярность имеет важное значение для эффективного лечения прямыми антикоагулянтами. Так как препараты этого типа имеют короткий период полураспада, пациенты, которые пропускают прием дозы преднамеренно или случайно, подвергаются риску тромбоза или возникновению неадекватной коагуляции. Учитывая, что положительный эффект от приема ППА быстро исчезает при прекращении поступления препарата в организм, крайне важно соблюдать прописанный врачом график приема.
Принципы антитромботической терапии у детей
Согласно данным литературы, тромбоз сосудов различной локализации в течение последних лет диагностируют у детей все чаще, при этом тромботические и тромбоэмболические осложнения занимают все большее место среди причин инвалидизации и смертности пациентов. Так, распространенность венозного тромбоза у детей в Дании и Нидерландах составляет 1,4 случая [33], в Канаде и Гонконге — соответственно 0,70–0,74 случая на 100 000 детского населения в год [15, 19]. Частота инсультов у детей в возрасте от 1 до 18 лет колеблется в пределах 1,29–13,0 на 100 000 детского населения в год, а у новорожденных достигает 25,0 на 100 000 в год, при этом в половине случаев инсульт имеет ишемическую природу [34]. Клинически манифестные признаки различных тромботических осложнений наблюдаются у 5,3 пациентов на 10 000 детей, госпитализированных в течение года [21].
Те или иные виды тромбоза наблюдаются у детей разного возраста, но, суммируя данные ряда публикаций, можно сделать вывод о том, что наиболее высокий риск их развития отмечается у детей первого года жизни и у подростков, особенно у девочек. У большинства детей тромботические события отмечаются на фоне различных заболеваний — врожденных пороков сердца, ревматической, инфекционной и онкологической патологии, после хирургических вмешательств, травмы и т. д. [22, 26].
Тромбофилия, характеризующаяся активацией свертывания крови, может быть вызвана как генетически обусловленными, так и приобретенными изменениями в системе гемостаза, определяя повышенный риск развития тромбоза сосудов различного калибра у пациента. Среди генетически обусловленных изменений наиболее часто у детей диагностируют тромбофилии, связанные с дефицитом естественных антикоагулянтов — антитромбина III (АТ III), протеинов C и S, резистентностью к активированному протеину С, обусловленной мутацией гена V фактора, мутацией аллеля G20210A в гене протромбина. Тромбофилию могут определять и другие генетически детерминированные нарушения гемостаза: высокие уровни ингибитора активатора плазминогена 1, дефицит плазминогена, дефицит гепарин-кофактора II и др. Гомозиготные формы некоторых из этих мутаций ассоциированы с возможностью развития тромбоза у детей уже в периоде новорожденности (фульминантная пурпура новорожденных). Показано, что тромбоз у детей с генетически обусловленными тромбофилиями в большинстве случаев возникает при воздействии дополнительных факторов риска. Но и пациенты с гетерозиготными формами мутаций нуждаются в профилактической антитромботической терапии, если предполагается воздействие на них тех или иных заранее известных факторов риска, например хирургического вмешательства.
Среди приобретенных изменений наиболее часто у детей наблюдаются тромбофилии, обусловленные иммунными факторами. Большое внимание специалисты уделяют изучению специфического синдрома, возникающего в организме при появлении антител, обладающих способностью взаимодействовать с антигенными детерминантами мембранных фосфолипидов и связанных с ними гликопротеинов [11]. Клинико-лабораторный симптомокомплекс, патогенетически связанный с синтезом антифосфолипидных антител (аФЛ) и характеризующийся венозным и/или артериальным тромбозом, у взрослых женщин синдромом потери плода (более двух случаев потери плода) и часто умеренной тромбоцитопенией, называется антифосфолипидным синдромом (АФС) [2, 6]. Причиной развития тромботических осложнений у детей разного возраста, в том числе и у новорожденных, могут явиться аФЛ. АФС может быть первичным или вторичным, развиваясь на фоне различных заболеваний. Чаще тромбоз в рамках АФС диагностируют у детей на фоне ревматической патологии, в первую очередь при системной красной волчанке, онкологических и инфекционных заболеваниях. Кроме того, тромбоз у детей может быть обусловлен метаболическими (гипергомоцистеинемия, диабет), медикаментозными и ятрогенными (шунтирование, протезирование) факторами и др.
К настоящему времени сложилось представление о тромбозе у детей как о мультифакториальной патологии, что определяет его значение в качестве мультидисциплинарной проблемы, привлекающей внимание специалистов различного профиля: педиатров, неонатологов, детских ревматологов, онкологов, инфекционистов, врачей отделений реанимации и интенсивной терапии и др.
Антикоагулянтная терапия необходима для лечения и предупреждения тромботических осложнений, однако определение тактики ее проведения у детей часто вызывает трудности, что обусловлено рядом причин. Установлено, что эпидемиология тромбозов и их локализация у детей и взрослых имеют существенные различия. Принципы антитромботической терапии детей были экстраполированы из рекомендаций терапевтов; вместе с тем очевидно, что при лечении этого контингента следует учитывать важные онтогенетические особенности гемостаза, которые касаются как патофизиологии тромботического процесса, так и ответа на лечение. Действительно, развитие тромбозов и эмболий у детей происходит на фоне формирующейся системы гемостаза, что определяет особенности их патогенеза, а также ответа организма ребенка на фармакологическое действие антитромботических препаратов. Установлено, в частности, что распределение, связывание и клиренс антитромботических препаратов имеют различия, ассоциированные с возрастом. Не вызывает сомнений, что частота и спектр интеркуррентных заболеваний, а также их лечение значительно меняются с возрастом больных, в то время как воздействие антитромботических препаратов существенно зависит от приема большого ряда других лекарственных препаратов. Следует отметить, что антитромботические препараты не выпускаются в дозах или формах, удобных для использования у детей, например в виде суспензий или жидкостей, а низкомолекулярные гепарины (НМГ), как правило, расфасованы в шприцы со стандартной дозировкой для взрослых. Особенности питания детей различного возраста, в частности вскармливания грудных детей, определяют существенные различия в их обеспеченности витамином К, что определяет трудности в разработке стандартных рекомендаций по применению оральных антикоагулянтов у детей разного возраста. Наконец, проведение длительной терапии антикоагулянтами может быть затруднено в связи с негативным отношением ребенка, что наиболее типично для подростков, или их родителей, т. е. зависит от социальных факторов [20].
Все вышеизложенное объясняет тот факт, что при наличии достаточно четких рекомендаций по диагностике, терапии и профилактике тромботических осложнений у взрослых в педиатрической практике эта проблема до сих пор не решена. Рекомендации по лечению и профилактике тромбоза у детей остаются недостаточно обоснованными и требуют дальнейшей разработки.
Как известно, фармакологические средства, влияющие на свертывающую систему крови, разделены на три большие группы: антикоагулянты прямого действия, антикоагулянты непрямого действия (АНД) и антиагреганты. Для правильного выбора нужного препарата необходимо учитывать различия в тромбообразовании в артериальном и венозном русле: при артериальном тромбозе ведущими факторами являются поражение и дисфункция сосудистой стенки и активация тромбоцитов, а также стеноз сосудов или вазоконстрикция; при венозном — системная гиперкоагуляция, замедление и нарушение кровотока.
В соответствии с патогенетическими механизмами происходит выбор антитромботических препаратов и их комбинаций.
Прямые антикоагулянты
Прямым антикоагулянтам принадлежит важная роль в профилактике и лечении тромботических осложнений. Наибольшее распространение в клинической практике всего мира получили гепарины, представляющие собой различающиеся по молекулярной массе гликозаминогликаны, состоящие из сульфатированных остатков Д-глюкозамина и Д-глюкуроновой кислоты. Механизм антикоагулянтного действия гепаринов связан с тем, что они образуют комплекс с антитромбином III, повышая способность последнего ингибировать тромбин, фактор Хагемана, факторы IX, X, XI и др.
Нефракционированный гепарин (НФГ) — основной препарат этой группы, широко использующийся для лечения как взрослых, так и детей. Тактика применения НФГ у детей должна основываться на мониторинге активированного частичного тромбопластинового времени (АЧТВ) с целью поддержания его на уровне в 1,5–2,5 раза более высоком по сравнению с нормой. Трудности, связанные с контролем за терапией НФГ, отмечаются у детей с АФС при наличии волчаночного антикоагулянта (особой группы аФЛ), определяющего удлинение АЧТВ.
НФГ обладает рядом нежелательных побочных свойств, которые ограничивают его применение в клинической практике. Вследствие гетерогенности структуры НФГ имеет относительно невысокую биодоступность (30%). Кроме того, НФГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. При появлении антител к этому комплексу возможно развитие гепариновой иммунной тромбоцитопении, ассоциированной с потенциально наиболее опасной формой тромбоза, что определяет необходимость контроля количества тромбоцитов в крови. Одним из нежелательных эффектов НФГ является истощение антитромбина III при длительном применении препарата в больших дозах, что может вновь привести к гиперкоагуляции и тромбообразованию. Лечение гепаринами, в том числе НФГ, сопряжено с риском развития ряда осложнений, в первую очередь возникновения кровотечений. К другим побочным влияниям НФГ относятся остеопороз, алопеция, возможно проявление реакции гиперчувствительности.
Низкомолекулярные гепарины (НМГ), получаемые путем деполимеризации НФГ, имеют более низкую молекулярную массу. Изменение структуры молекулы гепарина, т. е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой изменения его фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность (около 98%), чем НФГ, и больший период полужизни. НМГ меньше связываются с различными белками, клетками, т. е. их эффект более предсказуем. В отличие от НФГ почечный клиренс НМГ значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). НМГ в гораздо меньшей степени, чем НФГ, связываются с клетками эндотелия, что обеспечивает длительную циркуляцию их в плазме (в 2–4 раза дольше). Противотромботический эффект НМГ в основном зависит от их влияния на фактор Ха, НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Кроме того, НМГ способствуют активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена. Контроль за лечением НМГ осуществляется на основании оценки анти-Ха-активности и у большинства больных не требуется. Контролировать лечение НМГ необходимо у детей, особенно раннего возраста, у пациентов с нарушением функции почек (фильтрация менее 30 мл/мин), у больных с онкопатологией и при наличии высокого риска кровотечений.
В целом НМГ следует отнести к группе препаратов выбора для профилактики и лечения тромботических осложнений, поскольку они имеют более предсказуемое антикоагулянтное действие, обладают длительным действием, что определяет возможность их введения 1–2 раза в сутки, в большинстве случаев не требуют регулярного лабораторного контроля. НМГ устойчивы к действию антигепаринового фактора тромбоцитов, поэтому примерно в 10 раз реже, чем НФГ, вызывают гепарин-индуцированную тромбоцитопению. НМГ в меньшей степени, чем НФГ, способствуют развитию остеопороза [4, 23, 24, 32].
В последние годы НМГ стали доступнее и в качестве альтернативных гепарину препаратов все чаще используются как для лечения, так и для профилактики тромбоза у детей. По данным литературы, НМГ у детей столь же эффективны и так же хорошо переносятся, как НФГ, и более просты для применения. Затраты на приобретение НМГ компенсируются за счет более простого лабораторного мониторинга и сокращения длительности пребывания больных в стационаре.
Показания к назначению НФГ и НМГ включают все случаи, сопряженные с необходимостью экстренной и интенсивной гипокоагуляции: острый тромбоз, требующий экстренного медицинского вмешательства (глубокий венозный тромбоз, тромбоэмболия легочных артерий и мозговых сосудов, острый инфаркт миокарда и обусловленные им тромбоэмболические осложнения), операции на сердце и кровеносных сосудах, синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и др.
Прямые антикоагулянты применяют при проведении экстракорпоральных методов (гемосорбция, гемодиализ, перитонеальный диализ) при наличии тромбинемии, которую диагностируют с учетом показателей фибринопептида А, D-димера, фрагментов протромбина 1+2, комплекса тромбин-антитромбин III, растворимых комплексов фибрин-мономера (РФМК), фибриногена. Тромбинемия является важным предиктором тромботической опасности, и динамический контроль ее выраженности является эффективным методом оценки проведенного лечения. Существенное повышение уровня Д-димера, комплекса тромбин-антитромбин III и фрагментов протромбина 1+2 наблюдаются при тромбозах, ТЭЛА, и уже в начальных стадиях ДВС-синдрома, что определяет диагностическую значимость этих маркеров. Вместе с тем следует отметить, что исследование Д-димера имеет ограниченное значение для диагностики тромбоза у новорожденных, поскольку существенные колебания его уровня в этом возрасте наблюдаются и у здоровых детей [10].
НФГ предпочтительны в сложных случаях при наличии высокого риска развития кровотечений и необходимости быстрого прекращения гепаринотерапии. НФГ используются при экстракорпоральном кровообращении в кардиохирургии, при этом контроль осуществляется на основании оценки свертывания крови прямо у постели больного.
НМГ широко применяются для профилактики тромбоза при пороках сердца, для предупреждения и лечения венозного тромбоэмболизма у взрослых. Данные метаанализа свидетельствуют о том, что НМГ более эффективны в качестве стартовой терапии при венозном тромбоэмболизме у взрослых, чем НФГ, поскольку обеспечивают существенно более низкую частоту массивных кровотечений в начале лечения и более высокие показатели общей выживаемости [31]. Отмечены преимущества НМГ и у детей с тяжелым венозным тромбозом [9]. Следует подчеркнуть, что оптимальная продолжительность антикоагулянтной терапии после эпизода венозного тромбоза должна определяться индивидуально, с учетом оценки риска рецидива тромбоза при прекращении лечения и риска развития кровотечения при его дальнейшем проведении, в частности наиболее продолжительная терапия показана детям при наличии аФЛ и злокачественных новообразований [12].
Противопоказаниями для применения прямых антикоагулянтов являются гипокоагуляция различного генеза (гемофилия и др.), кровотечение, язвенная болезнь желудка или двенадцатиперстной кишки, язвенный колит в стадии обострения с опасностью возникновения кровотечения, гепарин-индуцированная тромбоцитопения в анамнезе для НФГ, тяжелые нарушения функции печени и почек.
Непрямые антикоагулянты
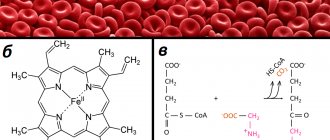
АНД являются препаратами выбора для длительной профилактики тромботических осложнений. Согласно рекомендациям, взрослые пациенты с венозным тромбоэмболизмом получают в течение не менее 5–7 дней НФГ внутривенно или НМГ подкожно, затем в течение 3 и более месяцев осуществляется переход на лечение антагонистами витамина К [30]. В настоящее время «золотым стандартом» из препаратов этой группы признан варфарин из-за его меньшей токсичности, быстрого действия и короткого (около 2 сут) последействия. Варфарин относится к производным кумарина. Главный механизм его действия состоит в блокаде конечного этапа синтеза (γ-карбоксилирования) в клетках печени витамин К-зависимых факторов свертывания крови — факторов VII, X, IX и II (протромбина), а также в меньшей степени двух антикоагулянтов — протеинов C и S. Под влиянием АНД образуются неактивные белковые молекулы факторов VII, X, IX и II, не участвующие в процессе свертывания крови, в результате чего возникает гипокоагуляция, препятствующая образованию тромбина, развитию и прогрессированию тромбоэмболий. Скорость снижения активности вышеперечисленных факторов неодинакова. В первую очередь снижается активность фактора VII, а в последнюю — протромбина (примерно через 4 сут после начала приема препарата). В ходе исследований последних лет было установлено, что для достижения более выраженного антитромботического эффекта первостепенное значение имеет именно снижение содержания в плазме протромбина [18], поэтому при переводе больного с лечения НФГ или НМГ на поддерживающую терапию или профилактику варфарином последний важно назначать за 4–5 дней до отмены гепаринов для подбора оптимальной дозы препарата.
Лечебно-профилактическое применение варфарина должно сопровождаться систематическим лабораторным контролем. Цель лабораторного контроля при лечении АНД состоит в необходимости достижения и поддержания на нужном уровне гипокоагуляционного эффекта этих препаратов при минимальном риске развития геморрагических осложнений. В 1937 г. A. J. Quick и соавторы предложили использовать показатель протромбинового времени для оценки степени гипокоагуляции [27]. Сейчас результаты протромбинового теста принято оценивать с помощью показателя — Международного Нормализованного Отношения (МНО) (INR — International Normalized Ratio). МНО позволяет производить математическую коррекцию, стандартизирующую протромбиновое время различных тромбопластинов, имеющих различную чувствительность. Оральные антикоагулянты все чаще используются в педиатрической практике, поэтому необходимо расширять возможности лабораторного мониторинга детей по месту жительства и их самоконтроля.
Индивидуальная чувствительность к варфарину обусловлена в первую очередь полиморфизмом цитохрома Р450СYP2C9, являющегося ключевым ферментом в окислении и клиренсе варфарина [6]. Фармакокинетические свойства варфарина зависят от структурного полиморфизма гена цитохрома СYP2C9, метаболизирующего варфарин. Каталитическая активность СYP2C9 является решающим фактором в определении концентрации варфарина в плазме крови. К настоящему времени идентифицировано шесть вариантов структурного полиморфизма. Данные аллельные варианты гена получили название СYP2C9*1 («дикий» аллель), СYP2C9*2 (Arg144Cys) и СYP2C9*3 (Ile 359Leu). Каталитическая активность фермента, кодируемого аллелями СYP2C9*2 и СYP2C9*3, снижена относительно СYP2C9*1. Было показано, что необходимая ежедневная доза варфарина у носителей мутантных аллелей СYP2C9*2 и СYP2C9*3 существенно ниже, чем у лиц с «диким» генотипом [17], а риск развития геморрагических осложнений выше. У пациентов с АФС нередко наблюдается резистентность к варфарину, которая имеет генетическую природу (мутация V и II факторов свертывания крови). В таких ситуациях приходится назначать в несколько раз большую дозу варфарина, чем обычно. Определение аллельных вариантов СYP2C9*2 и СYP2C9*3 у пациентов необходимо для оптимизации сроков подбора требуемой дозы варфарина и предупреждения развития геморрагических осложнений. Так, при обследовании 24 детей с системной красной волчанкой в нашей клинике аллельные варианты CYP2C9*1, CYP2C9*2 и CYP2C9*3 были выявлены соответственно у 62,5, 25,0 и 12,5% больных, что сопоставимо с частотами аллельных вариантов гена CYP2C9 в популяции в исследовании О. В. Сироткиной и соавторов [3]. Проведение терапии варфарином у этих детей требовало строго индивидуального подхода.
Лечение тромботических осложнений у детей с помощью оральных антикоагулянтов является предметом активного изучения и обсуждения в течение последнего десятилетия, однако рекомендации по применению АНД у детей разного возраста еще находятся в стадии разработки. Так, авторы проспективных исследований, проведенных в Канаде и Аргентине, подчеркнув трудности использования варфарина у детей, отметили, что пациентам в возрасте до 12 мес требуются относительно большие дозы для достижения и поддержания МНО в необходимом терапевтическом интервале, более быстрая коррекция терапии при изменении МНО в целях избежания передозировки препарата, более частый лабораторный контроль при подборе дозы, а затем более редкий — при ее поддержании [5].
В 2000 г. VI Согласительной конференцией по антитромботической терапии Американской коллегии торакальных врачей произведен пересмотр диапазона терапевтических значений МНО и показаний для применения АНД [25], в частности при установлении рекомендуемых значений МНО у больных с АФС в пределах 2,0–3,0 [25]. Данные проспективных исследований свидетельствуют о том, что у больных с достоверным вторичным и первичным АФС при лечении высокими дозами варфарина, позволяющими поддерживать состояние гипокоагуляции на уровне 3,0–4,0 по МНО, отмечается достоверное снижение частоты рецидивирования тромбозов [8], сопряженное, однако, с развитием геморрагических осложнений. Между тем недавно исследователи установили, что лечение варфарином в относительно низкой дозе (МНО в пределах 1,5–2,5) столь же эффективно для профилактики рецидивирования венозных тромбозов при АФС, как и применение более высоких доз препарата [1].
При невозможности использования варфарина длительную профилактику тромбоза можно проводить НМГ. Лечение НМГ безопаснее, чем терапия антагонистами витамина К, поэтому их предпочтительно назначать некоторым пациентам, живущим в отдаленных местах, не желающим регулярно проводить лабораторный мониторинг или имеющим противопоказания к применению антагонистов витамина К. Данные метаанализа свидетельствуют о том, что НМГ столь же эффективны, как и варфарин в предотвращении рецидива венозного тромбоза, однако более дороги [16, 30].
Антиагреганты — препараты, снижающие функциональную активность тромбоцитов, используются для профилактики и купирования тромбозов в артериальном и микроциркуляторном русле. Антиагреганты, применяемые в клинической практике, включают три основные группы препаратов: ацетилсалициловую кислоту (АСК), тиенопиридины и блокаторы гликопротеиновых рецепторов IIb/IIIa тромбоцитов. Об эффективности лечения антитромбоцитарными средствами судят на основании исследования адгезивно-агрегационной активности тромбоцитов в динамике. Критериями эффективности терапии АСК, по данным агрегатограммы, являются снижение коллаген- и аденозиндифосфат (АДФ)-индуцированной агрегации тромбоцитов до 20%; для тиенопиридинов — снижение АДФ-индуцированной агрегации тромбоцитов.
Антиагреганты могут применяться самостоятельно или в качестве дополнения к антикоагулянтам. Наиболее широкое распространение в качестве антиагреганта получила АСК, для взрослых рекомендуемая доза препарата составляет 75–150 мг/сут, для детей — 1,5 мг/кг/сут [14]. Результаты проспективного мультицентрового исследования продемонстрировали сходную эффективность АСК и НМГ в предотвращении рецидива тромбоза у детей, перенесших ишемический инсульт [29]. Вместе с тем имеются сообщения о возможности проведения комбинированной терапии АНД и низкими дозами АСК при недостаточной эффективности монотерапии варфарином [28]. Одной из проблем, заставляющих проводить поиск новых антиагрегантных препаратов, является резистентность к АСК, характеризующаяся неспособностью препарата предупреждать развитие тромботических осложнений, адекватно подавляя продукцию тромбоксана А2. Резистентность к АСК выявляется у 5–45% пациентов, причем как среди различных групп больных, так и у здоровых лиц. Среди причин устойчивости к АСК рассматривают: полиморфизм и/или мутацию гена циклооксигеназы-1; возможность образования тромбоксана А2 в макрофагах и эндотелиальных клетках посредством циклооксигеназы-2; полиморфизм рецепторов IIb/IIIа тромбоцитов; активацию тромбоцитов через другие пути, которые не блокируются АСК.
Тиенопиридины (тиклопидин, клопидогрель) — угнетают АДФ-зависимый путь агрегации тромбоцитов, их действие наступает медленнее, чем у АСК, поэтому в начале терапии используются нагрузочные дозы препаратов. Среди нежелательных побочных эффектов тиенопиридинов следует назвать возможность развития тромбоцитопенической пурпуры и нейтропении в начале лечения с последующими рецидивами, реже отмечающихся при лечении клопидогрелем. Клопидогрель применяют в качестве препарата, альтернативного АСК, при невозможности использовать последний, например, в кардиохирургии.
Разные механизмы антитромбоцитарного действия тиенопиридинов и АСК предоставляют возможность комбинированного применения этих препаратов. Так, результаты различных международных мультицентровых рандомизированных исследований подтвердили преимущества комбинированной терапии клопидогрелем в сочетании с АСК по сравнению с монотерапией АСК или АСК и плацебо у взрослых больных с сердечно-сосудистыми заболеваниями и показали хорошую переносимость препарата [13]. Сложности по применению тиенопиридинов в детской практике связаны с отсутствием разработанных доз для детей. Вместе с тем анализ опыта применения клопидогреля у 15 детей с пороками сердца в детском госпитале в Торонто [7] в дозах 1–6 мг/кг/сут в течение 1–6 мес продемонстрировал перспективность использования препарата для профилактики рецидивов тромбоза при относительно низкой частоте осложнений. В качестве стартовой дозы клопидогреля для детей авторы называют 1 мг/кг/сут.
Среди новых и перспективных препаратов рассматривают блокаторы гликопротеиновых рецепторов IIb/IIIa, которые предотвращают образование связей тромбоцитов с фибриногеном и фибронектином, воздействуя на основной механизм агрегации тромбоцитов. Исследования показали высокую эффективность этих препаратов у взрослых больных кардиологического профиля, однако сведения о применении таких средств у детей практически отсутствуют. В доступной литературе нам встретилось лишь одно сообщение об успешном применении абциксимаба в комплексном лечении детей с болезнью Кавасаки. Авторами отмечено, что добавление препарата к стандартной терапии сопровождалось большим регрессом диаметра аневризм коронарных артерий в ранние сроки заболевания [20].
Таким образом, лечение и профилактика тромботических осложнений представляют собой одну из наиболее актуальных мультидисциплинарных проблем современной педиатрии, которая до сих пор не решена. Необходимость совершенствования медицинской помощи детям требует привлечения внимания педиатров к поиску наиболее оптимальных схем антикоагулянтной терапии у детей разного возраста.
Литература
- Алекберова З. С., Решетняк Т. М., Кошелева Н. М. и др. Антифосфолипидный синдром при системной красной волчанке: оценка диагностических и классификационных критериев//Клиническая медицина. 1996. № 6. С. 39–42.
- Насонов Е. Л., Иванова М. М. Антималярийные (аминохинолиновые) препараты: новые фармакологические свойства и перспективы клинического применения//Клиническая фармакология. Терапия. 1998. № 3. С. 65–68.
- Сироткина О. В., Улитина А. С., Тараскина А. Е., Кадинская М. И., Вавилова Т. В., Пчелина С. Н., Шварц Е. И. Аллельные варианты СYP2C9*2 и СYP2C9*3 гена цитохрома СYP2C9 в популяции Санкт-Петербурга и их клиническое значение при антикоагулянтной терапии варфарином//Российский кардиологический журнал. 2004. № 6. С. 47–50.
- Шилова А. Н., Ходоренко С. А., Воробьев П. А. и др. Сравнительное изучение эффективности профилактического применения нефракционированного и низкомолекулярного гепаринов при хирургическом лечении онкологических больных//Клиническая геронтология. 2002. Т. 8. № 4. С. 11–17.
- Bonduel M. M. Oral anticoagulation therapy in children//Thromb. Res. 2006: 118: 85–94.
- Crowther M. A., Ginsberg J. S., Julian J. et al. A comparison of two intensities of warfarin for the prevention of recurrent thrombosis in patients with the antiphospholipid antibody syndrome//New. Engl. J. Med. 2003; 349: 1133–1138.
- Finkelstein Y., Nurmohamed L., Avner M. et al. Clopidogrel use in children//J. Pediatr. 2005; 147: 657–661.
- Harrison L., Johnston M., Massicotte M. P. et al. Comparison of 5-mg and 10-mg loading doses in initiation of warfarin therapy//Ann. Intern. Med. 1997; 126: 133–136.
- Jilma B., Kamath S., Lip G. Y. H. Antithrombotic therapy in special circumstances. II — In children thrombophilia, and miscellaneous conditions//BMJ. 2003; 326: 37–40.
- John C. M., Harkensee C. Thrombolytic agents for arterial and venous thromboses in neonates//The Cochrane Database of Systematic Reviews. 2005; 25: CD004342.
- Kandiah D. A., Krilis S. A. Immunology of antiphospholipid antibodies and their interaction with plasma proteins//Lupus. 1996; 5: 153–155.
- Kearon C. Duration of anticoagulation for venous thromboembolism//J. Thrombosis. Thrombolysis. 2001; 12: 59–65.
- Keller T. T., Squizzato A., Weeda V. B., Middeldorp S. Clopidogrel and aspirin versus aspirin for preventing cardiovascular disease in those at high risk//The Cochrane Database of Systematic Reviews 2005; 1: CD005158.
- Kutteh W. H. Antiphospholipid antibodies and reproduction//J. Reprod. Immunol. 1997; 35: 151–171.
- Lee A. C. W., Li C. H., Szeto S. C., Ma E. S. K. Symptomatic venous thromboembolism in Hong Kong Chinese Children//Hong Kong Med. J. 2003; 9: 259–262.
- Merkel N., Gunther G., Schobess R. Long-term treatment of thrombosis with enoxaparin in pediatric and adolescent patients//Acta. Haematol. 2006; 115: 230–236.
- Miners J. O., Birkett D. J. Cytochrome P. 450 CYP2C9: an enzyme of major importance in human drug metabolism//Br. J. Clin. Pharmacol. 1998; 45: 25–538.
- Mitchell L., Abshire T., Hanna K. et al. Supranormalizing antithrombin levels is safe in children with acute lymphoblastic leukemia treated with L-asparaginase: results of the PARKAA study [abstract]//Blood. 1999; 94 (suppl): 27.
- Monagle P., Adams M., Mahoney M. et al. Outcome of pediatric thromboembolic disease: a report from the Canadian Childhood Thrombophilia Registry//Pediatr. Res. 2000; 47: 763–766.
- Monagle P., Chan A., Massicotte P., Chalmers E., Michelson A. D., Antithrombotic Therapy in Children: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy//Chest. 2004; 126: 645–687.
- Nowak-Gottl U., Duering C., Kempf-Bielack B., Strater R. Thromboembolic diseases in neonates and children//Pathophysiol. Haemost. Thromb. 2003/2004; 33: 269–274.
- Ogasawara M., Aoki K., Matsuura E., Kunimatsu M. Anticardiolipin antibodies in patients with pregnancy loss induse factor Xa production in the presense of beta 2-glycoprotein I//Amer. J. Reprod. Immunol. 1995; 34: 269–273.
- Perona A., Galligani L. The clinical syndrome associated with antiphospholipid antibodies. A diagnosis to be confirmed after a long follow-up//Minerva. Pediatr. 1995; 47: 39–41.
- Petri M. Evidence-based management of thrombosis in the antiphospholipid antibody syndrome//Curr. Rheumatol. Report. 2003; 5: 370–373.
- Severin T., Sutor A. H. Heparin-induced thrombocytopenia in pediatricsn//Semin. Thromb. Hemost. 2001; 27: 293–299.
- Solymar L., Rao P. S., Mardini M. et al. Prosthetic valves in children and adolescents//Am. Heart. J. 1991; 121: 557–568.
- Stein P. D., Alpert J. S., Bussey H. I., Dalen J. E., Turpie A. G. Antithrombotic therapy in patients with mechanical and biological prosthetic heart valves//Chest. 2001; 119 (Suppl): 220–227.
- Steward D. J., Haining R. L., Henne K. R. et al. Genetic association between sensitivity to warfarin and expression of CYPC9*3//Pharmacogenetics. 1997; 7: 361–367.
- Strater R., Kurnik K., Heller C. et al. Aspirin versus low-dose low-molecular-weight heparin: antithrombotic therapy in pediatric ischemic stroke patients: a prospective follow-up study//Stroke. 2001; 32: 2554–2558.
- Van der Heijden J. F., Hutten B. A., Buller H. R., Prins M. H.//Vitamin K antagonists or low-molecular-weight heparin for the long term treatment of symptomatic venous thromboembolism//The Cochrane Database of Systematic Reviews. 2001; 1: CD002001.
- Van Dongen C. J. J., van den Belt A. G. M., Prins M. H., Lensing A. W. A. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism//The Cochrane Database of Systematic Reviews. 2004; 18: CD001100.
- Von Landenberg P., von Landenberg C., Scholmerich J., Lackner K. J. Antiphospholipid syndrome. Pathogenesis, molecular basis and clinical aspects//Med. Clin. 2001; 96: 331–342.
- Van Ommen C. H., Heijboer H., Buller H. R. et al. Venous thromboembolism in childhood: a prospective two-year registry in the Netherlands//J. Pediatr. 2001; 139: 676–681.
- Williams A. N. Childhood stroke: beyond re-inventing the wheel//Eur. J. Paediatr. Neurol. 2000; 4: 103–107.
Н. С. Подчерняева, доктор медицинских наук, профессор М. Ф. Меграбян Н. Д. Вашакмадзе С. Г. Нестерова ММА им. И. М. Сеченова, Москва
Можно ли комбинировать антикоагулянты прямого и непрямого действия?
Как уже стало понятно, антикоагулянты используются с лечебной и профилактической целью при сердечных приступах, стенокардии, эмболии сосудов различных органов, тромбозе, тромбофлебите. При острых состояниях обычно назначают антикоагулянты прямого действия, которые обеспечивают немедленный эффект и препятствуют свертываемости крови. Через 3-4 дня (при условии успешности первичного лечения) терапию могут усилить антикоагулянтами непрямого действия.
Комбинированная антикоагулянтная терапия также проводится перед операциями на сердце и сосудах, при переливании крови, а также для профилактики тромбоза. Лечение комбинацией из разных видов антикоагулянтов должно проводиться под постоянным контролем медицинских работников. В связи с увеличением частоты приступов стенокардии и пароксизмальной мерцательной аритмии, при лечении двумя видами препаратов одновременно, постоянно контролируется наличие осадка в моче, скорость свертывания крови и уровень протромбина в крови.
Комбинированная антикоагулянтная терапия должна происходить под контролем медиков
Лечение комбинацией разных антикоагулянтов противопоказано при:
- геморрагическом диатезе;
- заболеваниях, сопровождающихся понижением свертываемости крови;
- во время беременности;
- нарушении функции печени и почек;
- злокачественных новообразований;
- язвенной болезни.
Также необходимо срочно прервать комбинированную терапию при появлении крови в моче.
Назначение лекарств, показания и противопоказания
Медикаменты изготавливаются в таблетках, инъекционных растворах, мазях, гелях. Антикоагулянты предназначены для терапии и предупреждения формирования тромбов. Активные компоненты влияют на выработку элементов свертывающей системы, уменьшают скорость образования сгустков крови, оседающих на внутренней поверхности кровеносных сосудов.
Антикоагулянтные медикаменты назначаются:
- при острых тромбозах вен;
- предотвращения возникновения тромбоэмболии – при замене сердечных клапанов, наджелудочковой тахиаритмии;
- сердечных приступах, закупорках артериальных сосудов в легких;
- ишемических инсультах;
- атеросклеротических повреждениях сосудов;
- травмах, шоковых, септических поражениях;
- варикозной болезни;
- геморрое с тромбами;
- формировании сгустков крови в НПВ.
Медикаментозные средства не применяются:
- при дефиците лактозы, нарушенном всасывании галактозы, глюкозы;
- язвах ЖКТ, аневризмах;
- почечных, печеночных патологиях;
- кровотечениях, тромбоцитопении.
Запрещен одновременный прием антикоагулянтов с Аспирином, Пенициллином, Дипиридамолом, Циметидином и другими представителями группы НВПС.
При терапевтических процедурах могут возникать побочные реакции, проявляющиеся при неверно подобранных дозах лекарств, нарушении схемы лечения. Общая симптоматика включает приступы тошноты со рвотой, диарею, болезненность в области живота, аллергию с крапивной лихорадкой. Иногда начинается массовое выпадение волос, некрозы.
Как определить эффективность от приема антикоагулянтов?
Непрямые коагулянты легко обнаружить в крови и даже измерить их эффективность. Для этого разработан специальный показатель под названием «международное нормализованное отношение».
- Человек, не принимающий непрямые антикоагулянты, будет иметь МНО чуть ниже 1.
- Пациент, принимающий варфарин, будет иметь МНО между 2,0 и 3,0. Увидев такие высокие показатели, медики будут готовы к тому, что может возникнуть внезапное кровотечение.
- Показатель МНО между 1 и 2 укажет на то, что больному может угрожать развитие ишемического инсульта.
- При МНО 4 и выше существует наибольший риск несвертывания крови и развития геморрагического инсульта.
Анализ крови на МНО показателен при терапии непрямыми антикоагулянтами
Но анализ крови на МНО не даст объективных показателей, если пациент принимает прямые антикоагулянты. Самой большой проблемой, связанной с новейшими прямыми антикоагулянтами, является отсутствие надежного способа оценки их эффективности. Врачи могут узнать время остановки кровотечения, но нет никакого показателя, который бы оценил наличие антикоагулянтного воздействия. Например, это очень важно при лечении пациентов, поступивших в скорую помощь в бессознательном состоянии. Если в медицинской карте не указано никакой информации о приеме больным антикоагулянтов с прямым действием, оперативно выявить их в крови достаточно сложно.
Что делать при передозировке?
Несмотря на все вышеперечисленные преимущества, врачи все же обеспокоены отсутствием конкретных антидотов для использования, в случае если возникла передозировка. Чтобы не допустить такого тяжелого состояния, врачи придерживаются следующих правил:
- снижают дозу эпобаксана уже после 7 дней применения;
- ксалерто требует снижения дозы после курса длиной в 21 день.
В настоящий момент при возникновении опасных для жизни кровотечений, в том числе вызванных непрямыми антикоагулянтами, пациенту вводится свежезамороженная плазма, концентрат протромбинового комплекса, а также Фитонадион.
Фитонадион – один из немногих антидотов к антикоагулянтам
Фармакология и механизм действия каждого антидота отличаются. Для различных антикоагулянтов потребуются различные дозы и стратегии введения антидотов. Длительность курса и дозировка антидотов рассчитывается в зависимости о того, как пациент реагирует на уже введенные препараты (бывают случаи, когда некоторые антидоты не только останавливают кровотечение, но и активизируют агрегацию тромбоцитов).
Показатели смертности при приеме ППА и АВК
У пациентов, получавших прямые антикоагулянты для профилактики осложнений болезней сердца, зарегистрировано большее количество внезапных кровотечений, но в то же время более низкие показатели смертности, в сравнении с пациентами, которые получали анагонисты витамина К. Не нужно делать вывод о том, что наличие кровотечений каким-то образом помогает уменьшить показатели смертности.
Такие противоречивые результаты связаны с тем, что большинство исследований проводятся в условиях стационара. Все кровотечения, которые возникают тогда, когда пациент находится в больнице и получает прямые антикоагулянты через капельницу, очень быстро купируются квалифицированным медицинским персоналом и не приводят к летальному исходу. А вот непрямые антикоагулянты больной чаще всего принимает без присмотра врачей, что и приводит к более высокому показателю летальных исходов.