Отсутствие идеального препарата для лечения больных сахарным диабетом 2 типа, который мог бы обеспечить не только адекватный контроль уровня гликемии с минимальным количеством побочных эффектов (прибавка веса, увеличение риска развития гипогликемии, негативное влияние на сердце, почки, печень), но и сохранить секреторную способность β-клеток, заставило ученых продолжить поиски новых возможностей воздействия на причину возникновения и прогрессирования этого заболевания.
В поисках оптимального метода лечения СД2 научные исследования были направлены на изучение принципиально нового механизма регуляции гомеостаза глюкозы посредством гормонов желудочно-кишечного тракта, называемых инкретинами.
Выяснилось, что при пероральной нагрузке глюкозой инсулин секретируется в гораздо большем количестве, чем в ответ на внутривенное введение аналогичного количества глюкозы. Разница в секреции инсулина в ответ на пероральную и внутривенную нагрузки глюкозой называют «инкретиновым эффектом» (рис. 1).[1]
История открытия инкретинов
Первые сведения об инкретинах появились более 100 лет назад. В 1902 году Bayliss и Starling обнаружили, что кишечная слизь содержит гормон, стимулирующий экзокринную секрецию поджелудочной железы, и назвали его «секретин». Четырьмя годами позже, в 1906 году, Moore опубликовал статью под названием «Лечение сахарного диабета при помощи экстракта слизистой двенадцатиперстной кишки». [2]
В своей статье ученый предположил, что «секретин» может воздействовать не только на экзокринную, но и на эндокринную часть поджелудочной железы. Для подтверждения своей гипотезы исследователь выделил экстракт слизистой двенадцатиперстной кишки и начал использовать его в практике лечения пациентов с глюкозурией. Ниже представлен один из случаев из его практики:
«Пациент 25 лет, кучер, попал в Королевский лазарет г. Ливерпуля 14 сентября 1904 года с жалобами на частое мочеиспускание, потерю веса, избыточную слабость и сильную жажду.
При обследовании пациента диурез составил 110- 120 унций [3-3,5 л] и содержал 195 г сахара. 24 сентября пациенту была назначена 1 драхма [3,6 г] бикарбоната натрия в сутки, и такая терапия поддерживалась до 18 ноября. 11 октября была начата терапия кодеином в дозе S гранул [0,03 г] 3 раза в день… На фоне такого лечения не наблюдалось никакого снижения сахара, и 24 ноября пациент был переведен на 0,3 г феназона [антипирин] три раза в день.
После назначения феназона уровень сахара стал медленно снижаться. .. до середины января 1905 г и оставался стабильным в пределах от 40 до 65 г в сутки. Не отменяя феназона, мы дали пациенту экстракт слизистой двенадцатиперстной кишки… по пол-унции… три раза в день, а 8 февраля 1905 года доза была удвоена.
Количество сахара [в моче] в течение первых трех недель оставалась неизменным, однако 28 февраля 1905 года оно внезапно снизилось до 32 граммов. Второго марта оно уже составило 25 грамм… Количество сахара продолжало снижаться, и, наконец, в мае сахар в моче перестал определяться, и исчезла полиурия. Пациент вернулся к своей работе и вскоре перестал приходить за экстрактом».
Однако, несмотря на невероятный успех доктора Moore, финал этой истории оказался достаточно драматичным.
«Пациент чувствовал себя удовлетворительно вплоть до 14 августа 1905 года…, когда он заболел простудой на работе. ..С тех пор он становился все слабее и потерял в весе. Тринадцатого октября пациент вернулся в лазарет, где у него определялось от 4 до 5 процентов сахара в 80-100 унциях суточной мочи. Несмотря на назначение экстракта, снижения уровня сахара не наблюдалось, и скоро обнаружилось, что пациент страдает от быстропрогрессирующего туберкулеза, от которого он и умер 17 декабря 1905 года».
Несмотря на то, что этот случай закончился летально, нельзя не отметить существенных успехов доктора Moore в терапии препаратом, который стал предшественником инкретинов. Само же название «инкретин» было предложено La Barre в 1932 году для гормона, выделенного из слизи верхнего отдела кишечника и способного вызывать гипогликемию.
Первый гормон с инкретиновой активностью был выделен из экстракта дуоденальной слизи свиньи. Благодаря свойству ингибировать секрецию соляной кислоты желудка пептид был назван «желудочным ингибиторным полипептидом» (ЖИП). Позже выяснилось, что главным биологическим эффектом этого вновь открытого пептида является глюкозозависимая стимуляция секреции инсулина, в связи с чем было предложено переименовать ЖИП в глюкозозависимыи инсулинотропный полипептид (ГИП). Местом его синтеза являются К-клетки слизистой кишечника, в основном – двенадцатиперстной и тощей кишки.
В 1983 году Bell и соавторы из гена проглюкагона хомяка выделили последовательность, кодирующую два глюкагоноподобных пептида – ГПП-1 и ГПП-2. На мышиных моделях было показано, что именно ГПП-1 стимулировал глюкозозависимую секрецию инсулина, т.е. обладал инкретиновой активностью. Местом синтеза этого гормона являются эндокринные L-клетки слизистой подвздошной кишки (рис. 2).
Глюкагоноподобные пептиды, как и глюкагон, являются продуктами гена проглюкагона. В поджелудочной железе в результате считывания этого гена синтезируется глюкагон, а в L-клетках тонкого кишечника – ГПП-1, ГПП-2 и глицентин (энтероглюкагон). ГПП-2 несмотря на свою структурную схожесть с ГПП-1, не оказывает такого же биологического эффекта: действие ГПП-2 ограничивается регуляцией процессов роста в интестинальном тракте.
АПУД-система[ | ]
Основная статья: Диффузная эндокринная система
Термин и понятие АПУД-системы («APUD» — акроним, образованный от первых букв английских слов a
mine — амины,
p
recursor — предшественник,
u
ptake — усвоение, поглощение;
d
ecarboxylation — декарбоксилирование) был предложен Э. Пирсом (англ. A.G.E. Pearse) в 1969 году, исходя из способности клеток АПУД-системы усваивать предшественники аминов (моноамины L-дигидроксифенилаланин и 5-HTP), декаробоксилировать их и синтезировать амины, необходимые для образования регуляторных пептидов.[2]
В последнее время вместо термина АПУД-система снова вошёл в употребление ранее принятый синоним диффузная эндокринная система
, в то же время производные термины, такие как
апудоциты
— клетки, входящие в состав АПУД-системы,
апудомы
— опухоли, возникающие в результате гиперплазии апудоцитов, активно используются в современной медицинской лексике.
Сходства и различия ГПП-1 и ГИП
Высвобождение ГПП-1 и ГИП зависит от пищевых, неврогенных и гормональных стимулов и происходит сразу после приема пищи: значительное увеличение концентрации инкретинов отмечается через 10-15 минут.
Результаты исследований показали, что секреция ГПП-1 и ГИП стимулируется всасыванием в кишечнике жиров и углеводом. На секрецию ГПП-1 также влияет всасывание белков. Более того, для высвобождения инкретиновых гормонов из К- и L-клеток достаточно простого контакта этих нутриентов со слизистой кишечника, что приводит к быстрому подъему уровня инсулина в крови. Однако подъем плазменной концентрации ГПП-1 происходит слишком быстро для того, чтобы быть следствием прямой активации L-клеток: большинство из этих клеток расположено в дистальной части тонкой кишки, и для того, чтобы нутриенты достигли этого уровня, потребовалось бы больше времени.
Альтернативной теорией, объясняющей скорость реакции высвобождения инкретинов клеток кишечника, является теория неврогенной регуляции, подразумевающей, что активация холинергических мускариновых рецепторов, находящихся на поверхности L-клеток, вызывает секрецию ГПП-1. Однако данных, подтверждающих наличие вагусного влияния на функцию L-клеток, очень мало, а активация симпатической нервной системы вовсе приводит к ингибированию секреторной функции L-клеток.
Третьей гипотезой, призванной объяснить раннее начало инкретиновой секреции, является теория паракринного влияния. Соматостатин, высвобождаемый из D-клеток кишечника, подавляет секрецию инкретинов, а угнетение действия соматостатина вызывает резкий подъем уровня ГПП-1. В опытах на животных ГИП в высоких дозах также стимулирует выработку ГПП-1 L-клетками, хотя наличие этого эффекта у человека не доказано.
Общие свойства ГИП и ГПП-1:
- быстро (ГПП-1 — в течение 2 минут, ГИП в течение — 6 минут) подвергаются расщеплению ферментом дипептидилпептидазой 4-го типа (ДПП-4) (рис. 3).
- ГПП-1 разрушается, еще не покинув кишечник, так как ДПП-4 присутствует на поверхности эндотелиальных клеток капилляров слизистой кишечника.
- Способствуют увеличению массы β-клеток (на животных моделях)
Различия ГИП и ГПП-1:
- ГИП: Не влияет на эвакуацию пищи из желудка
- Не влияет на процесс насыщения и массу тела
- Не влияет на секрецию глюкагона α-клетками поджелудочной железы
- Не влияет на сердечно-сосудистую систему
- Секреция ГИП у больных диабетом сохранена
- Не стимулирует (или слабо стимулирует) секрецию инсулина у больных СД2
- Замедляет эвакуацию пищи из желудка
Содержание
- 1 АПУД-система
- 2 Апудоциты гастроэнтеропанкреатической эндокринной системы 2.1 Эндокринные клетки желудка
- 2.2 Эндокринные клетки двенадцатиперстной и тощей кишок
- 2.3 Эндокринные клетки подвздошной и толстой кишок
- 2.4 Эндокринные клетки поджелудочной железы
- 3.1 Инкретины
- 4.1 Випома
Мишени и механизм действия ГПП-1
Как следует из приведенных данных, ГПП-1 имеет большую привлекательность, чем ГИП, для лечения больных СД2. В связи с этим абсолютное большинство исследований в настоящее время направлено на изучение биологической активности и создание аналогов ГПП-1 как терапии СД2.
Детальное изучение эффектов ГПП-1 показало его непосредственное влияние не только на поджелудочную железу, но и на ткани печени, желудка, мозга, сердечной мышцы (рис. 4).
Эффекты ГПП-1 опосредуются рецепторами (рГПП-1), которые были найдены в островках поджелудочной железы, почках, сердце, желудке, легких, а также в периферической и центральной нервной системе.
Влияние ГПП-1:
- На β-клетки поджелудочной железы
ГПП-1 обладает множественным влиянием на эндокринную часть поджелудочной железы, но его принципиальным действием является потенцирование секреции инсулина.
Механизм данного влияния следующий: контакт ГПП-1 с рецептором – увеличение количества внутриклеточного цАМФ – стимуляция протеинкиназы А – экзоцитоз инсулиновых гранул из β-клеток.
Важно, что стимуляция секреции инсулина глюкагоноподобным пептидом-1 носит глюкозозависимый характер, т.е. ГПП-1 стимулирует секрецию инсулина только при высоких значениях гликемии. Как только уровень глюкозы плазмы снижается до нормального уровня (приблизительно до 4.5 ммоль/л), стимулирующий эффект ГПП-1 исчезает.
Помимо стимуляции секреции инсулина, ГПП-1 оказывает воздействие и на все этапы процесса биосинтеза инсулина, т.е. подготавливает запасы инсулина к его секреции, что предупреждает истощение запасов инсулина вследствие стимуляции его секреции.
В экспериментальных работах показано, что ГПП-1 воздействует на массу β-клеток, стимулируя их пролиферацию и неогенез и блокируя апоптоз. Однако эти данные в настоящее время не имеют клинического подтверждения у человека.
- На а-клетки поджелудочной железы
ГПП-1 вызывает снижение секреции глюкагона.
Этот эффект может быть обусловлен:
- Непрямой стимуляцией α-клеток – через стимуляцию секреции инсулина и соматостатина.
- Прямой стимуляцией α-клеток, поскольку в них также обнаружены рецепторы к ГПП-1. Подтверждением прямого действия ГПП-1 на α-клетки является тот факт, что у больных СД1 (при полном отсутствии секреции инсулина) введение ГПП-1 также подавляло секрецию глюкагона и снижало уровень гликемии.
Подавление секреции глюкагона под воздействием ГПП-1 также носит глюкозозависимый характер.
- На клетки желудочно-кишечного тракта (ЖКТ)
Стимуляция рГПП-1 в подвздошной кишке обеспечивает снижение моторики ЖКТ, замедление опорожнения желудка и всасывания глюкозы. В результате наблюдается снижение уровня постпрандиальной гликемии. Этот эффект носит название «кишечный тормоз».
Суть феномена заключается в том, что пища, попавшая в дистальные отделы кишечника, способна затормозить моторику и секреторную активность верхних отделов кишечника и желудка. Механизм этого феномена связан с активацией афферентных волокон блуждающего нерва и торможением прохождения импульса по эфферентным. Исследование на здоровых добровольцах показало, что внутривенное введение ГПП-1 вызывает дозозависимое снижение скорости опорожнения желудка. В результате постпрандиальный уровень глюкозы в крови снижается вплоть до базального уровня.
Предполагают, что снижение постпрандиальной концентрации глюкозы при введении ГПП-1 достигается преимущественно за счет торможения опорожнения желудка, а не только благодаря увеличению синтеза инсулина поджелудочной железой.
- На сердечную мышцу
Рецепторы к ГПП-1 были обнаружены в миокарде, что нашло свое применение в клинической практике. Исследования на мышах, лишенных рГПП-1, выявили у них сниженную сократимость левого желудочка и диастолическую дисфункцию, а испытания на собаках показали, что введение ГПП-1 может улучшить сердечную функцию у животных с сердечной недостаточностью, усиливая сердечный выброс.
На животных с ишемией миокарда была продемонстрирована способность ГПП-1 уменьшать размер инфаркта, что говорит о возможной кардиопротективной роли этого инкретина.
Кроме того, обнаружено и не опосредованное рГПП-1 благоприятное воздействие ГПП-1 на коронарный кровоток. Так, в эксперименте на собаках с дилатационной кардиомиопатией показано, что метаболит ГПП-1 (ГПП-1 (9-36)), образующийся в результате разрушения ГПП-1 ферментом ДПП-4, усиливает поступление глюкозы в миокард, что улучшает функцию левого желудочка у этих животных. Этот же метаболит обладает способностью вызывать NO-зависимую вазодилагацию коронарных сосудов и, как следствие, улучшать кровоснабжение сердечной мышцы.
- На ткань мозга
Поскольку рГПП-1 были найдены в ядрах гипоталамуса, отвечающих за процесс насыщения, то воздействие на эти рецепторы может влиять на пищевое поведение. У крыс введение ГПП-1 в желудочки мозга способствовало уменьшению времени приема пищи и ее количества, в то время как противоположный эффект наблюдался при назначении антагонистов ГПП-1.
Последующие испытания показали, что центральное введение агонистов ГПП-1 вызывает уменьшение частоты приемов пищи и воды, что приводит к снижению веса. Аналогичные результаты были получены и в клинических испытаниях агонистов ГПП-1 у здоровых людей, больных диабетом и у лиц с ожирением, когда периферическое подкожное введение этих препаратов приводило к быстрому наступлению насыщения, уменьшению количества потребленной пищи и снижению веса.
- На печень, скелетные мышцы, жировую ткань
В печени ГПП-1 ингибирует глюконеогенез, а в жировой и мышечной тканях способствует усвоению глюкозы. Однако эти эффекты оказывают меньший эффект на снижение гликемии по сравнению с регуляцией секреции инсулина и глюкагона.
- На костную ткань
В эксперименте показано, что ГПП-1 контролирует процесс резорбции костной ткани. В отсутствие рГПП-1 у мышей наблюдалась кортикальная остеопения, увеличение числа остеокластов и маркеров резорбции кости.
- Эти эффекты устранялись в присутствии кальцитонина, что свидетельствовало о том, что протективное воздействие ГПП-1 на костную ткань осуществляется посредством кальцитонин-зависимого механизма.
Роль и место инкретинов в достижении всестороннего гликемического контроля
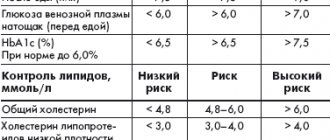
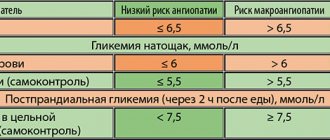
В 2010 г. число больных СД во всем мире, по данным Международной федерации диабета (IDF), составляло 285 млн человек, причем 85–90% из них страдают именно СД 2 типа. Прогнозы IDF в отношении темпов увеличения распространенности СД в мире неутешительны – к 2030 г. общее число больных СД, по приблизительным оценкам, увеличится в 1,5 раза и составит 438 млн человек [1]. Актуальность проблемы СД 2 типа обусловлена не только ростом его распространенности, но и теми серьезными осложнениями, которые развиваются на фоне этого заболевания. Доказано, что СД 2 типа связан со значительным риском развития в первую очередь сердечно–сосудистых заболеваний (ССЗ): ишемической болезни сердца, инсульта, артериальной гипертензии, облитерирующего атеросклероза артерий нижних конечностей. Риск развития инфаркта и инсульта у больных с СД 2 типа в 2–4 раза, а ампутации нижних конечностей – в 10–15 раз выше в сравнении с пациентами без СД. В 75% случаев именно ССЗ являются причиной смерти у больных СД 2 типа. Установлена также взаимосвязь между СД 2 типа и риском возникновения хронической болезни почек и слепоты [2]. Поскольку основным патофизиологическим нарушением при СД, приводящим к развитию осложнений, является хроническая гипергликемия, лечение СД, направленное на контроль гликемии, как показали крупные международные исследования, значительно снижает риск развития микро– и макроваскулярных осложнений у пациентов как с СД 1 типа, так и с СД 2 типа [3,4]. В течение многих лет традиционными и общепринятыми показателями компенсации углеводного обмена, на которые ориентировались врачи при выборе тактики лечения, являлись глюкоза плазмы натощак (ГПН) и гликозилированный гемоглобин (HbA1c). Важность контроля HbA1c была подтверждена еще в исследовании DCCT (Diabetes Control and Complications Trial) у пациентов с СД 1 типа. Результаты исследования показали, что постоянный контроль гликемии (средний уровень HbA1c ~7% в течение 6,5 года) приводил к снижению риска развития микроальбуминурии на 39%, протеинурии – на 54%, нейропатии – на 60%, ретинопатии – на 76% (рис. 1) [4]. Крупномасштабное проспективное исследование UKPDS (United Kingdom Prospective Diabetes Study) продемонстрировало, что снижение HbA1c на 1% приводит к уменьшению риска развития любых связанных с СД 2 типа осложнений на 21%, включая снижение риска инфаркта миокарда на 14%, инсульта – на 12% и микроваскулярных осложнений – на 37% (р <0,0001) [3]. Однако существует ряд факторов, ограничивающих применение контроля HbA1c в клинической практике, – некоторые состояния, при которых измерение HbA1c может давать ложные результаты – как завышенные, так и заниженные (табл. 1) [5–9]. Кроме этого, HbA1c не отражает вариабельность уровня гликемии в течение суток. У пациентов с одинаковыми значениями HbA1c колебания гликемии в течение суток, как показывают результаты длительного мониторирования уровня глюкозы, могут сильно варьировать – от гипогликемии до гипергликемии. Вариабельность гликемии, в первую очередь, является предиктором тяжелых гипогликемий, особенно у пациентов с СД на инсулинотерапии [10]. Как правило, гипогликемия представляет собой серьезное осложнение интенсивного лечения СД 2 типа. Так, например, недавний мета–анализ 13 исследований с включением более 34 000 пациентов показал, что интенсивная терапия СД 2 типа увеличивает риск возникновения гипогликемии более чем в 2 раза в сравнении со стандартной терапией [11]. При этом данные исследования VADT (the Veteran Affairs Diabetes Trial) свидетельствуют о том, что гипогликемия является даже более значимым фактором риска развития ССЗ, чем значения HbA1c, ЛПВП, наличие ССЗ в анамнезе, возраст пациента [12]. Подтверждением существенного вклада гипогликемии в риск развития ССЗ могут быть результаты эксперимента, продемонстрировавшего, что гипогликемия сопровождается развитием ишемии миокарда: при проведении CGMS (Continuous Glucose Monitoring System) и суточного мониторирования ЭКГ на фоне подтвержденных гипогликемических состояний, включая и бессимптомные, были отмечены развитие эпизодов стенокардии и появление нарушений ЭКГ, характерных для ишемии [13]. Кроме этого, гипогликемия играет серьезную роль в формировании приверженности пациентов к лечению – страх перед гипогликемией очень часто приводит к отказу больного от рекомендованного лечения и, как следствие, к отсутствию адекватного гликемического контроля [14]. Согласно данным литературы, вариабельность гликемии также может иметь значение для развития окислительного стресса и, как результат, прогрессирования осложнений СД, что было продемонстрировано in vitro, в экспериментах на животных и в исследованиях у пациентов с СД 2 типа. Были получены также интересные данные о том, что вариабельность гликемии связана с увеличением смертности у пациентов без СД, но находящихся в тяжелом состоянии из–за других заболеваний [10]. В настоящее время все больше внимания начинают уделять внимание контролю постпрандиальной гликемии (ППГ), что обусловлено накоплением убедительных доказательств, полученных в исследованиях, ее роли в гликемическом контроле и в развитии поздних осложнений СД. Данные ряда эпидемиологических исследований показывают, что часто у больных с СД 2 типа и НbA1c <7,0% определяются высокие уровни постпрандиальной гликемии [15]. Так, например, в исследовании Национального регистра здоровья США NHANES III (The Third National Health and Nutrition Examination Survey) было обнаружено, что у 40% больных с СД 2 типа, получающих пероральные сахароснижающие препараты и имеющих хороший гликемический контроль (НbA1c <7,0%), определяются уровни ППГ более 11,1 ммоль/л при значениях ГПН менее 6,7 ммоль/л. Более того, в этом же исследовании было показано, что все пациенты с НbA1c от 7,0 до 7,9% имеют значения ППГ более 11,1 ммоль/л [16]. Какое же значение имеет ППГ для пациентов с СД 2 типа? Как было установлено, именно ППГ является независимым и более значимым фактором риска ССЗ, чем ГПН. В исследовании DECODE (The Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe) с анализом данных 25 000 больных СД было установлено, что ППГ является более мощным предиктором развития ССЗ и смертности вследствие любых причин (рис. 2) [17]. Обнаружено, что ППГ запускает целый каскад метаболических нарушений, включая окислительный стресс, нарушение реактивности сосудов, гиперкоагуляцию и эндотелиальную дисфункцию, которые приводят к прогрессированию атеросклероза и развитию макроваскулярных осложнений СД 2 типа [18–20]. Кроме этого, была выявлена тесная взаимосвязь между ППГ и риском развития ретинопатии, увеличением толщины интимы сонной артерии, увеличением риска развития рака поджелудочной железы, а также нарушением когнитивной функции у пожилых пациентов с СД 2 типа [21–23]. Стоит также отметить, что вклад ППГ в значение HbA1c возрастает по мере улучшения гликемического контроля и приближения HbA1c к нормальным значениям [24]. Учитывая все вышесказанное, необходимо отметить, что эффективное управление СД 2 типа невозможно без всестороннего гликемического контроля, который подразумевает контроль трех показателей уровня гликемии – ГПН, ППГ и HbA1c (так называемую глюкозную триаду). При выборе тактики лечения пациента с СД 2 типа врач должен ориентироваться на все три показателя, именно такой подход обеспечит эффективность и безопасность рекомендованного лечения и позволит пациенту избежать тяжелых осложнений СД 2 типа. В настоящее время для лечения СД 2 типа существует несколько классов пероральных сахароснижающих препаратов с различными механизмами действия, безопасностью и эффективностью: производные сульфонилмочевины и меглитиниды, стимулирующие секрецию инсулина; метформин, подавляющий процессы синтеза глюкозы печенью; тиазолидиндионы, повышающие чувствительность к инсулину в периферических тканях; ингибиторы α–глюкозидазы, уменьшающие всасывание глюкозы в тонком кишечнике; препараты с инкретиновым эффектом, восстанавливающие физиологическую секрецию инсулина. Однако, несмотря на широкий выбор лекарственных препаратов, большинство пациентов во всем мире не достигают целевых значений гликемии. Существует несколько барьеров для достижения оптимального гликемического контроля у пациентов с СД 2 типа. Одним из них является естественное прогрессирующее течение СД 2 типа, которое характеризуется нарастающей дисфункцией β–клеток и снижением секреции инсулина. Эти патофизиологические нарушения требуют постоянной интенсификации сахароснижающей терапии для поддержания оптимального гликемического контроля. Другим барьером для достижения контроля гликемии являются такие осложнения лечения, как гипогликемии, увеличение массы тела при длительном приеме, неудовлетворительная переносимость и, как следствие, низкая приверженность пациентов к рекомендованному лечению. Появление нового класса лекарственных препаратов инкретинового ряда стало настоящим прорывом в современной диабетологии, потому что именно на данный класс препаратов во всем мире возлагают большие надежды, связанные с преодолением барьеров при достижении адекватного гликемического контроля – дисфункцией β–клеток и осложнениями лечения. Препараты с инкретиновым эффектом – это новый класс сахароснижающих препаратов, основным механизмом действия которых являются глюкозозависимые повышение секреции инсулина и подавление секреции глюкагона. Благодаря механизму действия препараты этой группы позволяют безопасно контролировать все показатели глюкозной триады – HbA1c, ГПН и ППГ, что, безусловно, является их преимуществом и для врача, и для пациента, поскольку только всесторонний гликемический контроль, как было сказано выше, позволяет значительно снизить риск развития тяжелых осложнений СД 2 типа – в первую очередь ССЗ. Другим преимуществом препаратов данной группы является их хороший профиль безопасности: для них характерны низкий риск развития гипогликемии и отсутствие негативного влияния на массу тела [25]. Так что же это такое – инкретиновый эффект? Инкретины – это биологически активные вещества, гормоны, вырабатывающиеся в клетках кишечника в ответ на прием пищи и ответственные за 50–70% постпрандиальной секреции инсулина у здоровых лиц. Именно этот вклад инкретинов в секрецию инсулина и называют инкретиновым эффектом (рис. 3) [26]. Наиболее значимую роль в секреции инсулина и обмене углеводов играют глюкагоноподобный пептид–1 (ГПП–1) и глюкозозависимый инсулинотропный пептид (ГИП). ГИП секретируется К–клетками двенадцатиперстной и тощей кишки в ответ на прием пищи, богатой углеводами и жирами. Кроме этого, ГИП участвует в метаболизме липидов в адипоцитах и обладает пролиферативным эффектом на β–клетки. ГПП–1 секретируется L–клетками подвздошной и толстой кишки. ГПП–1 обладает разными эффектами на обмен углеводов, включая глюкозозависимую стимуляцию секреции инсулина, глюкозозависимое подавление секреции глюкагона, снижение аппетита и скорости опорожнения желудка и, возможно, улучшение чувствительности к инсулину. Помимо этого, ГПП–1 увеличивает транскрипцию гена инсулина и принимает участие во всех этапах биосинтеза инсулина [27–29]. Исследования на животных продемонстрировали, что под действием ГПП–1 происходят увеличение массы β–клеток и подавление процессов их апоптоза [30]. Инкретины быстро разрушаются под действием фермента дипептидилпептидазы–4 (ДПП–4), которая обнаружена не только в эндотелии сосудов слизистой оболочки кишечника, но и широко представлена во многих тканях организма человека, включая легкие, головной мозг, почки, надпочечники, поджелудочную железу, кишечник и лимфоциты. ГПП–1 разрушается практически сразу после секреции. Период полужизни для ГПП–1 составляет менее 2 мин., для ГИП – 5–6 мин. [27–29]. Однако установлено, что у пациентов с СД 2 типа инкретиновый эффект снижен, что может быть обусловлено нарушением процессов секреции инкретинов, их ускоренным метаболизмом или нечувствительностью клеточных рецепторов к их действию. Интересным является тот факт, что у пациентов с СД 2 типа снижается в первую очередь концентрация ГПП–1 при сохранении биологической активности этого инкретина, тогда как уровни ГИП остаются в пределах нормальных значений или близких к нормальным, но он утрачивает все эффекты на секрецию инсулина (рис. 4) [31,32]. Именно эти данные позволили разработать и внедрить в клиническую практику класс препаратов, сахароснижающий механизм которых основан на эффектах ГПП–1. В клинической практике применяются препараты, являющиеся агонистами или миметиками ГПП–1, то есть обладающие эффектами ГПП–1 на секрецию инсулина и глюкагона, но устойчивые при этом к действию фермента ДПП–4, и ингибиторы ДПП–4, на фоне применения которых происходят увеличение концентрации естественного ГПП–1 в 1,5–3 раза и, как следствие, глюкозозависимая стимуляция секреции инсулина и подавление секреции глюкагона. В настоящее время для врачей и пациентов в России доступны два агониста ГПП–1, устойчивых к действию ДПП–4, – лираглютид, экзенатид и несколько ингибиторов ДПП–4 – саксаглиптин, ситаглиптин, вилдаглиптин. Внедрение в клиническую практику новых классов сахароснижающих препаратов, обеспечивающих всесторонний гликемический контроль, является перспективным подходом к лечению СД 2 типа.
Литература 1. International Diabetes Federation. IDF Diabetes Atlas, 4th ed. Brussels, Belgium: International Diabetes Federation, 2009. https://www.idf.org/diabetesatlas, accessed July 6th 2011. 2. US Department of Health and Human Services, National Diabetes Information Clearinghouse. National Diabetes Statistics, 2007. NIH Publication No. 08–3892. https://diabetes.niddk.nih.gov/dm/pubs/statistics/DM_Statistics.pdf. Last updated: June 2008. Accessed October 19, 2010. 3. Stratton I.M., Adler A.I., Neil A.W. et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. // BMJ. 2000; 321:405–412. 4. The DCCT Research Group. The effect of intensive treatment of diabetes on the development and progression of long–term complications in insulin–dependent diabetes mellitus. // N Engl J Med. 1993; 329: 977–986. 5. Koskinen L.K. et al. Does uremia interfere with HbA1c results in the FPLC method with Mono S cation exchanger? // Clin Chem Acta. 1998 May 8; 273(1): 69–79. 6. Wang X. et al. Hemoglobin A1c levels in non–diabetic patients with end–stage renal disease (ESRD) receiving hemodialysis. // J Endocrinol Invest. 2004 Sep; 27(8): 733–5. 7. Coban E. et al. Effect of iron deficiency anemia on the levels of hemoglobin A1c in nondiabetic patients. // Acta Haematol. 2004 112(3): 126–8. 8. Camargo J.L. et al. Conditions associated with very low values of glycohaemoglobin measured by an HPLC method. // J Clin Pathol 2004 Apr; 57(4): 346–9. 9. Tseng C.L. et al. Seasonal patterns in monthly hemoglobin A1c values. // Am J Epidemiol. 2005 Mar 15; 161(6): 565–74. 10. Siegelaar S.E., Holleman F., Hoekstra J.B., DeVries J.H. Glucose variability; does it matter? // Endocr Rev. 2010 Apr;31(2):171–82. Epub 2009 Dec 4. 11. Boussageon R., Bejan–Angoulvant T., Saadatian–Elahi M. et al. Effect of intensive glucose lowering treatment on all cause mortality, cardiovascular death, and microvascular events in type 2 diabetes: meta–analysis of randomised controlled trials. // BMJ. 2011 Jul 26; 343:d4169. 12. Skyler S., Bergenstal R., Bonow R. et al. Intensive Glycemic Control and the Prevention of Cardiovascular Events: Implications of the ACCORD, ADVANCE and VA. // Diabetes Trials Diabetes Care. 2009; 32(1):187–192. 13. Desousza L.C. et al. Accotiation of Hypoglycemia and Cardiac Ischemia. // Diabetes Care. 2003; 26: 1458–8. 14. Marrett E. et al. Patient–reported outcomes in a survey of patients treated with oral antihyperglycaemic medications: associations with hypoglycaemia and weight gain. // Diabetes, Obesity and Metabolism. 2009; 11: 1138–1144. 15. Gerich J.E. Clinical significance, pathogenesis, and management of postprandial hyperglycemia. // Arch. Intern. Med. 163, 1306–1316 (2003). 16. Saydah S., Loria C., Eberhardt M., Brancati F. Subclinical states of glucose intolerance and risk of death in the US. // Diabetes Care. 2001; 24:447–453. 17. The DECODE Study Group. Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria. // Lancet. 1999; 354: 617–621. 18. Ceriello A., Bortolotti N., Motz E. et al. Meal induced oxidative stress and low density lipoprotein oxidation in diabetes: the possible role of hyperglycaemia. // Metabolism. 1999; 48:1503–08. 19. Kawano H., Motoyama T., Hirashima O., et al. Hyperglycaemia rapidly suppresses flow mediated endothelium dependant vasodilation of brachial artery. // J Am Coll Cardiol. 1999;34:146–54. 20. Ceriello A. Coagulation activation in diabetes mellitus: the role of hyperglycaemia and therapeutic prospects. // Diabetologia. 1993; 36:1119–25. 21. Larsson S.C., Bergkvist L., Wolk A. Consumption of sugar and sugar–sweetened foods and the risk of pancreatic cancer in a prospective study. // Am J Clin Nutr 2006; 84(5):1171–1176. 22. Abbatecola A.M., Rizzo M.R., Barbieri M. et al. Postprandial plasma glucose excursions and cognitive functioning in aged type 2 diabetics. // Neurology 2006; 67(2):235–240. 23. Hanefeld M., Koehler C., Schaper F. et al. Postprandial plasma glucose is an independent risk factor for increased carotid intima–media thickness in non–diabetic individuals. // Atherosclerosis. 1999;144(1):229–235. 24. Monnier L., Lapinski H., Collette C. Contributions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of Type 2 diabetic patients: variations with increasing levels of HbA1C. // Diabetes Care. 26, 881–885 (2003). 25. Deacon C.F. Dipeptidyl peptidase–4 inhibitors in the treatment of type 2 diabetes: a comparative review. // Diabetes, Obesity and Metabolosm. 2011;13:7–18. 26. Nauck M.A., Homberger E., Siegel E.G. et al. Incretin effects of increasing glucose loads in man calculatedfrom venous insulin and C–peptide responses. // J Clin Endocrinol Metab. 1986; 63:492–498. 27. Baggio L.L., Drucker D.J. Biology of incretins: GLP–1 and GIP. // Gastroenterology. 2007; 132:2131–2157. 28. Holst J.J. The physiology of glucagon–like peptide 1. // Physiol Rev. 2007; 87:1409–1439. 29. Holst J.J, Vilsboll T., Deacon C.F. The incretin system and its role in type 2 diabetes mellitus. // Mol Cell Endocrinol. 2009; 297:127–136. 30. Drucker D.J. Glucagon–like peptides: regulators of cell proliferation, differentiation, and apoptosis. // Mol Endocrinol. 2003;17:161–171. 31. Amori R.E., Lau J., Pittas A.G. Efficacy and safety of incretin therapy in type 2diabetes: systematic review and meta–analysis. // JAMA. 2007; 298(2):194–206. 32. Toft–Nielsen M.B., Damholt M.B., Madsbad S. et al. Determinants of the impaired secretion of glucagon–like peptide–1 in type 2 diabetic patients. // J Clin Endocrinol Metab. 2001; 86(8):3717–3723.
Инкретиновый эффект при сахарном диабете 2 типа
У пациентов с СД2 и с ожиреним наблюдается значительное снижение инкретинового эффекта, т.е. снижение секреции инсулина в ответ на пероральную нагрузку глюкозой при сохранной его секреции в ответ на внутривенное введение глюкозы (рис.5).
Снижение инкретинового эффекта влечет за собой нарушение инсулинового ответа на прием углеводов и, соответственно, увеличение уровня глюкозы в крови.
При изучении причины снижения инкретинового ответа у больных с СД2 было установлено, что это связно с более низкой секрецией ГПП-1 (при сохранной секреции ГИП). На стадии предиабета также отмечается снижение секреции ГПП-1, однако менее выраженное, чем у больных с СД2. (рис.6)
ВЫВОДЫ:
- Инкретины — это гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и стимулирующие секрецию инсулина.
- «Инкретиновым эффект» — это разница в секреции инсулина в ответ на пероральную и внутривенную нагрузки глюкозой.
- Глюкозозависимая стимуляция секреции инсулина и глюкозозависимое подавление секреции глюкагона, обеспечиваемые ГПП-1, являются механизмами защиты от возникновения гипогликемических состояний.
- ГПП-1 вызывает дозозависимое снижение скорости опорожнения желудка. Это приводит к значительному снижению постпрандиального уровня глюкозы в крови. Предположительно, этот эффект достигается преимущественно за счет торможения опорожнения желудка, а не только благодаря увеличению синтеза инсулина поджелудочной железой.
- Активация рГПП, как и прямое воздействие метаболита ГПП-1 на сердечную мышцу, обеспечивают благоприятные сердечно-сосудистые эффекты аналогов ГПП-1: увеличение сердечного выброса, уменьшение зоны инфаркта миокарда, улучшение коронарного кровотока.
- Воздействие ГПП-1 на ядра гипоталамуса способствует быстрому наступлению насыщения, уменьшению количества потребляемой пищи и, как следствие, к снижению массы тела.
- ГПП-1 снижает инсулинорезистентность периферических тканей и снижает продукцию глюкозы печенью.
- ГПП-1 препятствует развитию остеопороза и остеопении.
- У пациентов с инсулинорезистентностью наблюдается значительное снижение секреции инсулина в ответ на пероральную нагрузку глюкозой при сохранной его секреции в ответ на внутривенное введение глюкозы. Снижение инкретинового эффекта влечет за собой ослабление инсулинового ответа на прием углеводов и, как следствие, увеличение уровня глюкозы в крови.
Источники:
- ДЕДОВ И.И. et al. ПОКАЗАТЕЛИ УГЛЕВОДНОГО ОБМЕНА И ПРОДУКЦИЯ ИНКРЕТИНОВ У БОЛЬНЫХ МОРБИДНЫМ ОЖИРЕНИЕМ, В ТОМ ЧИСЛЕ ПЕРЕНЕСШИХ БИЛИОПАНКРЕАТИЧЕСКОЕ ШУНТИРОВАНИЕ // Ожирение и метаболизм. 2014. № 1. P. 24–31.
- Moore В. On the treatment of diabetes mellitus by acid extract of duodenal mucous // Biochem J. 1906. Vol. 1. P. 28–38.
Апудомы[ | ]
Основная статья: Апудомы
Апудо́мы — опухоли, исходящие из клеточных элементов, расположенных в различных органах и тканях (преимущественно островковые (инкреторные) клетки поджелудочной железы, клетки других отделов ЖКТ, С-клетки щитовидной железы), продуцирующих полипептидные гормоны. В настоящее время описаны следующие виды апудом:[10]
- ВИПома;
- Гастринома;
- Глюкагонома;
- Карциноид;
- Нейротензинома;
- ППома;
- Соматостатинома;
- Инсулинома
Випома[ | ]
Основная статья: ВИПома
ВИПо́ма (синдром Вернера-Моррисона, панкреатическая холера, синдром водной диареи-гипокалиемии-ахлоргидрии) характеризуется наличием водной диареи и гипокалиемии в результате гиперплазии островковых клеток или опухоли, часто злокачественной, исходящей из островковых клеток поджелудочной железы (чаще тела и хвоста), которые секретируют вазоактивный интестинальный полипептид (ВИП). В редких случаях ВИПома может приходиться на ганглионейробластомы, которые локализуются в ретроперитонеальном пространстве, лёгких, печени, тонкой кишке и надпочечниках, встречаются в детском возрасте и, как правило, доброкачественные. Размер панкреатических ВИПом 1…6 см. В 60 % случаев злокачественных новообразований на момент диагностики имеются метастазы.[11] Заболеваемость ВИПомой очень мала (1 случай в год на 10 млн человек) или 2 % от всех эндокринных опухолей желудочно-кишечного тракта. В половине случаев опухоль злокачественная. Прогноз чаще неблагоприятный..[12]
Гастринома[ | ]
Основная статья: Гастринома
При гиперплазии G-клеток образуется гастрино́ма — доброкачественная или злокачественная опухоль, локализующаяся в поджелудочной железе, двенадцатиперстной или тощей кишке, или даже в перипанкреатических лимфатических узлах, в воротах селезёнки или стенке желудка. Эта опухоль вырабатывает большее количество гастрина, возникает гипергастринимия, которая, через механизм стимуляции париетальных клеток, является причиной чрезмерной продукции соляной кислоты и пепсина. В нормальной ситуации G-клетки под воздействием соляной кислоты тормозят выработку гастрина, но на G-клетки гастрино́м фактор кислотности не влияет. В результате развиваются множественные пептические язвы желудка, двенадцатиперстной или тощей кишки. Секреция гастрина гастриномами особенно резко усиливается после приема пищи.
Клиническое проявление гипергастринимии — синдром Золлингера — Эллисона (1-го типа)..[13]
Глюкагонома[ | ]
Основная статья: Глюкагонома
Глюкагоно́ма — опухоль, чаще злокачественная, исходящая из Альфа-клеток панкреатических островков. Характеризуется мигрирующим эрозивным дерматозом, ангулярным хейлитом, стоматитом, глосситом, гипергликемией, нормохромной анемией. Растёт медленно, метастазирует в печень. Встречается 1 случай на 20 млн в возрасте от 48 до 70 лет, чаще у женщин.[10]
Карцино́ид[ | ]
| Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
Не́йротензино́ма[ | ]
| Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
ППома[ | ]
Основная статья: ППома
ППо́ма — опухоль поджелудочной железы, секретирующая панкреатический полипептид (ПП). Клинические проявления практически отсутствуют. Чаще диагностируется после метастазирования в печень.[10] Лечение: оперативное, химиотерапия и симптоматическое. Прогноз зависит от срока начала лечения.
Соматостатинома[ | ]
Основная статья: Соматостатинома
Сома́тостатино́ма — злокачественная медленно растущая опухоль, характеризуется повышением уровня соматостатина. Это редкое заболевание, встречается у лиц старше 45 лет — 1 случай на 40 млн.[10]
Различают:
- соматостатиному
из дельта-клеток поджелудочной железы и - апудому
, секретирующую соматостатин — опухоль двенадцатиперстной кишки.
Диагноз на основании клиники и повышения уровня соматостатина в крови. Лечение оперативное, химиотерапия и симптоматическое. Прогноз зависит от своевременности лечения.
Инсулинома[ | ]
Основная статья: Инсулинома