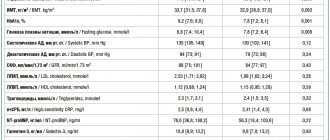
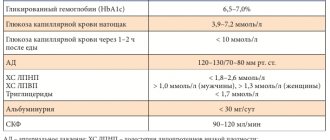
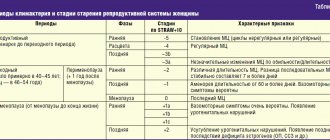
Пембролизумаб (Кейтруда, Китруда, MK-3475) — инновационный препарат, который был одобрен FDA (Американским управлением по надзору за качеством пищевых продуктов и медикаментов) в сентябре 2014 года, и в настоящее время уже достаточно широко применяется для лечения меланомы на поздних стадиях.
В 2014 году Кейтруда получила статус «приоритетное рассмотрение» и «прорыв в медицине». Это означает, что Пембролизумаб был включен в группу лекарственных средств, способных повысить эффективность и безопасность лечения редких и серьезных заболеваний. Именно поэтому препарат был так быстро одобрен и внедрен в клиническую практику -обычно это происходит намного дольше.
Как действует Пембролизумаб?
Препараты для иммунотерапии меланомы и других злокачественных опухолей существуют уже достаточно давно. Но они всегда имели низкую эффективность, и до недавнего времени ученые не знали, как справиться с этой проблемой.
Задача иммунотерапии — активировать иммунную систему больного, заставить её атаковать и уничтожать раковые клетки. Долгое время препятствием для достижения этой цели становился белок PD-1.
Белок PD-1 блокирует работу иммунной системы. Он не дает Т-лимфоцитам распознавать и уничтожать раковые клетки. Кейтруда содержит моноклональные антитела, которые блокируют PD-1. Препарат помогает убрать «тормоз», благодаря чему лимфоциты приобретают способность атаковать опухолевую ткань.
Актуальность
31 августа U.S. Food and Drug Administration (FDA), на основании результатов двух недавно завершенных исследований, выпустило предупреждения о рисках, ассоциированных с использованием пембролизумаба (Кейтруда) в комбинации с дексаметазоном и иммуномодуляторами (леналидомид или помалидомид) у больных множественной миеломой.
Такое заключение стало прямым следствием обзора данных двух клинических исследований — KEYNOTE-183 и KEYNOTE-185 — в которых изучалась эффективность и безопасность пембролизумаба у пациентов с множественной миеломой. 3 июля 2021 года FDA потребовало прекратить лечение у всех пациентов, получавших комбинированную терапию (пембролизумаб + иммуномодулятор) в связи с выявленным повышением летальности, по сравнению с лицами из контрольной группы.
Вместе с тем, пембролизумаб может использоваться у пациентов с такими заболеваниями, как меланома, рак легкого, рак главы и шеи, классическая лимфома Ходжкина, уроэпителиальная карцинома, опухоли с микросателлитной нестабильностью.
Обращает на себя внимание, что в настоящее время проводятся еще несколько клинических исследований по изучению пембролизумаба в комбинации с другими ингибиторами PD-1/PD-L1 и другими лекарственными препаратами. FDA планирует прямое сотрудничество с компаниями-производителями этих препаратов с целью определения профиля безопасности терапии.
Насколько эффективен Пембролизумаб?
В Калифорнийском Университете в Лос-Анджелесе было проведено исследование, в котором приняли участие 173 человека с диагностированной прогрессирующей меланомой. Их разделили на две группы. В одной из них пациенты получали стандартную дозу препарата 2 мг на килограмм массы тела через каждые 3 недели. Во второй группе доза была увеличена в 5 раз (10 мг/кг).
У 24% пациентов, получавших препарат в дозе 2 мг/кг, опухоль уменьшилась более чем на треть. Повторный рост меланомы не отмечался, а эффект препарата сохранялся от 1,4 до 8,5 месяцев (в отдельных случаях — дольше).
Китруда® (Keytruda)
Краткий обзор профиля безопасности
Применение препарата Китруда® наиболее часто связывают с развитием иммуноопосредованных нежелательных реакций. Большинство из них, включая тяжелые реакции, разрешались после начала соответствующей терапии или после прекращения использования препарата Китруда® (см. далее «Описание некоторых нежелательных реакций»).
Безопасность пембролизумаба при применении в качестве монотерапии изучалась в клинических исследованиях у 5884 пациентов с распространенной меланомой, меланомой 3-й стадии после хирургического лечения (адъювантная терапия), НМРЛ, кЛХ, уротелиальным раком или раком головы и шеи в четырех режимах дозирования (2 мг/кг каждые 3 недели, 200 мг каждые 3 недели или 10 мг/кг каждые 2 или 3 недели). На основании всех зарегистрированных нежелательных лекарственных реакций далее и в Таблице 2 приведена частота независимо от оценки исследователем причинно-следственной связи. В этой популяции пациентов медиана времени наблюдения составила 7,3 месяца (диапазон от 1 дня до 31 месяца), и наиболее частыми нежелательными реакциями при применении пембролизумаба были усталость (32%), тошнота (20%) и диарея (20%). Большинство сообщенных нежелательных реакций при применении в качестве монотерапии были 1 или 2 степени тяжести. Наиболее серьезными нежелательными реакциями были иммуноопосредованные нежелательные реакции и тяжелые инфузионные реакции (см. «Особые указания»).
Безопасность пембролизумаба при применении в комбинации с химиотерапией изучалась в клинических исследованиях у 1067 пациента с НМРЛ или ПРГШ в режимах дозирования 200 мг, 2 мг/кг или 10 мг/кг каждые три недели. На основании всех зарегистрированных нежелательных лекарственных реакций далее и в Таблице 2 приведена частота независимо от оценки исследователем причинно-следственной связи. В этой популяции пациентов наиболее частыми нежелательными реакциями были анемия (50%), тошнота (50%), усталость (37%), запор (35%), диарея (30%), нейтропения (30%), снижение аппетита (28%) и рвота (25%). Частота возникновения нежелательных реакций 3- 5 степени тяжести у пациентов с НМРЛ составила 67% при применении пембролизумаба в комбинации с химиотерапией и 66% при применении только химиотерапии, у пациентов с ПРГШ составила 85% при применении пембролизумаба в комбинации с химиотерапией и 84% при применении химиотерапии в комбинации с цетуксимабом.
Безопасность пембролизумаба при применении в комбинации с акситинибом изучалась в клиническом исследовании у 429 пациентов с распространенным ПКР в режиме дозирования 200 мг пембролизумаба каждые три недели и 5 мг акситиниба два раза в день. В этой популяции пациентов наиболее частыми нежелательными реакциями были диарея (54%), повышение артериального давления (45%), усталость (38%), гипотиреоз (35%), снижение аппетита (30%), синдром ладонно-подошвенной эритродизестезии (28%), тошнота (28%), повышение активности АЛТ (27%), повышение активности ACT (26%), дисфония (25%), кашель (21%) и запор (21%). Частота возникновения нежелательных реакций 3-5 степени тяжести составила 76% при применении пембролизумаба в комбинации с акситинибом и 71% при монотерапии сунитинибом.
Безопасность пембролизумаба при применении в комбинации с ленватинибом изучалась у 94 пациентов с раком эндометрия в режиме дозирования пембролизумаб 200 мг каждые три недели и ленватиниб 20 мг перорально один раз в сутки до развития признаков неприемлемой токсичности или прогрессирования заболевания, установленных исследователем. В этой популяции пациентов наиболее частыми нежелательными явлениями были повышение артериального давления (64%), диарея (63%), усталость (54%), снижение аппетита (51%), гипотиреоз (49%), тошнота (48%), рвота (39%), стоматит (36%), снижение веса (36%), артралгия (33%), головная боль (33%), запор (32%), дисфония (29%), инфекция мочевыводящих путей (29%), боль в животе (27%), гипомагниемия (27%), синдром ладонноподошвенной эритродизестезии (26%), одышка (25%), кашель (21%), миалгия (21%) и боль в спине (20%). Среди указанных наиболее частых зарегистрированных нежелательных явлений, развившихся более чем у 2% пациентов, были отмечены следующие нежелательные явления 3-4 степени тяжести: повышение артериального давления, усталость, боль в животе, тошнота, диарея, инфекция мочевыводящих путей, снижение веса, гипомагниемия, синдром ладонно-подошвенной эритродизесгезии и одышка.
Табличный перечень нежелательных реакций
Нежелательные реакции, наблюдавшиеся в клинических исследованиях пембролизумаба при применении в качестве монотерапии, или в комбинации с химиотерапией, или с другими противоопухолевыми препаратами или сообщенные в рамках пострегистрационного использования препарата Китруда®, перечислены в Таблице 2. Нежелательные реакции, возникающие при применении только пембролизумаба или только химиотерапии, могут возникать при их совместном применении, даже если в клинических исследованиях комбинированной терапии о данных реакциях не сообщалось.
Эти реакции представлены по системно-органным классам и частоте. Частоты указаны по следующим категориям: очень частые (≥ 1/10); частые (≥ 1/100 до < 1/10); нечастые (≥ 1/1000 до < 1/100); редкие (≥ 1/10000 до < 1/1000); очень редкие (< 1/10000) и неизвестно (частота не может быть оценена на основании имеющихся данных). В каждой частотной группе нежелательные реакции расположены в порядке убывания серьезности.
Таблица 2: Нежелательные реакции у пациентов, получавших терапию препаратом Китруда®*
| Монотерапия | В комбинации с химиотерапией | В комбинации с акситинибом | |
| Инфекционные и паразитарные заболевания | |||
| Частые | пневмония | пневмония | пневмония |
| Нарушения со стороны кровии лимфатической системы | |||
| Очень частые | анемия | анемия, нейтропения, тромбоцитопения | |
| Частые | тромбоцитопения, лимфопения | фебрильная нейтропения, лейкопения, лимфопения | анемия, нейтропения, лейкопения, тромбоцитопения |
| Нечастые | нейтропения, лейкопения, эозинофилия | лимфопения, эозинофилия | |
| Редкие | иммунная тромбоцитопеническая пурпура, гемолитическая анемия, истинная эритроцитарная аплазия, гемофагоцитарный лимфогистиоцитоз | эозинофилия | |
| Нарушения состороны иммунной системы | |||
| Частые | инфузионная реакцияa | инфузионная реакцияa | инфузионная реакцияa |
| Нечастые | саркоидоз | ||
| Неизвестно | отторжение трансплантата солидного органа | ||
| Нарушения со стороны эндокринной системы | |||
| Очень частые | гипотиреозb | гипертиреоз, гипотиреозb | |
| Частые | гипертиреоз | гипотиреоз, гипертиреоз | гипофизитd, тиреоидитe, недостаточность функции надпочечниковc |
| Нечастые | недостаточность функции надпочечниковc, гипофизитd, тиреоидитe | гипофизитd, тиреоидитe, недостаточность функции надпочечниковc | |
| Нарушения со стороны обмена веществ и питания | |||
| Очень частые | снижение аппетита | гипокалиемия, снижение аппетита | снижение аппетита |
| Частые | гипонатриемия, гипокалиемия, гипокальциемия | гипонатриемия, гипокальциемия | гипокалиемия, гипонатриемия, гипокатьциемия |
| Нечастые | сахарный диабет 1 типаf | сахарный диабет 1 типа | сахарный диабет 1 типаf |
| Нарушения психики | |||
| Частые | бессонница | бессонница | бессонница |
| Нарушения со стороны нервной системы | |||
| Очень частые | головная боль | головокружение, головная боль, периферическая нейропатия, дисгевзия | головная боль, дисгевзия |
| Частые | головокружение, периферическая нейропатия, вялость, дисгевзия | вялость | головокружение, вялость, периферическая нейропатия |
| Нечастые | эпилепсия | эпилепсия | миастенический синдромi |
| Редкие | энцефалит, синдром Гийена-Барреg, миелитh, миастенический синдромi, менингит (асептический)j | ||
| Нарушения со стороны органа зрения | |||
| Частые | сухость глаз | сухость глаз | сухость глаз |
| Нечастые | увеитk | увеитk | |
| Редкие | синдром Фогта- Коянаги-Харада | ||
| Нарушения со стороны сердца | |||
| Частые | нарушение сердечного ритма†(включая фибрилляцию предсердий) | нарушение сердечного ритма†(включая фибрилляцию предсердий) | нарушение сердечного ритма† (включая фибрилляцию предсердий) |
| Нечастые | перикардиальный выпот, перикардит | перикардиальный выпот | миокардитl |
| Редкие | миокардитl | миокардитl, перикардит | |
| Нарушения со стороны сосудов | |||
| Очень частые | повышение артериального давления | ||
| Частые | повышение артериального давления | повышение артериального давления | |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | |||
| Очень частые | одышка, кашель | одышка, кашель | одышка, кашель, дисфония |
| Частые | пневмонитm | пневмонитm | пневмонитm |
| Нарушения со стороны желудочно-кишечного тракта | |||
| Очень частые | диарея, боль в животеn, тошнота, рвота, запор | диарея, тошнота, рвота, запор, боль в животеn | диарея, боль в животеn, тошнота, рвота, запор |
| Частые | колитo, сухость во рту | колитo, сухость во рту | колитo, сухость во рту |
| Нечастые | панкреатитp, изъязвление стенки желудочно-кишечного трактаq | панкреатитp, изъязвление стенки желудочно-кишечного трактаq | панкреатитp, изъязвление стенки желудочно-кишечного трактаq |
| Редкие | перфорация тонкого кишечника | ||
| Нарушения со стороны печени и желчевыводящих путей | |||
| Частые | гепатитr | ||
| Нечастые | гепатитr | гепатитr | |
| Нарушения со стороны кожи и подкожных тканей | |||
| Очень частые | cыпьs, зудt | cыпьs, алопеция, зудt | синдром ладонно-подошвенной эритродизестезии, сыпьs, зудt |
| Частые | тяжелые кожные реакцииu, эритема, сухость кожи, витилигоv, экзема, алопеция, акнеиформный дерматит | тяжелые кожные реакцииu, эритема, сухость кожи | тяжелые кожные реакцииu, акнеиформный дерматит, дерматит, сухость кожи, алопеция, экзема, эритема |
| Нечастые | лихеноидный кератозw, псориаз, дерматит, папула, изменения цвета волос | псориаз, акнеиформный дерматит, дерматит, витилигоv, экзема | изменения цвета волос, лихеноидный кератоз, папула, псориаз, витилигоv |
| Редкие | токсический эпидермальный некролиз, синдром Стивенса-Джонсона, узловатая эритема | изменения цвета волос, лихеноидный кератоз, папула | |
| Нарушения со стороны скелетно-мышечной системы и соединительной ткани | |||
| Очень частые | скелетно-мышечная больx, артратгия | скелетно-мышечная больx, артралгия | скелетно-мышечная больx, артралгия, боль в конечности |
| Частые | боль в конечности, миозитy, артритz | миозитy, боль в конечности, артритz | миозитy, артритz, теносиновитaa |
| Нечастые | теносиновитaa | теносиновитaa | синдром Шегрена |
| Редкие | синдром Шегрена | синдром Шегрена | |
| Нарушения со стороны почек и мочевыводящих путей | |||
| Частые | нефритbb, острое повреждение почек | острое повреждение почек, нефритbb | |
| Нечастые | нефритbb | ||
| Общие расстройства и нарушения в месте введения | |||
| Очень частые | усталость, астения, отекcc, повышение температуры тела | усталость, астения, повышение температуры тела, отекcc | усталость, астения, повышение температуры тела |
| Частые | гриппоподобное заболевание, озноб | озноб, гриппоподобное заболевание | отекcc, гриппоподобное заболевание, озноб |
| Лабораторные и инструментальные данные | |||
| Очень частые | повышение концентрации креатинина в крови | повышение активности алт, повышение активности act, повышение концентрации креатинина в крови | |
| частые | повышение активности act, повышение активности алт, гиперкальциемия, повышение активности щелочной фосфатазы в крови, повышение концентрации билирубина в крови, повышение концентрации креатинина в крови | гиперкальциемия, повышение активности алт, повышение активности act, повышение активности щелочной фосфатазы в крови | повышение активности щелочной фосфатазы в крови, гиперкальциемия, повышение концентрации билирубина в крови |
| нечастые | повышение активности амилазы | повышение концентрации билирубина в крови, повышение активности амилазы | повышение активности амилазы |
*частота нежелательных реакций, перечисленных в таблице 2, может быть связана не только с применением пембролизумаба в качестве монотерапии, но и с основным заболеванием или с другими лекарственными препаратами, используемыми в комбинированной терапии.
†на основании стандартных запросов в базу данных нежелательных реакций, включающих брадиаритмии и тахиаритмии.
следующие термины представляют собой группу взаимосвязанных событий, которые описывают медицинское состояние, а не одно событие:
a. инфузионные реакции (гиперчувствительность к лекарственному препарату, анафилактическая реакция, анафилактоидная реакция, гиперчувствигельность и синдром высвобождения цитокинов);
b. гипотиреоз (микседема);
c. недостаточность функции надпочечников (первичная недостаточность коры надпочечников, острая недостаточность коры надпочечников, вторичная недостаточность коры надпочечников);
d. гипофизит (гилопитуитаризм);
e. тиреоидит (аутоиммунный тиреоидит и заболевание щитовидной железы);
f. сахарный диабет 1 типа (диабетический кетоацидоз);
g. синдром гийена-барре (аксональная нейропатия и демиелинизирующая полинейропатия);
h. миелит (включая поперечный миелит);
i. миастенический синдром (миастения гравис, включая обострение);
j. менингит асептический (менингит, менингит неинфекционный);
k. увеит (воспаление радужной оболочки глаза и иридоциклит);
l. миокардит (аутоиммунный миокардит);
m. пневмониг (интерстициальное заболевание легких и пневмония организующаяся);
n. боль в животе (дискомфорт в животе, боль в верхней части живота, боль в нижней части живота);
о. колит (колит микроскопический, энтероколит, геморрагический энтероколит и аутоиммунный колит);
р. панкреатит (аутоиммунный панкреатит и острый панкреатит);
q. изъязвление стенки желудочно-кишечного тракта (язва желудка и дуоденальная язва);
r. гепатит (аутоиммунный гепатит, иммуноопосредованный гепатит, лекарственное повреждение печени и острый гепатит);
s. сыпь (эритематозная сыпь, фолликулярная сыпь, генерализованная сыпь, макулезная сыпь, макулезная-папулезная сыпь, папулезная сыпь, зудящая сыпь, везикулярная сыпь и сыпь на половых органах);
t. зуд (крапивница, папулезная крапивница, генерализованный зуд и зуд половых органов);
u. тяжелые кожные реакции (буллезный дерматит, эксфолиативный дерматит, генерализованный эксфолиативный дерматит, мультиформная эритема, эксфолиативная сыпь, пемфигус, некроз кожи, токсикодермия и любое из следующих явлений ≥ 3 степени тяжести: острый фебрильный нейтрофильный дерматоз, ушиб, пролежень, дерматит псориазиформный, медикаментозная сыпь, желтуха, пемфигоид, зуд, генерализованный зуд, сыпь, эритематозная сыпь, генерализованная сыпь, макулезно-папулезная сыпь, зудящая сыпь, пустулезная сыпь и повреждение кожи);
v. витилиго (депигментация кожи, гипопигментация кожи и гипопигментация век);
w. лихеноидный кератоз (красный плоский лишай и склероатрофический лишай);
x. скелетно-мышечная боль (скелетно-мышечный дискомфорт, боль в спине, скелетно-мышечная скованность, скелетно-мышечная боль в грудной клетке и кривошея);
y. миозит (миалгия, миопатия, полимиалгия ревматическая и рабдомиолиз);
z. артрит (отек суставов, полиартрит и суставной выпот);
аа. теносиновит (тендинит, синовит и боль в сухожилиях);
bb. нефрит (аутоиммунный нефрит, тубулоинтерстициальный нефрит и почечная недостаточность, острая почечная недостаточность или острое повреждение почек с признаками нефрита, нефротический синдром и мембранозный гломерулонефрит);
сс. отек (отек периферический, генерализованный отек, гиперволемия, задержка жидкости, отек век и отек губ, отек лица, локализованный отек и периорбитальный отек).
описание некоторых нежелательных реакций
данные для следующих иммуноопосредованных нежелательных реакций основаны на информации у пациентов, получавших пембролизумаб в клинических исследованиях в четырех режимах дозирования (2 мг/кг каждые 3 недели, 10 мг/кг каждые 2 или 3 недели или 200 мг каждые 3 недели). рекомендации по ведению пациентов с указанными нежелательными реакциями описаны в разделе «особые указания».
иммуноопосредованные нежелательные реакции
(см. «особые указания»)
иммуноопосредованный пневмонит
у 253 (4,3%) пациентов, получивших пембролизумаб, развился пневмонит, в том числе 2, 3, 4 или 5 степени тяжести у 106 (1,8%), 69 (1,2%), 13 (0,2%) и 9 (0,2%) пациентов соответственно. медиана времени до начала развития пневмонита составила 3,3 месяца (диапазон от 2 дней до 26,8 месяца). медиана продолжительности составила 1,9 месяца (диапазон от 1 дня до 25,3+ месяца). пневмонит развивался наиболее часто у пациентов, которым проводили лучевую терапию органов грудной клетки в анамнезе (8,1%), чем у пациентов, которым ранее не проводили лучевую терапию органов грудной клетки (3,4%). прекращение терапии пембролизумабом в связи с пневмонитом потребовалось у 98 (1,7%) пациентов. пневмонит разрешился у 138 пациента, в 2 случаях наблюдались осложнения.
у пациентов с нмрл развился пневмонит в 160 (5,7%) случаях, в том числе 2, 3, 4 или 5 степени тяжести у 62 (2,2%), 47 (1,7%), 14 (0,5%) и 10 (0,4%) пациентов соответственно. у пациентов с нмрл, которым проводили лучевую терапию в анамнезе, пневмонит развился в 8,9% случаев.
иммуноопосредованный колит
у 107 (1,8%) пациентов, получивших пембролизумаб, развился колит, в том числе 2, 3 или 4 степени тяжести у 31 (0,5%), 62 (1,1%) и 3 (<0,1%) пациентов соответственно. медиана времени до начала развития колита составила 4,3 месяца (диапазон от 7 дней до 24,3 месяца). медиана продолжительности составила 0,9 месяца (диапазон от 1 дня до 8,7+ месяца). прекращение терапии пембролизумабом в связи с колитом потребовалось у 29 (0,5%) пациентов. колит разрешился у 84 пациентов, в 2 случаях наблюдались осложнения.
иммуноопосредованный гепатит
у 50 (0,8%) пациентов, получивших пембролизумаб, развился гепатит, в том числе 2, 3 или 4 степени тяжести у 8 (0,1%), 31 (0,5%) и 8 (0,1%) пациентов соответственно. медиана времени до начала развития гепатита составила 3,6 месяца (диапазон от 8 дней до 21,4 месяца). медиана продолжительности составила 1,1 месяца (диапазон от 1 дня до 20,9+ месяца). прекращение терапии пембролизумабом в связи с гепатитом потребовалось у 19 (0,3%) пациентов. гепатит разрешился у 36 пациентов.
иммуноопосредованный нефрит
у 22 (0,4%) пациентов, получивших пембролизумаб в качестве монотерапии, развился нефрит, в том числе 2, 3 или 4 степени тяжести у 5 (0,1%), 14 (0,2%) и 1 (< 0,1%) пациентов соответственно. медиана времени до начала развития нефрита составила5,0 месяца (диапазон от 12 дней до 21,4 месяца). медиана продолжительности составила 2,6 месяца (диапазон от 6 дней до 12,0 месяца). прекращение терапии пембролизумабом в связи с нефритом потребовалось у 10 (0,2%) пациентов. нефрит разрешился у 13 пациентов, в 3 случаях наблюдались осложнения. у пациентов с неплоскоклеточным нмрл, получивших терапию пембролизумабом в комбинации с химиотерапией, включающей пеметрексед и препарат платины (n=488), частота развития нефрита составила 1,4% (все степени тяжести) с частотой 0,8% для 3 степени тяжести и 0,4% для 4 степени тяжести.
иммуноопосредованные эндокринопатии
у 46 (0,8%) пациентов, получивших пембролизумаб, развилась недостаточность функции надпочечников, в том числе 2, 3 или 4 степени тяжести у 19(0,3%), 20(0,3%) и 3(0,1%) пациентов соответственно. медиана времени до начала развития недостаточности функции надпочечников составила 5,4 месяца (диапазон от 1 дня до 17,7 месяца). медиана продолжительности не была достигнута (диапазон от 3 дней до 26,2+ месяца). прекращение терапии пембролизумабом в связи с недостаточностью функции надпочечников потребовалось у 4 (0,1%) пациентов.
недостаточность функции надпочечников разрешилась у 16 пациентов, в 4 случаях наблюдались осложнения.
у 36 (0,6%) пациентов, получивших пембролизумаб, развился гипофизит, в том числе 2, 3 или 4 степени тяжести у 13 (0,2%), 19 (0,3%) и 1 (< 0,1%) пациентов соответственно. медиана времени до начала развития гипофизита составила 5,9 месяца (диапазон от 1 дня до 17,7 месяца). медиана продолжительности составила 3,3 месяца (диапазон от 3 дней до 18,1+месяца). прекращение терапии пембролизумабом в связи с гипофизитом потребовалось у 8 (0,1%) пациентов. гипофизит разрешился у 17 пациентов, в 8 случаях наблюдались осложнения. у 244 (4,1%) пациентов, получивших пембролизумаб, развился гипертиреоз, в том числе 2 или 3 степени тяжести у 64 (1,1%) и 7 (0,1%) пациентов соответственно. медиана времени до начала развития гипертиреоза составила 1,4 месяца (диапазон от 1 дня до 22,5 месяца). медиана продолжительности составила 1,8 месяца (диапазон от 4 дней до 29,2+ месяца). прекращение терапии пембролизумабом в связи с гипертиреозом потребовалось у 3 (0,1%) пациентов. гипертиреоз разрешился у 191 (78,3%) пациентов, в 5 случаях наблюдались осложнения.
у 645 (11,0%) пациентов, получивших пембролизумаб, развился гипотиреоз, в том числе 2 или 3 степени тяжести у 475 (8,1%) и 7 (0,1%) пациентов соответственно. медиана времени до начала развития гипотиреоза составила 3,5 месяца (диапазон от 1 дня до 19,6 месяца). медиана продолжительности не была достигнута (диапазон от 2 дней до 32,6+ месяца). прекращение терапии пембролизумабом в связи с гипотиреозом потребовалось у 2 пациентов (<0,1%). гипотиреоз разрешился у 153 (23,7%) пациентов, в 10 случаях наблюдались осложнения. у пациентов с клх (n=241) частота развития гипотиреоза составила 14,1% (все степени тяжести) с частотой 0,4% для 3 степени тяжести. у пациентов с пргш, (n=909), получивших пембролизумаб в качестве монотерапии, частота развития гипотиреоза составила 16,1% (все степени тяжести) с частотой 0,3% для 3 степени тяжести. у пациентов с пргш (n=276), получивших пембролизумаб в комбинации с химиотерапией, включавшей препарат платины и 5-фу, частота развития гипотиреоза составила 15,2%, все случаи были 1 или 2 степени тяжести.
иммуноопосредованные кожные нежелательные реакции
у 89 (1,5%) пациентов, получивших пембролизумаб, развились иммуноопосредованные тяжелые кожные реакции, в том числе 2, 3 или 5 степени тяжести у 10 (0,2%), 65 (1,1%) и 1 (< 0,1%) пациентов соответственно. медиана времени до начала развития тяжелых кожных реакций составила 3,3 месяца (диапазон от 3 дней до 19,4 месяца). медиана продолжительности составила 1,6 месяца (диапазон от 1 дня до 27,3+ месяца). прекращение терапии пембролизумабом в связи с тяжелыми кожными реакциями потребовалось у 9 (0,2%) пациентов. тяжелые кожные реакции разрешились у 64 пациентов.
наблюдались редкие случаи синдрома стивенса-джонсона и токсического эпидермального некролиза, некоторые из них с летальным исходом (см. разделы «способ применения и дозы» и «особые указания»).
другие злокачественные опухоли
монотерапия
нежелательные явления у пациентов с мрл, раком желудка, злокачественными новообразованиями с высоким уровнем микросателлитной нестабильности, гцр или раком шейки матки, как правило, были сходны с таковыми у пациентов с меланомой или нмрл.
осложнения аллогенной трансплантации гемопоэтических стволовых клеток при клх
из 23 пациентов с клх, которым была выполнена аллогенная трансплантация гемопоэтических стволовых клеток после лечения препаратом китруда®, у 6 пациентов (26%) развилась реакция «трансплантат против хозяина», в одном случае с летальным исходом, и у 2 пациентов (9%) развился тяжелый облитерирующий эндофлебит печёночных вен после кондиционирования со сниженной интенсивностью, в одном случае с летальным исходом. у 23 пациентов медиана продолжительности периода наблюдения после аллогенной трансплантации гемопоэтических стволовых клеток составила 5,1 месяца (диапазон: 0-26,2 месяца).
комбинированная терапия
нежелательные явления у ранее нелеченых пациентов с нмрл, получавших пембролизумаб в комбинации с карбоплатином и паклитакселом или альбумин-стабилизированным нанодисперсным паклитакселом в исследовании keynote-407, как правило, были сходны с таковыми у пациентов в исследовании keynote-189, за исключением алопеции (46%) и артралгии (21%).
у пациентов с пргш, получавших препарат китруда® в комбинации с химиотерапией (препарат платины и 5-фу), следующие нежелательные реакции были более тяжелой степени (3-4 степень) и развивались чаще (разница ≥ 2%) по сравнению с цетуксимабом в комбинации с химиотерапией (препарат платины и 5-фу): усталость (7% в сравнении с 4,9%), воспаление слизистой (10% в сравнении с 5%) и стоматит (8% в сравнении с 3,5%).
повышение активности ферментов печени при терапии пембролизумабом в комбинации с акситинибом при пкр
в клиническом исследовании у ранее нелеченых пациентов с пкр, получавших пембролизумаб в комбинации с акситинибом, наблюдалась более высокая, чем ожидаемая, частота повышения активности алт (20%) и повышения активности act (13%) 3 и 4 степени тяжести. медиана времени до начала повышения активности алт составила 2,3 месяца (диапазон от 7 дней до 19,8 месяца). у пациентов с повышением активности алт выше вгн ≥ 3 раз (2-4 степень тяжести, n=116) в 94% случаев нежелательная реакция уменьшилась до 0-1 степени тяжести. 59% пациентов с повышенной активностью алт получали системные кортикостероиды. в случае разрешения 92 пациентам (84%) была повторно назначена монотерапия пембролизумабом (3%) или акситинибом (31%) или комбинированная терапия (50%). среди этих пациентов у 55% не наблюдалось повторного повышения активности алт выше вгн > 3 раз, у всех пациентов с повторным повышением активности алт выше вгн > 3 раз наступило разрешение. явлений со стороны печени 5 степени тяжести зарегистрировано не было.
отклонение лабораторных показателей
среди пациентов, получавших пембролизумаб в качестве монотерапии, процент пациентов, у которых наблюдалось отклонение лабораторных показателей от исходных значений до 3 или 4 степени тяжести, составил: снижение числа лимфоцитов 10,9%, снижение концентрации натрия 8,2%, снижение концентрации гемоглобина 6,3%, снижение концентрации фосфатов 5,2%, увеличение концентрации глюкозы 4,8%, повышение активности act 2,8%, повышение активности щелочной фосфатазы 2,7%, повышение активности алт 2,7%, снижение концентрации калия 2,2%, повышение концентрации кальция 1,8%, снижение числа нейтрофилов 1,8%, повышение концентрации калия 1,8%, повышение концентрации билирубина 1,7%, снижение числа тромбоцитов 1,7%, снижение концентрации альбумина 1,6%, снижение концентрации кальция 1,5%, повышение концентрации креатинина 1,3%, снижение числа лейкоцитов 0,8%, повышение концентрации магния 0,7%, снижение концентрации глюкозы 0,6%, снижение концентрации магния 0,2%, повышение концентрации натрия 0,2%.
среди пациентов, получавших пембролизумаб в комбинации с химиотерапией, доля пациентов, у которых наблюдалось отклонение лабораторных показателей от исходных значений до 3 или 4 степени тяжести, составил: снижение числа нейтрофилов 26,7%, снижение числа лимфоцитов 23,9%, снижение концентрации гемоглобина 19,1%, снижение числа лейкоцитов 17,9%, снижение числа тромбоцитов 12,2%, снижение концентрации натрия 10,2%, снижение концентрации фосфатов 8,9%, повышение концентрации глюкозы 7,4%, снижение концентрации калия 6,5%, повышение концентрации креатинина 3,3%, повышение активности алт 3,1%, повышение активности act 3,1%, снижение концентрации кальция 3,1%, повышение концентрации калия 3,0%, снижение концентрации альбумина 2,9%, повышение концентрации кальция 2,3%, повышение активности щелочной фосфатазы 1,2%, снижение концентрации глюкозы 0,8%, повышение концентрации билирубина 0,7%, повышение концентрации натрия 0,3%.
среди пациентов, получавших пембролизумаб в комбинации с акситинибом, доля пациентов, у которых наблюдалось отклонение лабораторных показателей от исходных значений до 3 или 4 степени тяжести, составил: повышение активности алт 20,1%, повышение активности act 13,2%, снижение числа лимфоцитов 10,8%, повышение концентрации глюкозы 8,9%, снижение концентрации натрия 7,8%, снижение концентрации фосфатов 6,4%, повышение концентрации калия 6,2%, повышение концентрации креатинина 4,3%, снижение концентрации калия 3,6%, повышение концентрации билирубина 2,1%, снижение концентрации гемоглобина 2,1%, повышение активности щелочной фосфатазы 1,7%, повышение мно 1,5%, снижение числа лейкоцитов 1,4%, снижение числа тромбоцитов 1,4%, удлинение активированного частичного тромбопластинового времени 1,2%, снижение числа нейтрофилов 1,2%, повышение концентрации натрия 1,2%, снижение концентрации кальция 0,7%, повышение концентрации кальция 0,7%, снижение концентрации альбумина 0,5%, снижение концентрации глюкозы 0
,
2
%.
иммуногенность
у 36 (1,8%) из 2034 подлежащих оценке пациентов, получивших лечение препаратом китруда® в клинических исследованиях в дозах 2 мг/кг каждые три недели, 200 мг каждые три недели или 10 мг/кг каждые две или три недели в качестве монотерапии, результаты тестирования на антитела к пембролизумабу были положительными, среди них у 9 (0,4%) пациентов были нейтрализующие антитела против пембролизумаба признаков изменения фармакокинетического профиля или профиля безопасности после появления связывающих или нейтрализующих антител против пембролизумаба не наблюдалось.
дети
безопасность пембролизумаба при применении в качестве монотерапии в режиме дозирования 2 мг/кг каждые 3 недели оценивалась в исследовании i/ii фазы keynote-051 у 154 пациентов детского возраста с распространенной меланомой, лимфомой или распространенными, рецидивирующими или рефрактерными солидными опухолями с положительной экспрессией pd-l1. профиль безопасности у пациентов детского возраста был сходным с таковым у взрослых пациентов, получивших пембролизумаб. наиболее частыми нежелательными реакциями (сообщенными с частотой не менее 20% у пациентов детского возраста) были повышение температуры тела (31%), рвота (26%), головная боль (22%), боль в животе (21%), анемия (21%) и запор (20%). большинство сообщенных нежелательных реакций при применении в качестве монотерапии были 1 или 2 степени тяжести. у 69 (44,8%) пациентов была одна или больше нежелательных реакций 3-5 степени тяжести, из которых у 6 (3,9%) пациентов была одна или больше нежелательных реакций, которые привели к летальному исходу. частота приведена на основании всех зарегистрированных нежелательных лекарственных реакций независимо от оценки исследователем причинно-следственной связи.
сообщение о предполагаемых нежелательных реакциях
сообщения о предполагаемых нежелательных реакциях после государственной регистрации лекарственного препарата важны. это позволяет осуществлять непрерывный мониторинг соотношения польза / риск лекарственного препарата. медицинским работникам предлагается сообщать о любых предполагаемых нежелательных реакциях.
Безопасна ли Китруда?
Второе исследование было проведено с участием 411 пациентов, которые имели прогрессирующую меланому и принимали Кейтруду. При этом тяжелые побочные эффекты со стороны кишечника, легких и печени отмечались редко.
Чаще всего у больных возникали такие побочные эффекты, как повышенная утомляемость, кашель, тошнота, сыпь, кожный зуд, снижение аппетита, запор, диарея, боли в суставах (источник).
Информация носит справочный характер. «Евроонко» сотрудничает с израильскими, европейскими и американскими врачами, которые накопили значительный опыт работы с препаратом Кейтруда.
Запись на консультацию круглосуточно
+7+7+78
Исследование KEYNOTE-185
В исследовании KEYNOTE-185 (3 фаза) оценивалась эффективность и безопасность леналидомида в комбинации с низкой дозой дексаметазона с или без пембролизумаба у больных множественной миеломой, у которых невозможна трансплантация аутологичных стволовых клеток.
- Из 301 рандомизированного пациента, 19 умерли в группе пембролизумаба, по сравнению с 9 пациентами из группы контроля (коэффициент рисков, 2.06 (95% CI: 0.93-4.55)).
- Отмечено 22% повышение риска тяжелой токсичности (степень 3-5) в группе пембролизумаба, а также более высокая частота серьезных нежелательных явлений (54% vs. 39%).
- Причинами смерти у больных из группы пембролизумаба, не ассоциированными с прогрессией заболевания, являлись, легочная эмболия, кишечная ишемия, миокардит, сердечная недостаточность, внезапная смерть, пневмония.
Источник:
FDA. Drug Safety and Availability. 31August 2017
Форма выпуска
Концентрат для приготовления раствора для инфузий. Прозрачный или опалесцирующий от бесцветного до светло-желтого цвета раствор.
В 1 флаконе содержится:
действующее вещество: пембролизумаб 100,0 мг;
вспомогательные вещества: L-гистидин 1,2 мг; L-гистидина гидрохлорида моногидрат 6,8 мг; полисорбат – 80 0,8 мг; сахароза 280 мг; вода для инъекций до 4,0 мл.
По 4 мл препарата во флаконе из бесцветного стекла типа I (Евр. Фарм., Фарм. США), укупоренный пробкой из хлорбутилового каучука, обжатый алюминиевым колпачком и защищенный пластиковой крышкой.
Взаимодействие с другими лекарственными препаратами
Специальных исследований фармакокинетического взаимодействия препарата Кейтруда с другими лекарственными препаратами не проводили. Поскольку пембролизумаб выводится из кровообращения за счет катаболизма, то не следует ожидать метаболических лекарственных взаимодействий.
Следует избегать применения системных кортикостероидов или иммуносупрессантов до начала терапии препаратом Кейтруда, учитывая их возможное влияние на фармакодинамическую активность и эффективность препарата Кейтруда. Тем не менее, системные кортикостероиды или другие иммуносупрессанты можно использовать после начала лечения пембролизумабом для терапии иммуноопосредованных нежелательных реакций (см. «Особые указания»).
Побочные эффекты
Со стороны крови и лимфатической системы
: анемия, лимфопения.
Со стороны нервной системы
: головная боль.
Со стороны желудочно-кишечного тракта:
тошнота, диарея, запор, рвота, боль в животе.
Со стороны обмена веществ и питания
: снижение аппетита.
Со стороны дыхательной системы, органов грудной клетки и средостения:
одышка, кашель.
Со стороны кожи и подкожных тканей
: зуд, сыпь, витилиго.
Со стороны скелетно-мышечной и соединительной ткани
: артралгия, боль в спине.
Со стороны лабораторных показателей
: гипокальциемия, гипергликемия, гипонатриемия, гипоальбуминемия, повышение активности щелочной фосфатазы,
гипетриглицеридемия, повышение активности АЛТ, повышение активности ACT, гиперхолестеринемия, снижение концентрации бикарбоната,
Общие расстройства и нарушения в месте введения
: усталость, лихорадка, периферический отек, астения.