Аллергия
Рак шейки матки
Рак матки
Ревматизм
Артрит
10727 18 Ноября
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Белок S100: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
Белок S100 представляет собой вещество (белок), которое присутствует во многих органах (в коже, печени, почках, сердце и др.). Его основная особенность заключается в способности связывать кальций и за счет этого влиять на многие процессы, происходящие в организме. Этот белок необходим для нормальной работы клеток органов и тканей, но самое большое содержание S100 выявлено в клетках головного мозга.
Уровень белка S100 в крови позволяет оценить степень повреждения мозга при инсульте, черепно-мозговой травме и других состояниях, приводящих к неврологическим заболеваниям. Концентрация белка S100 повышается при онкологических заболеваниях. Огромное значение имеет исследование уровня белка S100 для оценки и контроля лечения рака кожи.
Основные сведения
Термином «белок S 100» объединена целая группа кальцийсвязывающих белков с низким молекулярным весом, встречающихся только у позвоночных. Всего их насчитывается около 25. В организме эти белки выполняют множество разнообразных функций и участвуют в самых разных внутри- и внеклеточных процессах, регулируют клеточный цикл и апоптоз и участвуют в процессе развития онкологических заболеваний.
Белки S 100 ткане- и клеточноспецифичны, т.е. секретируются только определенными видами клеток. В нашем случае, повышение продукции подвида белка S 100 (В) провоцируется активностью клеток меланомы. Но кроме этого анализ может дать клинически важную информацию и о ряде других заболеваний: болезнь Альцгеймера, инсульт или другие неврологические патологии. В случае травматического повреждения мозговой ткани, субарахноидального кровотечения, воспалительных процессов данное исследование тоже будет весьма полезно.
Подготовка к процедуре
- Предпочтительно выдержать 4 часа после последнего приема пищи.
- Рекомендуется сдавать кровь утром, в период с 8 до 11 часов, накануне избегать пищевых перегрузок.
- Исключить прием алкоголя накануне исследования.
- Не курить минимально в течение 1 часа до исследования.
- Исключить физические и эмоциональные перегрузки накануне исследования.
- При исследовании концентрации белка S100 в динамике рекомендуется проводить повторные исследования в одной и той же лаборатории.
Функция белка S100
Различные формы белков S100 представляют наиболее универсальные из известных макромолекул, которые участвуют в регуляции практически всех основных мембранных, цитоплазматических и ядерных метаболических процессов, связанных с обеспечением механизмов восприятия и интеграции поступающей в нервную систему информации, принимают участие в ответе генов раннего реагирования, в реализации генетических программ апоптоза и антиапоптозной защиты.
Представители S100 белков демонстрируют выраженную тканеспецифичную и клеточноспецифичную экспрессию. Они вовлечены в различные процессы – сокращение, подвижность, клеточный рост и дифференциация, прогрессия клеточного цикла, транскрипция, клеточная организация мембран и динамика цитоскелета, защита от оксидативного повреждения клетки, фосфорилирование, секреция.
Показано, что S100Β проявляет нейротрофическую активность при физиологической концентрации и нейротоксическую при высокой концентрации.
Экспериментально доказано участие белков группы S100 в регуляции процессов направленного роста отростков нейронов, в завершении нейроонтогенеза как в морфологическом, так и функциональном отношении, в становлении основных форм врожденного поведения, в механизмах памяти и обучения. Многочисленные исследования доказали связь белка S100 с развитием тревожных расстройств.
Референсные значения
В норме концентрация белка S100 в крови менее 0,105 мкг/л. Интерпретация результата проводится с целью комплексной оценки состояния при различных заболеваниях головного мозга, прогноза и контроля лечения при онкологии, а также при воспалительных процессах, например, при ревматоидном артрите.
Существуют несколько разных видов белка S100. Для указания вида белка S100 к названию прибавляют буквенно-цифровое обозначение, например, S100А1. Разные виды белка S100 характерны для различных органов. Определение конкретного вида белка S100 имеет значение в кардиологии, онкологии, при травмах и патологиях головного мозга.
В кардиологии повышенные концентрации таких видов как S100A1, S100A2 и S100A4 позволяют судить об остром повреждении клеток сердца (инфаркте миокарда) и инфекционном эндокардите (поражении сердца, особенно его клапанов, различными бактериями). Уровень S100 используют в дополнение к «классическим» биомаркерам: креатинкиназе (СК), креатинкиназе-МВ (СК-МВ) и тропонину-I.
Исследование группы белков S100 является ценным у пациентов с воспалительными заболеваниями и аллергией. При остром воспалении, как правило, повышаются уровни S100A8, S100A9 и / или S100A12. Эти белки считаются неспецифическими маркерами активации фагоцитов (клеток, уничтожающих бактерии и вирусы), поэтому определение значений S100A8 / A9 и S100A12 с другими маркерами того или иного заболевания повышает диагностическую точность. В таблице представлена связь белка S100 с некоторыми заболеваниями.
| Показатель (белок S100) | Болезни, при которых S100 играет роль дополнительного биомаркера воспаления и аллергии |
| S100В | Витилиго (нарушение пигментации кожи) |
| S100А4 | Связь между воспалением и прогрессированием опухоли Аллергия Сезонный аллергический ринит (аллергический насморк) |
| S100А7 | Псориаз (воспалительное заболевание кожи) |
| S100А8 | Ревматоидный артрит (хроническое воспаление суставов) Болезнь Крона (хроническое заболевание кишечника) Воспаление желудочно-кишечного тракта Воспалительные заболевания легких |
| S100А12 | Болезнь Кавасаки (повреждение мелких сосудов собственной иммунной системой) Воспаление сосудов и атеросклероз |
Представляемый Независимой лабораторией ИНВИТРО тест количественного определения S100 направлен на выявление таких видов белка как S100A1B и S100BB.
Жизнь современного человека неизбежно связана со стрессовыми ситуациями, порождающими целый спектр эмоциональных переживаний. Стресс негативно воздействует на все сферы жизни, препятствуя развитию личности, ухудшая восприятие информации (обучение), принятие адекватных решений и провоцируя негативное поведение человека — курение, злоупотребление алкоголем и т. д. По оценкам Всемирной организации здравоохранения, миллионы людей в мире страдают от связанных со стрессом невротических и соматоформных расстройств, нарушений настроения, в частности, различных видов депрессии. Прогнозируется [1], что к 2030 г. клиническая депрессия станет самым частым заболеванием в мире. Связанные со стрессом расстройства являются также факторами, утяжеляющими течение соматических и неврологических заболеваний (инсульт, деменция, рассеянный склероз, болезнь Паркинсона и эпилепсия) [2].
Наиболее часто применяемыми в медицинской практике лекарственными средствами для коррекции указанных выше нарушений являются психотропные препараты группы транквилизаторов (производные бензодиазепина) и селективные ингибиторы обратного захвата серотонина. Однако они обладают рядом побочных эффектов, ограничивающих их применение в амбулаторной практике, особенно у тех лиц, чья профессия требует быстрой психической и двигательной реакций. Кроме того, при бесконтрольном длительном применении таких препаратов, особенно в высоких дозах, высок риск формирования психической и физической зависимостей [3].
В качестве перспективных препаратов рассматриваются лекарственные средства, активность которых направлена на биохимическую коррекцию нарушений интегративной деятельности мозга. Одним из способов такого воздействия на организм является модуляция активности эндогенных регуляторов функций, например белков S100.
Белки S100 — мультигенное семейство низкомолекулярных гомо- и гетеродимерных Са2+-связывающих белков. Среди более чем 20 представителей этого семейства в центральной нервной системе (ЦНС) доминирующее положение занимает димер S100 В [4, 5]. Это белок синтезируется в основном астроцитами и клетками микроглии, а затем транспортируется в нейроны, где может находиться в растворимой форме или форме, ассоциированной с внутриклеточными мембранами, центромерами, микротрубочками и промежуточными филаментами III типа. Данный белок участвует во многих внутри- и внеклеточных процессах. В частности, показано, что S100B стимулирует дифференцировку и пролиферацию нейронов, стимулирует рост дендритов, влияет на целостность цитоскелета, ингибируя сборку микротубул путем изолирования тубулина и стимуляции чувствительности к Са2+ формирующихся микротубул, а также, ингибируя сборку промежуточных филаментов, увеличивает выживаемость нейронов, участвует в трансдукции Ca2+-сигнала (сопрягая повышающийся уровень внутриклеточного Са2+ и фосфорилирование белков), регулирует энергетический метаболизм клетки [4, 5]. Кроме того, S100B влияет на импульсную активность нейронов за счет модуляции К+-токов: при воздействии белка на нейрон происходит гиперполяризация потенциала покоя, подавляется спонтанная генерация потенциалов действия, изменяется ответ нейрона на стимуляцию от тонического к фазическому, снижается продолжительность потенциала действия, повышается следовая гиперполяризация и уменьшается входное сопротивление клетки [6]. Описанные эффекты способствуют стабилизации импульсной активности нейрона и более дифференцированному ответу на стимуляцию.
Впервые S100 В был обнаружен в цереброспинальной жидкости (ЦСЖ) пациента с диагнозом рассеянный склероз на стадии обострения [7]. Затем его выявили в повышенном количестве в биологических жидкостях (периферическая кровь, ЦСЖ, амниотическая жидкость, слюна) пациентов с другими повреждениями мозга (острый энцефаломиелит, боковой амиотрофический склероз, внутричерепные опухоли и др.). С тех пор белок S100B используют в качестве диагностического маркера различных заболеваний, например, гипоксического повреждения мозга (в частности, ишемии после инсульта) и болезни Альцгеймера [8]. Динамика концентрации S100B при тяжелых поражениях ЦНС у новорожденных в первую неделю жизни позволяет прогнозировать исход заболевания и корректировать терапию [9].
Показано, что уровень S100B в плазме крови повышен при депрессии [10]. Этот факт свидетельствует в пользу гипотезы о вовлеченности нейродегенеративных процессов в патогенез данного заболевания. Накоплено достаточно информации и об участии белков S100 в патогенезе тревоги. Так, трансгенные мыши с увеличенной экспрессией белка S100 демонстрировали повышенную тревожность в тестах «открытое поле» (ОП) и Y-образный лабиринт [11], а мыши, нокаутные по S100, напротив, обладали пониженной тревожностью [12]. Стресс иммобилизации и электрошок вызывали повышение содержания белка S100 в сыворотке крови экспериментальных животных [13], а запах хищника — в ЦСЖ [14]. Представляет интерес также тот факт, что увеличение количества S100B имеет место в крови и моче здоровых людей в результате продолжительной умственной и физической активности со стрессорной нагрузкой [15]. Антитела к белку S100 изменяют активность нейронов гиппокампа и гипоталамуса, вызывая их торможение, и как следствие, снимают мотивационное напряжение, направленное на осуществление алкогольного стереотипа поведения [16].
Из вышеизложенного следует, что белки S100 являются перспективной фармакологической мишенью при поиске веществ для лечения психических и неврологических расстройств, лекарственной зависимости, коррекции нейродегенеративных процессов, а также регуляции работы организма в состоянии стресса.
В настоящее время не существует низкомолекулярных лигандов, с помощью которых можно было бы регулировать активность белков S100. Однако воздействие на функции белка можно осуществить с помощью антител. Это подтверждает существование на современном фармацевтическом рынке таких препаратов, как тенотен, тенотен детский, диваза, бризантин, колофорт и пропротен-100, активным компонентом которых являются релиз-активные формы антител к белку S100 (РА анти-S100). Особенность данных препаратов заключается в том, что, благодаря определенной технологии производства, разведения анти-S100 приобретают так называемую «релиз-активность», благодаря чему препараты способны оказывать модифицирующее воздействие на белок S100 (их эндогенный лиганд).
Основой для появления таких препаратов послужили предварительные ex
vivo
исследования под руководством акад. РАН М.Б. Штарка в «НИИ молекулярной биологии и биофизики», в которых было показано, что РА анти-S100, не оказывая непосредственного влияния на индукцию длительной посттетанической потенциации (ДПТП) в срезах гиппокампа крыс, препятствуют блокирующему действию на ДПТП больших доз антител к S100 [17].
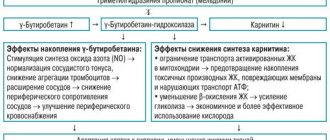
В дальнейшем спектр фармакологической активности РА анти-S100 был установлен в многочисленных экспериментальных и клинических исследованиях. Основные, выявленные в доклинических исследованиях (на клеточном, тканевом и органном уровнях) свойства РА анти-S100, являющиеся наиболее перспективными в терапевтическом отношении, представлены в данном обзоре (см. рисунок).
Экспериментально изученные эффекты РА анти-S100
Доклинические исследования РА анти-S100
Доклинические исследования препаратов, содержащих РА анти-S100, были проведены в соответствии с национальными и международными рекомендациями в ведущих исследовательских центрах России, стран СНГ и за рубежом: «НИИ фармакологии и регенеративной медицины имени Е.Д. Гольдберга» (Томск, Россия), «Институт экспериментальной медицины» (Санкт-Петербург, Россия), «НИИ фармакологии имени В.В. Закусова» (Москва, Россия), «Научный (Новосибирск, Россия), «Научно-исследовательский институт нормальной физиологии имени П.К. Анохина» (Москва, Россия), МГУ им. М.В. Ломоносова (Москва, Россия), Украинский Научно-исследовательский институт клинической и экспериментальной неврологии и психиатрии Министерства охраны здоровья Украины (Харьков, Украина), (Париж, Франция), (Париж, Франция), (Госсели, Бельгия).
Анксиолитическая активность РА анти-S100
Исследования проводили с использованием базисных методов оценки анксиолитического действия: методики конфликтной ситуации в варианте Vogel, приподнятого крестообразного лабиринта (ПКЛ) и теста ОП, которые широко используются в России и за рубежом [18]. Эксперименты осуществляли на беспородных белых крысах-самцах (230—250 г). Активность Р.А. анти-S100 оценивали в сравнении с диазепамом или плацебо (дистиллированная вода, ДВ).
Конфликтная ситуация по Vogel создавалась столкновением питьевой и оборонительной мотиваций, когда каждая попытка взятия животным воды наказывалась электроболевым раздражением. Мерой выраженности анксиолитического эффекта препарата считали увеличение числа наказуемых взятий воды из поилок [18]. Для изучения активности РА анти-S100 в зависимости от индивидуальной реакции на стресс использовали также дополнительные группы животных: перед введением препаратов крыс типировали на высоко- и низкоактивных в тесте вынужденного плавания в сосуде со свободновращающимися колесами по Nomura, в котором моделируется стресс и оценивается астено-депрессивное состояние животных.
РА анти-S100 по выраженности анксиолитического эффекта не уступал диазепаму [19]. При этом у низкоактивных животных, характеризующихся склонностью к тревожно-депрессивному поведению [20], РА анти-S100 превосходил диазепам по эффективности, а у высокоактивных — не уступал диазепаму. Полученные данные свидетельствуют о наличии у РА анти-S100 в дополнение к анксиолитической активности антиастенического, активирующего действия, что отличает его от диазепама, сочетающего анксиолитический эффект с седативным.
Метод ПКЛ основан на страхе открытого пространства и падения с высоты: животных помещают на центральную площадку установки-лабиринта и регистрируют латентный период первого выхода в открытые рукава лабиринта, число полных и неполных выходов и длительность пребывания в них, а также число свешиваний с открытых рукавов [18].
Установлено, что РА анти-S100 и диазепам обладали сходным анксиолитическим эффектом: препараты увеличивали число выходов в открытые рукава (в 1,9 и 2,3 раза соответственно), время, проведенное в открытых рукавах (в 5,4 и 7 раз), а также число свешиваний (в 5 и 9 раз) [20].
Тест ОП широко применяется для исследования особенностей поведения крыс: животных помещают в центр ОП и визуально оценивают горизонтальную и вертикальную активность, выходы в центр ОП, а также количество актов дефекаций и уринаций (эмоциональность).
РА анти-S100 и диазепам проявили выраженную противотревожную активность в ОП, это выражалось, прежде всего, в том, что крысы стали выходить в центр поля, чего не наблюдалось в контрольной группе. При этом, в отличие от диазепама, снижающего горизонтальную активность животных в 1,5 раза, РА анти-S100 не изменял этот показатель и, следовательно, не оказывал седативного действия.
Антистрессорная активность РА анти-S100
Эффективность в отношении соматовегетативных проявлений стресса
В повседневной жизни у здорового человека нередко возникает стресс ожидания боли или других неприятных воздействий. В частности, перед хирургической операцией, в ожидании амбулаторного приема, перед экзаменами, ответственными встречами появляются немотивированная тревога, чувство внутреннего беспокойства, страх. Обозначенные эмоционально-аффективные расстройства, в совокупности с имеющимся дефектом нейровегетативной регуляции висцеральных систем провоцируют развитие дисбаланса вегетативной нервной системы, при котором в патологический процесс вовлекаются все органы и системы организма (сердечно-сосудистая, дыхательная, пищеварительная, мочеполовая, эндокринная и др.). Негативно окрашенные воспоминания человека на фоне измененной вегетативно-висцеральной регуляции, в свою очередь, могут стать пусковым фактором в развитии вегетативной дистонии. Так, например, в ожидании стоматологического приема пациент помнит о болевых ощущениях предыдущего лечения, а появление в комнате ожидания врача в белом халате, звуки и запахи из процедурного кабинета являются дополнительными раздражителями и усиливают стресс ожидания боли. Появившиеся негативные эмоции запускают каскад соматовегетативных проявлений стресса перед непосредственным воздействием болевого раздражителя, в особенности, на фоне конституциональной предрасположенности [21].
Экспериментальное изучение действия РА анти-S100 при стрессе ожидания боли проводили на беспородных белых крысах-самцах (220—280 г) путем моделирования условного эмоционального рефлекса на неизбегаемое электроболевое раздражение с дальнейшей регистрацией как спонтанного поведения животных в стрессорной ситуации (повторное помещение в экспериментальную камеру), так и эмоциональной реакции при усилении стресса дополнительным раздражителем (поднесение к голове животного незнакомого предмета) [22]. Активность Р.А. анти-S100 оценивали в сравнении с диазепамом, вводя препараты через сутки после выработки условного рефлекса.
Крысы контрольной группы при последующем помещении их в опасную камеру реагировали замиранием (45%) или активно пытались выбраться из камеры (35%). Только 20% крыс продемонстрировали спокойное поведение. При этом у животных (особенно с пассивной реакцией) наблюдались соматовегетативные проявления стресса: учащалось дыхание, усиливались уринация и дефекация, появлялся писк. РА анти-S100 и диазепам вызывали снижение числа крыс с пассивной и активной реакцией на стресс и существенно (в 3 раза) увеличивали число животных со спокойной ориентировочно-исследовательской реакцией. Соматовегетативные проявления стресса также нормализовались в обеих группах.
Эмоциональная реакция тревоги и беспокойства, связанная с ожиданием болевого раздражения в условиях опасной камеры, значительно усиливалась при использовании дополнительной провокации — поднесении к голове животного незнакомого предмета. Это проявлялось в увеличении числа крыс с активным (до 40%) или пассивным (до 55%) поведением и уменьшении числа животных со спокойным поведением (до 5%). Нарушение дыхания, писк, дефекация и уринация также повышались. РА анти-S100 и диазепам снижали выраженность стресса ожидания боли. При этом препарат РА анти-S100 одинаково (на 20%) снижал число животных со спонтанной активной и пассивной реакциями, в то время как диазепам более выражено снижал число животных с активными попытками выбраться из камеры (на 30%), чем число животных с замиранием (всего на 10%). Такая же тенденция сохранялась и при дополнительной негативной провокации, что может быть связано с наличием у диазепама седативного эффекта и отсутствием такого действия у РА анти-S100, а также с более выраженной, чем у диазепама, эффективностью РА анти-S100 у животных, более чувствительных к стрессу.
Экспрессия белка c-Fos
Известно, что в условиях эмоционального напряжения экспрессия раннего гена с-fos
в паравентрикулярных ядрах гипоталамуса является одним из первичных звеньев, отражающих активацию ЦНС и характеризующих устойчивость животных к стрессорной нагрузке [23]. Эффективность стресспротективных соединений можно оценить по их способности подавлять стрессиндуцированную экспрессию раннего гена
с-fos
в данной структуре.
Исследование было проведено на крысах-самцах линии Вистар (250—280 г), разделенных на активных и пассивных в тесте О.П. Ранее было показано, что активные животные в популяционном плане прогностически устойчивы к стрессу, пассивные — предрасположены к нему [20].
Крысам вводили РА анти-S100, имипрамин (препарат, подавляющий экспрессию раннего гена c-fos
) или ДВ и далее подвергали одночасовой иммобилизации с одновременным электрокожным раздражением [24]. Экспрессию белка
с-Fos
в нейронах парвоцеллюлярной части паравентрикулярных ядер гипоталамуса мозга животных выявляли непрямым гистохимическим методом через 90 мин после проведенных процедур — на пике экспрессии
с-Fos
.
В ответ на стресс экспрессия белка c-Fos
статистически значимо повышалась и у активных, и у пассивных животных (в 20—25 раз), причем у последних это повышение было более выражено. РА анти-S100 и имипрамин проявили одинаково выраженную антистрессорную активность в отношении пассивных животных: наблюдалось снижение числа Fos-позитивных клеток в 1,2 и 1,5 раза, соответственно.
Язвообразование при стрессе иммобилизации
Еще одним важным показателем развития стрессорного ответа организма и выраженности деструктивных процессов является язвообразование на слизистой оболочке желудка. Известно, что иммобилизационная стрессорная нагрузка сопровождается выраженным язвообразованием слизистой оболочки желудка, а также морфо-функциональными изменениями органов, участвующих в развитии стресса: гипертрофией надпочечников и инволюцией тимуса [25].
Исследование антистрессорной активности РА анти-S100 было проведено на крысах-самцах линии Вистар (250—280 г), разделенных на активных и пассивных в тесте О.П. Животным вводили РА анти-S100 или ДВ [24]. Через 24 ч половину крыс из каждой группы фиксировали за лапы на специальной платформе в течение 1 ч и далее подсчитывали количество образовавшихся в желудке язв.
В группе пассивных животных наблюдалось на 72,7% язв больше, чем в группе активных крыс, что подтверждает их более высокую чувствительность к стрессу. Препарат Р.А. анти-S100 уменьшал число животных с язвами и общее количество язв в группе пассивных (но не активных) крыс, что дополняет ранее полученные результаты по более высокой эффективности препарата у пассивных, высокочувствительных к стрессу животных [26].
Таким образом, можно сделать вывод о защитном действии РА анти-S100 в отношении стрессиндуцированного язвообразования на слизистой оболочке желудка.
Антидепрессивная активность РА анти-S100
Антидепрессивная активность РА анти-S100 была изучена в тесте поведенческого отчаяния (беспомощности)по Porsolt и вынужденного плавания в сосуде с колесами по Nomura на беспородных белых крысах-самцах (250—300 г) [27]. Активность Р.А. анти-S100 оценивали в сравнении с амитриптилином.
В тесте поведенческого отчаяния (беспомощности) по Porsolt животных помещали в сосуд с водой. Крысы начинали проявлять бурную двигательную активность, направленную на поиск выхода из аверсивной (неприятной) ситуации, но затем зависали в воде, оставаясь полностью неподвижными или совершая незначительные движения, необходимые для поддержания морды над водой. Длительность иммобилизации является показателем депрессивного состояния. Препарат Р.А. анти-S100 проявил антидепрессивное действие, сравнимое с амитриптилином: время иммобилизации уменьшалось в 1,6 и 1,8 раза соответственно [27].
В тесте вынужденного плавания по Nomura животных помещали в сосуд с колесами, заполненный водой. Регистрировали число оборотов колес за 10 мин. Препарат Р.А. анти-S100 и амитриптилин статистически значимо уменьшали проявления депрессивного состояния (оба препарата повышали число оборотов колеса в 1,8 раза) [27].
Антиагрессивная активность РА анти-S100
Данный вид активности РА анти-S100 изучали в условиях немотивированной и мотивированной агрессии на беспородных половозрелых белых крысах-самцах (200—250 г) в сравнении с диазепамом, вводя препараты однократно или в течение 4 дней перед тестированием [28].
В тесте немотивированной агрессии, основанном на изучении порога агрессивной реакции пары животных на электродном полу при усилении стимулирующего тока, агрессивной реакцией считали такое поведение крыс, при котором животные вставали на задние лапы мордами друг к другу (стойка боксеров) и старались наносить удары передними конечностями и укусить друг друга.
РА анти-S100 и диазепам при однократном и (в еще большей степени) курсовом введении повышали порог агрессивной реакции; по эффективности препарат РА анти-S100 не уступал диазепаму. Так, после однократного введения РА анти-S100 оцениваемый показатель повышался на 23,1%, а после 4-дневного — на 34,9% по сравнению с контролем, в то время как диазепам повышал пороги агрессивной реакции на 26,3 и 31,3% соответственно [28].
Метод мотивированной агрессии основан на изучении интенсивности агрессивной реакции, вызванной у пары крыс стремлением избежать электроболевого наказания на небольшой платформе. Критерием эффективности веществ с антиагрессивным действием по данному тесту является длительность совместного нахождения в тесных, но безопасных условиях.
У крыс вырабатывали условный рефлекс избегания электроболевого раздражения лап на безопасной скамейке, установленной в центре камеры с электродным полом, а затем сажали в камеру парами и наблюдали за их поведением в течение 2 мин. Контрольные животные начинали драться за безопасную скамейку, размеры которой позволяли разместиться на ней двум особям. Критерием эффективности веществ с антиагрессивным действием по данному тесту служила длительность совместного избегания болевого воздействия.
РА анти-S100 и диазепам оказывали выраженное антиагрессивное действие, увеличивая длительность совместного избегания: при однократном введении соответственно в 3,4 и 3,1 раза, а при курсовом — в 3,8 и 3,3 раза [28].
Ноотропная (антиамнестическая, нейропротективная) активность РА анти-S100
Наличие у РА анти-S100 способности улучшать когнитивные функции нашло подтверждение в экспериментальных исследованиях эффективности препарата на моделях таких широко распространенных патологий, как геморрагический и ишемический инсульт, рассеянный склероз, болезнь Альцгеймера, синдром дефицита внимания и гиперактивности. Кроме того, наличие у РА анти-S100 антиамнестической активности показали на модели амнезии в условиях нарушения процесса выработки условного рефлекса или при его формировании с использованием субоптимального подкрепления.
Геморрагический инсульт
— является жизненно-угрожающей сосудистой катастрофой. Клиническим отображением возникшего в тканях мозга кровоизлияния служит развитие психоневрологического дефицита: от легкой до тяжелой степени выраженности с когнитивным, эмоционально-волевым, речевым, двигательным и сенсорными дефектами. Лечение геморрагического инсульта на первом этапе включает комплекс реанимационных мероприятий, направленных в первую очередь на поддержание работы витальных центров головного мозга. В дальнейшем основной целью проводимой терапии является восстановление утраченных функций ЦНС. С этой целью используются препараты нейропротективного, антиоксидантного, ноотропного действия [29].
Геморрагический инсульт моделировали у беспородных крыс-самцов (200—250 г) [30]. Активность Р.А. анти-S100 оценивали в сравнении с нимодипином, вводя препараты однократно до операции по моделированию патологии и затем в течение 14 дней. Изучали выживаемость животных, действие веществ на вызванный геморрагическим инсультом неврологический дефицит по шкале McGrow, нарушения когнитивных функций в тесте выработки условного рефлекса пассивного избегания (УРПИ), эмоциональный статус в тестах ПКЛ и ОП, нарушение координации движений в тесте вращающегося стержня [31].
В контрольной группе (без введения препаратов) к 14-м суткам наблюдалась 50% смертность, развитие неврологического дефицита у 60% выживших крыс, а также снижение мышечного тонуса в 50% случаев и амнезия (уменьшение в 2 раза латентного времени УРПИ). Препарат Р.А. анти-S100 предотвращал гибель животных, приводил к уменьшению доли крыс с неврологическим дефицитом и сниженным мышечным тонусом, а также оказывал антиамнестическое и анксиолитическое действие [30]. Нимодипин не влиял на выживаемость животных после геморрагического инсульта и проявлял сходное с РА анти-S100 влияние на неврологический дефицит и мышечный тонус при значительно менее выраженных антиамнестическом и анксиолитическом эффектах [30].
Ишемические инсульты
составляют 70—85% от всех случаев инсульта, и соотношение частоты ишемических и геморрагических типов инсульта составляет 4:1 [32].
Противоишемическое действие РА анти-S100 исследовали на модели локального фотохимического повреждения префронтальной коры головного мозга животных в модификации И.В. Викторова [33]. Такая модель позволяет получить нарушения памяти и способности к обучению без расстройств двигательной координации и мышечного тонуса и широко используется для оценки действия противоишемических веществ.
Эксперимент проводили на беспородных белых крысах-самцах (180—200 г). Активность Р.А. анти-S100 оценивали в сравнении с пирацетамом, кавинтоном или 0,9% NaCl, вводя препараты в течение 9 дней после моделирования фототромбоза. Затем оценивали влияние препаратов на патоморфологические изменения коры головного мозга, поведенческие реакции животных в ОП и воспроизведение выработанного до операции УРПИ.
Препарат РА анти-S100 полностью устранял амнезию, вызванную ишемическим инсультом, и превосходил по эффективности пирацетам и кавинтон. При этом было показано положительное нейропротективное влияние РА анти-S100 на ткань мозга: препарат восстанавливал нарушения как в зоне некроза, так и в перифокальной зоне [33].
Депривация глюкозы и кислорода
Современные in vitro
модели ишемии головного мозга включают модели создания гипоксии клеток мозга (модели с депривацией кислорода), модели с депривацией кислорода и одновременного создания других условий (депривация кислорода и глюкозы, депривация кислорода/глюкозы и создание метаболических условий ишемии), а также модели глутаматной эксайтотоксичности и окислительного стресса [34]. При этом для поиска веществ, обладающих нейропротективными свойствами, в качестве объекта исследования часто используют перевиваемые культуры нейробластомы — клетки, у которых есть все важные свойства, типичные для нейронов: они электрически и химически возбудимы, имеют ионные каналы и рецепторы, обладают ферментативным аппаратом для синтеза медиаторов, а также системой, необходимой для их инактивации, образуют отростки, подобные нервным волокнам [35].
Эксперимент проводили на клетках нейробластомы опухоли мыши (С 1300), которые помещали в среду с РА анти-S100 или с ДВ без глюкозы, предварительно аэрированную бескислородной газовой смесью (95% N2 и 5% СO2) на 20 ч [36]. Контрольные культуры находились в СО2-инкубаторе в стандартной среде, содержавшей глюкозу. Препараты тестировали по трем схемам: 1) вносили их в культуральную среду одновременно с клетками; 2) за 20 ч до гипоксического воздействия, перенося далее клетки в среду без препарата; 3) за 20 ч до гипоксического воздействия и на всем его протяжении. Нейропротективную активность РА анти-S100 оценивали по числу выживших клеток.
Во всех вариантах тестирования эффективность препарата РА анти-S100 превышала значение в контроле (15%), составив соответственно 27, 32 и 35% [36].
Рассеянный склероз
Данная патология относится к группе неврологических заболеваний, характеризующихся развитием тяжелых прогрессирующих органических поражений в ЦНС и периферической нервной системе, патофизиологическую основу которых составляет разрушение миелиновой оболочки.
Наиболее адекватной моделью рассеянного склероза является экспериментальный аллергический энцефаломиелит (ЭАЭ), вызываемый введением гомогената спинного мозга [37]. В этой модели, как и при рассеянном склерозе, осуществляется иммунный ответ на все компоненты миелина: индуцируется воспаление с последующей демиелинизацией, дегенерацией аксонов, а затем самих нервных клеток. Проявляется патологическая цепь событий с развитием парезов, параличей и других симптомов болезни.
ЭАЭ моделировали на крысах-самках линии Вистар (200—220 г) путем введения гомогената гомологичного спинного мозга с полным адъювантом Фрейнда в основание хвоста [38]. Активность Р.А. анти-S100 оценивали в сравнении с глатирамера ацетатом (копаксон) и ДВ, вводя препараты в течение 30 дней после индукции патологии.
РА анти-S100 и копаксон одинаково (в 2 раза) увеличивали выживаемость животных. Оба препарата снижали тяжесть заболевания, что выражалось в уменьшении суммарного балла за все исследование и максимального балла на пике исследования. Копаксон преимущественно влиял на крыс с легкой формой ЭАЭ, снижая их число в 4 раза по сравнению с контролем, тогда как РА анти-S100 — на животных с тяжелой формой ЭАЭ, снижая их число в 7 раз по сравнению с контролем [38].
Болезнь Альцгеймера
представляет собой медленно прогрессирующее дегенеративное заболевание ЦНС. Ведущей причиной развития болезни Альцгеймера в настоящее время считают накопление в клетках головного мозга патологического белка бета-амилоида, приводящее к потере нейронов и синаптических связей в коре головного мозга и некоторых подкорковых областях, в результате чего возникает широкий спектр психоневрологических проявлений. На первый план выступают когнитивные и эмоционально-личностные нарушения, приобретающие более грубый характер по мере прогрессирования заболевания. Поэтому для коррекции мнестических и эмоциональных нарушений у пациентов с болезнью Альцгеймера часто используют ноотропные, нейропротективные, антиокидантные и анксиолитические препараты [39].
Заболевание моделировали на беспородных белых крысах-самцах (230—250 г) путем введения М-холиноблокатора скополамина — воспроизводили холинергический дефицит, который возникает при старении и является одним из основных патогенетических механизмов развития болезни Альцгеймера. Далее в течение 10 дней животным вводили РА анти-S100 или ДВ, после чего оценивали когнитивные функции (динамика обучения в тесте формирования УРАИ), неврологический статус по шкале McGrow, мышечный тонус (подтягивание на проволоке), координацию движений (тест вращающегося стержня) и анксиогенез (ПКЛ) [19].
Курсовое введение РА анти-S100 приводило к восстановлению способности к обучению УРАИ; уменьшало долю животных со сниженным мышечным тонусом (в 1,5—2 раза) и птозом. Препарат оказывал анксиолитическое действие в ПКЛ (в 5 раз увеличивал время, проведенное в открытых рукавах) и повышал двигательную активность [40].
Синдром дефицита внимания и гиперактивности
(СДВГ) — неврологическо-поведенческое расстройство, начинающееся в детском возрасте [41]. В основе формирования СДВГ лежат нейробиологические факторы: генетические механизмы и раннее органическое повреждение ЦНС. Именно они определяют нарушения высших психических функций (память, внимание, речь, праксис и поведение), соответствующие клинической картине СДВГ. Применение ноотропных препаратов при СДВГ является патогенетически обоснованным. Ноотропы оказывают стимулирующее действие на недостаточно сформированные высшие психические функции, а также положительно влияют на обменные процессы в ЦНС и способствуют созреванию тормозных и регуляторных систем мозга.
Эксперименты проводили на беспородных белых крысах (возраст 30—35 дней, соответствующий 4,8—10,5 года жизни человека), среди которых с помощью теста ОП были отобраны животные с повышенной двигательной активностью, и далее, с использованием тест-стимулов и показателей шкалы Brady, Nauta, выбраны крысы с импульсивным неадекватным поведением [42]. Активность Р.А. анти-S100 оценивали в сравнении с фенибутом и ДВ, вводя препараты в течение 7 дней до тестирования.
Препарат РА анти-S100 обладал выраженной способностью улучшать обучение УРПИ и уменьшать гиперактивность животных, что выражалось в увеличении по сравнению с контролем латентного времени захода в темную камеру в 3,4 раза и уменьшении числа перемещений между освещенной платформой и темной камерой в 3 раза. По влиянию на обучение РА анти-S100 превосходил фенибут [42].
Амнезия в условиях нарушения процесса выработки условного рефлекса или при его формировании с использованием субоптимального подкрепления
Мнемотропную активность РА анти-S100 изучали также в условиях нарушения формирования УРПИ и при незавершенном процессе его выработки [42]. Для этого белым беспородным крысам (возраст 30—35 дней) в течение 10 дней вводили РА анти-S100, пирацетам или Д.В. Затем делали инъекцию скополамина и обучали УРПИ, либо только обучали УРПИ с использованием субоптимального подкрепления — в режиме, при котором наблюдалась недостаточная выработка рефлекса. Через сутки после обучения УРПИ оценивали сохранность мнестических процессов.
На обеих моделях был отмечен положительный мнемотропный эффект тестируемых препаратов. Так, в первом случае РА анти-S100 и пирацетам увеличивали латентный период захода в камеру, где ранее наносилось электроболевое раздражение, соответственно в 8,6 и 8,9 раза; во втором — показатели превышали значение в контроле в 4 и 2 раза.
Превентивная и терапевтическая активность РА анти-S100 в условиях формирования патологической зависимости и абстиненции
Возникновение патологического влечения к алкоголю связывают с нарушением деятельности некоторых структур ствола мозга и лимбической системы, где находится так называемая «система подкрепления». Хроническая алкогольная интоксикация ассоциируется с патологическими изменениями деятельности кальциевых, калиевых и натриевых каналов. Этим объясняются грубые нарушения функционирования мозга, особенно резко проявляющиеся в первые дни после прекращения злоупотребления спиртными напитками. Хроническая алкоголизация приводит также к дисбалансу нейромедиаторных систем (ГАМК-, глутамат-, дофамин-, серотонинергической, опиои
Что за тест анти-RBD и что он показывает?
В настоящее время известно, что оболочка каждого вируса SARS-CoV-2 состоит из 4 структурных белков: S белок (spike), или белок-шип; N белок, или нуклеокапсидный белок: М белок, или мембранный белок и Е белок оболочки. S белок (spike) или белок-шип. Именно он придает вирусу узнаваемый вид «вируса с короной». Одним из свойств S белка, точнее его рецептор-связывающего домена (RBD) является способность объединять оболочку (мембрану) вируса с клеткой человека, тем самым обеспечивая проникновение в клетку и дальнейшее заражение организма. В ответ на заражение организм начинает реагировать выработкой антител различных классов. Именно их обнаружение позволяет установить факт инфицирования даже у бессимптомных пациентов. IgG начинают выявляться в среднем на 3-й неделе заболевания, перемещаясь по сосудистому руслу пациентов длительно время. При лабораторном тестировании возможно определение IgG к различным белкам вируса. Наличие антител класса IgG к нуклеокапсидному белку является показателем перенесенной инфекции.
Выявление IgG к рецептору связывающего домена (RDB) – позволяет судить о наличии защитного иммунитета, который мог сформироваться после перенесенного заболевания, так и после вакцинации. Антитела к рецептору связывающего домена S белка обладают нейтрализующими свойствами и препятствуют связыванию вируса с клетками человека, тем самым обеспечивая важную роль в определении индивидуального протективного (защитного) иммунного ответа к SARS-CoV-2.
Особенности подготовки и проведение анализа
Подготовка к процедуре исключает прием пищи в последние двенадцать часов, а вот воду необходимо пить.
Чтобы определить мозгоспецифический белок, отбирается венозная кровь с локтевого сгиба (3—5 мл), утром натощак методом пункции. Проба отправляется в пробирке на электрохемилюминесцентный иммуноанализ. От пациента требуется правильно подготовиться:
- Последний раз поесть за 4—6 часов, идеально — за 8—12.
- Перед анализом пить только воду (очищенную, без газа).
- За 4 суток исключить тренировки.
- За 30 минут до забора пробы не нервничать, не курить.
Отобранный биоматериал подвергается центрифугированию в условиях лаборатории, что провела забор пробы. Этот этап необходим для удаления факторов свертывания. Онкомаркер S100 рассчитывается по уровню свечения при реакции помеченных ферментом антител с хемилюминесцентным субстратом. Анализ проводится несколько часов, а ответ выдается обычно через сутки, не включая день взятия биоматериала, в единицах измерения — мкг/л (микрограмм на литр).