Фармакологическое действие
Соматотропный гормон.
Стимулирует скелетный и соматический рост, а также оказывает выраженное влияние на метаболические процессы. Стимулирует рост костей скелета, воздействуя на пластинки эпифиза трубчатых костей, костный метаболизм у детей. Способствует нормализации структуры тела посредством увеличения мышечной массы и снижения жировой массы тела. У больных с дефицитом гормона роста и остеопорозом заместительная терапия приводит к нормализации минерального состава и плотности костей. Увеличивает число и размер клеток мышц, печени, вилочковой железы, половых желез, надпочечников, щитовидной железы. Стимулирует транспорт аминокислот в клетку и синтез белков, снижает концентрацию холестерина, воздействуя на профиль липидов и липопротеидов. Подавляет высвобождение инсулина. Способствует задержке натрия, калия и фосфора. Увеличивает массу тела, мышечную активность и физическую выносливость.
Синдром Шерешевского—Тернера (СШТ) — хромосомная болезнь, в основе которой лежит полная либо частичная Х-моносомия, представленная во всех клетках или в мозаичном варианте. К основным клиническим признакам СШТ относятся аномалии физического развития, низкорослость и половой инфантилизм [1—3].
Нарушение роста наблюдается в 95% случаев СШТ и проявляется сниженными массо-ростовыми показателями при рождении, низкими темпами роста и отсутствием ростового скачка в подростковом возрасте [4—6]. Средний конечный рост при СШТ варьирует в различных популяциях от 140 до 147 см [5, 7].
Низкий рост становится зачастую серьезной психологической проблемой и причиной социальной дезадаптации [8]. Разработка генно-инженерного метода получения рекомбинантного гормона роста (р-ГР) произвела настоящую революцию в лечении детей с различными вариантами низкорослости. Появилась возможность, в частности, увеличить скорость роста у детей с СШТ и тем самым значительно улучшить ростовой прогноз.
Оценить эффективность и безопасность двухлетнего лечения девочек с СШТ отечественным генно-инженерным препаратом гормона роста (соматотропина) Растан явилось целью данной работы.
Материал и методы
Под наблюдением находились 29 девочек с подтвержденным путем кариотипирования диагнозом СШТ.
Хронологический возраст при постановке диагноза составлял 7,9±1,2 года (0÷13,1 года), на момент начала терапии — 9,8±1,6 года (5,0÷15,1 года). Костный возраст соответствовал 7,5±1,1 года (4÷11 лет).
Рост пациентов измеряли с использованием механического ростомера Харпендера (Harpender stadiometer, Holstan Ltd, Crymych, Dyfed, UK) с точностью до 0,1 см. Массу тела измеряли с помощью напольных электронных весов. Показатели роста оценивали в SDS.
SDS роста и скорости роста для детей с СШТ был рассчитан дважды: по перцентильным таблицам для здоровых детей [9] и для детей с СШТ [10]. Стадию полового развития определяли согласно классификации J. Tanner [11]. Степень дифференцирования костного скелета оценивали по нормам, разработанным W. Greulich, S. Pule [12].
Все обследованные пациентки в качестве стимулирующей рост терапии получали р-ГР Растан (ОАО «Фармстандарт-УфаВИТА») в виде лиофилизата 1,33 мг для приготовления раствора для подкожного введения. Штамм и технология получения соматотропина разработаны в Институте биоорганической химии РАН под руководством академика РАН А.И. Мирошникова. р-ГР назначали в дозе 0,05 мг/кг массы тела ежедневно подкожно вечером (20.00—22.00 ч). Длительность лечения составила 24 мес.
В качестве критериев оценки эффективности препарата использовали динамику роста, SDS роста, годовой скорости роста и SDS скорости роста в период терапии.
Статистическую обработку полученных данных проводили на персональном компьютере с использованием программ Statistica for Windows, версия 5.5 и Microsoft Excel (2002). Данные представлены в виде среднее ± стандартное отклонение (min÷max). Статистически значимыми считали различия при р<0,05.
Результаты
Нарушение роста и физического развития было выявлено у всех пациенток с СШТ. Средний SDS роста по сравнению со здоровой популяцией составлял –3,0±1,1, а средний SDS роста, рассчитанный для больных с СШТ, составлял –0,99±0,8. Характеристика пациенток с СШТ представлена в табл. 1.
Средняя величина SDS роста родителей составляла 0,3±0,1 и не отличалась от таковой в здоровой популяции.
Среди сопутствующих заболеваний у 9 девочек был выявлен сколиоз, у 12 — патология сердечно-сосудистой системы, у 8 — патология почек. Однако степень тяжести указанных состояний вряд ли могла значимо влиять на рост.
Средний уровень глюкозы плазмы крови натощак составлял 4,5±0,6 ммоль/л, средний уровень гликированного гемоглобина HbA1c — 5,4%, что не выходило за пределы нормы.
У 27 девочек зарегистрирована первая стадия пубертатного периода по Таннеру, у 2 больных — вторая. При оценке состояния и функции щитовидной железы у 2 девочек выявлен аутоиммунный тиреоидит со снижением тиреоидной функции, по поводу чего назначалась терапия левотироксином натрия, доза которого варьировала от 50 до 100 мкг и корректировалась в зависимости от концентрации ТТГ и свободного тироксина в сыворотке крови. До начала терапии р-ГР только одна девочка получала заместительную терапию микрофоллином (в дозе 1/8 таблетки в сутки). У другой девочки выявлено спонтанное половое развитие (стадия развития молочных желез B2 по Таннеру), в возрасте 12 лет через 6 мес лечения р-ГР. Результаты лечения р-ГР больных с СШТ представлены в табл. 2.
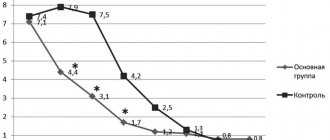
До начала лечения р-ГР рост девочек с СШТ увеличивался в среднем на 4,2±0,6 см/год. Средняя скорость роста в первый год лечения составила 8,7±0,6 см/год, на втором году лечения — 6,2±1,2 см/год. За 2 года терапии р-ГР девочки прибавили в росте в среднем 14,9 см.
Увеличение SDS роста было достоверным через 12 мес (р=0,002) и 24 мес (р=0,003) лечения р-ГР. Всего за 2 года рост девочек в среднем увеличился на 0,84 SD.
Показатели SDS скорости роста также достоверно увеличивались через 12 мес (р=0,001) и 24 мес (р=0,004) лечения р-ГР.
За 2 года терапии показатели гликемии не выходили за границы нормы, средний уровень HbA1c у пациенток с СШТ через 2 года лечения р-ГР составил 5,8%.
Обсуждение
Низкорослость является характерным признаком СШТ и формируется в результате сниженных темпов роста в детском и подростковом периоде [7]. Результаты многочисленных исследований [4, 6], проведенных во многих странах, свидетельствуют о том, что у девочек с СШТ, не получавших никакой стимулирующей рост терапии, конечный рост тела на 20 см ниже среднепопуляционного роста девочек.
В последние десятилетия доказано, что ведущую роль в патогенезе низкорослости при СШТ имеют непосредственные генетические нарушения, обусловленные делецией гена SHOX, находящегося на Х-хромосоме [13], приводя к нарушению спонтанной секреции гормона роста (ГР), нечувствительности к ГР и нарушениям в системе ГР/инсулиноподобный фактор роста 1-го типа.
Отставание в росте обследуемых нами 29 девочек с СШТ было значительным. Однако при сравнении с популяцией девочек с СШТ оказалось, что отставание в росте у этих девочек немного больше, чем в среднем характерно для стандартов данного синдрома (SDS 0,99±0,37).
В настоящее время наиболее эффективным средством лечения низкорослости у больных с СШТ являются препараты р-ГР, назначаемые на длительный период. Во многих странах в рамках научных программ изучаются потенциальные возможности р-ГР (одного или в комбинации с половыми гормонами) для лечения больных с СШТ с целью ускорить рост в детстве и увеличить показатели конечного роста [14—16].
Терапия р-ГР в детском возрасте у девочек с СШТ не является заместительной, однако может оказывать положительное воздействие [17].
Общепринятым считается лечение пациенток с СШТ р-ГР в дозе 0,375 мг/кг/нед или 0,05 мг/кг/сут, что на 50% превышает стандартную дозу, используемую у детей с соматотропной недостаточностью.
Проведенное нами лечение девочек с СШТ р-ГР в дозе 0,05 мг/кг/сут, несомненно, дало положительные результаты. Если до лечения девочки вырастали в среднем около 4 см в год, то во время терапии за 1-й год пациентки прибавили в росте в среднем 8,7 см (+0,5 SD), за второй год 6,0 см (+0,34 SD).
В других исследованиях, в которых изучалась зависимость ростового эффекта от дозы р-ГР, была подтверждена большая эффективность высоких доз. Есть сообщения о значительной прибавке роста (10,6 см) у 12 девочек с СШТ, получавших лечение р-ГР по схеме со ступенчатым повышением дозы. Такая схема подразумевала применение р-ГР в начальной дозе 0,7 ед/кг/нед с повышением до 1,4 ед/кг/нед, а затем — до 2,1 ед/кг/нед каждые 6 мес, что позволяло постоянно поддерживать скорость роста, в 2 раза превышавшую таковую до начала терапии. В то же время прибавка роста у 17 девочек с СШТ, получавших фиксированную стандартную дозу 0,9 ед/кг/нед, составила только 5,2 см.
По результатам одного из долгосрочных исследований (Dutch study), в котором р-ГР в дозах от 0,045, 0,067 и 0,089 мг/кг/сут вводили ежедневно в течение 7 лет, показано, что самые высокие дозы и наиболее длительное лечение приводило к увеличению конечного роста от 159,1, 161,8 и 167,2 см соответственно, а максимальные дозы р-ГР обеспечивали и наиболее выраженную прибавку роста (16 см против 12,5 см) [18].
Конечная прибавка роста, определяемая как разница между конечным ростом и прогнозируемым до начала терапии, после лечения дозами р-ГР (0,05 мг/кг/сут) варьировала у различных авторов от 3,1 до 21,4 см [15, 19—27]. При этом необходимо отметить, что важной характерной чертой всех указанных исследований стали значительные индивидуальные колебания достигнутого конечного роста. В нашем исследовании девочки в среднем прибавили в росте в среднем 14,7 см за 2 года терапии р-ГР, что соответствует 0,84 SD, однако конечного роста пока никто не достиг. В более ранних исследованиях, проведенных в ЭНЦ (Н.Н. Волеводз, 2005), конечный рост пациенток с СШТ, получавших лечение р-ГР, не достиг социально приемлемого уровня, а рост 3 пациенток, завершивших лечение, составил всего 139,1, 140,5 и 144,9 см [1]. Данное обстоятельство было связано с поздним назначением р-ГР (в среднем в 12 лет) и коротким периодом лечения (в среднем 12 мес), что не позволило им достичь социально приемлемого роста.
Аналогичные данные получены в Национальном кооперативном исследовании роста (NCGS). В нем указывается, что возрастной пик назначения р-ГР приходится на 10—12 лет. Таким образом, начатое с запозданием лечение не позволяет, к сожалению, в полной мере проявить р-ГР свое терапевтическое действие и помочь большинству этих детей достичь роста 150 см [17].
В настоящее время имеются результаты применения р-ГР у маленьких детей с СШТ. M. Davenport и соавт. [28] наблюдали 88 девочек с СШТ в возрасте от 9 мес до 4 лет, из которых 45 в течение 2 лет получали лечение р-ГР в дозе 0,05 мг/кг/сут, а 43 находились в группе контроля и терапии не получали. Рост детей к началу лечения составлял –1,4 и –1,8 SDS соответственно. К концу 2-го года наблюдения показатели роста в группе лечения соответствовали –0,3 SDS (+1,1 SDS), а в группе контроля –2,2 SDS (–0,5 SDS). Следовательно, у девочек, не получавших лечение р-ГР, через 2 года ухудшились показатели роста, в то время как дефицит роста у девочек на фоне лечения уменьшился.
Таким образом, результаты многочисленных исследований [29, 30] и проведенного множественного регрессионного анализа показали, что важным прогностическим показателем эффективности лечения девочек с СШТ считается скорость роста в 1-й год терапии. Помимо этого, среди факторов, положительно влияющих на результаты терапии р-ГР, относят дозу и частоту инъекций, время индукции пубертатного периода и дозу используемых эстрогенов. Выявлена зависимость степени увеличения конечного роста от длительности лечения.
При оценке безопасности терапии р-ГР Растан нами не было отмечено ни одного случая серьезных нежелательных явлений, которые привели бы к прекращению применения препарата, а также неожиданных, не характерных для соматотропина. В настоящее время во многих публикациях высказываются опасения, что лечение р-ГР может увеличить риск развития ряда свойственных СШТ осложнений, таких как нарушение толерантности к углеводам, костно-суставные изменения, дислипидемия и сердечно-сосудистые заболевания. Данные исследования KIGS подтверждают, что при СШТ частота побочных эффектов выше, чем при идиопатическом дефиците ГР (148 на 1000 лет лечения по сравнению с 89/1000 лет лечения). При СШТ чаще выявляли сахарный диабет 1-го и 2-го типа, сколиоз и эпифизиолиз бедренной кости, а по частоте головных болей и внутричерепной гипертензии пациентки с СШТ уступали только больным с краниофарингиомой. Однако все эти осложнения сами по себе свойственны СШТ, и могут отчасти рассматриваться как сопутствующие заболевания.
Выводы
1. Лечение девочек с СШТ генно-инженерным препаратом соматотропина Растан позволяет добиться повышения темпов роста. За 1-й год лечения прибавка в росте составила 8,7 см, за 2-й год — 6,0 см (средняя прибавка за 2 года лечения 14,7 см).
2. За исследуемый период времени использования препарата р-ГР Растан не зарегистрировано каких-либо нежелательных явлений, что свидетельствует о его безопасности в детском возрасте.
Способы применения и дозы
Растан вводят подкожно, медленно, 1 раз в сутки, обычно на ночь. Следует менять места инъекций для профилактики развития липоатрофии.
Растворять содержимое флакона рекомендуется в 1 мл прилагаемого растворителя, исходя из рассчитанной дозы. Для этого отбирают растворитель шприцем и вводят во флакон с препаратом через пробку. Осторожно покачивают до полного растворения содержимого флакона. Резкое встряхивание при этом недопустимо. Приготовленный раствор хранится во флаконе не более двух недель при температуре от 2 ºС до 8 ºС.
Дозы подбирают индивидуально с учетом выраженности дефицита гормона роста, массы или площади поверхности тела, эффективности в процессе терапии.
У детей при недостаточной секреции гормона роста рекомендуется доза 25-35 мкг/кг/сут. (0,07-0,1 МЕ/кг/сут.), что соответствует 0,7-1 мг/м2/сут (2-3 МЕ/м²/сут.). Лечение начинают как можно в более раннем возрасте и продолжают до полового созревания и/или до закрытия зон роста костей. Возможно прекращение лечения при достижении желаемого результата.
При синдроме Шерешевского-Тернера, при хронической почечной недостаточности у детей, сопровождающейся задержкой роста, рекомендуется доза 45-50 мкг/кг/сут. (0,14 МЕ/кг), что соответствует 1,4 мг/м2/сут (4,3 МЕ/м²/сут). При недостаточной динамике роста может потребоваться коррекция дозы.
При дефиците гормона роста у взрослых начальная доза составляет 0,15-0,3 мг/сут. (что соответствует 0,45-0,9 МЕ/сут.) с последующим ее увеличением, в зависимости от эффекта. При титровании дозы в качестве контрольного показателя может использоваться уровень инсулиноподобного ростового фактора (ИРФ-I) в сыворотке крови. Поддерживающая доза подбирается индивидуально, но не превышает, как правило, 1 мг/сут, что соответствует 3 МЕ/сут. Пожилым рекомендуются более низкие дозы.
Вопросы эффективности и безопасности применения препаратов гормона роста в педиатрической практике
Применение препаратов гормона роста (ГР) в терапевтических алгоритмах заболеваний, сопровождающихся нарушениями динамики ростовых показателей, сегодня обусловлено широкой доступностью несмотря на высокую стоимость. Рекомбинантный человеческий ГР, полученный биосинтетическим путем, используют в педиатрической практике как средство стимуляции роста, так и как метаболический регулятор нарушенных обменных процессов начиная с 1985 г. Вместе с тем препараты соматропина (МНН препаратов гормона роста) имеют определенные показания с доказанной эффективностью. Основным показанием к назначению соматропина является гипопитуитаризм. Именно лечение недостаточности ГР при гипопитуитаризме препаратами соматропина является патогенетически обоснованным и проводится с заместительной целью.
Применение ГР при других вариантах низкорослости возможно, но прогностически непредсказуемо. К настоящему времени имеются данные об эффективности лечения ГР детей с внутриутробной задержкой роста, семейной низкорослостью, синдромами Шерешевского–Тернера, Прадера–Вилли, Рассела–Сильвера, анемией Фанкони, гликогенозом, хронической почечной недостаточностью, скелетными дисплазиями, муковисцидозом [1].
С 2003 г. в США используют биосинтетический ГР для лечения детей с идиопатической низкорослостью. Возраст в начале терапии ГР и ответ на терапию ГР в первый год лечения являются основными факторами, определяющими конечный рост при идиопатической низкорослости. Предполагалось, что дети с хорошим ростовым ответом в первый год лечения ГР при идиопатической низкорослости скорее всего будут иметь хороший конечный рост при использовании даже низких доз ГР [2]. Однако результаты наблюдения показали, что индивидуальный эффект терапии остается сложным для предсказания. Большая вариабельность ауксиологических данных, возраст, показатели роста и костного возраста на момент начала терапии, скорость роста в первый год лечения определяют многофакторный анализ, сложный для прогнозирования.
Достаточно сложно прогнозировать ответ на лечение ГР также и при заместительной терапии. Оценка эффективности лечения ГР при соматотропной недостаточности по ауксиологическим параметрам показала, что ростовой ответ является переменным и различен в каждом конкретном случае [3]. Характерной особенностью терапии соматотропной недостаточности является то, что по данным наблюдений за терапией пациентов результат первого года лечения выше, чем в последующие годы. При этом отмечено, что единственным клинически значимым предиктором ответа роста на начало лечения в первый год является возраст начала терапии. Тогда как ни пик ГР при проведении стимуляционных тестов, ни пол, ни рост на момент начала терапии, индекс массы тела (ИМТ), костный возраст, доза ГР не влияют на скорость роста в первый год терапии. Более ранняя диагностика и лечение ГР позволяют достичь лучшего конечного роста в тяжелых случаях недостаточности ГР. Показано, что лучший ответ на лечение отмечался у детей с тяжелой степенью недостаточности ГР [4]. Но, по другим данным, конечный рост не имеет существенных различий у пациентов с тяжелым дефицитом ГР и пациентов с парциальным дефицитом ГР [5].
Рядом исследований было показано, что рост родителей является одним из показателей, который позволяет прогнозировать конечный рост у пациентов с дефицитом ГР, получающих заместительную терапию ГР. Было отмечено, что лечение ГР имеет лучшую эффективность у пациентов, в семьях которых не было родственников с низкорослостью [6].
Хотя лечение препаратами ГР не всегда сопровождается достижением генетически детерминированного роста, увеличение роста в первый год лечения в возрасте до начала полового развития коррелирует с общей прибавкой в росте при терапии. Это подтверждает важность начала лечения до начала пубертата [7].
В настоящее время ведется ряд исследований, с помощью которых подбирается необходимое сочетание лекарственных препаратов, комбинация с которыми ГР улучшит результаты лечения. Так, было показано, что одновременное назначение при врожденном дефиците ГР заместительной терапии ГР и агониста гонадолиберина с целью торможения инициации полового развития не имеет преимуществ перед назначением только ГР [8].
Ростовые эффекты ГР при соматотропной недостаточности у пациентов и с изолированным дефицитом ГР, и у пациентов с множественной недостаточностью гормонов гипофиза выражены с одинаковой степенью: 89% пациентов с изолированной недостаточностью ГР и 81% пациентов при множественном дефиците гормонов гипофиза достигают прогнозируемого роста. Причем бо?льшая прибавка в росте наблюдается в возрасте до начала пубертата [9].
Многолетний опыт лечения препаратами ГР показал, что лечение детей с низкорослостью с использованием дозы соматропина, рассчитанной на массу тела ребенка, сопровождается большой вариабельностью в ростовом ответе на терапию ГР. Вопрос, почему дети с недостаточностью ГР, терапия которых направлена на простое замещение недостающего ГР, имеют такие различные клинические исходы, до настоящего времени не решен.
Ведутся исследования, направленные на поиск фармакогеномных маркеров с прогностической значимостью чувствительности клеток к ГР.
Изучено изменение уровня инсулиноподобного фактора роста 1 (ИФР-1) после 1 месяца лечения ГР у детей с недостаточностью ГР и доказано, что имеется зависимость между полиморфизмом клеточного регулятора CDK4 и степенью изменения концентрации ИФР-1. Дальнейшее изучение взаимосвязи геномных маркеров и ранних изменений уровня ИФР-1 может позволить разработать стратегию быстрого индивидуального подбора дозы ГР при врожденной соматотропной недостаточности [10].
Также на конечный рост пациентов, получающих лечение ГР, оказывает влияние наличие или отсутствие полиморфизма SOCS2 (rs3782415). Полиморфизм, выявляемый в GHR, IGFBP3 и SOCS2 локусах, влияет на результаты роста пациентов с врожденной соматотропной недостаточностью, получающих ГР. Использование этих генетических маркеров может определить пациентов, генетически предрасположенных к менее результативному лечению [11].
Конечным результатом подобных исследований должно стать признание важности индивидуального дозирования ГР для каждого пациента на основе конкретных индивидуальных геномных характеристик. Это позволит значительно улучшить терапию, которая в течение долгих лет базируется на принципе «одна дозировка подходит всем».
Насколько терапевтическая эффективность соматропина сопоставима с его безопасностью — вопрос, требующий глубокого детального анализа, решение которого возможно путем накопления опыта применения ГР при лечении различных форм низкорослости.
Безопасность во время лечения и неблагоприятные эффекты лечения ГР тщательно отслеживаются и описываются у детей с дефицитом ГР (как с изолированной, так и с множественной недостаточностью гормонов аденогипофиза) и у детей с идиопатической низкорослостью [12]. Согласно имеющейся информации, полученной в основном из постмаркетинговых исследований, поддерживаемых производителями препаратов ГР, имеется низкая частота (менее 3% пролеченных детей) побочных эффектов и увеличение благоприятного профиля безопасности ГР. Тем не менее, полный спектр потенциальных побочных эффектов ГР не точно диагностируется при помощи постмаркетинговых исследований. Это связано с достаточно длительным сроком лечения, меняющимися в динамике характеристиками больного и невозможностью отследить нежелательные явления после окончания лечения пациента [13–15].
Редко возникающим нежелательным явлением при лечении ГР является внутричерепная гипертензия. Более высокий риск ее развития отмечен в группах больных с хронической почечной недостаточностью, синдромом Шерешевского–Тернера и с органическими причинами дефицита ГР. Внутричерепная гипертензия обычно развивается в начальном периоде лечения или при увеличении дозы препаратов соматропина, прекращается с окончанием терапии ГР. Показанием для проведения фундоскопии офтальмологом являются симптомы, указывающие на внутричерепную гипертензию, такие как сильная головная боль, двоение/нечеткое зрение и рвота. Лечение часто может быть возобновлено при более низких дозах ГР без возврата симптомов.
К осложнениям терапии соматропином относят изменения в костной системе — эпифизеолиз и сколиоз. Эпифизеолиз диагностируется с частотой 73 на 100 000 лет лечения и встречается реже у больных с изолированным дефицитом ГР и идиопатической низкорослостью по сравнению с теми пациентами, у которых дефицит ГР наблюдается вследствие внутричерепных новообразований, краниофарингеомы [16]. Средняя продолжительность от начала терапии ГР до появления эпифизеолиза колеблется от 0,4 до 2,5 лет. Рекомендовано регулярное наблюдение за появлением соответствующих симптомов, таких как боли в бедре и/или боли в колене, изменения в походке, в случае положительного результата — тщательное обследование и консультация ортопеда. Эпифизеолиз требует хирургического вмешательства на эпифизе бедренной кости.
Сколиоз прогрессирует во время лечения ГР из-за быстрого роста, а не является прямым побочным эффектом ГР. Наиболее часто сколиоз развивается при лечении синдромальных форм низкорослости (например, при синдроме Шерешевского–Тернера и синдроме Прадера–Вилли) [17]. У 0,2% детей с идиопатической низкорослостью или с изолированным дефицитом ГР, получавших ГР, отмечено прогрессирование сколиоза [18]. Регулярное обследование на предмет наличия или прогрессирования сколиоза рекомендуется всем пациентам, получающим препараты ГР.
Данные научных публикаций и собственный практический клинический опыт свидетельствуют о необходимости мониторинга показателей метаболизма глюкозы у пациентов, получающих ГР. Это связано с доказанным фактом наличия резистентности к инсулину при лечении препаратами соматропина. Заболеваемость сахарным диабетом (СД) 1-го типа не увеличивается при терапии ГР. Вместе с тем известно, что больные с синдромом Шерешевского–Тернера, Прадера–Вилли имеют высокий риск развития неиммунных форм сахарного диабета. Снижение чувствительности к инсулину и компенсаторное увеличение секреции инсулина с обеспечением эугликемии сопровождается нарушением толерантности к глюкозе и требует коррекции метаболических нарушений, а в ряде случаев отмены препаратов ГР [19]. Мониторинг потенциального развития сахарного диабета с тестированием крови на уровень глюкозы и/или HbA1c должен быть включен в алгоритм наблюдения за всеми пациентами, получающими препараты ГР.
Патофизиологические и эпидемиологические наблюдения позволяют выразить опасение, что ГР может увеличить риск развития злокачественной опухоли во время или после терапии. Известно, что реализация ростового эффекта ГР опосредована соматомединами, один из которых ИФР-1. ИФР-1 и ГР относятся к веществам с митогенной и антиапоптозной активностью, и их рецепторы обнаружены в опухолях. Состояния нарушенной и избыточной секреции/действия ГР ассоциированы со снижением и повышением риска злокачественности соответственно. Снижение ИФР-1 через ограничение калорийности индуцирует апоптоз и предотвращает или замедляет рост опухоли [20–22]. Некоторые немногочисленные эпидемиологические исследования соотносят увеличение ГР и уровни ИФР-1 с опухолями толстой кишки, молочной железы, щитовидной железы и раком предстательной железы у взрослых [23]. В целом данные литературы указывают на разрешающую/факультативную, а не причинную роль ГР в онкогенезе.
Заболеваемость впервые выявленными во время лечения лейкемией или злокачественными новообразованиями в целом после лечения у детей без сопутствующих факторов риска не увеличивается по сравнению с таковой в общей популяции. Несмотря на данные об отсутствии влияния ГР на появление второго новообразования у детей, в анамнезе которых была неоплазия [24, 25], пункт о повышенном риске развития второго новообразования у пациентов, получавших ГР, в настоящее время присутствует в инструкции по применению на всех препаратах ГР в США. Отсутствуют данные относительно эффектов ГР на риск развития неоплазии у больных с заболеваниями, которые сами отнесены в группу повышенного риска возникновения новообразований. Риск новообразований у пациентов, получающих лечение ГР, был рассмотрен Комитетом по лекарственным средствам и терапии Общества детских эндокринологов, и ключевой рекомендацией является необходимость продолжающегося наблюдения всех пациентов, получавших лечение ГР, и это имеет первостепенное значение [26].
Перед началом терапии ребенка препаратами гормона роста его родители должны быть информированы о неопределенности в отношении долгосрочной безопасности (о неблагоприятных эффектах после терапии в зрелом возрасте).
Долгосрочные исследования (в среднем 17 лет) по наблюдению 6928 детей с изолированной соматотропной недостаточностью идиопатической низкорослостью, или низким гестационным возрастом, которые начали лечение ГР в период между 1985 и 1996 гг., во Франции показали 30%-й рост общей смертности по сравнению с населением в целом [27]. Все виды смертности, связанной с раком, не были увеличены, но стандартизованные показатели смертности были повышены в группах больных с опухолями костной системы, больных с нарушениями в системе кровообращения и больных с кровоизлиянием в мозг. Применение дозы препаратов ГР более 50 мкг/кг/день не рекомендовано. Полученные из той же базы данные в недавнем исследовании показали значительно более высокий риск развития инсульта (особенно геморрагического инсульта) среди пациентов, получавших ГР в детстве [28]. В противоположность этому последующее наблюдение 2543 пациентов с изолированной соматотропной недостаточностью, идиопатической низкорослостью или низким гестационным возрастом из других европейских стран не выявили никакого эффекта воздействия ГР и/или дозы на смертность или частоту развития сердечно-сосудистых событий [29].
Таким образом, имеющиеся данные относительно безопасности терапии ГР для детей с различными формами низкорослости определяют необходимость формирования персонализированного алгоритма диспансерного наблюдения пациента и должны включать информирование родителей ребенка об имеющихся сегодня сведениях о нежелательных явлениях как во время лечения, так и в отдаленные периоды жизни.
Применение высоких доз препаратов гормона роста при синдромальных формах низкорослости должно иметь взвешенный подход к сопоставлению показателей эффективности и безопасности лечения. Увеличение дозы ГР определяет рост шансов, отдаленных метаболических или злокачественных рисков, не обнаруженных в ходе проведенных на сегодняшний день исследований. Изменение характеристик пациентов, этнических особенностей и рост уровня ожирения в детстве может увеличить риск развития СД 2-го типа у получающих ГР.
Определенные побочные эффекты препаратов ГР, связанные с ускоренным ростом (прогрессирование сколиоза и эпифизеолиз) и другими неизвестными механизмами (внутричерепная гипертензия), встречаются редко, однако требуют упреждающего разъяснения и тщательного контроля.
Кроме того, следует помнить об отдаленных последствиях гормонального лечения. Поскольку исследования населения, не получающего ГР, свидетельствуют о том, что высокие нормальные уровни свободного ИФР-1 (часто выявляемые у детей, получавших ГР) могут увеличить риски онкологических заболеваний, потенциальные связи между воздействием ГР и будущими рисками возникновения неоплазии требуют постоянного контроля. И, наконец, соответствующий уровень допустимого риска для новейшей и потенциально самой большой группы пациентов, получавших ГР, — практически здоровых, но низкорослых детей — еще предстоит определить [30].
Литературы
- Петеркова В. А. Гипофизарная карликовость: диагностика и лечение // Педиатрия. 2009. № 87 (02). С. 104–110.
- Ranke M. B., Lindberg A., Price D. A. et al. KIGS International Board. Age at growth hormone therapy start and first-year responsiveness to growth hormone are major determinants of height outcome in idiopathic short stature // Horm Res. 2007. № 68 (2). Р. 53–62.
- Kelnar C. J. Growth hormone for short children — whom should we be treating and why? // J R Coll Physicians Edinb. 2012. № 42 (1). Р. 32–33.
- Ranke M. B., Lindberg A. KIGS International Board. Observed and predicted growth responses in prepubertal children with growth disorders: guidance of growth hormone treatment by empirical variables // J Clin Endocrinol Metab. 2010. № 95 (3). Р. 1229–1237.
- Cardoso D. F., Martinelli C. E. Jr, Campos V. C. et al. Comparison between the growth response to growth hormone (GH) therapy in children with partial GH insensitivity or mild GH deficiency // Arq Bras Endocrinol Metabol. 2014. № 58 (1). Р. 23–29.
- Hilczer M., Smyczynska J., Lewinski A. Parentally-adjusted deficit of height as a prognostic factor of the effectiveness of growth hormone (GH) therapy in children with GH deficiency // Neuro Endocrinol Lett. 2006. № 27 (1–2). Р. 149–152.
- Reiter E. O., Price D. A., Wilton P. et al. Effect of growth hormone (GH) treatment on the near-final height of 1258 patients with idiopathic GH deficiency: analysis of a large international database // J Clin Endocrinol Metab. 2006. № 91 (6). Р. 2047–2054.
- Colmenares A., González L., Gunczler P., Lanes R. Is the growth outcome of children with idiopathic short stature and isolated growth hormone deficiency following treatment with growth hormone and a luteinizing hormone-releasing hormone agonist superior to that obtained by GH alone? // J Pediatr Endocrinol Metab. 2012. № 25 (7–8). Р. 651–657.
- Darendeliler F., Lindberg A., Wilton P. Response to growth hormone treatment in isolated growth hormone deficiency versus multiple pituitary hormone deficiency // Horm Res Paediatr. 2011. № 76. Suppl 1. Р. 42–46.
- Stevens A., Clayton P., Tatò L. et al. Pharmacogenomics of insulin-like growth factor-I generation during GH treatment in children with GH deficiency or Turner syndrome // Pharmacogenomics J. 2014. № 14 (1). Р. 54–62.
- Braz A. F., Costalonga E. F., Trarbach E. B. Genetic predictors of long-term response to growth hormone (GH) therapy in children with GH deficiency and Turner syndrome: the influence of a SOCS2 polymorphism // J Clin Endocrinol Metab. 2014. № 99 (9). Р. 1808–1813.
- Wilson T. A., Rose S. R., Cohen P. et al. Update of guidelines for the use of growth hormone in children: The Lawson Wilkins Pediatric Endocrinology Society Drug and Therapeutics Committee // J Pediatr. 2003. № 143. Р. 415–421.
- Bell J., Parker K. L., Swinford R. D. et al. Long-term safety of recombinant human growth hormone in children // J Clin Endocrinol Metab. 2010. № 95. Р. 167–177.
- Darendeliler F., Karagiannis G., Wilton P. Headache, idiopathic intracranial hypertension and slipped capital femoral epiphysis during growth hormone treatment: a safety update from the KIGS database // Horm Res. 2007. № 68. Suppl 5. P. 41–47.
- Grimberg А., DiVall S., Polychronakos C. et al. Guidelines for Growth Hormone and Insulin-Like Growth Factor-I Treatment in Children and Adolescents: Growth Hormone Deficiency, Idiopathic Short Stature, and Primary Insulin-Like Growth Factor-I Deficiency // Horm Res Paediatr. 2021. № 86. Р. 361–397.
- Mostoufi-Moab S., Isaacoff E. J., Spiegel D. et al. Childhood cancer survivors exposed to total body irradiation are at significant risk for slipped capital femoral epiphysis during recombinant growth hormone therapy // Pediatr Blood Cancer. 2013. № 60. Р. 1766–1771.
- Kim J. Y., Rosenfeld S. R., Keyak J. H. Increased prevalence of scoliosis in Turner syndrome // J Pediatr Orthop. 2001. № 21. Р. 765–766.
- Cohen P., Bright G. M., Rogol A. D. et al. Effects of dose and gender on the growth and growth factor response to GH in GH-deficient children: implications for efficacy and safety // J Clin Endocrinol Metab. 2002. № 87. Р. 90–98.
- Bareille P., Azcona C., Matthews D. R. et al. Lipid profile, glucose tolerance and insulin sensitivity after more than four years of growth hormone therapy in non-growth hormone deficient adolescents // Clin Endocrinol (Oxf). 1999. № 51. Р. 347–353.
- Aguiar-Oliveira M., Oliveira F. T., Pereira R. M. et al. Longevity in untreated congenital growth hormone deficiency due to a homozygous mutation in the GHRH receptor gene // J Clin Endocrinol Metab. 2010. № 95. Р. 714–721.
- Orme S. M., McNally R. J. Q., Cartwright R. A., Belchetz P. E. For the United Kingdom Acromegaly Study Group: Mortality and cancer incidence in acromegaly: a retrospective cohort study // J Clin Endocrinol Metab. 1998. № 83. Р. 2730–2734.
- Speakman J. R., Mitchell S. E. Caloric restriction // Mol Aspects Med. 2011. № 32. Р. 159–221.
- Cohen P., Clemmons D. R., Rosenfeld R. G. Does the GH-IGF axis play a role in cancer pathogenesis? // Growth Horm IGF Res. 2000. № 10. Р. 297–305.
- Wilton P., Mattsson A. F., Darendeliler F. Growth hormone treatment in children is not associated with an increase in the incidence of cancer: experience from KIGS (Pfizer International Growth Database) // J Pediatr. 2010. № 157. Р. 265–270.
- Mackenzie S., Craven T., Gattamaneni H. R. et al. Longterm safety of growth hormone replacement after CNS irradiation // J Clin Endocrinol Metab. 2011. № 96. Р. 2756–2761.
- Raman S., Grimberg A., Waguespack S. G. et al. Risk of neoplasia in pediatric patients receiving growth hormone therapy — a report from the Pediatric Endocrine Society Drug and Therapeutics Committee // J Clin Endocrinol Metab. 2015. № 100. Р. 2192–2203.
- Carel J. C., Ecosse E., Landier F. et al. Long-term mortality after recombinant growth hormone treatment for isolated growth hormone deficiency or childhood short stature: preliminary report of the French SAGhE study // J Clin Endocrinol Metab. 2012. № 97. Р. 416–425.
- Poidvin A., Touze E., Ecosse E. et al. Growth hormone treatment for childhood short stature and risk of stroke in early adulthood // Neurology. 2014. № 83. Р. 780–786.
- Savendahl L., Maes M., Albertsson-Wikland K. et al. Long-term mortality and causes of death in isolated GHD, ISS, and SGA patients treated with recombinant growth hormone during childhood in Belgium, The Netherlands, and Sweden: preliminary report of 3 countries participating in the EU SAGhE study // J Clin Endocrinol Metab. 2012. № 97. Р. 213–217.
- Allen D. B. Growth hormone therapy for short stature: is the benefit worth the burden? // Pediatrics. 2006. № 118. Р. 343–348.
Е. Б. Башнина, доктор медицинских наук, профессор О. С. Берсенева1
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
1 Контактная информация
Особые указания
На фоне лечения Растаном возможно потребуется коррекция доз гипогликемических препаратов у больных сахарным диабетом, может произойти манифестация латентно протекающего гипотиреоза, а у пациентов, получающих левотироксин натрия, могут появиться признаки гипертиреоза. Во время лечения необходимо контролировать состояние глазного дна, особенно, при симптомах внутричерепной гипертензии. Отек зрительного нерва требует отмены препарата. Обнаружение хромоты на фоне терапии соматропином требует тщательного наблюдения. Необходимо менять места подкожных инъекций в связи с возможностью развития липоатрофий. Во время трансплантации почки лечение препаратом следует отменить.
При условии отсутствия симптомов повышения внутричерепного давления (головная боль, тошнота, рвота, нарушение зрения), Растан не оказывает влияния на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Растан® (Rastan)
Лечение соматропином должно проводиться врачами, имеющими опыт диагностики и лечения пациентов с недостаточностью ГР или с синдромом Шерешевского-Тернера.
Не следует превышать максимально рекомендованную суточную дозу (см. раздел «Способ применения и дозы»).
Стимуляция продольного роста может проводиться у детей до закрытия эпифизарных зон роста.
Недостаточность гормона роста у взрослых сохраняется в течение всей жизни и нуждается в соответствующем лечении, однако в настоящее время результаты длительной терапии взрослых отсутствуют.
Синдром Шерешевского-Тернера
У пациенток с синдромом Шерешевского-Тернера во время лечения соматропином рекомендуется проводить мониторинг пропорционального роста верхних и нижних конечностей, и при выявлении усиленного роста дозу препарата необходимо снизить до нижней границы диапазона доз.
У девочек с синдромом Шерешевского-Тернера обычно имеется повышенный риск развития среднего отита, в связи с чем должно осуществляться наблюдение отоларингологом.
Хроническая почечная недостаточность Нарушение роста у детей с ХПН должно быть точно установлено до начала лечения препаратом соматропина при помощи мониторинга роста на фоне оптимальной терапии ХПН в течение одного года. Во время терапии соматропином следует продолжать консервативное лечение ХПН традиционными лекарственными препаратами и, при необходимости, диализом. Во время трансплантации почки терапию соматропином следует прекратить.
Синдром Пуадера-Вилли Отмечались сообщения о летальных случаях у детей с СПВ с недостаточностью ГР, получавших терапию соматропином и имевших как минимум один из следующих факторов риска: ожирение тяжелой степени, дыхательную недостаточность в анамнезе, ночное апноэ или неидентифицированную инфекцию дыхательных путей.
Возможным фактором риска может быть мужской пол пациента.
Пациенты с СПВ при наличии одного или более из перечисленных факторов относятся к группе высокого риска при применении соматропина.
Перед назначением соматропина пациентам с недостаточностью ГР в сочетании с СПВ необходимо рассмотреть соотношение потенциального риска и пользы.
У пациентов с СПВ лечение соматропином должно быть обязательно сопряжено с ограниченной по калорийности диетой. Пациенты с СПВ должны активно следить за своей массой тела как перед применением соматропина, так и во время него.
Опухоли
Пациенты, имеющие в анамнезе злокачественные новообразования, должны быть тщательно обследованы на предмет их рецидива. В случае возникновения или рецидива злокачественного новообразования терапию соматропином следует прекратить.
Пациентам с недостаточностью ГР, возникшей вторично при наличии новообразований головного мозга, следует проводить более частые обследования для исключения прогрессирования и рецидива основного заболевания.
Соматропин не следует назначать в случае выявления каких-либо признаков активного роста опухоли. Перед назначением соматропина опухолевый процесс должен быть в неактивной фазе и противоопухолевая терапия должна быть завершена. При появлении признаков возобновления роста опухоли введение препарата следует прекратить.
Сообщалось о развитии вторичных доброкачественных и злокачественных новообразований у пациентов с перенесенным в детском возрасте раком и получающих терапию соматропином. Наиболее частым осложнением являлось развитие внутричерепных опухолей, в частности, менингиомы у пациентов, ранее получавших радиотерапию головы по поводу первичных новообразований. Однако о рецидивах первичных новообразований у этой категории пациентов не сообщалось.
Лейкемия
Сообщалось о развитии лейкемии у детей, получавших лечение соматропином. Взаимосвязь между возникновением лейкемии и терапией соматропином не установлена.
Доброкачественная внутричерепная гипертензия
В случае появления тяжелых или рецидивирующих головных болей, нарушения зрения, тошноты и/или рвоты, рекомендуется проведение фундоскопии для выявления возможного отека диска зрительного нерва. При подтверждении диагноза следует оценить наличие доброкачественной внутричерепной гипертензии и, при подтверждении диагноза, терапию соматропином следует прекратить.
На сегодня нет четких указаний по схеме применения гормона роста у пациентов с корригированной внутричерепной гипертензией. Тем не менее опыт клинического применения свидетельствует о том, что возобновление лечения соматропином во многих случаях не приводит к рецидиву внутричерепной гипертензии. Если применение соматропина было возобновлено, необходимо тщательное наблюдение за возможным появлением симптомов внутричерепной гипертензии.
Эпифизеолиз
У пациентов с эндокринными нарушениями, включая недостаточность ГР, могут более часто наблюдаться эпифизеолизы головок трубчатых костей. Необходимо проводить тщательное обследование, если во время лечения у ребенка появилась хромота.
Гипопитуитаризм
Пациенты с гипопитуитаризмом (недостаточностью нескольких гормонов гипофиза) в случае проведения стандартной гормональной заместительной терапии при введении соматропина должны находиться под строгим наблюдением.
Функция щитовидной железы
При лечении соматропином было выявлено усиленное преобразование тироксина (Т4) в трийодтиронин (Т3), что может служить причиной снижения концентрации Т4 и повышения концентрации Т3 в плазме крови.
У здоровых добровольцев, как правило, концентрации тиреоидных гормонов в плазме крови оставались в пределах нормы. Воздействие соматропина на концентрацию тиреоидных гормонов может иметь клиническую значимость у пациентов с центральным субклиническим гипотиреозом, у которых потенциально может развиться гипотиреоз. С другой стороны, у пациентов, получающих тироксин в качестве заместительной гормональной терапии, может развиться гипертиреоз. Исходя из этого, рекомендуется контролировать функцию щитовидной железы после начала терапии соматропином, а также при каждом изменении его дозы. Отсутствие адекватной терапии гипотиреоза может препятствовать получению оптимальных результатов лечения соматропином.
Образование антител к соматропину
Возможно образование антител к соматропину. Исследование титра антител к соматропину следует проводить в тех случаях, когда пациент не отвечает на терапию.
Чувствительность к инсулину
Соматропин снижает чувствительность к инсулину, особенно в больших дозах у пациентов с высокой чувствительностью, что может вызвать развитие гипергликемии у пациентов с неадекватной секрецией инсулина.
Таким образом, могут быть обнаружены ранее не диагностированные нарушение толерантности к глюкозе и сахарный диабет.
У всех пациентов, получающих соматропин, необходим периодический мониторинг концентрации глюкозы, особенно у пациентов с высоким риском возникновения сахарного диабета: у пациентов с ожирением, синдромом Шерешевского-Тернера, семейным анамнезом сахарного диабета, при приеме ГКС или имевшемся ранее нарушении толерантности к глюкозе. В ходе лечения соматропином более тщательный мониторинг необходим пациентам с диагностированным сахарным диабетом 1 или 2 типа или с нарушением толерантности к глюкозе (см. раздел «Взаимодействие с другими лекарственными средствами»). У таких пациентов следует оценить необходимость в коррекции дозы гипогликемических препаратов при назначении соматропина.
Сколиоз
У некоторых детей в период чрезмерно быстрого роста (особенно часто у детей с СПВ) может наблюдаться прогрессирование сколиоза. В течение всего периода лечения соматропином должен проводиться мониторинг для выявления признаков сколиоза. Однако имеющиеся данные говорят о том, что терапия соматропином не влияет на частоту или тяжесть развития сколиоза.
Панкреатит
По сравнению со взрослыми, у пациентов детского возраста, получающих терапию соматропином, может повышаться риск развития панкреатита. Несмотря на редкость данного осложнения, следует проявлять повышенное внимание к пациентам детского возраста с болями в животе.
Ожирение
У пациентов с ожирением более вероятно возникновение нежелательных явлений при введении доз, рассчитанных по массе тела.
Гиперэстрогения у женщин
Женщинам с гиперэстрогенией или женщинам, принимающим перорально эстрогены, может понадобиться назначение более высоких доз соматропина, чем мужчинам.
Пожилой возраст
Пациенты пожилого возраста могут быть более чувствительны к действию соматропина и, следовательно, увеличивается вероятность развития побочных эффектов. Поэтому целесообразно применение меньшей начальной дозы и более медленное увеличение дозы препарата.
Опыт лечения соматропином пациентов старше 60 лет отсутствует.
Ургентные состояния
Безопасность продолжения терапии соматропином у пациентов с тяжелыми заболеваниями, связанными с осложнениями после открытых операций на сердце или брюшной полости, множественных травм, связанных с несчастными случаями, а также пациентов с острой дыхательной недостаточностью, получающих заместительную терапию по зарегистрированным показаниям, у которых в процессе терапии появились упомянутые заболевания, не установлена. Поэтому соотношение потенциального риска и пользы продолжения терапии соматропином у пациентов в ургентном состоянии, должно быть тщательно оценено.